鲁教版九年级下册化学 7.4酸碱中和反应 课件(17张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 7.4酸碱中和反应 课件(17张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-25 09:36:12 | ||
图片预览






文档简介
第四节 酸碱 中和反应
紫色石蕊试液遇到酸变成红色,遇到碱变成蓝色。无色酚酞试液遇到酸不变色,遇到碱变成红色。
一知识回顾
酸碱指示剂在酸碱性溶液中,
怎样变色的?
二你知道这其中的道理吗?
我们都可能有被蚊虫叮咬的经历,如果涂上肥皂水等碱性物质,可
以减轻皮肤的痒痛,这是为什么那?
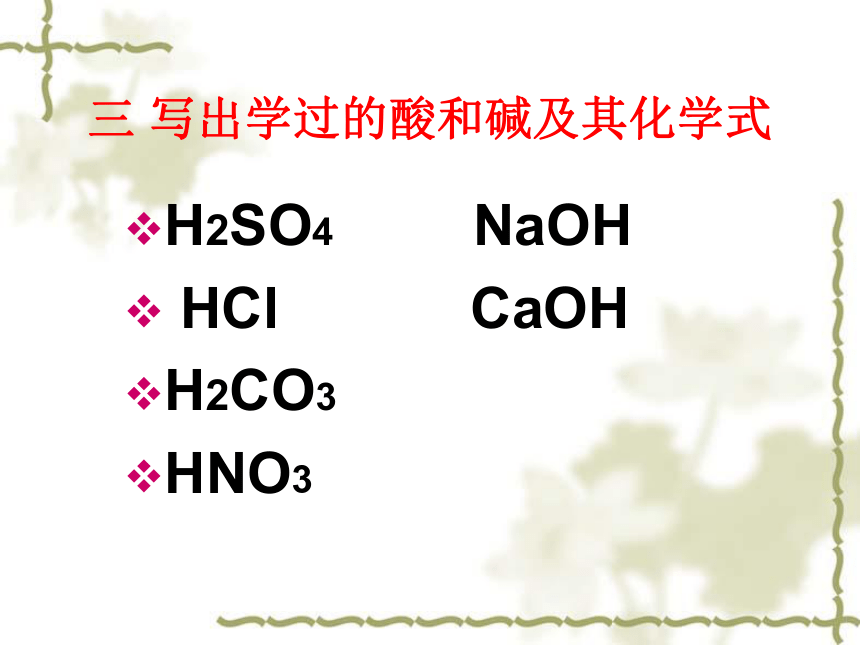
三 写出学过的酸和碱及其化学式
H2SO4 NaOH
HCl CaOH
H2CO3
HNO3
第四节 酸碱中和反应
(第1课时)
方案1:取少量稀盐酸于试管中,滴加紫色石蕊试液,再逐滴滴加氢氧化钠溶液,观察溶液颜色变化。
方案2:取少量氢氧化钠溶液于试管中,滴加无色酚酞试液,再逐滴滴加稀盐酸 ,观察溶液颜色变化。
友情提示:
药品用量:液体1-2毫升,指示剂3-5滴。
酸和碱都有一定的腐蚀性,不要将酸碱溅到皮肤上。液体要逐滴加入,并不断振荡试管。
实验操作 实验现象 结论
溶液先变为红
色,滴加盐酸
后红色消失,
溶液变为无色
HCL+NaOH
能反应
盐酸和氢氧化钙会发生化学反应吗?
结论:盐酸和氢氧化钙发生了化学反应。
实验操作
现象
向两只烧杯中分别加入少量的氢氧化钙固体,再分别加入10mL的蒸馏水,然后各滴加2-3滴酚酞试液,搅拌,观察现象。
向其中一只烧杯中加入10mL稀盐酸,向另一只烧杯中加入10mL蒸馏水,搅拌,观察现象。
烧杯底部有白色固体;溶液变为红色。
加稀盐酸的烧杯中氢氧化钙固体消失,溶液变为无色;另一烧杯中无变化。
观察实验
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4+ 2NaOH === Na2SO4 + 2H2O
?
盐
金属离子
酸根离子
Cl_ SO42_
CO32_ NO3_ 等
盐
由金属离子和酸根离子构成的化合物。
HCl + NaOH === NaCl + H2O
碱
酸
盐
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4+ 2NaOH === Na2SO4 + 2H2O
水
+
+
中和反应:
酸和碱作用生成盐和水的
反应。
下列反应,属于中和反应的是( )
A Zn +2HCl == ZnCl2 + H2
B CuO + 2HCl == CuCl2 + H2O
C Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D AgNO3 + HCl == AgCl + HNO3
C
某气体只能用向上排空气法收集,由此得出它应具备下列性质中的哪几项( )
A①③ B②③
C①④ D②④
①不易溶于水 ②易溶于水
③密度比空气小 ④密度比空气大
D
拓 展 延 伸
通过本节课的学习,你有哪些收获?
【挑战自我】
1.在滴有酚酞的NaOH稀溶液中,加入足量盐酸,加酸前后溶液颜色依次为 ( )
A.红色、无色 B.无色、红色
C.红色、蓝色 D.蓝色、无色
2.在实验室里,欲使碱性溶液变成中性,下列试剂中最好选用哪一种组合 ( )
① NaOH溶液②稀盐酸 ③石灰水 ④酚酞试液
A. ①或③ B. 只有②
C. 只有① D. ②和④
A
D
1.某溶液的pH是5,若将溶液的pH上升到8,应采用的措施是加入适量( )。
A、紫色石蕊试液 B、酸溶液
C、碱溶液 D、蒸馏水
C
2.右图所示是小明同学探究氢氧化钠跟盐酸是否发生反应的装置图
﹙ 1 ﹚图中仪器名称
a ;
b ;
c .
﹙2﹚当滴入盐酸溶液的量较少时。氢氧化钠有剩余。溶液中含有的溶质是 。 溶液显 ___ 色,当滴入的盐酸与氢氧化钠恰好完全反映时,溶液中 性,溶液
变为 色,此时,溶质是 当滴入盐酸溶液过量时,溶液中含有的溶质 ,溶液显 性,溶液呈 色 。
a
b
c
并滴入酚酞试液
胶头滴管
玻璃棒
烧杯
NaCl NaOH
红
无
NaCl
NaCl HCl
酸
无
紫色石蕊试液遇到酸变成红色,遇到碱变成蓝色。无色酚酞试液遇到酸不变色,遇到碱变成红色。
一知识回顾
酸碱指示剂在酸碱性溶液中,
怎样变色的?
二你知道这其中的道理吗?
我们都可能有被蚊虫叮咬的经历,如果涂上肥皂水等碱性物质,可
以减轻皮肤的痒痛,这是为什么那?
三 写出学过的酸和碱及其化学式
H2SO4 NaOH
HCl CaOH
H2CO3
HNO3
第四节 酸碱中和反应
(第1课时)
方案1:取少量稀盐酸于试管中,滴加紫色石蕊试液,再逐滴滴加氢氧化钠溶液,观察溶液颜色变化。
方案2:取少量氢氧化钠溶液于试管中,滴加无色酚酞试液,再逐滴滴加稀盐酸 ,观察溶液颜色变化。
友情提示:
药品用量:液体1-2毫升,指示剂3-5滴。
酸和碱都有一定的腐蚀性,不要将酸碱溅到皮肤上。液体要逐滴加入,并不断振荡试管。
实验操作 实验现象 结论
溶液先变为红
色,滴加盐酸
后红色消失,
溶液变为无色
HCL+NaOH
能反应
盐酸和氢氧化钙会发生化学反应吗?
结论:盐酸和氢氧化钙发生了化学反应。
实验操作
现象
向两只烧杯中分别加入少量的氢氧化钙固体,再分别加入10mL的蒸馏水,然后各滴加2-3滴酚酞试液,搅拌,观察现象。
向其中一只烧杯中加入10mL稀盐酸,向另一只烧杯中加入10mL蒸馏水,搅拌,观察现象。
烧杯底部有白色固体;溶液变为红色。
加稀盐酸的烧杯中氢氧化钙固体消失,溶液变为无色;另一烧杯中无变化。
观察实验
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4+ 2NaOH === Na2SO4 + 2H2O
?
盐
金属离子
酸根离子
Cl_ SO42_
CO32_ NO3_ 等
盐
由金属离子和酸根离子构成的化合物。
HCl + NaOH === NaCl + H2O
碱
酸
盐
2HCl + Ca(OH)2 === CaCl2 + 2H2O
H2SO4+ 2NaOH === Na2SO4 + 2H2O
水
+
+
中和反应:
酸和碱作用生成盐和水的
反应。
下列反应,属于中和反应的是( )
A Zn +2HCl == ZnCl2 + H2
B CuO + 2HCl == CuCl2 + H2O
C Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D AgNO3 + HCl == AgCl + HNO3
C
某气体只能用向上排空气法收集,由此得出它应具备下列性质中的哪几项( )
A①③ B②③
C①④ D②④
①不易溶于水 ②易溶于水
③密度比空气小 ④密度比空气大
D
拓 展 延 伸
通过本节课的学习,你有哪些收获?
【挑战自我】
1.在滴有酚酞的NaOH稀溶液中,加入足量盐酸,加酸前后溶液颜色依次为 ( )
A.红色、无色 B.无色、红色
C.红色、蓝色 D.蓝色、无色
2.在实验室里,欲使碱性溶液变成中性,下列试剂中最好选用哪一种组合 ( )
① NaOH溶液②稀盐酸 ③石灰水 ④酚酞试液
A. ①或③ B. 只有②
C. 只有① D. ②和④
A
D
1.某溶液的pH是5,若将溶液的pH上升到8,应采用的措施是加入适量( )。
A、紫色石蕊试液 B、酸溶液
C、碱溶液 D、蒸馏水
C
2.右图所示是小明同学探究氢氧化钠跟盐酸是否发生反应的装置图
﹙ 1 ﹚图中仪器名称
a ;
b ;
c .
﹙2﹚当滴入盐酸溶液的量较少时。氢氧化钠有剩余。溶液中含有的溶质是 。 溶液显 ___ 色,当滴入的盐酸与氢氧化钠恰好完全反映时,溶液中 性,溶液
变为 色,此时,溶质是 当滴入盐酸溶液过量时,溶液中含有的溶质 ,溶液显 性,溶液呈 色 。
a
b
c
并滴入酚酞试液
胶头滴管
玻璃棒
烧杯
NaCl NaOH
红
无
NaCl
NaCl HCl
酸
无
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
