化学课件比赛课件:3.1.1《盐类的水解》(苏教版选修4)
文档属性
| 名称 | 化学课件比赛课件:3.1.1《盐类的水解》(苏教版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 67.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-02 14:20:36 | ||
图片预览



文档简介
(共13张PPT)
廉江中学
学习目标:
1、理解盐类水解产生的原因;
2、能运用盐类水解规律判断盐溶液的酸碱性;
第三单元 盐类的水解
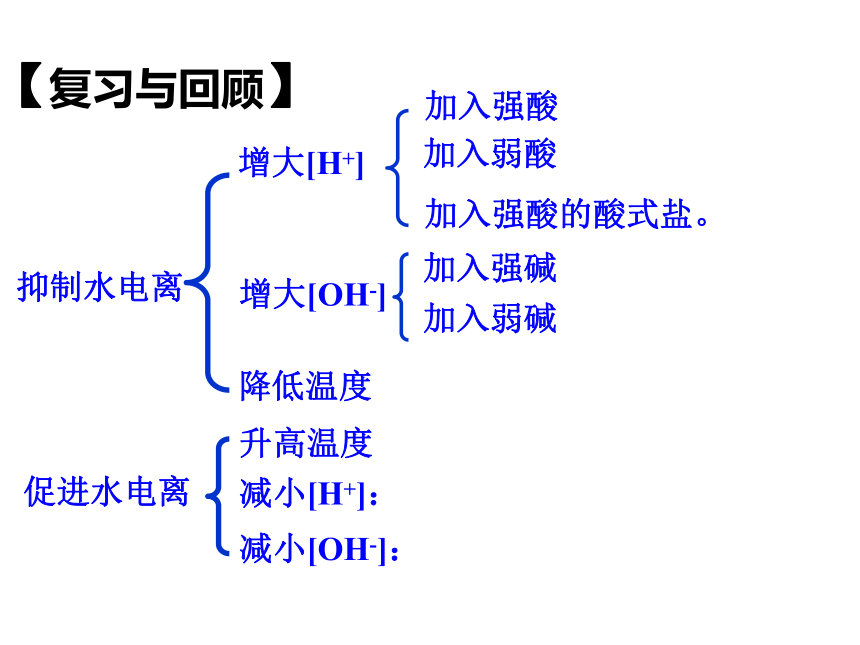
加入强酸
增大[OH-]
增大[H+]
减小[H+]:
减小[OH-]:
升高温度
降低温度
加入强酸的酸式盐。
抑制水电离
促进水电离
加入弱酸
加入强碱
加入弱碱
【复习与回顾】
盐类的水解规律
【思考】1.酸溶液呈酸性,碱溶液呈碱性,那么, 盐溶解于水后,所形成的水溶液是否呈中性?
2.Na2CO3俗称“纯碱”,但它明明属于盐类,为什么叫它“纯碱”?
到底是酸性还是碱性呢?
使用pH试纸
使用pH计
使用方法:直接把待测液滴在干燥的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比
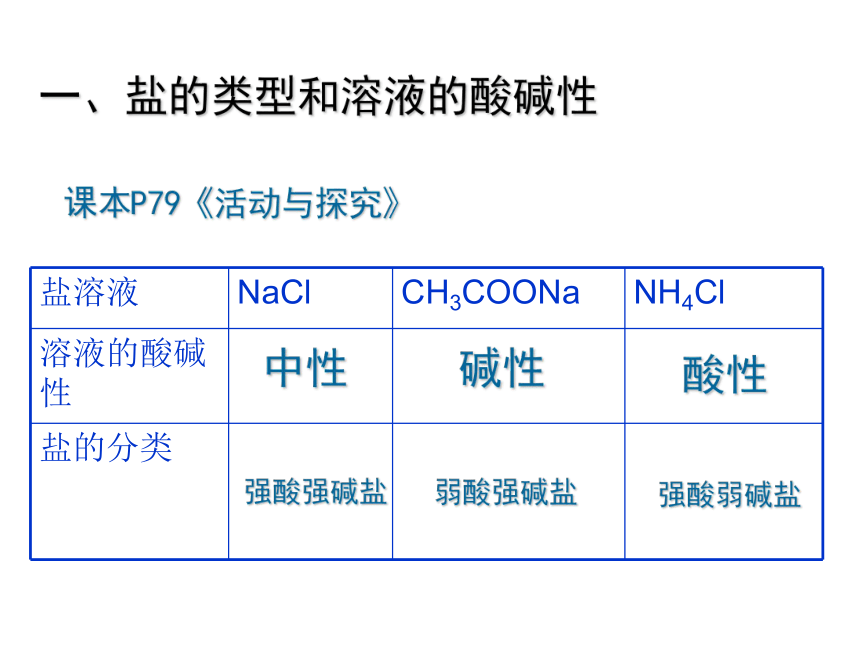
课本P79《活动与探究》
盐溶液 NaCl CH3COONa NH4Cl
溶液的酸碱性
盐的分类
中性
碱性
酸性
强酸强碱盐
弱酸强碱盐
强酸弱碱盐
一、盐的类型和溶液的酸碱性
(1)NaCl、CH3COONa、NH4Cl溶液中存在着几种离子?
(2)哪些离子可能相互结合,对水的电离平衡有何影响?
(3)为什么它们的溶液分别显中性、碱性和酸性?
二、盐水解的原理
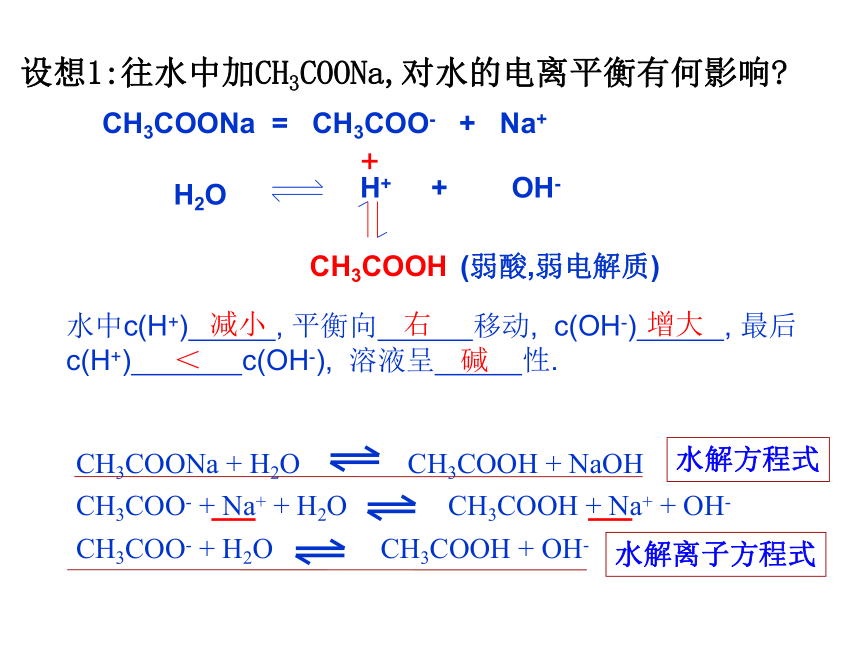
设想1:往水中加CH3COONa,对水的电离平衡有何影响
设想2:往水中加NH4Cl,对水的电离平衡有何影响
设想1:往水中加CH3COONa,对水的电离平衡有何影响
CH3COONa = CH3COO- + Na+
H2O
H+ + OH-
+
CH3COOH
(弱酸,弱电解质)
水中c(H+) , 平衡向 移动, c(OH-) , 最后c(H+) c(OH-), 溶液呈 性.
减小
右
增大
<
碱
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + Na+ + H2O CH3COOH + Na+ + OH-
CH3COO- + H2O CH3COOH + OH-
水解方程式
水解离子方程式
设想2:往水中加NH4Cl,对水的电离平衡有何影响
NH4Cl = NH4+ + Cl-
H2O
OH- + H+
+
NH3·H2O
(弱碱,弱电解质)
水中c(OH-) , 平衡向 移动, c(H+) , 最后c(H+) c(OH-), 溶液呈 性.
减小
右
增大
>
酸
NH4Cl+H2O NH3·H2O + HCl
NH4+ + H2O NH3·H2O + H
+
在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,导致水的电离平衡发生了移动, 使得c(H+)≠c(OH-),从而使这类盐溶液呈现酸碱性.盐和水的这种作用称之为“盐类的水解”.
⑴含弱酸阴离子的盐:
CH3COO - 、CO3 2- 、F - 、S 2- 等
⑵含弱碱阳离子的盐:
NH4+ 、Al3+ 、Cu2+ 、Fe3+ 、Ag+等
三、盐类水解的定义
结合盐类水解的定义,探究下列问题:
⒈从盐的组成角度分析盐类水解的条件、实质是什么?
⒉盐类水解反应与中和反应的关系如何?反应程度如何?
水解的实质:
水解反应与中和反应的关系:
水解的条件:
易溶于水、生成弱电解质。
破坏了水的电离平衡。
盐类水解后生成酸和碱,即盐类的水解反应可看作是酸碱中和反应的逆反应。
酸+碱 盐+水
中和
水解
四、 盐类水解的规律
水解
水解
不水解
弱碱
阳离子
弱酸
阴离子
无
弱碱
弱酸
无
酸性
碱性
中性
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解,
`
类型
实例
是否水解
水解的离子
生成的弱电解质
溶液的酸碱性
强酸弱碱盐
NH4Cl
强碱弱酸盐
CH3COONa
强酸强碱盐
NaCl
越弱越水解,
都弱都水解。
—条件
—结果
—程度
五、盐类水解的化学、离子方程式的书写:
⒈盐类水解是可逆反应,反应方程式中要写 符号,不写“=”符号。
⒉盐类水解的程度一般很小,水解产物很少,通常不生成沉淀和气体,不用“↓”、“↑”符号,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。
⒊多元弱酸盐分步水解,以第一步水解为主,水解方程式一般只写第一步;多元弱碱盐的水解不分步书写。
廉江中学
学习目标:
1、理解盐类水解产生的原因;
2、能运用盐类水解规律判断盐溶液的酸碱性;
第三单元 盐类的水解
加入强酸
增大[OH-]
增大[H+]
减小[H+]:
减小[OH-]:
升高温度
降低温度
加入强酸的酸式盐。
抑制水电离
促进水电离
加入弱酸
加入强碱
加入弱碱
【复习与回顾】
盐类的水解规律
【思考】1.酸溶液呈酸性,碱溶液呈碱性,那么, 盐溶解于水后,所形成的水溶液是否呈中性?
2.Na2CO3俗称“纯碱”,但它明明属于盐类,为什么叫它“纯碱”?
到底是酸性还是碱性呢?
使用pH试纸
使用pH计
使用方法:直接把待测液滴在干燥的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比
课本P79《活动与探究》
盐溶液 NaCl CH3COONa NH4Cl
溶液的酸碱性
盐的分类
中性
碱性
酸性
强酸强碱盐
弱酸强碱盐
强酸弱碱盐
一、盐的类型和溶液的酸碱性
(1)NaCl、CH3COONa、NH4Cl溶液中存在着几种离子?
(2)哪些离子可能相互结合,对水的电离平衡有何影响?
(3)为什么它们的溶液分别显中性、碱性和酸性?
二、盐水解的原理
设想1:往水中加CH3COONa,对水的电离平衡有何影响
设想2:往水中加NH4Cl,对水的电离平衡有何影响
设想1:往水中加CH3COONa,对水的电离平衡有何影响
CH3COONa = CH3COO- + Na+
H2O
H+ + OH-
+
CH3COOH
(弱酸,弱电解质)
水中c(H+) , 平衡向 移动, c(OH-) , 最后c(H+) c(OH-), 溶液呈 性.
减小
右
增大
<
碱
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + Na+ + H2O CH3COOH + Na+ + OH-
CH3COO- + H2O CH3COOH + OH-
水解方程式
水解离子方程式
设想2:往水中加NH4Cl,对水的电离平衡有何影响
NH4Cl = NH4+ + Cl-
H2O
OH- + H+
+
NH3·H2O
(弱碱,弱电解质)
水中c(OH-) , 平衡向 移动, c(H+) , 最后c(H+) c(OH-), 溶液呈 性.
减小
右
增大
>
酸
NH4Cl+H2O NH3·H2O + HCl
NH4+ + H2O NH3·H2O + H
+
在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,导致水的电离平衡发生了移动, 使得c(H+)≠c(OH-),从而使这类盐溶液呈现酸碱性.盐和水的这种作用称之为“盐类的水解”.
⑴含弱酸阴离子的盐:
CH3COO - 、CO3 2- 、F - 、S 2- 等
⑵含弱碱阳离子的盐:
NH4+ 、Al3+ 、Cu2+ 、Fe3+ 、Ag+等
三、盐类水解的定义
结合盐类水解的定义,探究下列问题:
⒈从盐的组成角度分析盐类水解的条件、实质是什么?
⒉盐类水解反应与中和反应的关系如何?反应程度如何?
水解的实质:
水解反应与中和反应的关系:
水解的条件:
易溶于水、生成弱电解质。
破坏了水的电离平衡。
盐类水解后生成酸和碱,即盐类的水解反应可看作是酸碱中和反应的逆反应。
酸+碱 盐+水
中和
水解
四、 盐类水解的规律
水解
水解
不水解
弱碱
阳离子
弱酸
阴离子
无
弱碱
弱酸
无
酸性
碱性
中性
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解,
`
类型
实例
是否水解
水解的离子
生成的弱电解质
溶液的酸碱性
强酸弱碱盐
NH4Cl
强碱弱酸盐
CH3COONa
强酸强碱盐
NaCl
越弱越水解,
都弱都水解。
—条件
—结果
—程度
五、盐类水解的化学、离子方程式的书写:
⒈盐类水解是可逆反应,反应方程式中要写 符号,不写“=”符号。
⒉盐类水解的程度一般很小,水解产物很少,通常不生成沉淀和气体,不用“↓”、“↑”符号,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。
⒊多元弱酸盐分步水解,以第一步水解为主,水解方程式一般只写第一步;多元弱碱盐的水解不分步书写。
