【课件比赛作品】化学:第三章第二节第一课时《几种重要的金属化合物》(新人教必修一)
文档属性
| 名称 | 【课件比赛作品】化学:第三章第二节第一课时《几种重要的金属化合物》(新人教必修一) |  | |
| 格式 | rar | ||
| 文件大小 | 626.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-02 14:20:36 | ||
图片预览





文档简介
(共14张PPT)
第二节 几种重要的金属化合物
第一课时
乾安县第四中学化学组:李伟东
一.钠的重要化合物
1.氧化钠和过氧化钠
思考交流
1.回忆实验,描述氧化钠和过氧化钠的颜色,状态。
2.与氧化钙与水、二氧化碳的反应相似,请你写出 氧化钠与水、二氧化碳的反应?
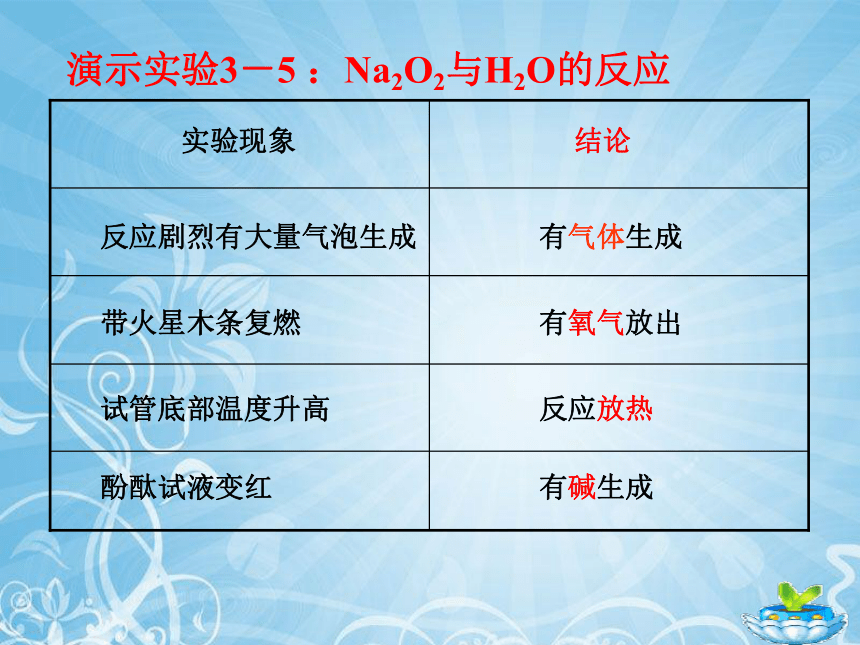
演示实验3-5 :Na2O2与H2O的反应
实验现象
结论
反应剧烈有大量气泡生成
带火星木条复燃
试管底部温度升高
酚酞试液变红
有气体生成
有氧气放出
反应放热
有碱生成
过氧化钠与水反应方程式:
2Na2O2+2H2O=4NaOH+O2↑ 放热
过氧化钠与二氧化碳反应方程式:
2Na2O2+2CO2=2Na2CO3+O2 放热
过氧化钠可作为呼吸面 具或潜水艇中的供氧剂
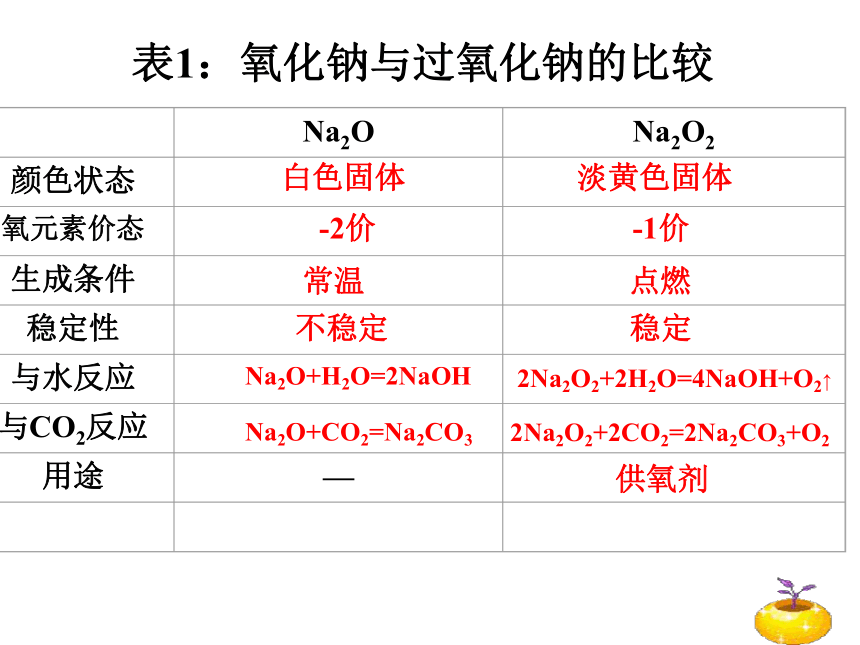
表1:氧化钠与过氧化钠的比较
Na2O
Na2O2
颜色状态
氧元素价态
生成条件
稳定性
与水反应
与CO2反应
用途
—
白色固体 淡黄色固体
-2价 -1价
常温 点燃
不稳定 稳定
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
供氧剂
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
苏氏三兄弟
小苏打
NaHCO3
苏 打(纯碱)
大苏打(海波)
Na2CO3
Na2S2O3
碳酸氢钠
碳酸钠
硫代硫酸钠
(1)在两支试管里分别加入少量的
Na2CO3 和 NaHCO3 (演示实验 )
步骤 Na2CO3 NaHCO3
①
②
③
初步结论
白色粉末,加水
变成晶体:放热
细小白色晶体,
加水部分溶解:吸热
溶解
固体量减少
溶液变红(较深)
溶液变微红色
溶解度比NaHCO3大
碱性比NaHCO3的强
溶解度比Na2CO3小
碱性比Na2CO3的弱
探究园地
(2)Na2CO3 和 NaHCO3 与稀盐酸
反应的离子方程式?
CO32-+ 2H+ = H2O + CO2 ↑
HCO3- + H+ = H2O + CO2 ↑
课外思考
为什么NaHCO3 与稀盐酸反应比Na2CO3与稀盐酸反应产生气体的速度快?
H+与弱酸根及弱酸的酸式根不共存
探究园地
(3)Na2CO3 和 NaHCO3 与BaCl2的反应
方程式
现象
白色沉淀
Na2CO3+BaCl2=BaCO3↓+2NaCl
无现象
NaHCO3
Na2CO3
───────
探究园地
(4)Na2CO3 和 NaHCO3 的热稳定性
现象 方程式 结论
不变混浊
不反应
受热
不分解
变混浊
2NaHCO3=Na2CO3+H2O+CO2↑
加热
受热
易分解
NaHCO3
Na2CO3
探究园地
表2:碳酸钠与碳酸氢钠的比较
碳酸钠
碳酸氢钠
化学式
式量
俗名
颜色状态
水溶性
与酸反应
热稳定性
用途
制玻璃、肥皂等 发酵粉、胃药等
白色粉末 细小白色晶体
纯碱、苏打 小苏打
106 84
Na2CO3 NaHCO3
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
稳定,不易分解 2NaHCO3=Na2CO3+H2O+CO2 ↑
加热
(25℃溶解度为33克)
(25℃溶解度为9克)
课外思考
Na2CO3和NaHCO3分别与Ca(OH)2溶液反应的实验现象和反应方程式。
练一练
如何鉴别固体NaHCO3与Na2CO3
第二节 几种重要的金属化合物
第一课时
乾安县第四中学化学组:李伟东
一.钠的重要化合物
1.氧化钠和过氧化钠
思考交流
1.回忆实验,描述氧化钠和过氧化钠的颜色,状态。
2.与氧化钙与水、二氧化碳的反应相似,请你写出 氧化钠与水、二氧化碳的反应?
演示实验3-5 :Na2O2与H2O的反应
实验现象
结论
反应剧烈有大量气泡生成
带火星木条复燃
试管底部温度升高
酚酞试液变红
有气体生成
有氧气放出
反应放热
有碱生成
过氧化钠与水反应方程式:
2Na2O2+2H2O=4NaOH+O2↑ 放热
过氧化钠与二氧化碳反应方程式:
2Na2O2+2CO2=2Na2CO3+O2 放热
过氧化钠可作为呼吸面 具或潜水艇中的供氧剂
表1:氧化钠与过氧化钠的比较
Na2O
Na2O2
颜色状态
氧元素价态
生成条件
稳定性
与水反应
与CO2反应
用途
—
白色固体 淡黄色固体
-2价 -1价
常温 点燃
不稳定 稳定
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
供氧剂
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
苏氏三兄弟
小苏打
NaHCO3
苏 打(纯碱)
大苏打(海波)
Na2CO3
Na2S2O3
碳酸氢钠
碳酸钠
硫代硫酸钠
(1)在两支试管里分别加入少量的
Na2CO3 和 NaHCO3 (演示实验 )
步骤 Na2CO3 NaHCO3
①
②
③
初步结论
白色粉末,加水
变成晶体:放热
细小白色晶体,
加水部分溶解:吸热
溶解
固体量减少
溶液变红(较深)
溶液变微红色
溶解度比NaHCO3大
碱性比NaHCO3的强
溶解度比Na2CO3小
碱性比Na2CO3的弱
探究园地
(2)Na2CO3 和 NaHCO3 与稀盐酸
反应的离子方程式?
CO32-+ 2H+ = H2O + CO2 ↑
HCO3- + H+ = H2O + CO2 ↑
课外思考
为什么NaHCO3 与稀盐酸反应比Na2CO3与稀盐酸反应产生气体的速度快?
H+与弱酸根及弱酸的酸式根不共存
探究园地
(3)Na2CO3 和 NaHCO3 与BaCl2的反应
方程式
现象
白色沉淀
Na2CO3+BaCl2=BaCO3↓+2NaCl
无现象
NaHCO3
Na2CO3
───────
探究园地
(4)Na2CO3 和 NaHCO3 的热稳定性
现象 方程式 结论
不变混浊
不反应
受热
不分解
变混浊
2NaHCO3=Na2CO3+H2O+CO2↑
加热
受热
易分解
NaHCO3
Na2CO3
探究园地
表2:碳酸钠与碳酸氢钠的比较
碳酸钠
碳酸氢钠
化学式
式量
俗名
颜色状态
水溶性
与酸反应
热稳定性
用途
制玻璃、肥皂等 发酵粉、胃药等
白色粉末 细小白色晶体
纯碱、苏打 小苏打
106 84
Na2CO3 NaHCO3
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
稳定,不易分解 2NaHCO3=Na2CO3+H2O+CO2 ↑
加热
(25℃溶解度为33克)
(25℃溶解度为9克)
课外思考
Na2CO3和NaHCO3分别与Ca(OH)2溶液反应的实验现象和反应方程式。
练一练
如何鉴别固体NaHCO3与Na2CO3
