鲁教版 化学 九年级下册 第七单元 常见的酸和碱复习(32张ppt)
文档属性
| 名称 | 鲁教版 化学 九年级下册 第七单元 常见的酸和碱复习(32张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 874.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-26 11:35:12 | ||
图片预览







文档简介
第七单元 常见的酸和碱
第一节 酸及其性质
一、常见的酸
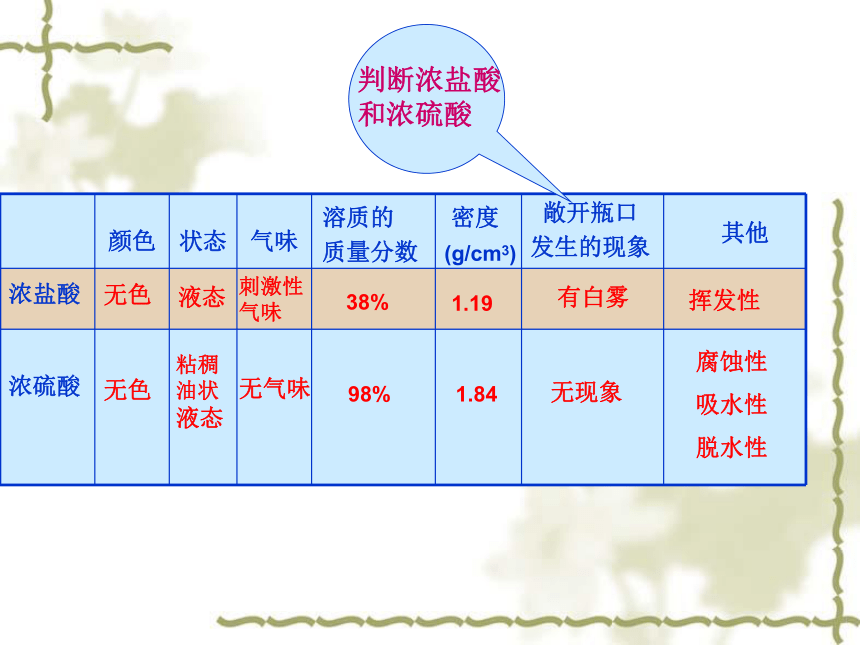
盐酸:氯化氢气体的水溶液,化学式 HCl
硫酸:化学式 H2SO4
颜色
状态
气味
敞开瓶口
发生的现象
粘稠
油状
液态
无色
浓盐酸
无色
液态
无气味
有白雾
无现象
38%
挥发性
1.19
1.84
98%
(g/cm3)
刺激性气味
其他
浓硫酸
溶质的
质量分数
密度
腐蚀性
吸水性
脱水性
判断浓盐酸
和浓硫酸
1、浓盐酸产生白雾的原因
浓盐酸易挥发,挥发出的氯化氢气体与空气中的水蒸气接触,形成盐酸小液滴。
2、敞口放置浓盐酸及浓硫酸后,其各自溶质质量分数的变化情况,以及自身的重量变化情况
溶质质量分数都会降低;浓盐酸的质量会降低,浓硫酸的质量会增加。
3、若不小心将浓硫酸沾到皮肤上,该怎样处理?
立即用大量的水冲洗,然后涂上3%~5%的碳酸氢钠(NaHCO3)溶液。
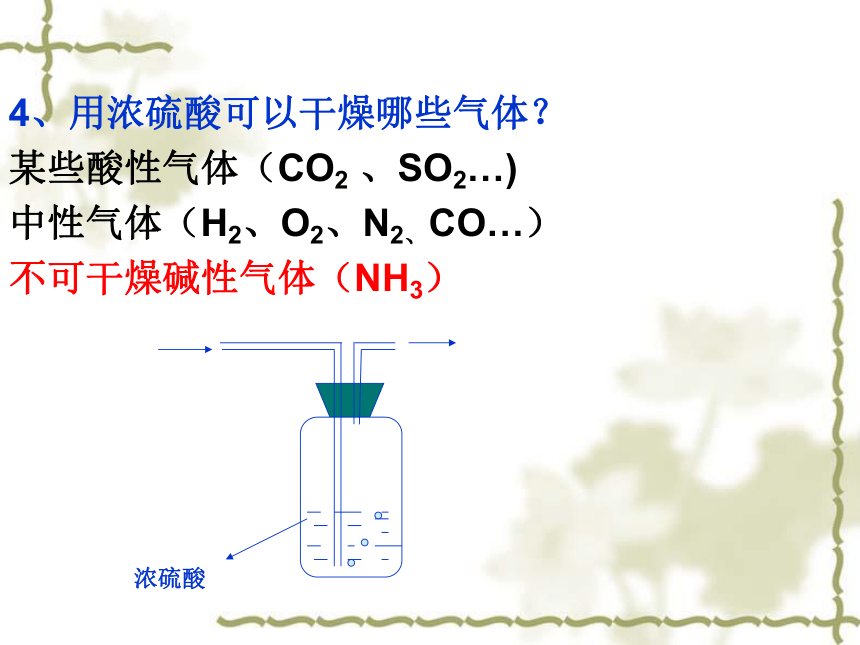
4、用浓硫酸可以干燥哪些气体?
某些酸性气体(CO2 、SO2…)
中性气体(H2、O2、N2、CO…)
不可干燥碱性气体(NH3)
浓硫酸
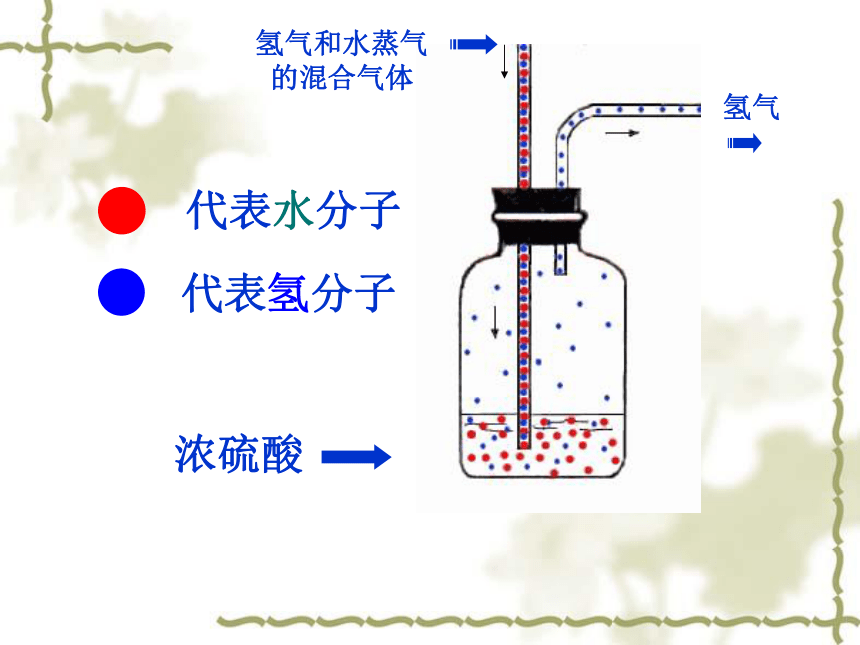
代表水分子
代表氢分子
浓硫酸
氢气和水蒸气
的混合气体
氢气
5、吸水性与脱水性分别属于哪种性质?
吸水性为物理性质
脱水性为化学性质
6、浓硫酸稀释时应怎样做?
把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可将水倒入浓硫酸中!!!
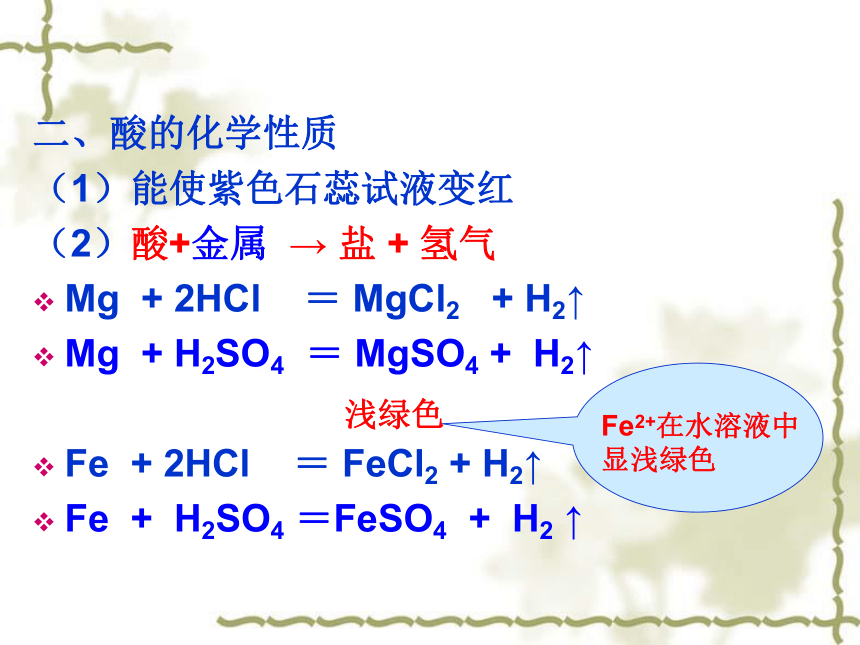
二、酸的化学性质
(1)能使紫色石蕊试液变红
(2)酸+金属 → 盐 + 氢气
Mg + 2HCl = MgCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 =FeSO4 + H2 ↑
Fe2+在水溶液中
显浅绿色
浅绿色
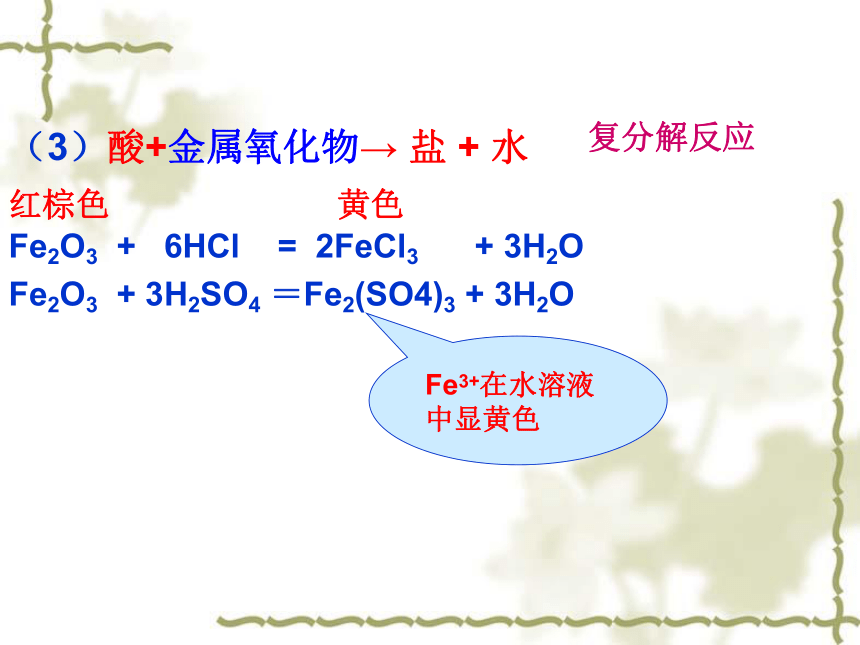
(3)酸+金属氧化物→ 盐 + 水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O
Fe3+在水溶液中显黄色
复分解反应
红棕色
黄色
(4)酸+某些盐 →新酸 + 新盐
Na2CO3(纯碱) + 2HCl = 2NaCl + H2O + CO2 ↑
AgNO3 + HCl = AgCl ↓(白色)+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓(白色) + 2HCl
(5)酸+碱→ 盐 + 水
NaOH + HCl = NaCl + H2O
2NaOH + H2SO4 =Na2SO4+ 2H2O
复分解反应
中和反应 或 复分解反应
酸具有相似化学性质的原因
酸溶液中都含有氢离子(H+)
酸 = H+ + 酸根离子
例:HCl H2SO4 H2CO3 HNO3
CH3COOH(醋酸)
盐
盐 = 金属离子(或铵根) + 酸根离子
NaCl Fe2(SO4)3 (NH4)2SO4
第二节 碱及其性质
一、常见的碱
碱 = 金属离子(或铵根) + OH-
NaOH Ca(OH)2 NH4OH
俗称
颜色
状态
露置在空气中的变化
溶解情况
其他
氢氧化钠
氢氧化钙
烧碱、火
碱、苛性
钠
熟石灰、
消石灰
微溶于水,水溶液俗称
石灰水
腐蚀性
腐蚀性
易溶
于水,
溶解时
放热
吸收水蒸
气而逐渐
溶解
可作干燥剂
固态
白色
白色
固态
无变化,
不可做
干燥剂
易潮解
用NaOH固体作为干燥剂
可干燥碱性(NH3) 、中性(H2、O2、N2 、CO等)
不可干燥酸性气体(CO2 、SO2 等)
装置:
NaOH固体
若不慎将氢氧化钠沾在皮肤上
立即用大量的水冲洗,然后涂上硼酸溶液。
二、碱的化学性质
1、碱与酸碱指示剂反应
紫色石蕊试液
无色酚酞试液
红色石蕊试纸
pH
NaOH、Ca(OH)2
变蓝色
变红色
变蓝色
pH>7
2、酸 + 碱 → 盐 + 水
NaOH + HCl = NaCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
实质:
H++OH- ===H2O
中和反应 或 复分解反应
3、 碱 + 非金属氧化物 →盐 + 水
CO2+Ca(OH)2==CaCO3↓+ H2O
CO2+2NaOH==Na2CO3+H2O
检验CO2的
反应方程式
水蒸气
溶解
CO2
因此, NaOH固体必须密封保存
碱与金属氧化物一般不反应
NaOH固体不仅吸收空气中的( )而
( ),而且与空气中的( )反应
而( )
变质
4、 碱 + 某些盐溶液→新盐 + 新碱
蓝色沉淀
蓝色溶液
2NaOH + CuCl2 == Cu(OH)2 ↓ + 2NaCl
Ca(OH)2 + CuCl2 == Cu(OH)2 ↓ +CaCl2
Ca(OH)2 + Na2CO3== 2NaOH + CaCO3 ↓
纯碱
白色沉淀
Cu2+是蓝色的
复分解反应
区分NaOH溶液与Ca(OH)2溶液的方法
1、分别通入CO2气体,变浑浊的是Ca(OH)2溶液,不变的为NaOH溶液。
2、加入Na2CO3溶液,有白色沉淀产生的是Ca(OH)2溶液,无明显现象的为NaOH溶液。
检验NaOH溶液是否变质的方法
1、加入稀盐酸,若有气泡冒出,则变质。
2、加入澄清石灰水,若有白色沉淀产生,则变质。
AB + CD → AD + CB (相互交换成分)
复分解反应:如果两种化合物互相交换成分,生成另外两种新的化合物,那么这样的反应就叫做复分解反应。
复分解反应
复分解反应的条件
有气体放出,或有沉淀析出,或有水生成。
常见不溶物(沉淀):
BaCO3(白色) CaCO3(白色)
Fe(OH)3(红褐色) Cu(OH)2(蓝色) Mg(OH)2(白色)
AgCl(白色,不溶于酸) BaSO4(白色,不溶于酸)
目前学过的复分解反应有:
⑴酸+金属氧化物=盐+水
Fe2O3+6HCl=2FeCl3+3H2O
⑵酸+碱=盐+水
HCl + NaOH= NaCl + H2O
⑶酸+盐=新酸+新盐
⑷碱+盐=新碱+新盐
CaCO3 + 2 HCl =CaCl2 + H2O + CO2↑
2NaOH + CuCl2 == Cu(OH)2 ↓ + 2NaCl
一、检验酸碱性的方法
石蕊(紫色)试液:
酚酞试液(无色):
红色石蕊试纸:
蓝色石蕊试纸:
第三节 溶液的酸碱性
酸红 ,碱蓝,中紫色
遇酸变红
遇碱变蓝
遇碱变红
二、判断溶液酸碱性的强弱
1、pH值
pH值通常在0~14之间,通常为整数。
pH<7 酸性,越小酸性越强
pH=7 中性
pH>7 碱性,越大碱性越强
2、溶液pH值的测定方法
在洁净干燥的玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液,滴到试纸上,将试纸显示的颜色与标准比色卡对照,读出对应的pH值。
注意:在测溶液的pH值时,pH试纸必须保持干燥,不可用水润湿。
三、物质的酸碱性对生命活动的意义
人的体液的pH值必须在一定的范围内,如果pH超出正常范围,就会导致生理机能失调或 产生疾病。
大多数植物适宜在接近中性的土壤中生长,土壤的酸性太强(pH<4)或碱性太强(pH>8),作物就不能正常生长。
第四节 酸碱中和反应
一、中和反应
特指酸与碱的反应
酸 + 碱 → 盐 + 水
反应实质:
H++OH- ===H2O
二、中和反应的应用
1、通过检查溶液的pH值,可以知道酸碱反应情况。
酸与碱反应,若pH>7,则碱过量
若pH=7, 则恰好完全反应
若pH<7,则酸过量
2、应用
(1)医药卫生
(2)改变土壤的酸碱性
(3)处理工业废水
(4)调节溶液的酸碱性
第一节 酸及其性质
一、常见的酸
盐酸:氯化氢气体的水溶液,化学式 HCl
硫酸:化学式 H2SO4
颜色
状态
气味
敞开瓶口
发生的现象
粘稠
油状
液态
无色
浓盐酸
无色
液态
无气味
有白雾
无现象
38%
挥发性
1.19
1.84
98%
(g/cm3)
刺激性气味
其他
浓硫酸
溶质的
质量分数
密度
腐蚀性
吸水性
脱水性
判断浓盐酸
和浓硫酸
1、浓盐酸产生白雾的原因
浓盐酸易挥发,挥发出的氯化氢气体与空气中的水蒸气接触,形成盐酸小液滴。
2、敞口放置浓盐酸及浓硫酸后,其各自溶质质量分数的变化情况,以及自身的重量变化情况
溶质质量分数都会降低;浓盐酸的质量会降低,浓硫酸的质量会增加。
3、若不小心将浓硫酸沾到皮肤上,该怎样处理?
立即用大量的水冲洗,然后涂上3%~5%的碳酸氢钠(NaHCO3)溶液。
4、用浓硫酸可以干燥哪些气体?
某些酸性气体(CO2 、SO2…)
中性气体(H2、O2、N2、CO…)
不可干燥碱性气体(NH3)
浓硫酸
代表水分子
代表氢分子
浓硫酸
氢气和水蒸气
的混合气体
氢气
5、吸水性与脱水性分别属于哪种性质?
吸水性为物理性质
脱水性为化学性质
6、浓硫酸稀释时应怎样做?
把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可将水倒入浓硫酸中!!!
二、酸的化学性质
(1)能使紫色石蕊试液变红
(2)酸+金属 → 盐 + 氢气
Mg + 2HCl = MgCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 =FeSO4 + H2 ↑
Fe2+在水溶液中
显浅绿色
浅绿色
(3)酸+金属氧化物→ 盐 + 水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O
Fe3+在水溶液中显黄色
复分解反应
红棕色
黄色
(4)酸+某些盐 →新酸 + 新盐
Na2CO3(纯碱) + 2HCl = 2NaCl + H2O + CO2 ↑
AgNO3 + HCl = AgCl ↓(白色)+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓(白色) + 2HCl
(5)酸+碱→ 盐 + 水
NaOH + HCl = NaCl + H2O
2NaOH + H2SO4 =Na2SO4+ 2H2O
复分解反应
中和反应 或 复分解反应
酸具有相似化学性质的原因
酸溶液中都含有氢离子(H+)
酸 = H+ + 酸根离子
例:HCl H2SO4 H2CO3 HNO3
CH3COOH(醋酸)
盐
盐 = 金属离子(或铵根) + 酸根离子
NaCl Fe2(SO4)3 (NH4)2SO4
第二节 碱及其性质
一、常见的碱
碱 = 金属离子(或铵根) + OH-
NaOH Ca(OH)2 NH4OH
俗称
颜色
状态
露置在空气中的变化
溶解情况
其他
氢氧化钠
氢氧化钙
烧碱、火
碱、苛性
钠
熟石灰、
消石灰
微溶于水,水溶液俗称
石灰水
腐蚀性
腐蚀性
易溶
于水,
溶解时
放热
吸收水蒸
气而逐渐
溶解
可作干燥剂
固态
白色
白色
固态
无变化,
不可做
干燥剂
易潮解
用NaOH固体作为干燥剂
可干燥碱性(NH3) 、中性(H2、O2、N2 、CO等)
不可干燥酸性气体(CO2 、SO2 等)
装置:
NaOH固体
若不慎将氢氧化钠沾在皮肤上
立即用大量的水冲洗,然后涂上硼酸溶液。
二、碱的化学性质
1、碱与酸碱指示剂反应
紫色石蕊试液
无色酚酞试液
红色石蕊试纸
pH
NaOH、Ca(OH)2
变蓝色
变红色
变蓝色
pH>7
2、酸 + 碱 → 盐 + 水
NaOH + HCl = NaCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
实质:
H++OH- ===H2O
中和反应 或 复分解反应
3、 碱 + 非金属氧化物 →盐 + 水
CO2+Ca(OH)2==CaCO3↓+ H2O
CO2+2NaOH==Na2CO3+H2O
检验CO2的
反应方程式
水蒸气
溶解
CO2
因此, NaOH固体必须密封保存
碱与金属氧化物一般不反应
NaOH固体不仅吸收空气中的( )而
( ),而且与空气中的( )反应
而( )
变质
4、 碱 + 某些盐溶液→新盐 + 新碱
蓝色沉淀
蓝色溶液
2NaOH + CuCl2 == Cu(OH)2 ↓ + 2NaCl
Ca(OH)2 + CuCl2 == Cu(OH)2 ↓ +CaCl2
Ca(OH)2 + Na2CO3== 2NaOH + CaCO3 ↓
纯碱
白色沉淀
Cu2+是蓝色的
复分解反应
区分NaOH溶液与Ca(OH)2溶液的方法
1、分别通入CO2气体,变浑浊的是Ca(OH)2溶液,不变的为NaOH溶液。
2、加入Na2CO3溶液,有白色沉淀产生的是Ca(OH)2溶液,无明显现象的为NaOH溶液。
检验NaOH溶液是否变质的方法
1、加入稀盐酸,若有气泡冒出,则变质。
2、加入澄清石灰水,若有白色沉淀产生,则变质。
AB + CD → AD + CB (相互交换成分)
复分解反应:如果两种化合物互相交换成分,生成另外两种新的化合物,那么这样的反应就叫做复分解反应。
复分解反应
复分解反应的条件
有气体放出,或有沉淀析出,或有水生成。
常见不溶物(沉淀):
BaCO3(白色) CaCO3(白色)
Fe(OH)3(红褐色) Cu(OH)2(蓝色) Mg(OH)2(白色)
AgCl(白色,不溶于酸) BaSO4(白色,不溶于酸)
目前学过的复分解反应有:
⑴酸+金属氧化物=盐+水
Fe2O3+6HCl=2FeCl3+3H2O
⑵酸+碱=盐+水
HCl + NaOH= NaCl + H2O
⑶酸+盐=新酸+新盐
⑷碱+盐=新碱+新盐
CaCO3 + 2 HCl =CaCl2 + H2O + CO2↑
2NaOH + CuCl2 == Cu(OH)2 ↓ + 2NaCl
一、检验酸碱性的方法
石蕊(紫色)试液:
酚酞试液(无色):
红色石蕊试纸:
蓝色石蕊试纸:
第三节 溶液的酸碱性
酸红 ,碱蓝,中紫色
遇酸变红
遇碱变蓝
遇碱变红
二、判断溶液酸碱性的强弱
1、pH值
pH值通常在0~14之间,通常为整数。
pH<7 酸性,越小酸性越强
pH=7 中性
pH>7 碱性,越大碱性越强
2、溶液pH值的测定方法
在洁净干燥的玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液,滴到试纸上,将试纸显示的颜色与标准比色卡对照,读出对应的pH值。
注意:在测溶液的pH值时,pH试纸必须保持干燥,不可用水润湿。
三、物质的酸碱性对生命活动的意义
人的体液的pH值必须在一定的范围内,如果pH超出正常范围,就会导致生理机能失调或 产生疾病。
大多数植物适宜在接近中性的土壤中生长,土壤的酸性太强(pH<4)或碱性太强(pH>8),作物就不能正常生长。
第四节 酸碱中和反应
一、中和反应
特指酸与碱的反应
酸 + 碱 → 盐 + 水
反应实质:
H++OH- ===H2O
二、中和反应的应用
1、通过检查溶液的pH值,可以知道酸碱反应情况。
酸与碱反应,若pH>7,则碱过量
若pH=7, 则恰好完全反应
若pH<7,则酸过量
2、应用
(1)医药卫生
(2)改变土壤的酸碱性
(3)处理工业废水
(4)调节溶液的酸碱性
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
