鲁教版九年级下册化学 8.3海水“制碱” 课件(23张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 8.3海水“制碱” 课件(23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 647.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-26 00:00:00 | ||
图片预览






文档简介
Na2CO3
俗称:纯碱或苏打
第三节 海水“制碱”
自然界中有天然纯碱
内蒙古鄂尔多斯合同查汗淖碱湖
工业上是如何制纯碱?
天然碱
盐湖
纯碱(Na2CO3)
在工业上以氯化钠为主要原料,制取碳酸钠。
思考:NaCl Na2CO3 从组成上看发生了什么变化?你认为还需要含什么元素的物质参加反应?
制取碳酸钠所需要的反应物有:氯化钠、
二氧化碳。仅此这两种物质你认为行不行?
还需要:水、氨气
C、O
(媒介作用)
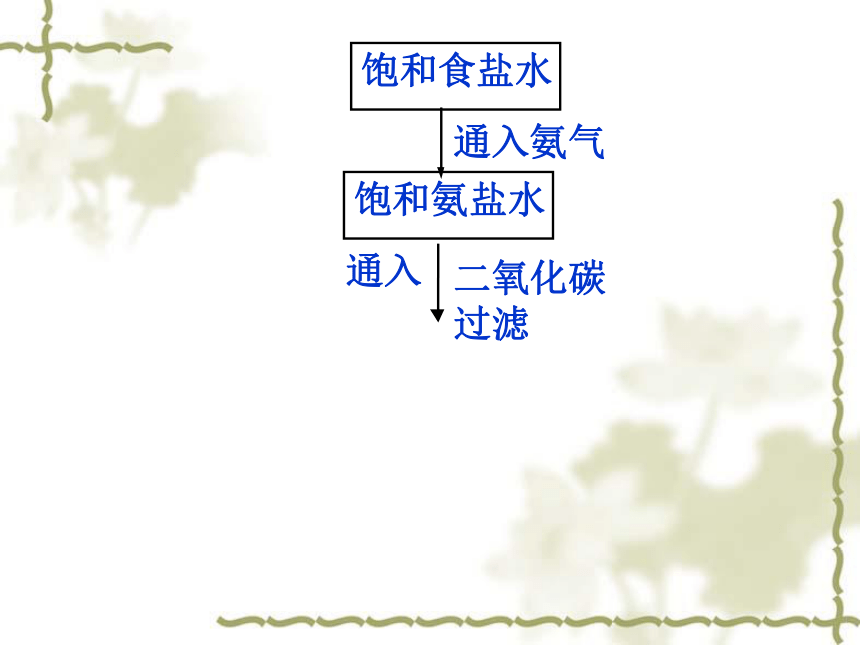
饱和食盐水
饱和氨盐水
通入
二氧化碳过滤
通入氨气
NaHCO3
加热
饱和食盐水
通入
饱和氨盐水
NH3
CO2过滤
NH4Cl
Na2CO3
NH3
熟石灰
NaCl +NH3+CO2+H2O== NaHCO3+ NH4Cl
2NaHCO3 ==== Na2CO3+CO2↑+ H2O
氨碱法制纯碱原理
△
Ca(OH)2+ 2NH4Cl == CaCl2 +2NH3 ↑ +2H2O
△
思考:
1、为什么采用饱和的食盐水?
3、氨盐水吸收二氧化碳后生成的碳酸 氢 钠和氯化铵,那种物质首先析出?
为什么?(提示:根据课本39页溶解度曲线)
2、在生产过程中为什么要先通入氨气得到饱和的氨盐水后再通入二氧化碳?
提高产量
使溶液显碱性,吸收更多的 CO2
NaHCO3,在同一温度下NaHCO3溶解度小
凡是黄头发蓝眼睛的人能办到的,我们黑头发黑眼睛的人也一定能办到!
侯德榜
1862年比利时科学家索尔维发明了氨碱法制纯碱,并对制碱技术进行了垄断。
侯氏制碱法的诞生
1921年10月侯德榜接受了永利碱业公司的聘请,毅然从美国启程回国,决心自己开发制碱新工艺, 经过600多次研究实验,分析了2000多个样品,历时5年,于1942年发明并创立了举世闻名的“侯氏制碱法”。本可以高价出售这一专利而获得巨额财富的侯德榜却把它公布于众,让世界各国人民共享这一科技成果,促进了世界制碱技术的发展。
侯氏制碱法的反应原理
① NaCl+ NH3+ H2O + CO2=== NaHCO3+ NH4Cl
② 2NaHCO3 ===== Na2CO3 + H2O + CO2↑
③向析出NaHCO3的母液中加入研细的NaCI,还得到另一产品NH4CI固体。
△
阅读课本44页多识一点:侯氏制碱法问题:
1、氨碱法制纯碱的优、缺点?
2、侯氏制碱法优于氨碱法之处是什么?
答:(1)氨碱法优点原料经济易得、CO2和NH3可回 收利用,缺点是CaCl2用处不大,污染环境。 NaCl利 用率低。
(2)侯氏制碱法优点NaCl可以循环利用,NH4Cl
可作化肥。
探究一:碳酸钠和碳酸氢钠的性质
碳酸钠
碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色 晶体
白色 粉末
可溶
显碱性
灭火器、制饮料、
发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易溶
显弱碱性
受热不易分解
受热易分解
无色酚酞
稀盐酸
氢氧化钙溶液
氯化钡溶液
实验现象
有气泡产生
反应表达式
变红
无
白色沉淀
白色沉淀
BaCl2+Na2CO3=BaCO3↓+ 2NaCl
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 +2HCl =2NaCl+CO2↑+ H2O
探究二:碳酸钠的化学性质:把以下几种溶液分别和碳酸钠溶液混合
★
化学性质:
1、受热易分解
2、与酸反应
NaHCO3+HCl == NaCl + CO2 ↑+ H2O
2NaHCO3 == Na2CO3 + CO2 ↑ + H2O
探究三:联系你学过的知识并根据碳酸氢钠的组成,
猜测碳酸氢钠可能具有哪些化学性质?
△
3、溶液显碱性
注:1、碳酸氢钠还有其它性质。
2、根据物质的储存方法可以推测出物质所具有的化学性质。如:低温、避光可推测出物质受热、见光易分解;
复分解反应
(1)定义
两种化合物互相交换位置生成另外两种化合物的反应。
(2)公式:
(3)发生条件:
AB + CD = AD + CB
(1)反应物、生成物都是化合物。
(2)生成物中必须具备沉淀、气体、
水三者中的任何一个。
(4)复分解反应的实质:
以盐酸和氢氧化钠反应为例
HCl + NaOH = NaCI + H2O
(5)复分解反应的应用:
溶液中离子、化合物是否可以共存
﹛
H+
OH-
CO32-
OH-
﹛
H+
Mg2+ Fe3+ Cu2+ Al3+ NH+4
CO32-
﹛
H+
Ca2+ 、Ba2+等
Cl- ---
Ag+
SO42- ---
Ba2+
以下离子在溶液中不能共存
三.盐
1.定义:
金属离子和酸根离子组成的化合物。
2.分类(1):
按溶于水显示的颜色
无色:
蓝色:
黄色:
浅绿色:
钾、钠、铵、镁、铝、银、钡等 盐
铜盐 ( CuCl2 CuSO4 Cu(NO3)2 )
铁盐 ( FeCl3 Fe2(SO4)3 Fe(NO3)3)
亚铁盐 ( FeCl2 FeSO4 Fe(NO3)2)
分类(2):
按溶解性
可溶:
微溶:
难容:
钾、钠、铵、硝酸盐、都溶,
AgCl、 BaSO4、 CaCO3、 BaCO3
CaSO4 等
1.盛夏,在烈日下工作、出汗过多的人,所穿的深色衣服上会出现一些细小白色粉末,其主要成分为( )
A.纯碱 B.烧碱
C.氯化钠 D.油脂
2.在盐酸中加入下列物质后,溶液的pH不会显著升高的是 ( )
A、Fe(OH)3 B、Na2CO3
C、AgNO3 D、NaOH
课堂检测
3.下列物质俗名或主要成分与化学式不相符的是 ( )
A.纯碱 NaOH B.小苏打 NaHCO3
C.大理石 CaCO3 D.食盐 NaCl
4.检验碳酸盐的正确方法是( )
A.滴加盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加盐酸产生使澄清石灰水变浑浊的气体
课堂检测
5. 下列能在水中大量共存的一组离子是( )
A.K+、OH-、NO3-、H+ B.K+、Ag+、NO3-、Cl-
C.Ba2+、H+、Cl-、SO42- D.Na+、Ba2+、OH- 、NO3-
6.某化学活动小组同学打算用过滤方法分离下列混合物,其中不适宜用此法分离的一组是( )
A.碳酸钾、碳酸钙 B.氯化钡、氯化银
C.氢氧化钡、硫酸钡 D.硝酸银、硝酸钡
课堂检测
7.除去氯化钠中的杂质碳酸钠,下列方法能实现的是( )
A.加适量硝酸,蒸发结晶
B.加适量氯化钙,过滤后蒸发结晶
C.加适量氢氧化钡,过滤后蒸发结晶
D.加适量氢氧化钠,过滤后蒸发结晶
课堂检测
俗称:纯碱或苏打
第三节 海水“制碱”
自然界中有天然纯碱
内蒙古鄂尔多斯合同查汗淖碱湖
工业上是如何制纯碱?
天然碱
盐湖
纯碱(Na2CO3)
在工业上以氯化钠为主要原料,制取碳酸钠。
思考:NaCl Na2CO3 从组成上看发生了什么变化?你认为还需要含什么元素的物质参加反应?
制取碳酸钠所需要的反应物有:氯化钠、
二氧化碳。仅此这两种物质你认为行不行?
还需要:水、氨气
C、O
(媒介作用)
饱和食盐水
饱和氨盐水
通入
二氧化碳过滤
通入氨气
NaHCO3
加热
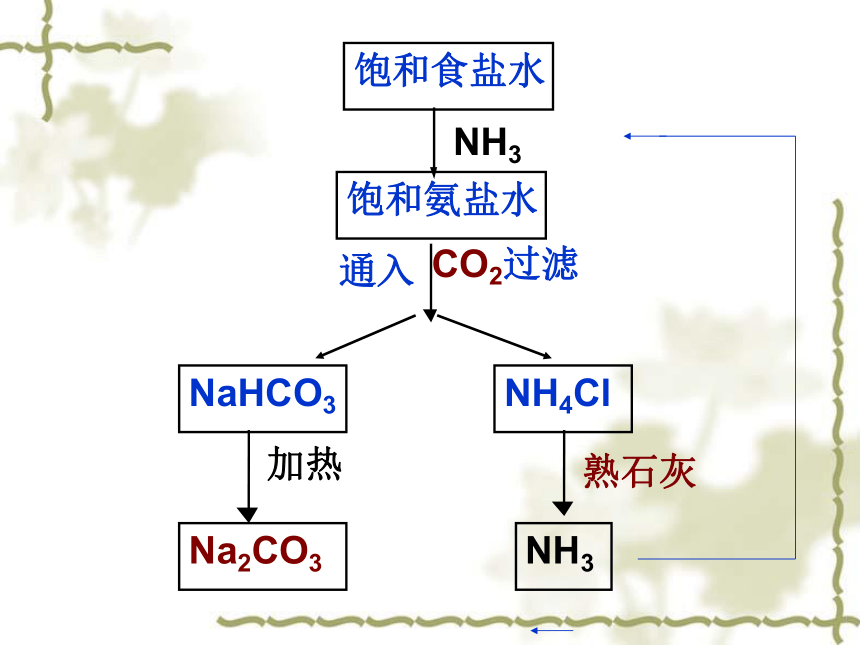
饱和食盐水
通入
饱和氨盐水
NH3
CO2过滤
NH4Cl
Na2CO3
NH3
熟石灰
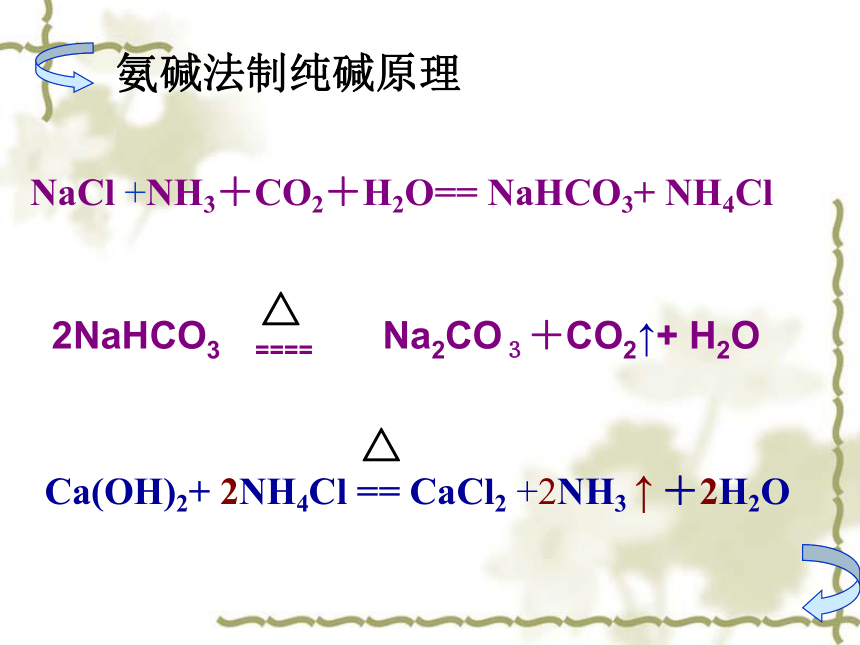
NaCl +NH3+CO2+H2O== NaHCO3+ NH4Cl
2NaHCO3 ==== Na2CO3+CO2↑+ H2O
氨碱法制纯碱原理
△
Ca(OH)2+ 2NH4Cl == CaCl2 +2NH3 ↑ +2H2O
△
思考:
1、为什么采用饱和的食盐水?
3、氨盐水吸收二氧化碳后生成的碳酸 氢 钠和氯化铵,那种物质首先析出?
为什么?(提示:根据课本39页溶解度曲线)
2、在生产过程中为什么要先通入氨气得到饱和的氨盐水后再通入二氧化碳?
提高产量
使溶液显碱性,吸收更多的 CO2
NaHCO3,在同一温度下NaHCO3溶解度小
凡是黄头发蓝眼睛的人能办到的,我们黑头发黑眼睛的人也一定能办到!
侯德榜
1862年比利时科学家索尔维发明了氨碱法制纯碱,并对制碱技术进行了垄断。
侯氏制碱法的诞生
1921年10月侯德榜接受了永利碱业公司的聘请,毅然从美国启程回国,决心自己开发制碱新工艺, 经过600多次研究实验,分析了2000多个样品,历时5年,于1942年发明并创立了举世闻名的“侯氏制碱法”。本可以高价出售这一专利而获得巨额财富的侯德榜却把它公布于众,让世界各国人民共享这一科技成果,促进了世界制碱技术的发展。
侯氏制碱法的反应原理
① NaCl+ NH3+ H2O + CO2=== NaHCO3+ NH4Cl
② 2NaHCO3 ===== Na2CO3 + H2O + CO2↑
③向析出NaHCO3的母液中加入研细的NaCI,还得到另一产品NH4CI固体。
△
阅读课本44页多识一点:侯氏制碱法问题:
1、氨碱法制纯碱的优、缺点?
2、侯氏制碱法优于氨碱法之处是什么?
答:(1)氨碱法优点原料经济易得、CO2和NH3可回 收利用,缺点是CaCl2用处不大,污染环境。 NaCl利 用率低。
(2)侯氏制碱法优点NaCl可以循环利用,NH4Cl
可作化肥。
探究一:碳酸钠和碳酸氢钠的性质
碳酸钠
碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色 晶体
白色 粉末
可溶
显碱性
灭火器、制饮料、
发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易溶
显弱碱性
受热不易分解
受热易分解
无色酚酞
稀盐酸
氢氧化钙溶液
氯化钡溶液
实验现象
有气泡产生
反应表达式
变红
无
白色沉淀
白色沉淀
BaCl2+Na2CO3=BaCO3↓+ 2NaCl
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 +2HCl =2NaCl+CO2↑+ H2O
探究二:碳酸钠的化学性质:把以下几种溶液分别和碳酸钠溶液混合
★
化学性质:
1、受热易分解
2、与酸反应
NaHCO3+HCl == NaCl + CO2 ↑+ H2O
2NaHCO3 == Na2CO3 + CO2 ↑ + H2O
探究三:联系你学过的知识并根据碳酸氢钠的组成,
猜测碳酸氢钠可能具有哪些化学性质?
△
3、溶液显碱性
注:1、碳酸氢钠还有其它性质。
2、根据物质的储存方法可以推测出物质所具有的化学性质。如:低温、避光可推测出物质受热、见光易分解;
复分解反应
(1)定义
两种化合物互相交换位置生成另外两种化合物的反应。
(2)公式:
(3)发生条件:
AB + CD = AD + CB
(1)反应物、生成物都是化合物。
(2)生成物中必须具备沉淀、气体、
水三者中的任何一个。
(4)复分解反应的实质:
以盐酸和氢氧化钠反应为例
HCl + NaOH = NaCI + H2O
(5)复分解反应的应用:
溶液中离子、化合物是否可以共存
﹛
H+
OH-
CO32-
OH-
﹛
H+
Mg2+ Fe3+ Cu2+ Al3+ NH+4
CO32-
﹛
H+
Ca2+ 、Ba2+等
Cl- ---
Ag+
SO42- ---
Ba2+
以下离子在溶液中不能共存
三.盐
1.定义:
金属离子和酸根离子组成的化合物。
2.分类(1):
按溶于水显示的颜色
无色:
蓝色:
黄色:
浅绿色:
钾、钠、铵、镁、铝、银、钡等 盐
铜盐 ( CuCl2 CuSO4 Cu(NO3)2 )
铁盐 ( FeCl3 Fe2(SO4)3 Fe(NO3)3)
亚铁盐 ( FeCl2 FeSO4 Fe(NO3)2)
分类(2):
按溶解性
可溶:
微溶:
难容:
钾、钠、铵、硝酸盐、都溶,
AgCl、 BaSO4、 CaCO3、 BaCO3
CaSO4 等
1.盛夏,在烈日下工作、出汗过多的人,所穿的深色衣服上会出现一些细小白色粉末,其主要成分为( )
A.纯碱 B.烧碱
C.氯化钠 D.油脂
2.在盐酸中加入下列物质后,溶液的pH不会显著升高的是 ( )
A、Fe(OH)3 B、Na2CO3
C、AgNO3 D、NaOH
课堂检测
3.下列物质俗名或主要成分与化学式不相符的是 ( )
A.纯碱 NaOH B.小苏打 NaHCO3
C.大理石 CaCO3 D.食盐 NaCl
4.检验碳酸盐的正确方法是( )
A.滴加盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加盐酸产生使澄清石灰水变浑浊的气体
课堂检测
5. 下列能在水中大量共存的一组离子是( )
A.K+、OH-、NO3-、H+ B.K+、Ag+、NO3-、Cl-
C.Ba2+、H+、Cl-、SO42- D.Na+、Ba2+、OH- 、NO3-
6.某化学活动小组同学打算用过滤方法分离下列混合物,其中不适宜用此法分离的一组是( )
A.碳酸钾、碳酸钙 B.氯化钡、氯化银
C.氢氧化钡、硫酸钡 D.硝酸银、硝酸钡
课堂检测
7.除去氯化钠中的杂质碳酸钠,下列方法能实现的是( )
A.加适量硝酸,蒸发结晶
B.加适量氯化钙,过滤后蒸发结晶
C.加适量氢氧化钡,过滤后蒸发结晶
D.加适量氢氧化钠,过滤后蒸发结晶
课堂检测
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
