鲁教版九年级下册化学 9.2金属的化学性质 课件(17张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 9.2金属的化学性质 课件(17张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 264.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-26 21:15:48 | ||
图片预览





文档简介
铝在空气中剧烈燃烧,生成白色固体
反应的化学方程式为
实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。
镁、铝在常温下极易与氧气反应。
铁、铜在一定条件下能与氧气反应。
金即使在高温时也不能与氧气反应。
A组:3只试管里已分别加入约5mL稀盐酸,现在请分别放入适量的铁、铜、铝。
B组:用稀硫酸代替稀盐酸进行实验,并比较发生的现象。
金属铁、铜、铝与酸反应的比较
2、下列物质不能由金属和酸反应直接生成的是 ( )
A ZnCl2 B CuSO4
C FeCl2 D Al2(SO4)3
3、下列化学变化属于置换反应的有( )
A CO+Fe2O3→Fe+CO2
B C+Fe2O3 → Fe+CO2
C H2O2 → H2O+O2
D Fe+AgNO3 → Fe(NO3)2+Ag
第二节
金属的化学性质
铁丝在纯氧中燃烧
铜在酒精灯上加热
?
镁在空气中燃烧
活泼性比较
化学方程式
现 象
实 验
回忆:金属与氧气反应的现象以及方程式
发出耀眼的白光,放热,生成白色固体
金属铜由红色变为黑色
火星四射,放出大量的热,生成黑色固体
? 点燃
3Fe+2O2== Fe3O4
△
2Cu+O2 ==2CuO
? 点燃
2Mg+O2==2MgO
观察:铝在空气中燃烧的现象
写出铝在空气中反应的化学方程式
点燃
4Al+3O2==2Al2O3
活动性:镁、铝 > 铁、铜 > 金
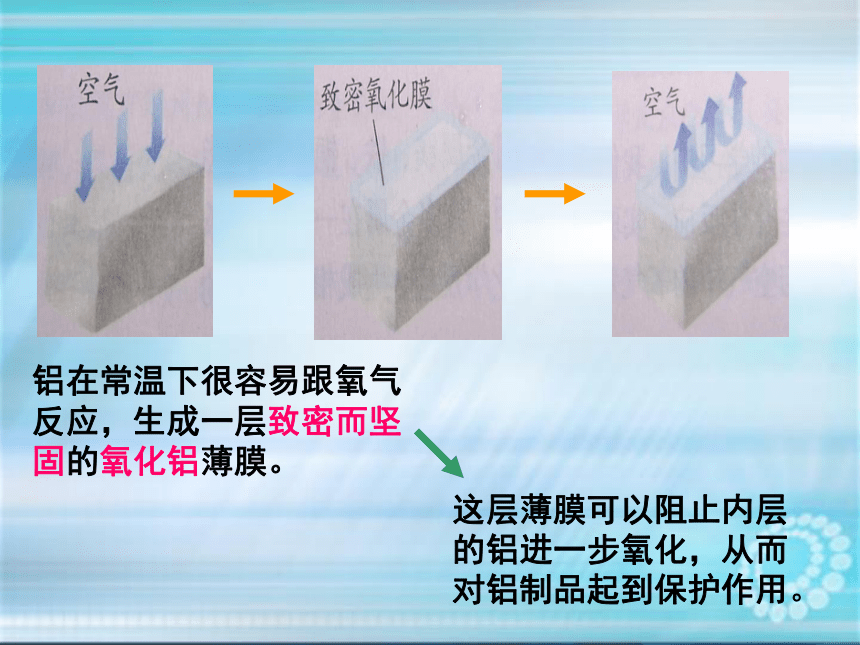
为什么铝制品不易生锈?
铝在常温下很容易跟氧气反应,生成一层致密而坚固的氧化铝薄膜。
这层薄膜可以阻止内层的铝进一步氧化,从而对铝制品起到保护作用。
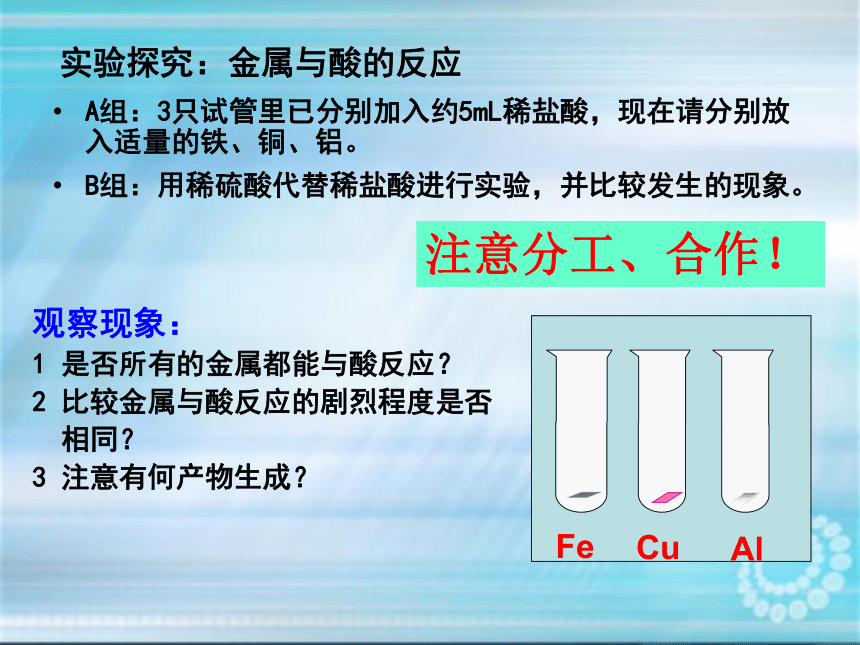
实验探究:金属与酸的反应
Al
Fe
Cu
注意分工、合作!
观察现象:
1 是否所有的金属都能与酸反应?
2 比较金属与酸反应的剧烈程度是否
相同?
3 注意有何产物生成?
问题:
1.金属铁铜铝中哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与盐酸、稀硫酸发生反应?反应后生成了什么气体?
铝、铁能与盐酸、稀硫酸发生反应,反应后生成了氢气。铜不能与盐酸、稀硫酸发生反应。
铁铜铝三种金属与酸反应时,铝最剧烈,铁次之,铜不反应。
2.比较铁铜铝三种金属分别与盐酸、稀硫酸反应的难易和剧烈程度?
铝
铁
铜
铜
铁
铝
与硫酸反应的方程式
与盐酸反应的方程式
反应现象
大量气泡,
反应最快
少量气泡,
反应适中
无现象
Fe + 2HCl = FeCl2 + H2↑
2Al + 6HCl = 2AlCl3 +
3H2↑
Fe + H2SO4 = FeSO4 + H2↑
2Al + 3 H2SO4 =
Al2(SO4 )3+ 3H2↑
将三种金属的活动性由强到弱的顺序进行排列。
三种金属的活动性强弱:
Al > Fe > Cu
K
Sn
Ca
Mg
Na
Al
Zn
Fe
Pb
(H)
Cu
Hg
Ag
Pt
Au
常见金属在溶液中的活动性如下:
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2. 排在氢前面的金属能与酸反应,放出氢气。排在氢后面的金属不能与酸反应。
观察以下反应的共同特征
Fe + 2HCl = H2 ↑ + FeCl2
2Al + 6HCl = 3H2 ↑ + 2AlCl3
2Al + 3 H2SO4 = 3H2 ↑ + Al2(SO4 )3
Fe + H2SO4 = H2↑ + FeSO4
新化合物
新单质
化合物
单质
小结:这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
置换反应:
单质+化合物=另一单质+另一化合物
A + BC → B + AC
通过这节课的学习你有哪些收获呢?
你呢?
1 、判断下列物质能否发生反应?若能,写出相关化学方程式。
(1)银与稀盐酸 (2)锌与稀硫酸溶液
(3)金与稀盐酸溶液 (4)镁与稀硫酸溶液 (5)镁与稀盐酸溶液 (6)锌与稀盐酸溶液
可发生反应的:(2)(4)(5)(6)
(2)Zn + H2SO4 = ZnSO4 + H2↑
(4)Mg + H2SO4 = MgSO4 + H2↑
(5)Mg + 2HCl = MgCl2 + H2↑
(6)Zn + 2HCl = ZnCl2 + H2↑
练习
B
BD
反应的化学方程式为
实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。
镁、铝在常温下极易与氧气反应。
铁、铜在一定条件下能与氧气反应。
金即使在高温时也不能与氧气反应。
A组:3只试管里已分别加入约5mL稀盐酸,现在请分别放入适量的铁、铜、铝。
B组:用稀硫酸代替稀盐酸进行实验,并比较发生的现象。
金属铁、铜、铝与酸反应的比较
2、下列物质不能由金属和酸反应直接生成的是 ( )
A ZnCl2 B CuSO4
C FeCl2 D Al2(SO4)3
3、下列化学变化属于置换反应的有( )
A CO+Fe2O3→Fe+CO2
B C+Fe2O3 → Fe+CO2
C H2O2 → H2O+O2
D Fe+AgNO3 → Fe(NO3)2+Ag
第二节
金属的化学性质
铁丝在纯氧中燃烧
铜在酒精灯上加热
?
镁在空气中燃烧
活泼性比较
化学方程式
现 象
实 验
回忆:金属与氧气反应的现象以及方程式
发出耀眼的白光,放热,生成白色固体
金属铜由红色变为黑色
火星四射,放出大量的热,生成黑色固体
? 点燃
3Fe+2O2== Fe3O4
△
2Cu+O2 ==2CuO
? 点燃
2Mg+O2==2MgO
观察:铝在空气中燃烧的现象
写出铝在空气中反应的化学方程式
点燃
4Al+3O2==2Al2O3
活动性:镁、铝 > 铁、铜 > 金
为什么铝制品不易生锈?
铝在常温下很容易跟氧气反应,生成一层致密而坚固的氧化铝薄膜。
这层薄膜可以阻止内层的铝进一步氧化,从而对铝制品起到保护作用。
实验探究:金属与酸的反应
Al
Fe
Cu
注意分工、合作!
观察现象:
1 是否所有的金属都能与酸反应?
2 比较金属与酸反应的剧烈程度是否
相同?
3 注意有何产物生成?
问题:
1.金属铁铜铝中哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与盐酸、稀硫酸发生反应?反应后生成了什么气体?
铝、铁能与盐酸、稀硫酸发生反应,反应后生成了氢气。铜不能与盐酸、稀硫酸发生反应。
铁铜铝三种金属与酸反应时,铝最剧烈,铁次之,铜不反应。
2.比较铁铜铝三种金属分别与盐酸、稀硫酸反应的难易和剧烈程度?
铝
铁
铜
铜
铁
铝
与硫酸反应的方程式
与盐酸反应的方程式
反应现象
大量气泡,
反应最快
少量气泡,
反应适中
无现象
Fe + 2HCl = FeCl2 + H2↑
2Al + 6HCl = 2AlCl3 +
3H2↑
Fe + H2SO4 = FeSO4 + H2↑
2Al + 3 H2SO4 =
Al2(SO4 )3+ 3H2↑
将三种金属的活动性由强到弱的顺序进行排列。
三种金属的活动性强弱:
Al > Fe > Cu
K
Sn
Ca
Mg
Na
Al
Zn
Fe
Pb
(H)
Cu
Hg
Ag
Pt
Au
常见金属在溶液中的活动性如下:
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2. 排在氢前面的金属能与酸反应,放出氢气。排在氢后面的金属不能与酸反应。
观察以下反应的共同特征
Fe + 2HCl = H2 ↑ + FeCl2
2Al + 6HCl = 3H2 ↑ + 2AlCl3
2Al + 3 H2SO4 = 3H2 ↑ + Al2(SO4 )3
Fe + H2SO4 = H2↑ + FeSO4
新化合物
新单质
化合物
单质
小结:这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
置换反应:
单质+化合物=另一单质+另一化合物
A + BC → B + AC
通过这节课的学习你有哪些收获呢?
你呢?
1 、判断下列物质能否发生反应?若能,写出相关化学方程式。
(1)银与稀盐酸 (2)锌与稀硫酸溶液
(3)金与稀盐酸溶液 (4)镁与稀硫酸溶液 (5)镁与稀盐酸溶液 (6)锌与稀盐酸溶液
可发生反应的:(2)(4)(5)(6)
(2)Zn + H2SO4 = ZnSO4 + H2↑
(4)Mg + H2SO4 = MgSO4 + H2↑
(5)Mg + 2HCl = MgCl2 + H2↑
(6)Zn + 2HCl = ZnCl2 + H2↑
练习
B
BD
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
