2021届高考化学 考前8天 实验基础 课件(34张ppt)
文档属性
| 名称 | 2021届高考化学 考前8天 实验基础 课件(34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 741.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-28 21:49:20 | ||
图片预览





文档简介
2021
高考倒计时●化学
实验基础
01
核 心 速 记
02
易 错 剖 析
目录
03
自 我 检 测
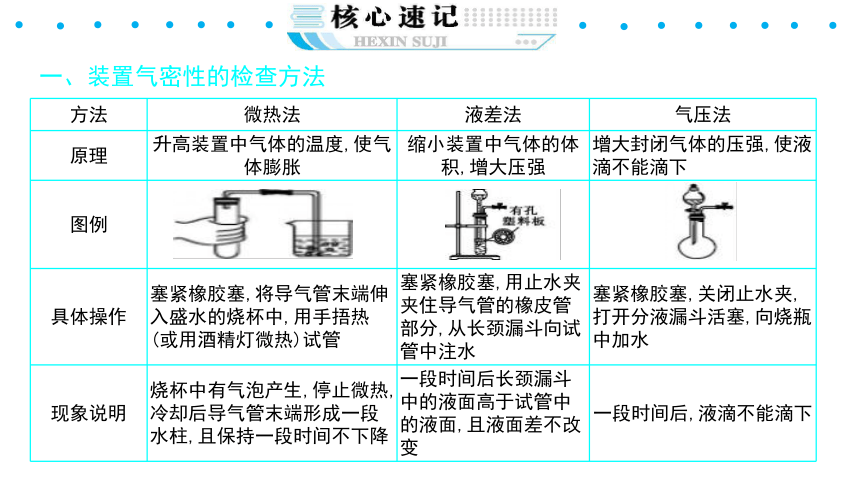
一、装置气密性的检查方法
{5940675A-B579-460E-94D1-54222C63F5DA}方法
微热法
液差法
气压法
原理
升高装置中气体的温度,使气体膨胀
缩小装置中气体的体积,增大压强
增大封闭气体的压强,使液滴不能滴下
图例
具体操作
塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)试管
塞紧橡胶塞,用止水夹夹住导气管的橡皮管部分,从长颈漏斗向试管中注水
塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向烧瓶中加水
现象说明
烧杯中有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降
一段时间后长颈漏斗中的液面高于试管中的液面,且液面差不改变
一段时间后,液滴不能滴下
二、常见物质(或离子)的检验
1.常见气体的检验
{5940675A-B579-460E-94D1-54222C63F5DA}常见气体
检验方法
H2
纯净的氢气在空气中燃烧火焰呈淡蓝色,混合气点燃有爆鸣声,生成物只有水
O2
可使带火星的木条复燃
Cl2
黄绿色气体,能使湿润的淀粉碘化钾试纸变蓝
SO2
无色有刺激性气味的气体,能使品红溶液褪色,加热后又显红色;能使酸性高锰酸钾溶液褪色
NH3
无色有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝;用蘸有浓盐酸的玻璃棒靠近时能生成白烟
NO2
红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液呈酸性
NO
无色气体,在空气中立即变成红棕色
CO2
无色无味气体,能使澄清石灰水变浑浊;能使燃着的木条熄灭
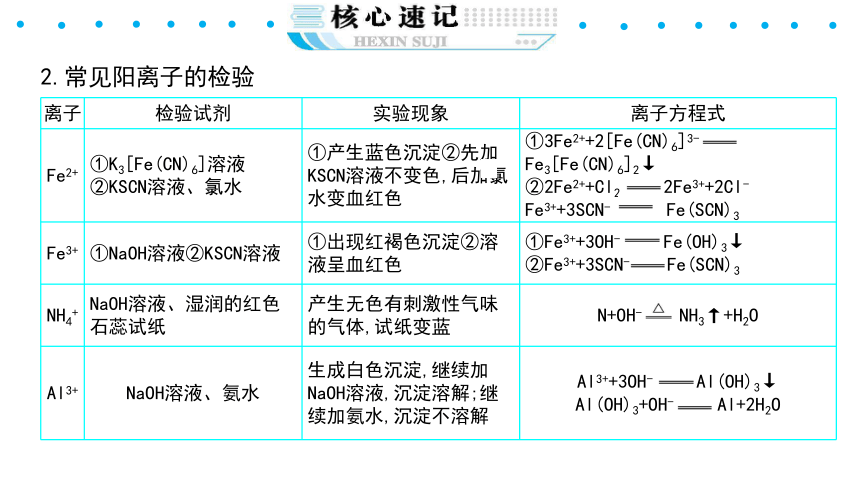
2.常见阳离子的检验
{5940675A-B579-460E-94D1-54222C63F5DA}离子
检验试剂
实验现象
离子方程式
Fe2+
①K3[Fe(CN)6]溶液②KSCN溶液、氯水
①产生蓝色沉淀②先加KSCN溶液不变色,后加氯水变血红色
①3Fe2++2[Fe(CN)6]3-Fe3[Fe(CN)6]2↓
②2Fe2++Cl2 2Fe3++2Cl-
Fe3++3SCN- Fe(SCN)3
Fe3+
①NaOH溶液②KSCN溶液
①出现红褐色沉淀②溶液呈血红色
①Fe3++3OH- Fe(OH)3↓
②Fe3++3SCN- Fe(SCN)3
NH4+
NaOH溶液、湿润的红色石蕊试纸
产生无色有刺激性气味的气体,试纸变蓝
N+OH- NH3↑+H2O
Al3+
NaOH溶液、氨水
生成白色沉淀,继续加NaOH溶液,沉淀溶解;继续加氨水,沉淀不溶解
Al3++3OH- Al(OH)3↓
Al(OH)3+OH- Al+2H2O
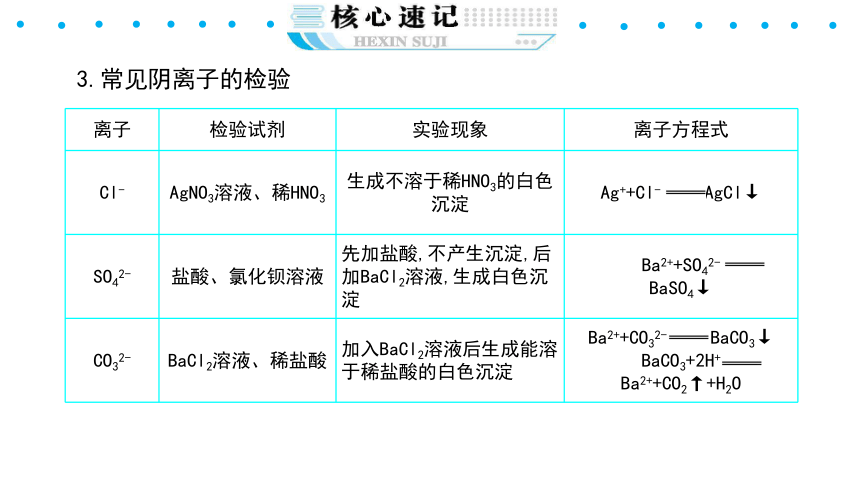
3.常见阴离子的检验
{5940675A-B579-460E-94D1-54222C63F5DA}离子
检验试剂
实验现象
离子方程式
Cl-
AgNO3溶液、稀HNO3
生成不溶于稀HNO3的白色沉淀
Ag++Cl- AgCl↓
SO42-
盐酸、氯化钡溶液
先加盐酸,不产生沉淀,后加BaCl2溶液,生成白色沉淀
Ba2++SO42-
BaSO4↓
CO32-
BaCl2溶液、稀盐酸
加入BaCl2溶液后生成能溶于稀盐酸的白色沉淀
Ba2++CO32- BaCO3↓
BaCO3+2H+ Ba2++CO2↑+H2O
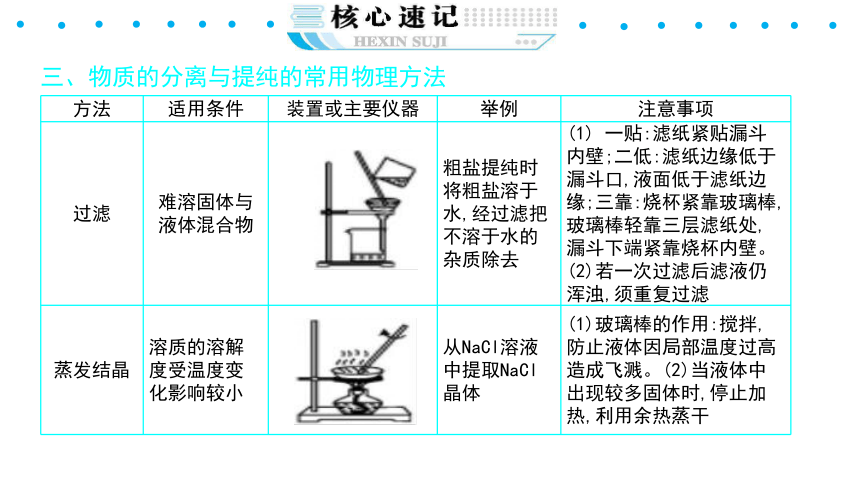
三、物质的分离与提纯的常用物理方法
{5940675A-B579-460E-94D1-54222C63F5DA}方法
适用条件
装置或主要仪器
举例
注意事项
过滤
难溶固体与液体混合物
粗盐提纯时将粗盐溶于水,经过滤把不溶于水的杂质除去
(1) 一贴:滤纸紧贴漏斗内壁;二低:滤纸边缘低于漏斗口,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。(2)若一次过滤后滤液仍浑浊,须重复过滤
蒸发结晶
溶质的溶解度受温度变化影响较小
从NaCl溶液中提取NaCl晶体
(1)玻璃棒的作用:搅拌,防止液体因局部温度过高造成飞溅。(2)当液体中出现较多固体时,停止加热,利用余热蒸干
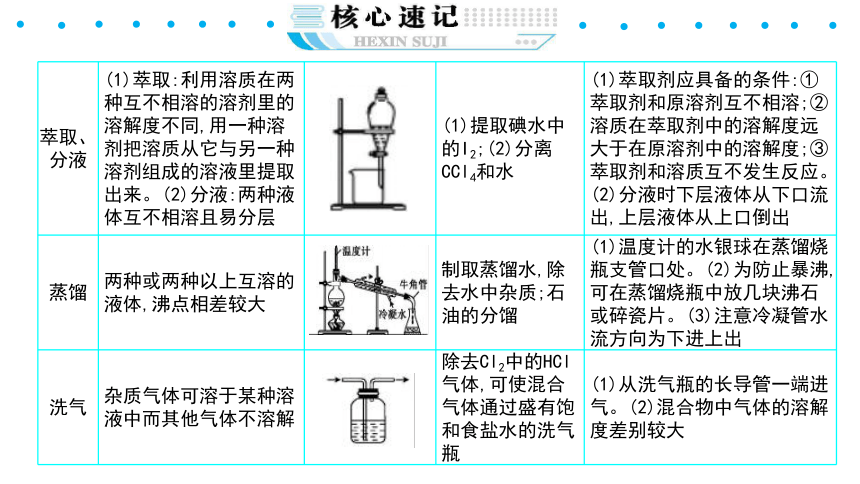
{5940675A-B579-460E-94D1-54222C63F5DA}萃取、分液
(1)萃取:利用溶质在两种互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来。(2)分液:两种液体互不相溶且易分层
(1)提取碘水中的I2;(2)分离CCl4和水
(1)萃取剂应具备的条件:①萃取剂和原溶剂互不相溶;②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度;③萃取剂和溶质互不发生反应。(2)分液时下层液体从下口流出,上层液体从上口倒出
蒸馏
两种或两种以上互溶的液体,沸点相差较大
制取蒸馏水,除去水中杂质;石油的分馏
(1)温度计的水银球在蒸馏烧瓶支管口处。(2)为防止暴沸,可在蒸馏烧瓶中放几块沸石或碎瓷片。(3)注意冷凝管水流方向为下进上出
洗气
杂质气体可溶于某种溶液中而其他气体不溶解
除去Cl2中的HCl气体,可使混合气体通过盛有饱和食盐水的洗气瓶
(1)从洗气瓶的长导管一端进气。(2)混合物中气体的溶解度差别较大
易错点一 对实验的基本操作、常见事故的处理和药品的存放不熟悉造成的错误
平时不注意实验操作的基本要领和注意事项,在做题时不积累操作的易错点;对常见仪器的使用和药品的保存方法掌握不牢固。
【纠错训练1】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法可以提纯下列物质的是(括号中物质为杂质)( )。
A.碘单质(二氧化硅) B.氯化钠(碳酸氢钠)
C.氯化铁(氯化亚铁) D.氢氧化镁(氢氧化钙)
A
【解析】文中提到的方法是“升华”。粗碘中含难挥发的杂质,加热使碘单质升华,收集碘蒸气即得纯度高的碘单质。
返回题目
【纠错训练2】下列实验操作(或方法)正确的是( )。
A.加热可以分离碘单质和氯化铵的混合物
B.用苯萃取溴水中的溴时有机相从分液漏斗上口倒出
C.用长颈漏斗向容器中加入酸液可控制加入量和速率
D.在盐酸中滴加含酚酞的硅酸钠溶液可制得硅酸胶体
【解析】A项,加热条件下,碘单质易升华,氯化铵易分解生成氨气和氯化氢,而氨气和氯化氢相遇重新产生氯化铵,采用加热方法不能分离氯化铵和碘单质,错误;B项,苯的密度小于水,上层的苯和溴从分液漏斗上口倒出,正确;C项,长颈漏斗不能控制速率,错误;D项,在盐酸中加入硅酸钠溶液,会产生硅酸沉淀,因为盐酸能使胶体聚沉,错误。
B
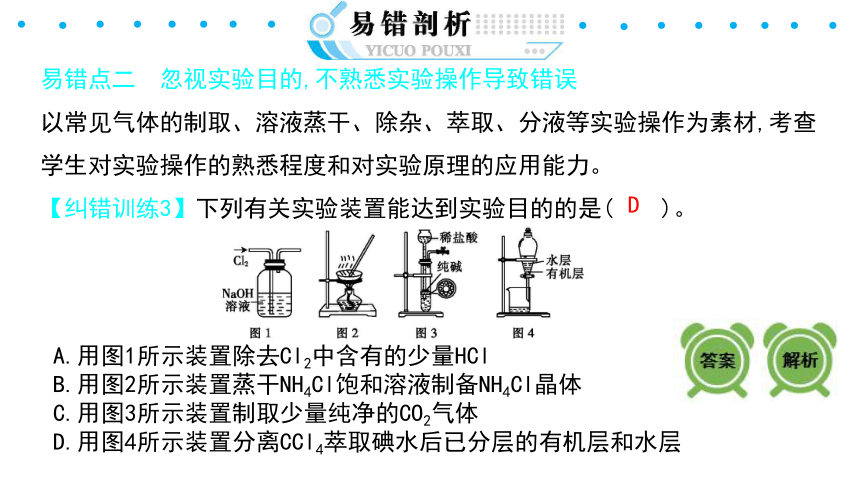
易错点二 忽视实验目的,不熟悉实验操作导致错误
以常见气体的制取、溶液蒸干、除杂、萃取、分液等实验操作为素材,考查学生对实验操作的熟悉程度和对实验原理的应用能力。
【纠错训练3】下列有关实验装置能达到实验目的的是( )。
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
D
【解析】图1所示装置中NaOH会与Cl2反应,A项错误; NH4Cl晶体受热分解,B项错误;纯碱是可溶性固体,C项错误;有机层从下口放出,水层从上口倒出,D项正确。
返回题目
易错点三 对实验现象分析不准确造成错解
观察实验现象时,要会对实验现象进行合理分析,不能看到相似的实验现象,就立即下结论,认为反应的实质是相同的,这样很容易出错。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
实验操作
实验现象
结论
A
向两份相同的蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液
均有固体析出
蛋白质均发生变性
B
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
C
向一定浓度的Na2SiO3溶液中通入适量CO2气体
出现白色沉淀
H2SiO3的酸性比H2CO3强
D
向浓度均为0.1 mol·L-1 的NaCl和NaI的混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
【纠错训练4】下列根据实验操作和现象所得出的结论正确的是( )。
D
【解析】向两份相同的蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,虽然均有固体析出,但前者是发生了盐析,后者是发生了变性;前者是可逆变化,后者是不可逆变化,A项错误。若溶液X中有SO32-也会出现白色沉淀,B项错误。结论应为H2CO3的酸性比H2SiO3强,C项错误。出现黄色沉淀说明生成了AgI,Ksp(AgCl)>Ksp(AgI),D项正确。
返回题目
易错点四 对气体的制备、除杂、收集、验满、尾气吸收等实验装置选择时造成错误
不明确实验装置在实验中的作用,实际上是对实验目的和所做实验的操作步骤不熟悉造成的,另外还要对气体的制取所需实验药品做出正确的选择。
【纠错训练5】实验创新是永恒的目标。简易、方便、绿色、安全等是实验改进的方向。
下列说法错误的是( )。
A.图甲中橡胶管维持气压平衡,防堵塞
B.图甲制备的气体已扣除了液体所占体积
C.图乙中长导管能检测装置是否堵塞
D.收集、干燥气体时气体都从管口X进入
D
【解析】A项,图甲是恒压分液漏斗,液体能顺利下滴,不堵塞,正确;B项,若恒压分液漏斗下滴液体体积为V,则进入分液漏斗的空气体积为V,故在测气实验中测得气体体积准确,正确;C项,如果图乙装置导管堵塞,瓶内液体被压入长导管中,会观察到液面上升,所以长导管能检测装置是否堵塞,正确;D项,收集密度小于空气的气体,则气体从管口Y进入,错误。
返回题目
1.下列说法正确的是( )。
A.容量瓶和分液漏斗使用前必须要检漏并干燥
B.蒸馏操作时,温度计水银球应插入液面下
C.检验含Fe2+、Fe3+、Cl-溶液中的Fe2+,加入酸性高锰酸钾溶液,观察溶液是否褪色
D.做过碘升华实验的圆底烧瓶可以用酒精洗涤
D
【解析】有塞子或活塞的仪器使用前需检漏,容量瓶和分液漏斗使用前必须要检漏,但一般不需干燥,A项错误;蒸馏操作时,温度计水银球应放在蒸馏烧瓶的支管口处,B项错误;酸性高锰酸钾也能氧化Cl-,也可能是酸性高锰酸钾与氯离子反应,C项错误;碘易溶于酒精,因此可用酒精洗涤做过碘升华实验的圆底烧瓶,D项正确。
返回题目
2.下列物质在实验室中的贮存方法,不正确的是( )。
A.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
D
【解析】保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉,防止亚铁离子水解和被氧化,A项正确;煤油起到隔绝空气的作用,B项正确;溴不易溶于水且密度比水大,水可起到液封作用,C项正确;浓硝酸有腐蚀性,会腐蚀橡胶塞,D项错误。
返回题目
3.下列关于仪器使用的说法正确的是( )。
A.装配NH3、HCl溶于水的装置,选择①或⑥
B.在空气中灼烧钠、胆矾,选择③或④
C.稀释硫酸和配制1 mol·L-1 H2SO4溶液,选择②
D.分离溶液中硫代硫酸钠晶体,选择⑤⑥
A
【解析】A项,氨气、氯化氢极易溶于水,吸收氨气、氯化氢时要防倒吸现象,干燥管、漏斗可用于装配防倒吸装置,正确;B项,钠、胆矾都是固体,灼烧时应选择③,错误;C项,容量瓶不能用来稀释硫酸,错误;D项,锥形瓶用于做滴定实验,过滤操作使用烧杯,错误。
返回题目
4.下列清洗仪器的方法和原理都正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
操作
原理
A
用热氢氧化钠溶液清洗试管内的硫黄
氢氧化钠溶液作溶剂,溶解硫黄
B
用饱和碳酸钠溶液浸泡试剂瓶内的硫酸钙,然后用盐酸溶解
硫酸钙转化成碳酸钙,盐酸清洗碳酸钙
C
用浓氨水浸泡除去试管内的银镜
浓氨水溶解银镜
D
用热饱和纯碱溶液洗涤试管内的油渍
油脂与碳酸钠反应
B
【解析】A项,原理应为硫与氢氧化钠反应生成硫化钠和亚硫酸钠,错误;B项,硫酸钙的溶度积大于碳酸钙,硫酸钙转化成碳酸钙,碳酸钙与盐酸反应,正确;C项,应用稀硝酸溶解银镜,浓氨水溶解氧化银,错误;D项,热饱和碳酸钠溶液中有氢氧化钠,氢氧化钠与油脂反应,错误。
返回题目
5.某混合物采用如下分离方法:
下列说法错误的是( )。
A.操作X使用漏斗、烧杯和玻璃棒
B.操作Y一定使用分液漏斗
C.操作Z可能使用酒精灯
D.上述分离过程可能发生化学变化
B
返回题目
【解析】A项,操作X可能是过滤,也可能是溶解、过滤,正确;B项,操作2可能是萃取、分液,也可能是蒸馏,蒸馏操作不需要分液漏斗,错误;C项,操作Z分离两种固体,可以加热,利用固变气,分离出固体,正确;D项,若固体1含氯化铵,则分离时发生了化学变化,正确。
6.某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100 mL上述溶液X,进行了如下实验,下列说法不正确的是( )。
A.气体A可能是CO2或SO2
B.溶液X中一定存在SO42-
C.溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D.向溶液A中加入硝酸酸化的硝酸银溶液可能生成白色沉淀
C
【解析】白色沉淀A部分溶于盐酸,溶于盐酸的部分可能是碳酸钡、亚硫酸钡或氢氧化镁,气体A可能是CO2或SO2,A项正确;X与Ba(OH)2反应生成白色沉淀,且白色沉淀A与足量盐酸反应,沉淀未完全溶解,则白色沉淀B一定为BaSO4,溶液中一定含有SO42-,B项正确;X与Ba(OH)2反应只有白色沉淀生成,则一定不含Fe3+,但溶液中可能含Mg2+ 、Na+,C项错误;由上述分析可知溶液中不确定是否含有Cl-,因此向溶液A中加入硝酸酸化的硝酸银溶液可能生成白色沉淀AgCl,D项正确。
返回题目
7.下列有关实验操作、现象和解释或结论都正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
实验操作
现象
解释或结论
A
向过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈血红色
稀HNO3将Fe氧化为Fe3+
B
两试管各加入5 mL 0.1 mol·L-1 Na2S2O3溶液,同时分别滴入5 mL 0.1 mol·L-1硫酸和盐酸
两支试管中溶液同时变浑浊
其他条件不变时,Cl-一定有催化效果
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
D
【解析】向过量的Fe粉中加入稀HNO3,充分反应后生成Fe2+,滴入KSCN溶液,无现象,A项错误;浓度相等的硫酸和稀盐酸,溶液中H+浓度不相等,无法证明Cl-是否有催化作用,B项错误;铝与稀硝酸发生氧化还原反应生成NO气体,有气泡生成,C项错误;试纸变蓝色,可说明浓氨水呈碱性,D项正确。
返回题目
8.通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。下列实验现象的推断和解释均正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
操作
实验现象
解释
A
向某钾盐中滴加浓盐酸,将产生的气体通入品红溶液中
品红溶液褪色
该钾盐为K2SO3或KHSO3
B
将足量过氧化钠固体加入紫色石蕊溶液中
溶液变成蓝色
过氧化钠与水反应生成氢氧化钠,溶液呈碱性
C
铝热剂溶于足量稀盐酸再滴加KSCN溶液,静置
出现血红色
铝热剂中一定含有氧化铁
D
将少量溴水加入KI溶液中,再加入CCl4,振荡
下层液体呈紫色
氧化性:Br2>I2
D
【解析】能够使品红溶液褪色的气体不一定是二氧化硫,可能是氯气,如氯酸钾与浓盐酸反应生成氯气,氯气能使品红溶液褪色,所以该钾盐可能为氯酸钾,A项错误;过氧化钠和水反应生成NaOH,导致溶液呈碱性,紫色石蕊试液遇碱变蓝色,过氧化钠具有强氧化性,能使有色物质褪色,所以溶液先变蓝色后褪色,B项错误;铝热剂溶于足量稀盐酸再滴加KSCN溶液,出现血红色,说明含有Fe3+,则原铝热剂中可能含有氧化铁或四氧化三铁,C项错误;将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,下层液体呈紫色,则说明溴能够与碘化钾反应生成单质碘,根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性Br2>I2,D项正确。
返回题目
延时符
谢
谢
观
赏
高考倒计时●化学
实验基础
01
核 心 速 记
02
易 错 剖 析
目录
03
自 我 检 测
一、装置气密性的检查方法
{5940675A-B579-460E-94D1-54222C63F5DA}方法
微热法
液差法
气压法
原理
升高装置中气体的温度,使气体膨胀
缩小装置中气体的体积,增大压强
增大封闭气体的压强,使液滴不能滴下
图例
具体操作
塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)试管
塞紧橡胶塞,用止水夹夹住导气管的橡皮管部分,从长颈漏斗向试管中注水
塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向烧瓶中加水
现象说明
烧杯中有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降
一段时间后长颈漏斗中的液面高于试管中的液面,且液面差不改变
一段时间后,液滴不能滴下
二、常见物质(或离子)的检验
1.常见气体的检验
{5940675A-B579-460E-94D1-54222C63F5DA}常见气体
检验方法
H2
纯净的氢气在空气中燃烧火焰呈淡蓝色,混合气点燃有爆鸣声,生成物只有水
O2
可使带火星的木条复燃
Cl2
黄绿色气体,能使湿润的淀粉碘化钾试纸变蓝
SO2
无色有刺激性气味的气体,能使品红溶液褪色,加热后又显红色;能使酸性高锰酸钾溶液褪色
NH3
无色有刺激性气味的气体,能使湿润的红色石蕊试纸变蓝;用蘸有浓盐酸的玻璃棒靠近时能生成白烟
NO2
红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液呈酸性
NO
无色气体,在空气中立即变成红棕色
CO2
无色无味气体,能使澄清石灰水变浑浊;能使燃着的木条熄灭
2.常见阳离子的检验
{5940675A-B579-460E-94D1-54222C63F5DA}离子
检验试剂
实验现象
离子方程式
Fe2+
①K3[Fe(CN)6]溶液②KSCN溶液、氯水
①产生蓝色沉淀②先加KSCN溶液不变色,后加氯水变血红色
①3Fe2++2[Fe(CN)6]3-Fe3[Fe(CN)6]2↓
②2Fe2++Cl2 2Fe3++2Cl-
Fe3++3SCN- Fe(SCN)3
Fe3+
①NaOH溶液②KSCN溶液
①出现红褐色沉淀②溶液呈血红色
①Fe3++3OH- Fe(OH)3↓
②Fe3++3SCN- Fe(SCN)3
NH4+
NaOH溶液、湿润的红色石蕊试纸
产生无色有刺激性气味的气体,试纸变蓝
N+OH- NH3↑+H2O
Al3+
NaOH溶液、氨水
生成白色沉淀,继续加NaOH溶液,沉淀溶解;继续加氨水,沉淀不溶解
Al3++3OH- Al(OH)3↓
Al(OH)3+OH- Al+2H2O
3.常见阴离子的检验
{5940675A-B579-460E-94D1-54222C63F5DA}离子
检验试剂
实验现象
离子方程式
Cl-
AgNO3溶液、稀HNO3
生成不溶于稀HNO3的白色沉淀
Ag++Cl- AgCl↓
SO42-
盐酸、氯化钡溶液
先加盐酸,不产生沉淀,后加BaCl2溶液,生成白色沉淀
Ba2++SO42-
BaSO4↓
CO32-
BaCl2溶液、稀盐酸
加入BaCl2溶液后生成能溶于稀盐酸的白色沉淀
Ba2++CO32- BaCO3↓
BaCO3+2H+ Ba2++CO2↑+H2O
三、物质的分离与提纯的常用物理方法
{5940675A-B579-460E-94D1-54222C63F5DA}方法
适用条件
装置或主要仪器
举例
注意事项
过滤
难溶固体与液体混合物
粗盐提纯时将粗盐溶于水,经过滤把不溶于水的杂质除去
(1) 一贴:滤纸紧贴漏斗内壁;二低:滤纸边缘低于漏斗口,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。(2)若一次过滤后滤液仍浑浊,须重复过滤
蒸发结晶
溶质的溶解度受温度变化影响较小
从NaCl溶液中提取NaCl晶体
(1)玻璃棒的作用:搅拌,防止液体因局部温度过高造成飞溅。(2)当液体中出现较多固体时,停止加热,利用余热蒸干
{5940675A-B579-460E-94D1-54222C63F5DA}萃取、分液
(1)萃取:利用溶质在两种互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来。(2)分液:两种液体互不相溶且易分层
(1)提取碘水中的I2;(2)分离CCl4和水
(1)萃取剂应具备的条件:①萃取剂和原溶剂互不相溶;②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度;③萃取剂和溶质互不发生反应。(2)分液时下层液体从下口流出,上层液体从上口倒出
蒸馏
两种或两种以上互溶的液体,沸点相差较大
制取蒸馏水,除去水中杂质;石油的分馏
(1)温度计的水银球在蒸馏烧瓶支管口处。(2)为防止暴沸,可在蒸馏烧瓶中放几块沸石或碎瓷片。(3)注意冷凝管水流方向为下进上出
洗气
杂质气体可溶于某种溶液中而其他气体不溶解
除去Cl2中的HCl气体,可使混合气体通过盛有饱和食盐水的洗气瓶
(1)从洗气瓶的长导管一端进气。(2)混合物中气体的溶解度差别较大
易错点一 对实验的基本操作、常见事故的处理和药品的存放不熟悉造成的错误
平时不注意实验操作的基本要领和注意事项,在做题时不积累操作的易错点;对常见仪器的使用和药品的保存方法掌握不牢固。
【纠错训练1】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法可以提纯下列物质的是(括号中物质为杂质)( )。
A.碘单质(二氧化硅) B.氯化钠(碳酸氢钠)
C.氯化铁(氯化亚铁) D.氢氧化镁(氢氧化钙)
A
【解析】文中提到的方法是“升华”。粗碘中含难挥发的杂质,加热使碘单质升华,收集碘蒸气即得纯度高的碘单质。
返回题目
【纠错训练2】下列实验操作(或方法)正确的是( )。
A.加热可以分离碘单质和氯化铵的混合物
B.用苯萃取溴水中的溴时有机相从分液漏斗上口倒出
C.用长颈漏斗向容器中加入酸液可控制加入量和速率
D.在盐酸中滴加含酚酞的硅酸钠溶液可制得硅酸胶体
【解析】A项,加热条件下,碘单质易升华,氯化铵易分解生成氨气和氯化氢,而氨气和氯化氢相遇重新产生氯化铵,采用加热方法不能分离氯化铵和碘单质,错误;B项,苯的密度小于水,上层的苯和溴从分液漏斗上口倒出,正确;C项,长颈漏斗不能控制速率,错误;D项,在盐酸中加入硅酸钠溶液,会产生硅酸沉淀,因为盐酸能使胶体聚沉,错误。
B
易错点二 忽视实验目的,不熟悉实验操作导致错误
以常见气体的制取、溶液蒸干、除杂、萃取、分液等实验操作为素材,考查学生对实验操作的熟悉程度和对实验原理的应用能力。
【纠错训练3】下列有关实验装置能达到实验目的的是( )。
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
D
【解析】图1所示装置中NaOH会与Cl2反应,A项错误; NH4Cl晶体受热分解,B项错误;纯碱是可溶性固体,C项错误;有机层从下口放出,水层从上口倒出,D项正确。
返回题目
易错点三 对实验现象分析不准确造成错解
观察实验现象时,要会对实验现象进行合理分析,不能看到相似的实验现象,就立即下结论,认为反应的实质是相同的,这样很容易出错。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
实验操作
实验现象
结论
A
向两份相同的蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液
均有固体析出
蛋白质均发生变性
B
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
C
向一定浓度的Na2SiO3溶液中通入适量CO2气体
出现白色沉淀
H2SiO3的酸性比H2CO3强
D
向浓度均为0.1 mol·L-1 的NaCl和NaI的混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
【纠错训练4】下列根据实验操作和现象所得出的结论正确的是( )。
D
【解析】向两份相同的蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,虽然均有固体析出,但前者是发生了盐析,后者是发生了变性;前者是可逆变化,后者是不可逆变化,A项错误。若溶液X中有SO32-也会出现白色沉淀,B项错误。结论应为H2CO3的酸性比H2SiO3强,C项错误。出现黄色沉淀说明生成了AgI,Ksp(AgCl)>Ksp(AgI),D项正确。
返回题目
易错点四 对气体的制备、除杂、收集、验满、尾气吸收等实验装置选择时造成错误
不明确实验装置在实验中的作用,实际上是对实验目的和所做实验的操作步骤不熟悉造成的,另外还要对气体的制取所需实验药品做出正确的选择。
【纠错训练5】实验创新是永恒的目标。简易、方便、绿色、安全等是实验改进的方向。
下列说法错误的是( )。
A.图甲中橡胶管维持气压平衡,防堵塞
B.图甲制备的气体已扣除了液体所占体积
C.图乙中长导管能检测装置是否堵塞
D.收集、干燥气体时气体都从管口X进入
D
【解析】A项,图甲是恒压分液漏斗,液体能顺利下滴,不堵塞,正确;B项,若恒压分液漏斗下滴液体体积为V,则进入分液漏斗的空气体积为V,故在测气实验中测得气体体积准确,正确;C项,如果图乙装置导管堵塞,瓶内液体被压入长导管中,会观察到液面上升,所以长导管能检测装置是否堵塞,正确;D项,收集密度小于空气的气体,则气体从管口Y进入,错误。
返回题目
1.下列说法正确的是( )。
A.容量瓶和分液漏斗使用前必须要检漏并干燥
B.蒸馏操作时,温度计水银球应插入液面下
C.检验含Fe2+、Fe3+、Cl-溶液中的Fe2+,加入酸性高锰酸钾溶液,观察溶液是否褪色
D.做过碘升华实验的圆底烧瓶可以用酒精洗涤
D
【解析】有塞子或活塞的仪器使用前需检漏,容量瓶和分液漏斗使用前必须要检漏,但一般不需干燥,A项错误;蒸馏操作时,温度计水银球应放在蒸馏烧瓶的支管口处,B项错误;酸性高锰酸钾也能氧化Cl-,也可能是酸性高锰酸钾与氯离子反应,C项错误;碘易溶于酒精,因此可用酒精洗涤做过碘升华实验的圆底烧瓶,D项正确。
返回题目
2.下列物质在实验室中的贮存方法,不正确的是( )。
A.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
D
【解析】保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉,防止亚铁离子水解和被氧化,A项正确;煤油起到隔绝空气的作用,B项正确;溴不易溶于水且密度比水大,水可起到液封作用,C项正确;浓硝酸有腐蚀性,会腐蚀橡胶塞,D项错误。
返回题目
3.下列关于仪器使用的说法正确的是( )。
A.装配NH3、HCl溶于水的装置,选择①或⑥
B.在空气中灼烧钠、胆矾,选择③或④
C.稀释硫酸和配制1 mol·L-1 H2SO4溶液,选择②
D.分离溶液中硫代硫酸钠晶体,选择⑤⑥
A
【解析】A项,氨气、氯化氢极易溶于水,吸收氨气、氯化氢时要防倒吸现象,干燥管、漏斗可用于装配防倒吸装置,正确;B项,钠、胆矾都是固体,灼烧时应选择③,错误;C项,容量瓶不能用来稀释硫酸,错误;D项,锥形瓶用于做滴定实验,过滤操作使用烧杯,错误。
返回题目
4.下列清洗仪器的方法和原理都正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
操作
原理
A
用热氢氧化钠溶液清洗试管内的硫黄
氢氧化钠溶液作溶剂,溶解硫黄
B
用饱和碳酸钠溶液浸泡试剂瓶内的硫酸钙,然后用盐酸溶解
硫酸钙转化成碳酸钙,盐酸清洗碳酸钙
C
用浓氨水浸泡除去试管内的银镜
浓氨水溶解银镜
D
用热饱和纯碱溶液洗涤试管内的油渍
油脂与碳酸钠反应
B
【解析】A项,原理应为硫与氢氧化钠反应生成硫化钠和亚硫酸钠,错误;B项,硫酸钙的溶度积大于碳酸钙,硫酸钙转化成碳酸钙,碳酸钙与盐酸反应,正确;C项,应用稀硝酸溶解银镜,浓氨水溶解氧化银,错误;D项,热饱和碳酸钠溶液中有氢氧化钠,氢氧化钠与油脂反应,错误。
返回题目
5.某混合物采用如下分离方法:
下列说法错误的是( )。
A.操作X使用漏斗、烧杯和玻璃棒
B.操作Y一定使用分液漏斗
C.操作Z可能使用酒精灯
D.上述分离过程可能发生化学变化
B
返回题目
【解析】A项,操作X可能是过滤,也可能是溶解、过滤,正确;B项,操作2可能是萃取、分液,也可能是蒸馏,蒸馏操作不需要分液漏斗,错误;C项,操作Z分离两种固体,可以加热,利用固变气,分离出固体,正确;D项,若固体1含氯化铵,则分离时发生了化学变化,正确。
6.某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100 mL上述溶液X,进行了如下实验,下列说法不正确的是( )。
A.气体A可能是CO2或SO2
B.溶液X中一定存在SO42-
C.溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D.向溶液A中加入硝酸酸化的硝酸银溶液可能生成白色沉淀
C
【解析】白色沉淀A部分溶于盐酸,溶于盐酸的部分可能是碳酸钡、亚硫酸钡或氢氧化镁,气体A可能是CO2或SO2,A项正确;X与Ba(OH)2反应生成白色沉淀,且白色沉淀A与足量盐酸反应,沉淀未完全溶解,则白色沉淀B一定为BaSO4,溶液中一定含有SO42-,B项正确;X与Ba(OH)2反应只有白色沉淀生成,则一定不含Fe3+,但溶液中可能含Mg2+ 、Na+,C项错误;由上述分析可知溶液中不确定是否含有Cl-,因此向溶液A中加入硝酸酸化的硝酸银溶液可能生成白色沉淀AgCl,D项正确。
返回题目
7.下列有关实验操作、现象和解释或结论都正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
实验操作
现象
解释或结论
A
向过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈血红色
稀HNO3将Fe氧化为Fe3+
B
两试管各加入5 mL 0.1 mol·L-1 Na2S2O3溶液,同时分别滴入5 mL 0.1 mol·L-1硫酸和盐酸
两支试管中溶液同时变浑浊
其他条件不变时,Cl-一定有催化效果
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
D
【解析】向过量的Fe粉中加入稀HNO3,充分反应后生成Fe2+,滴入KSCN溶液,无现象,A项错误;浓度相等的硫酸和稀盐酸,溶液中H+浓度不相等,无法证明Cl-是否有催化作用,B项错误;铝与稀硝酸发生氧化还原反应生成NO气体,有气泡生成,C项错误;试纸变蓝色,可说明浓氨水呈碱性,D项正确。
返回题目
8.通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。下列实验现象的推断和解释均正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}选项
操作
实验现象
解释
A
向某钾盐中滴加浓盐酸,将产生的气体通入品红溶液中
品红溶液褪色
该钾盐为K2SO3或KHSO3
B
将足量过氧化钠固体加入紫色石蕊溶液中
溶液变成蓝色
过氧化钠与水反应生成氢氧化钠,溶液呈碱性
C
铝热剂溶于足量稀盐酸再滴加KSCN溶液,静置
出现血红色
铝热剂中一定含有氧化铁
D
将少量溴水加入KI溶液中,再加入CCl4,振荡
下层液体呈紫色
氧化性:Br2>I2
D
【解析】能够使品红溶液褪色的气体不一定是二氧化硫,可能是氯气,如氯酸钾与浓盐酸反应生成氯气,氯气能使品红溶液褪色,所以该钾盐可能为氯酸钾,A项错误;过氧化钠和水反应生成NaOH,导致溶液呈碱性,紫色石蕊试液遇碱变蓝色,过氧化钠具有强氧化性,能使有色物质褪色,所以溶液先变蓝色后褪色,B项错误;铝热剂溶于足量稀盐酸再滴加KSCN溶液,出现血红色,说明含有Fe3+,则原铝热剂中可能含有氧化铁或四氧化三铁,C项错误;将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,下层液体呈紫色,则说明溴能够与碘化钾反应生成单质碘,根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性Br2>I2,D项正确。
返回题目
延时符
谢
谢
观
赏
同课章节目录
