2021届高考化学 考前7天 电解质溶液 课件(28张ppt)
文档属性
| 名称 | 2021届高考化学 考前7天 电解质溶液 课件(28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 525.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-29 07:17:18 | ||
图片预览





文档简介
2021
高考倒计时●化学
考前7天 电解质溶液
01
命 题 回 顾
02
答 题 要 领
目录
03
自 我 检 测
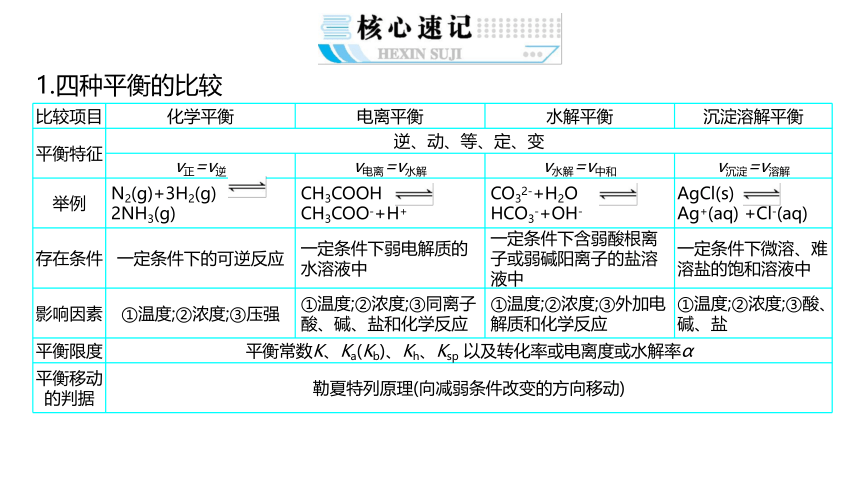
1.四种平衡的比较
{5940675A-B579-460E-94D1-54222C63F5DA}比较项目
化学平衡
电离平衡
水解平衡
沉淀溶解平衡
平衡特征
逆、动、等、定、变
v正=v逆
v电离=v水解
v水解=v中和
v沉淀=v溶解
举例
N2(g)+3H2(g) 2NH3(g)
CH3COOH CH3COO-+H+
CO32-+H2O HCO3-+OH-
AgCl(s) Ag+(aq) +Cl-(aq)
存在条件
一定条件下的可逆反应
一定条件下弱电解质的水溶液中
一定条件下含弱酸根离子或弱碱阳离子的盐溶液中
一定条件下微溶、难溶盐的饱和溶液中
影响因素
①温度;②浓度;③压强
①温度;②浓度;③同离子酸、碱、盐和化学反应
①温度;②浓度;③外加电解质和化学反应
①温度;②浓度;③酸、碱、盐
平衡限度
平衡常数K、Ka(Kb)、Kh、Ksp 以及转化率或电离度或水解率α
平衡移动的判据
勒夏特列原理(向减弱条件改变的方向移动)
2.盐类的水解规律
难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越热越水解,越稀越水解。
3.沉淀的生成与转化
(1)在难溶电解质的溶液中,当Qc>Ksp时,就会生成沉淀。
(2)难溶物的溶解度相差越大,沉淀转化的趋势越明显。
4.溶液的酸碱性与pH
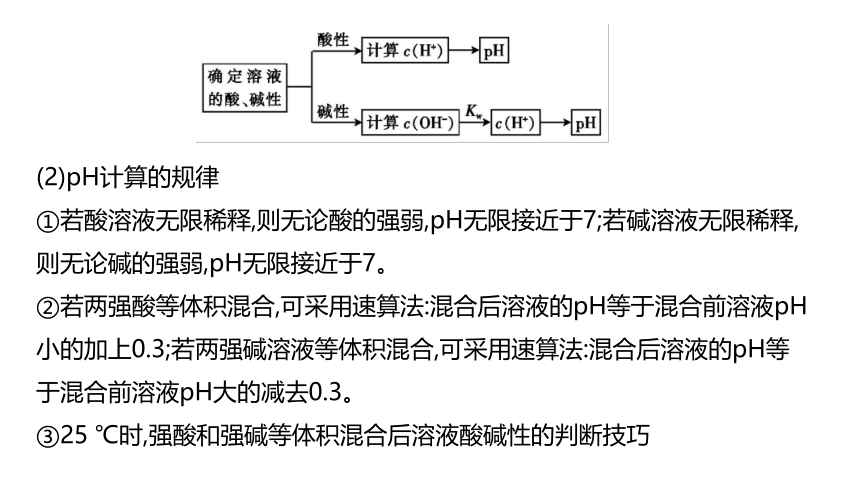
(1)pH计算的总体原则
(2)pH计算的规律
①若酸溶液无限稀释,则无论酸的强弱,pH无限接近于7;若碱溶液无限稀释,则无论碱的强弱,pH无限接近于7。
②若两强酸等体积混合,可采用速算法:混合后溶液的pH等于混合前溶液pH小的加上0.3;若两强碱溶液等体积混合,可采用速算法:混合后溶液的pH等于混合前溶液pH大的减去0.3。
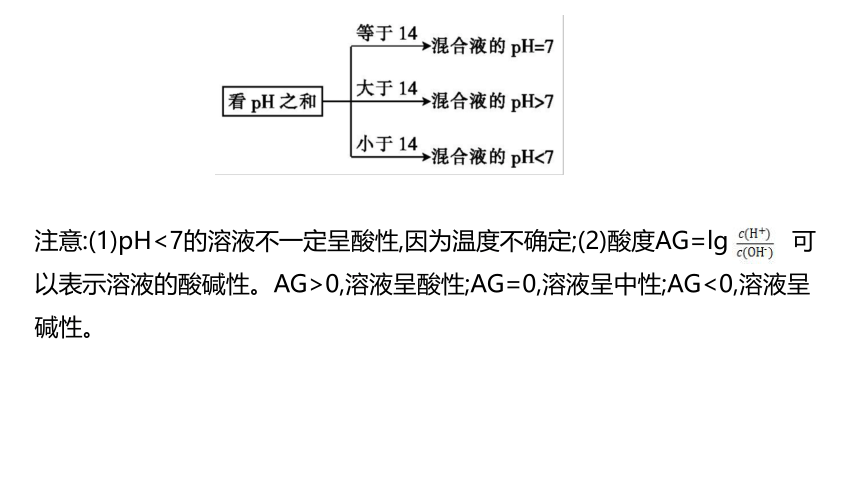
③25 ℃时,强酸和强碱等体积混合后溶液酸碱性的判断技巧
注意:(1)pH<7的溶液不一定呈酸性,因为温度不确定;(2)酸度AG=lg 可以表示溶液的酸碱性。AG>0,溶液呈酸性;AG=0,溶液呈中性;AG<0,溶液呈碱性。
易错点一 忽略了水的离子积是与温度有关的量
认为水的离子积就是1×10-14,而忽视了Kw是与温度有关的,所以会认为pH=7的溶液就一定是中性溶液。
【纠错训练1】已知温度为T ℃时,水的离子积常数为Kw。该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,下列条件中,可作为判断溶液呈中性的依据的是( )。
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C
答案
解析
【解析】A项,因无法确定酸与碱是否为强酸、强碱,故等浓度的一元酸和一元碱溶液等体积混合,反应后的溶液不一定呈中性;B项,因温度T不确定,pH=7不能说明溶液呈中性;C项,通过分析可知,c(H+)= mol·L-1=c(OH-),故溶液必然呈中性;D项,根据溶液中的电荷守恒可知,无论溶液呈酸性、碱性或中性,等式均成立,故无法判断。
易错点二 对电解质强弱的判断错误
判断电解质强弱的方法
(1)浓度与pH的关系,如0.01 mo1· L-1的醋酸溶液pH>2,说明醋酸是弱酸。
(2)测对应盐的酸碱性,如CH3COONa溶液呈碱性,则证明醋酸是弱酸。
(3)稀释前后的pH与稀释倍数的变化关系。如将pH=2的酸溶液稀释1000倍,若pH<5,则证明酸为弱酸;若pH=5,则证明酸为强酸。
(4)采用实验证明存在电离平衡,如醋酸溶液中滴入石蕊试液变红,再加CH3COONH4晶体,颜色变浅。
(5)同pH的强酸和弱酸,分别加该酸的钠盐固体,溶液的pH增大的是弱酸,pH几乎不变的是强酸。
【纠错训练2】下列说法能说明醋酸是弱电解质的是( )。
①往次氯酸钠溶液中加入醋酸可得次氯酸
②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢
④pH=2的醋酸溶液稀释1000倍后pH<5
A.①③④ B.①② C.②④ D.②
答案
解析
c
【解析】弱电解质中存在电离平衡,①只能说明醋酸的酸性强于次氯酸;②醋酸钠溶液呈碱性,说明醋酸钠能水解,因此醋酸是弱酸;③只能说明醋酸呈酸性;④pH=2的醋酸溶液稀释1000倍后pH<5,说明稀释过程中醋酸电离出氢离子,因此存在电离平衡,醋酸为弱酸。
答题提示 判断一种酸是强酸还是弱酸主要从以下几个方面进行分析:(1)在水溶液中是否完全电离;(2)在水溶液中是否存在电离平衡; (3)其盐溶液是否发生水解。
易错点三 对溶液蒸干、灼烧后产物的判断错误
加热、浓缩、蒸干盐溶液时,要考虑盐的水解
(1)易挥发的酸形成的盐:如加热AlCl3溶液至蒸干,再灼烧,最终得到的固体是Al2O3而不是AlCl3。这是因为反应AlCl3+3H2O Al(OH)3+3HCl,加热时生成的HCl挥发,AlCl3的水解平衡正向移动,使反应趋于完全,生成Al(OH)3,灼烧时Al(OH)3分解而最终生成Al2O3。为了制取无水盐(MgCl2、FeCl3),通常将结晶水合物在HCl气流中加热,以防止其水解,如MgCl2·6H2O在HCl气流中加热生成MgCl2和H2O。
(2)难挥发的酸形成的盐:如加热蒸干Fe2(SO4)3溶液,加热使反应Fe2(SO4)3+6H2O 2Fe(OH)3+3H2SO4向右移动,但H2SO4不易挥发,会与Fe(OH)3重新反应生成Fe2(SO4)3,所以蒸干后得到的固体仍为Fe2(SO4)3。
(3)酸式碳酸盐溶液蒸干得到正盐:如NaHCO3 Na2CO3;Ca(HCO3)2 CaCO3。
(4)弱酸的铵盐蒸干后无固体剩余:如NH4HCO3、(NH4)2CO3。
(5)K+、Na+的碳酸正盐溶液及偏铝酸盐溶液蒸干后得到的固体仍为原溶质。如Na2CO3、K2CO3、NaAlO2。
(6)由于 S0 32- 、Fe2+具有较强的还原性,故大部分亚硫酸盐溶液蒸干得硫酸盐,亚铁盐溶液蒸干得铁盐。
【纠错训练3】下列溶液在空气中加热蒸干并灼烧后,能得到相应溶质固体的是( )。
A.AlCl3 B.KHCO3
C.Fe2(SO4)3 D.FeSO4
答案
解析
C
【解析】加热时,AlCl3水解生成Al(OH)3和HCl,HCl易挥发,则溶液蒸干最终得到Al(OH)3固体,灼烧后得到Al2O3固体,A项错误;加热KHCO3溶液时,KHCO3受热分解生成K2CO3,灼烧后得到K2CO3固体,B项错误;加热时,Fe2(SO4)3水解生成Fe(OH)3和H2SO4,但H2SO4难挥发,会与Fe(OH)3反应重新生成Fe2(SO4)3,则最后固体仍为Fe2(SO4)3,C项正确;FeSO4中Fe2+具有还原性,加热时,FeSO4易被氧化为Fe2(SO4)3与Fe(OH)3,则最终得到的固体为Fe2(SO4)3与Fe2O3混合物,D项错误。
答题提示 “溶液在空气中加热蒸干并灼烧”需要考虑水解和分解。加热蒸干的过程中部分离子会发生水解,但是水解程度与形成的物质的挥发性有关,如FeCl3水解形成Fe(OH)3和HCl,HCl加热易挥发,会完全水解,最终得到Fe(OH)3沉淀。灼烧分解得到相应的氧化物。
1.已知pKa=-lgKa,室温下HNO2、CH3COOH、HCN、HClO的pKa依次为3.37、4.75、9.31、7.62。10 mL 0.1 mol·L-1下列盐溶液中含离子总数最多的是( )。
A.CH3COONa溶液 B.NaCN溶液
C.NaNO2溶液 D.NaClO溶液
答案
解析
C
【解析】根据电荷守恒可知,溶液中离子总浓度等于2c(Na+)+2c(H+),盐溶液浓度相等、体积相等,离子总数大小取决于c(H+)。依题意可知,pKa越小,Ka越大,溶液的酸性越强,c(H+)越大,故NaNO2溶液中离子总数最多。
2.室温下,下列混合溶液的pH一定小于7的是( )。
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
答案
解析
C
【解析】pH=3的盐酸中c(H+)=1×10-3 mol·L-1,pH=11的氨水中c(OH-)=1×10-3 mol·L-1,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7;pH=3的盐酸中c(H+)=1×10-3 mol·L-1,pH=11的氢氧化钡溶液中c(OH-)=1×10-3 mol·L-1,酸、碱都是强电解质,在室温下等体积混合后,pH=7;pH=3的醋酸中c(H+)=1×10-3 mol·L-1,pH=11的氢氧化钡溶液中c(OH-)=1×10-3 mol·L-1,由于醋酸为弱酸,则醋酸过量,在室温下等体积混合后,pH<7;pH=3的硫酸中c(H+)=1×10-3 mol·L-1,pH=11的氨水中c(OH-)=1×10-3 mol·L-1,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7。
3.水的电离平衡图像如图所示。
下列说法错误的是( )。
A.曲线上,温度T高于25 ℃
B.水的离子积常数:Kw(f)>Kw(d)=Kw(c)
C.常温下,向c点溶液中通入少量HCl,c沿直线cde向e迁移
D.c点溶液中水的电离程度一定小于d点溶液中水的电离程度
答案
解析
D
【解析】水电离是吸热过程,升温,水的电离程度增大,x 4.相同温度下,根据三种酸的电离常数判断,下列说法正确的是( )。
{5940675A-B579-460E-94D1-54222C63F5DA}酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y- HY+Z-能够发生
C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1 mol·L-1 HX溶液的电离平衡常数大于0.1 mol·L-1 HX溶液的电离平衡常数
B
答案
解析
【解析】相同温度下,酸溶液的电离平衡常数越大,酸性越强,三种酸的酸性强弱顺序为HX5.已知HA为一元酸,常温下向20 mL 0.01 mol· L-1HA溶液中滴加0.01 mol· L-1的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是( )。
A.常温下,该酸的电离常数K=10-5.6
B.该滴定过程中不可以选择甲基橙作指示剂
C.滴定至①处时,溶液中离子浓度关系为c(A-)>c(Na+)>c(H+)>c(OH-)
D.由①到③过程中,水的电离程度先增大后减小
答案
解析
D
【解析】HA H++A-,0.01 mol·L-1HA溶液的pH=3.8,c(H+)=10-3.8 mol·L-1,该酸的电离常数K= =10-5.6,A项正确;该滴定为强碱滴定弱酸,反应完全时,生成强碱弱酸盐,溶液呈碱性,应该选择酚酞作指示剂,若选用甲基橙作指示剂,因甲基橙的变色范围是3.1~4.4,误差较大,B项正确;①点溶液为等浓度的HA和NaA的混合溶液,且溶液呈酸性,HA的电离程度大于A-的水解程度,则溶液中离子浓度关系为c(A-)>c(Na+)>c(H+)>c(OH-),C项正确;在①②③点对应的溶液中,①点溶液为等浓度的HA和NaA的混合溶液,且溶液呈酸性,②点溶液呈中性,③点溶液是二者恰好完全反应生成的NaA溶液,溶液呈碱性,酸、碱溶液对水的电离起到抑制作用,会水解的盐对水的电离起到促进作用,所以由①到③过程中,水的电离程度逐渐增大,D项错误。
6.常温下,向20 mL 0.1 mo1 · L-1 Na2XO3溶液中滴加pH=1的盐酸溶液,含X的粒子的物质的量分数与pH关系如图所示(H2XO3分解生成的XO2气体未画出)。
下列说法错误的是( )。
A.B点消耗盐酸的体积为20 mL
B.B点溶液中离子浓度最大的是HXO3-
C.A点溶液中c(HXO3- )=c(XO32- )>c(OH-)>c(H+)
D.pH=9时,c(Na+)>c(HXO3-)+2c(XO32- )
答案
解析
B
【解析】盐酸的pH=1,c(H+)=0.1 mol·L-1,B点恰好生成NaHXO3,即恰好发生反应Na2XO3+HCl NaCl+NaHXO3,则消耗V[HCl(aq)]=20 mL,A项正确;B点溶液中的主要溶质是NaHXO3,c(Na+)最大,B项错误;A点中c(HXO3- )=c(XO32- ),溶液呈碱性,C项正确;pH=9时,c(OH-)>c(H+),根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(HXO3- )+2c(XO32- )推知,c(Na+)>c(HXO3- )+2c(XO32- ),D项正确。
延时符
谢
谢
观
赏
高考倒计时●化学
考前7天 电解质溶液
01
命 题 回 顾
02
答 题 要 领
目录
03
自 我 检 测
1.四种平衡的比较
{5940675A-B579-460E-94D1-54222C63F5DA}比较项目
化学平衡
电离平衡
水解平衡
沉淀溶解平衡
平衡特征
逆、动、等、定、变
v正=v逆
v电离=v水解
v水解=v中和
v沉淀=v溶解
举例
N2(g)+3H2(g) 2NH3(g)
CH3COOH CH3COO-+H+
CO32-+H2O HCO3-+OH-
AgCl(s) Ag+(aq) +Cl-(aq)
存在条件
一定条件下的可逆反应
一定条件下弱电解质的水溶液中
一定条件下含弱酸根离子或弱碱阳离子的盐溶液中
一定条件下微溶、难溶盐的饱和溶液中
影响因素
①温度;②浓度;③压强
①温度;②浓度;③同离子酸、碱、盐和化学反应
①温度;②浓度;③外加电解质和化学反应
①温度;②浓度;③酸、碱、盐
平衡限度
平衡常数K、Ka(Kb)、Kh、Ksp 以及转化率或电离度或水解率α
平衡移动的判据
勒夏特列原理(向减弱条件改变的方向移动)
2.盐类的水解规律
难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越热越水解,越稀越水解。
3.沉淀的生成与转化
(1)在难溶电解质的溶液中,当Qc>Ksp时,就会生成沉淀。
(2)难溶物的溶解度相差越大,沉淀转化的趋势越明显。
4.溶液的酸碱性与pH
(1)pH计算的总体原则
(2)pH计算的规律
①若酸溶液无限稀释,则无论酸的强弱,pH无限接近于7;若碱溶液无限稀释,则无论碱的强弱,pH无限接近于7。
②若两强酸等体积混合,可采用速算法:混合后溶液的pH等于混合前溶液pH小的加上0.3;若两强碱溶液等体积混合,可采用速算法:混合后溶液的pH等于混合前溶液pH大的减去0.3。
③25 ℃时,强酸和强碱等体积混合后溶液酸碱性的判断技巧
注意:(1)pH<7的溶液不一定呈酸性,因为温度不确定;(2)酸度AG=lg 可以表示溶液的酸碱性。AG>0,溶液呈酸性;AG=0,溶液呈中性;AG<0,溶液呈碱性。
易错点一 忽略了水的离子积是与温度有关的量
认为水的离子积就是1×10-14,而忽视了Kw是与温度有关的,所以会认为pH=7的溶液就一定是中性溶液。
【纠错训练1】已知温度为T ℃时,水的离子积常数为Kw。该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,下列条件中,可作为判断溶液呈中性的依据的是( )。
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C
答案
解析
【解析】A项,因无法确定酸与碱是否为强酸、强碱,故等浓度的一元酸和一元碱溶液等体积混合,反应后的溶液不一定呈中性;B项,因温度T不确定,pH=7不能说明溶液呈中性;C项,通过分析可知,c(H+)= mol·L-1=c(OH-),故溶液必然呈中性;D项,根据溶液中的电荷守恒可知,无论溶液呈酸性、碱性或中性,等式均成立,故无法判断。
易错点二 对电解质强弱的判断错误
判断电解质强弱的方法
(1)浓度与pH的关系,如0.01 mo1· L-1的醋酸溶液pH>2,说明醋酸是弱酸。
(2)测对应盐的酸碱性,如CH3COONa溶液呈碱性,则证明醋酸是弱酸。
(3)稀释前后的pH与稀释倍数的变化关系。如将pH=2的酸溶液稀释1000倍,若pH<5,则证明酸为弱酸;若pH=5,则证明酸为强酸。
(4)采用实验证明存在电离平衡,如醋酸溶液中滴入石蕊试液变红,再加CH3COONH4晶体,颜色变浅。
(5)同pH的强酸和弱酸,分别加该酸的钠盐固体,溶液的pH增大的是弱酸,pH几乎不变的是强酸。
【纠错训练2】下列说法能说明醋酸是弱电解质的是( )。
①往次氯酸钠溶液中加入醋酸可得次氯酸
②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢
④pH=2的醋酸溶液稀释1000倍后pH<5
A.①③④ B.①② C.②④ D.②
答案
解析
c
【解析】弱电解质中存在电离平衡,①只能说明醋酸的酸性强于次氯酸;②醋酸钠溶液呈碱性,说明醋酸钠能水解,因此醋酸是弱酸;③只能说明醋酸呈酸性;④pH=2的醋酸溶液稀释1000倍后pH<5,说明稀释过程中醋酸电离出氢离子,因此存在电离平衡,醋酸为弱酸。
答题提示 判断一种酸是强酸还是弱酸主要从以下几个方面进行分析:(1)在水溶液中是否完全电离;(2)在水溶液中是否存在电离平衡; (3)其盐溶液是否发生水解。
易错点三 对溶液蒸干、灼烧后产物的判断错误
加热、浓缩、蒸干盐溶液时,要考虑盐的水解
(1)易挥发的酸形成的盐:如加热AlCl3溶液至蒸干,再灼烧,最终得到的固体是Al2O3而不是AlCl3。这是因为反应AlCl3+3H2O Al(OH)3+3HCl,加热时生成的HCl挥发,AlCl3的水解平衡正向移动,使反应趋于完全,生成Al(OH)3,灼烧时Al(OH)3分解而最终生成Al2O3。为了制取无水盐(MgCl2、FeCl3),通常将结晶水合物在HCl气流中加热,以防止其水解,如MgCl2·6H2O在HCl气流中加热生成MgCl2和H2O。
(2)难挥发的酸形成的盐:如加热蒸干Fe2(SO4)3溶液,加热使反应Fe2(SO4)3+6H2O 2Fe(OH)3+3H2SO4向右移动,但H2SO4不易挥发,会与Fe(OH)3重新反应生成Fe2(SO4)3,所以蒸干后得到的固体仍为Fe2(SO4)3。
(3)酸式碳酸盐溶液蒸干得到正盐:如NaHCO3 Na2CO3;Ca(HCO3)2 CaCO3。
(4)弱酸的铵盐蒸干后无固体剩余:如NH4HCO3、(NH4)2CO3。
(5)K+、Na+的碳酸正盐溶液及偏铝酸盐溶液蒸干后得到的固体仍为原溶质。如Na2CO3、K2CO3、NaAlO2。
(6)由于 S0 32- 、Fe2+具有较强的还原性,故大部分亚硫酸盐溶液蒸干得硫酸盐,亚铁盐溶液蒸干得铁盐。
【纠错训练3】下列溶液在空气中加热蒸干并灼烧后,能得到相应溶质固体的是( )。
A.AlCl3 B.KHCO3
C.Fe2(SO4)3 D.FeSO4
答案
解析
C
【解析】加热时,AlCl3水解生成Al(OH)3和HCl,HCl易挥发,则溶液蒸干最终得到Al(OH)3固体,灼烧后得到Al2O3固体,A项错误;加热KHCO3溶液时,KHCO3受热分解生成K2CO3,灼烧后得到K2CO3固体,B项错误;加热时,Fe2(SO4)3水解生成Fe(OH)3和H2SO4,但H2SO4难挥发,会与Fe(OH)3反应重新生成Fe2(SO4)3,则最后固体仍为Fe2(SO4)3,C项正确;FeSO4中Fe2+具有还原性,加热时,FeSO4易被氧化为Fe2(SO4)3与Fe(OH)3,则最终得到的固体为Fe2(SO4)3与Fe2O3混合物,D项错误。
答题提示 “溶液在空气中加热蒸干并灼烧”需要考虑水解和分解。加热蒸干的过程中部分离子会发生水解,但是水解程度与形成的物质的挥发性有关,如FeCl3水解形成Fe(OH)3和HCl,HCl加热易挥发,会完全水解,最终得到Fe(OH)3沉淀。灼烧分解得到相应的氧化物。
1.已知pKa=-lgKa,室温下HNO2、CH3COOH、HCN、HClO的pKa依次为3.37、4.75、9.31、7.62。10 mL 0.1 mol·L-1下列盐溶液中含离子总数最多的是( )。
A.CH3COONa溶液 B.NaCN溶液
C.NaNO2溶液 D.NaClO溶液
答案
解析
C
【解析】根据电荷守恒可知,溶液中离子总浓度等于2c(Na+)+2c(H+),盐溶液浓度相等、体积相等,离子总数大小取决于c(H+)。依题意可知,pKa越小,Ka越大,溶液的酸性越强,c(H+)越大,故NaNO2溶液中离子总数最多。
2.室温下,下列混合溶液的pH一定小于7的是( )。
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
答案
解析
C
【解析】pH=3的盐酸中c(H+)=1×10-3 mol·L-1,pH=11的氨水中c(OH-)=1×10-3 mol·L-1,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7;pH=3的盐酸中c(H+)=1×10-3 mol·L-1,pH=11的氢氧化钡溶液中c(OH-)=1×10-3 mol·L-1,酸、碱都是强电解质,在室温下等体积混合后,pH=7;pH=3的醋酸中c(H+)=1×10-3 mol·L-1,pH=11的氢氧化钡溶液中c(OH-)=1×10-3 mol·L-1,由于醋酸为弱酸,则醋酸过量,在室温下等体积混合后,pH<7;pH=3的硫酸中c(H+)=1×10-3 mol·L-1,pH=11的氨水中c(OH-)=1×10-3 mol·L-1,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7。
3.水的电离平衡图像如图所示。
下列说法错误的是( )。
A.曲线上,温度T高于25 ℃
B.水的离子积常数:Kw(f)>Kw(d)=Kw(c)
C.常温下,向c点溶液中通入少量HCl,c沿直线cde向e迁移
D.c点溶液中水的电离程度一定小于d点溶液中水的电离程度
答案
解析
D
【解析】水电离是吸热过程,升温,水的电离程度增大,x
{5940675A-B579-460E-94D1-54222C63F5DA}酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y- HY+Z-能够发生
C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1 mol·L-1 HX溶液的电离平衡常数大于0.1 mol·L-1 HX溶液的电离平衡常数
B
答案
解析
【解析】相同温度下,酸溶液的电离平衡常数越大,酸性越强,三种酸的酸性强弱顺序为HX
A.常温下,该酸的电离常数K=10-5.6
B.该滴定过程中不可以选择甲基橙作指示剂
C.滴定至①处时,溶液中离子浓度关系为c(A-)>c(Na+)>c(H+)>c(OH-)
D.由①到③过程中,水的电离程度先增大后减小
答案
解析
D
【解析】HA H++A-,0.01 mol·L-1HA溶液的pH=3.8,c(H+)=10-3.8 mol·L-1,该酸的电离常数K= =10-5.6,A项正确;该滴定为强碱滴定弱酸,反应完全时,生成强碱弱酸盐,溶液呈碱性,应该选择酚酞作指示剂,若选用甲基橙作指示剂,因甲基橙的变色范围是3.1~4.4,误差较大,B项正确;①点溶液为等浓度的HA和NaA的混合溶液,且溶液呈酸性,HA的电离程度大于A-的水解程度,则溶液中离子浓度关系为c(A-)>c(Na+)>c(H+)>c(OH-),C项正确;在①②③点对应的溶液中,①点溶液为等浓度的HA和NaA的混合溶液,且溶液呈酸性,②点溶液呈中性,③点溶液是二者恰好完全反应生成的NaA溶液,溶液呈碱性,酸、碱溶液对水的电离起到抑制作用,会水解的盐对水的电离起到促进作用,所以由①到③过程中,水的电离程度逐渐增大,D项错误。
6.常温下,向20 mL 0.1 mo1 · L-1 Na2XO3溶液中滴加pH=1的盐酸溶液,含X的粒子的物质的量分数与pH关系如图所示(H2XO3分解生成的XO2气体未画出)。
下列说法错误的是( )。
A.B点消耗盐酸的体积为20 mL
B.B点溶液中离子浓度最大的是HXO3-
C.A点溶液中c(HXO3- )=c(XO32- )>c(OH-)>c(H+)
D.pH=9时,c(Na+)>c(HXO3-)+2c(XO32- )
答案
解析
B
【解析】盐酸的pH=1,c(H+)=0.1 mol·L-1,B点恰好生成NaHXO3,即恰好发生反应Na2XO3+HCl NaCl+NaHXO3,则消耗V[HCl(aq)]=20 mL,A项正确;B点溶液中的主要溶质是NaHXO3,c(Na+)最大,B项错误;A点中c(HXO3- )=c(XO32- ),溶液呈碱性,C项正确;pH=9时,c(OH-)>c(H+),根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(HXO3- )+2c(XO32- )推知,c(Na+)>c(HXO3- )+2c(XO32- ),D项正确。
延时符
谢
谢
观
赏
同课章节目录
