2021届高考化学 考前10天 电化学 课件(33张ppt)
文档属性
| 名称 | 2021届高考化学 考前10天 电化学 课件(33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 976.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-29 07:19:12 | ||
图片预览







文档简介
2021
高考倒计时●化学
考前10天 电化学
01
核 心 速 记
02
易 错 剖 析
目录
03
自 我 检 测
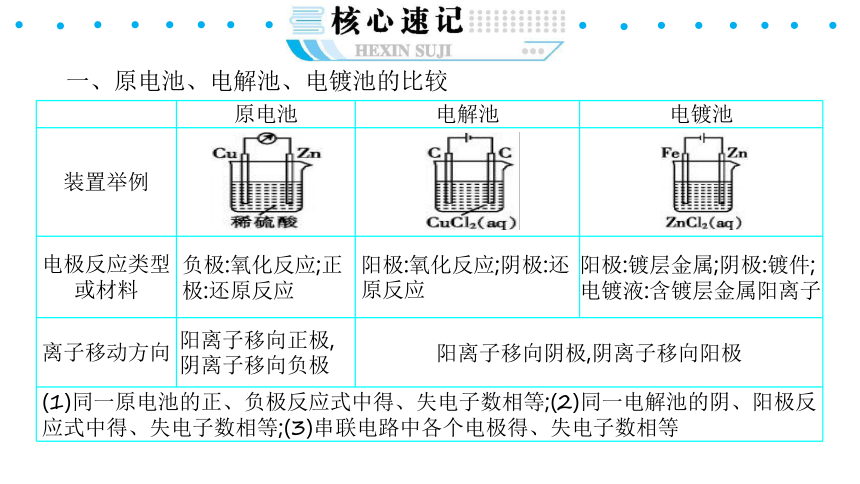
一、原电池、电解池、电镀池的比较
{5940675A-B579-460E-94D1-54222C63F5DA}
原电池
电解池
电镀池
装置举例
电极反应类型或材料
负极:氧化反应;正极:还原反应
阳极:氧化反应;阴极:还原反应
阳极:镀层金属;阴极:镀件;电镀液:含镀层金属阳离子
离子移动方向
阳离子移向正极,阴离子移向负极
阳离子移向阴极,阴离子移向阳极
(1)同一原电池的正、负极反应式中得、失电子数相等;(2)同一电解池的阴、阳极反应式中得、失电子数相等;(3)串联电路中各个电极得、失电子数相等
注意:某离子在哪一极参与电极反应,就向哪一极迁移。例如,Mg+NaClO+H2O Mg(OH)2+NaCl设计成原电池,ClO-向正极迁移并发生还原反应。
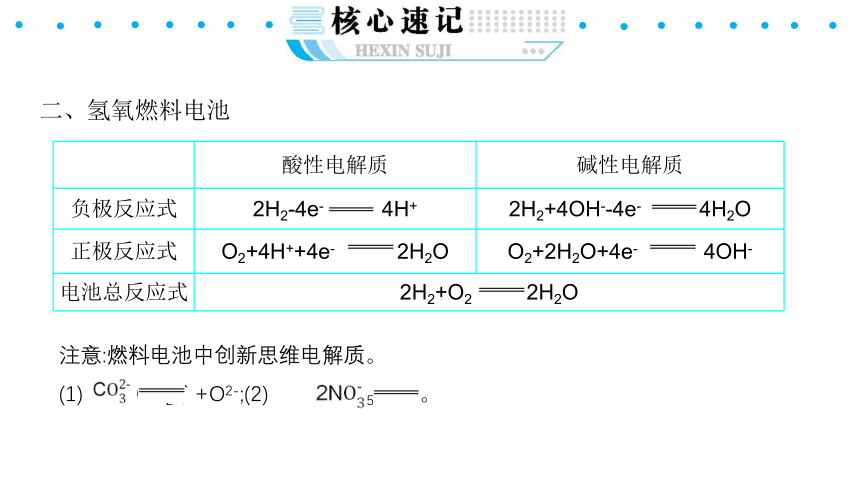
二、氢氧燃料电池
{5940675A-B579-460E-94D1-54222C63F5DA}
酸性电解质
碱性电解质
负极反应式
2H2-4e- 4H+
2H2+4OH--4e- 4H2O
正极反应式
O2+4H++4e- 2H2O
O2+2H2O+4e- 4OH-
电池总反应式
2H2+O2 2H2O
注意:燃料电池中创新思维电解质。
(1) CO2↑+O2-;(2) N2O5+O2-。
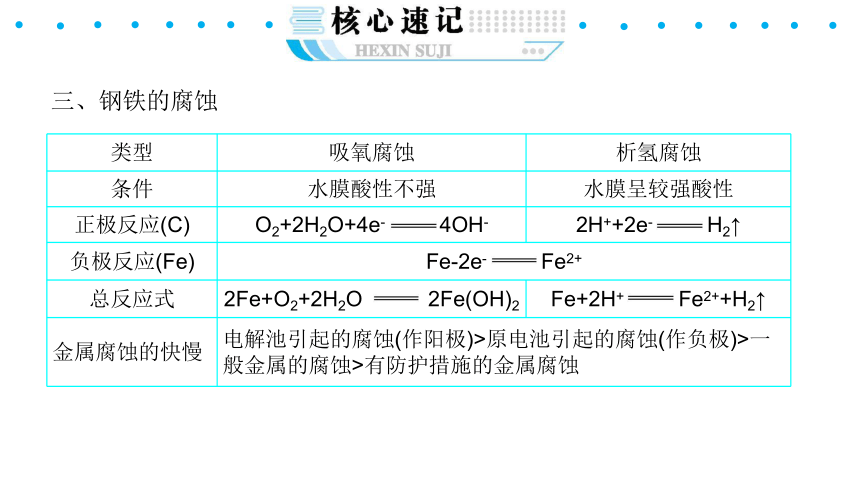
三、钢铁的腐蚀
{5940675A-B579-460E-94D1-54222C63F5DA}类型
吸氧腐蚀
析氢腐蚀
条件
水膜酸性不强
水膜呈较强酸性
正极反应(C)
O2+2H2O+4e- 4OH-
2H++2e- H2↑
负极反应(Fe)
Fe-2e- Fe2+
总反应式
2Fe+O2+2H2O 2Fe(OH)2
Fe+2H+ Fe2++H2↑
金属腐蚀的快慢
电解池引起的腐蚀(作阳极)>原电池引起的腐蚀(作负极)>一般金属的腐蚀>有防护措施的金属腐蚀
四、电解池中离子的放电顺序
1.阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸溶液)>Pb2+>Fe2+>Zn2+>H+(水提供)。
2.阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子。
注意:(1)没有说明时,铁在电极发生氧化反应只生成Fe2+。
(2)Fe3++e- Fe2+。
(3)放电顺序中“含氧酸根离子”指最高价含氧酸根离子,如 等。较低价态还原性离子,如 等可能在阳极上发生氧化反应。
易错点一 原电池正、负极的判断及电极反应式的书写
【纠错本实例】
1.能作为正、负极判断的标志
①方向:电流方向、电子移动方向、电解质溶液中离子的移动方向。
②反应:负极失电子,发生氧化反应;正极得电子,发生还原反应。
2.先分析正、负极,再根据正、负极反应规律去书写电极反应式。注意电解质溶液对正、负极反应产物的影响。若电解质溶液为酸性溶液,反应式两边不能出现OH-;若电解质溶液为碱性溶液,反应式两边不能出现H+。
3.正、负极反应式相加可得到电池的总反应式;电池的总反应式减去其中一极的电极反应式,可得到另一极的电极反应式。
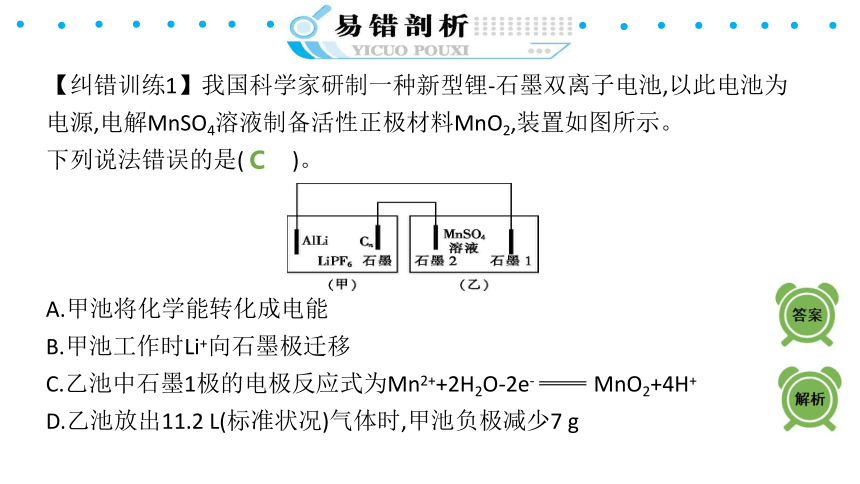
【纠错训练1】我国科学家研制一种新型锂-石墨双离子电池,以此电池为电源,电解MnSO4溶液制备活性正极材料MnO2,装置如图所示。
下列说法错误的是( )。
A.甲池将化学能转化成电能
B.甲池工作时Li+向石墨极迁移
C.乙池中石墨1极的电极反应式为Mn2++2H2O-2e- MnO2+4H+
D.乙池放出11.2 L(标准状况)气体时,甲池负极减少7 g
C
【解析】甲池是原电池,将化学能转化为电能,A项正确;甲池工作时,石墨极为正极,Li+向正极迁移,B项正确;乙池石墨1为阴极,石墨2为阳极,在阳极上生成MnO2,C项错误;乙池中石墨1极的电极反应式为2H++2e- H2↑,n(H2)=0.5 mol,转移电子n(e-)=1 mol,锂比铝活泼,甲池负极反应式为Li-e- Li+,m(Li)=7 g,D项正确。
返回题目
【纠错训练2】一种基于酸性燃料电池原理设计的酒精检测仪,负极上发生的反应为CH3CH2OH-4e-+H2O CH3COOH+4H+。下列有关说法正确的是( )。
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池总反应的化学方程式为CH3CH2OH+O2 CH3COOH+H2O
D.正极上发生的反应是O2+4e-+2H2O 4OH-
C
解析? 【解析】原电池中H+移向正极,A项错误;O2得电子被还原,化合价由0 -2,若有0.4 mol电子转移,则消耗氧气0.1 mol,标准状况下体积为2.24 L,B项错误;酸性电池中不可能得到OH-,D项错误。
返回题目
易错点二 多装置之间的联系
1.根据装置判断:判断一个装置是原电池还是电解池,关键是看装置是否有外加电源。若有外加电源,两极插入电解质溶液中,则一般是电解池。若无外接电源,可能是原电池;当两池串联时,电极材料的活动性相差较大的为原电池,电极材料活动性相差较小的为电解池。
2.根据反应方向判断:非自发的氧化还原反应一般通过电解池原理实现,如能使Cu+2HCl CuCl2+H2↑发生的装置一定是电解池。原电池中的氧化还原反应一般能自发进行。
【纠错训练3】某高能锂离子电池,以LiPF6·SO(CH3)2为电解质传导Li+。电池反应为4Li+FeS 2Fe+2Li2S。以此电池为电源处理含大量Na+、Cl-和S的废水,装置如图所示。
下列说法正确的是( )。
A.膜1、膜2分别为阳离子、阴离子交换膜
B.电池放电时正极反应式为FeS2+2e-+4Li+ Fe+2Li2S
C.通过两膜的阴离子总数一定等于阳离子总数
D.收集11.2 L(标准状况)Y气体时,理论上原料室左室净增40 g NaOH
A
解析? 根据物质流向,左室中稀氢氧化钠溶液进入,流出浓氢氧化钠溶液,说明Na+从原料室进入左室,X气体为H2,则Y气体为O2。左室为阴极区,电极反应式为2H2O+2e- 2OH-+H2↑,右室为阳极区,电极反应式为2H2O-4e- 4H++O2↑。膜1为阳离子交换膜,膜2为阴离子交换膜,A项正确;放电时正极的电极反应式为FeS2+4e-+4Li+ Fe+2Li2S,B项错误;通过两膜的正电荷总数等于负电荷总数,由于Na+、Cl-、S所带电荷数不完全相等,迁移的阴、阳离子总数不相等,C项错误;n(O2)=0.5 mol,转移电子n(e-)=2 mol,迁移阳离子n(Na+)=2 mol,n(NaOH)=2 mol,m(NaOH)=80 g,D项错误。
返回题目
易错点三 电化学的计算
【纠错本实例】
1.根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等。
2.根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据反应式列比例式计算。
3.根据关系式计算:由得失电子守恒关系建立计算所需的关系式——已知量与未知量之间的桥梁。串联电路中各电极得失电子数相等,即电路中通过的电量(电子总数)相等。通常存在下列物质的量关系:
。
【纠错训练4】约翰·B·古迪纳夫是钴酸锂二次电池的发明人,电解质LiPF6溶于混合有机溶剂,装置如图所示,放电过程反应为xLi+Li1-xCoO2
LiCoO2。
下列说法正确的是( )。
A.放电时,电子由R极流出,经电解质流向Q极
B.放电时,正极反应式为xLi++Li1-xCoO2+xe- LiCoO2
C.充电时,电源b极为负极
D.充电时,R极净增14 g时转移1 mol电子
B
解析? 电子由R极流出,经外电路流向Q极,电子只能在导线上迁移,离子只能在电解质中迁移,A项错误;放电时,Q极上发生还原反应,电极反应式为xLi++Li1-xCoO2+xe-
LiCoO2,B项正确;充电时,Q极为阳极,阳极与电源正极相连,b极为正极,C项错误;充电时,R极的电极反应式为Li++e- Li,R极净增的质量是锂的质量,n(Li)= =2 mol,增加2 mol Li时转移2 mol电子,D项错误。
返回题目
1.一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池如图所示。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应后的产物均为无毒无害的物质。下列说法正确的是( )。
A.电极甲发生还原反应
B.电池内的O2-由电极乙移向电极甲
C.电池总反应为N2H4+2O2 2NO+2H2O
D.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
B
解析? 通O2的一极为正极,通N2H4的一极为负极,即电极甲为负极,电极甲上发生氧化反应,A项错误;O2-从正极移向负极,B项正确;因为反应生成无毒无害物质,即N2H4转化成N2和H2O,C项错误;题目中没有说明条件是否为标准状况下,因此无法计算气体的体积,D项错误。
返回题目
2.某氟离子电池以熔融金属氟化物为电解质,其工作原理为3Mg+2BiF3
3MgF2+2Bi,装置如图所示。充电时,以甲烷燃料电池为电源。
下列说法错误的是( )。
A.放电时,电极a的电势低于电极b
B.放电时,电极a的电极反应式为Mg-2e-+2F- MgF2
C.充电时,甲烷燃料电池中充入甲烷的一极与电极b相连
D.充电时,每转移0.3 mol电子消耗20.9 g Bi
C
解析? 由电池反应式知,放电时镁为负极,即电极a为负极,电极b为正极,正极的电势高于负极,A项正确;放电时,Mg发生氧化反应生成MgF2,B项正确;充电时,电极b为阳极,与电源正极相连,而CH4燃料电池中充入甲烷的一极为负极,与电极a相连,C项错误;充电时,电极b的电极反应式为Bi-3e-+3F-
BiF3,每转移0.3 mol电子消耗0.1 mol(20.9 g)Bi,D项正确。
返回题目
3.一种高能量比的新型干电池以食盐水和氨水的混合液为电解质溶液,电池反应为3MnO2+Al+3H2O 3MnO(OH)+Al(OH)3。下列说法错误的是( )。
A.放电一段时间后,氨水和氯化钠溶液中的浓度均增大
B.若用食盐水和NaOH溶液作电解质溶液,其电池反应相同
C.正极反应式为MnO2+e-+H2O MnO(OH)+OH-
D.若电路中转移0.3 mol电子,理论上消耗26.1 g MnO2
B
解析? 由电池反应知,放电过程中消耗了水,电解质溶液浓度增大,A项正确;氢氧化钠是强碱,氢氧化铝溶于氢氧化钠溶液,若用氢氧化钠溶液代替氨水,电池反应式为3MnO2+Al+H2O+NaOH 3MnO(OH)+NaAlO2,B项错误;正极上二氧化锰发生还原反应,C项正确;转移1 mol电子时理论上消耗1 mol MnO2,转移0.3 mol电子,理论上消耗MnO2的质量为0.3 mol×87 g·mol-1=26.1 g,D项正确。
返回题目
4.某碱性电池的电池反应为Zn+ +OH-+H2O [Zn(OH)4]2-,装置如图所示。
已知:电流效率(η)等于电路通过的电子数与负极失去电子总数之比。
下列说法错误的是( )。
A.电池放电时,负极附近溶液pH升高
B.Pt极的电极反应式为 +2e-+H2O 3OH-
C.负极发生的副反应为Zn+2OH-+2H2O [Zn(OH)4]2-+H2↑
D.若溶解13 g Zn,电流表流过0.24 mol电子,则该电池效率为60%
A
解析? 负极反应式为Zn-2e-+4OH- [Zn(OH)4]2-,负极附近溶液pH下降,A项错误;铂极为正极,发生还原反应,电极反应式为 +2e-+H2O 3OH-,B项正确;锌直接与氢氧化钠反应,C项正确;n(Zn)=0.2 mol,理论上失去0.4 mol电子,电池效率为60%,D项正确。
返回题目
5.重铬酸钾(K2Cr2O7)是一种重要的氧化剂。工业上,常采用电解K2CrO4溶液制备重铬酸钾。某小组拟利用电伏电池为电源制备重铬酸钾,装置如图所示。
下列说法错误的是( )。
A.电极a为正极,不锈钢极产生H2
B.石墨极反应式为2H2O-4e- 4H++O2↑
C.电解过程中交换膜右侧溶液pH升高
D.每转移2 mol电子时理论上有1 mol离子由交换膜左侧向右侧迁移
D
解析? 如图所示,石墨极为阳极,不锈钢极为阴极,电极a为正极,电极b为负极。阴极的电极反应式为2H2O+2e- 2OH-+H2↑,A项正确;阳极上H2O发生氧化反应产生O2,B项正确;电解过程中,交换膜右侧生成了KOH,右侧溶液中KOH浓度增大,pH升高,C项正确;每转移2 mol电子,理论上有2 mol K+由交换膜左侧向右侧迁移,D项错误。
返回题目
6.把物质的量均为0.1 mol的AlCl3、CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。下列叙述正确的是( )。
A.阳极得到的气体中有O2且为0.35 mol
B.铝元素仅以Al(OH)3的形式存在
C.阴极质量增加3.2 g
D.电路中共转移0.9 mol电子
D
解析? 用惰性电极电解,阴极反应式为Cu2++2e- Cu,2H++2e- H2↑;阳极反应式为2Cl--2e- Cl2↑,4OH--4e- 2H2O+O2↑。①当电路中通过0.2 mol e-时,阴极Cu2+放电完毕,析出0.1 mol Cu,阳极产生0.1 mol Cl2。②当电路中通过0.4 mol e-时,阴极H+放电完毕,产生0.1 mol H2,阳极产生0.2 mol Cl2。③当电路中通过0.5 mol e-时,此时相当于电解氯化氢,阴极产生0.15 mol H2,阳极产生0.25 mol Cl2。④当电路中通过大于0.5 mol e-时,实际上是电解水,2H2O 2H2↑+O2↑,因两极收集到的气体体积相等,则电解水时产生的氢气要比氧气多0.1 mol,即电解水时产生0.2 mol H2、0.1 mol O2,转移0.4 mol e-,整个过程转移电子0.9 mol。阳极得到0.25 mol Cl2、0.1 mol O2,A项错误;铝元素以Al3+和Al(OH)3的形式存在,B项错误;阴极质量增加6.4 g,C项错误。
返回题目
延时符
谢
谢
观
赏
高考倒计时●化学
考前10天 电化学
01
核 心 速 记
02
易 错 剖 析
目录
03
自 我 检 测
一、原电池、电解池、电镀池的比较
{5940675A-B579-460E-94D1-54222C63F5DA}
原电池
电解池
电镀池
装置举例
电极反应类型或材料
负极:氧化反应;正极:还原反应
阳极:氧化反应;阴极:还原反应
阳极:镀层金属;阴极:镀件;电镀液:含镀层金属阳离子
离子移动方向
阳离子移向正极,阴离子移向负极
阳离子移向阴极,阴离子移向阳极
(1)同一原电池的正、负极反应式中得、失电子数相等;(2)同一电解池的阴、阳极反应式中得、失电子数相等;(3)串联电路中各个电极得、失电子数相等
注意:某离子在哪一极参与电极反应,就向哪一极迁移。例如,Mg+NaClO+H2O Mg(OH)2+NaCl设计成原电池,ClO-向正极迁移并发生还原反应。
二、氢氧燃料电池
{5940675A-B579-460E-94D1-54222C63F5DA}
酸性电解质
碱性电解质
负极反应式
2H2-4e- 4H+
2H2+4OH--4e- 4H2O
正极反应式
O2+4H++4e- 2H2O
O2+2H2O+4e- 4OH-
电池总反应式
2H2+O2 2H2O
注意:燃料电池中创新思维电解质。
(1) CO2↑+O2-;(2) N2O5+O2-。
三、钢铁的腐蚀
{5940675A-B579-460E-94D1-54222C63F5DA}类型
吸氧腐蚀
析氢腐蚀
条件
水膜酸性不强
水膜呈较强酸性
正极反应(C)
O2+2H2O+4e- 4OH-
2H++2e- H2↑
负极反应(Fe)
Fe-2e- Fe2+
总反应式
2Fe+O2+2H2O 2Fe(OH)2
Fe+2H+ Fe2++H2↑
金属腐蚀的快慢
电解池引起的腐蚀(作阳极)>原电池引起的腐蚀(作负极)>一般金属的腐蚀>有防护措施的金属腐蚀
四、电解池中离子的放电顺序
1.阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸溶液)>Pb2+>Fe2+>Zn2+>H+(水提供)。
2.阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子。
注意:(1)没有说明时,铁在电极发生氧化反应只生成Fe2+。
(2)Fe3++e- Fe2+。
(3)放电顺序中“含氧酸根离子”指最高价含氧酸根离子,如 等。较低价态还原性离子,如 等可能在阳极上发生氧化反应。
易错点一 原电池正、负极的判断及电极反应式的书写
【纠错本实例】
1.能作为正、负极判断的标志
①方向:电流方向、电子移动方向、电解质溶液中离子的移动方向。
②反应:负极失电子,发生氧化反应;正极得电子,发生还原反应。
2.先分析正、负极,再根据正、负极反应规律去书写电极反应式。注意电解质溶液对正、负极反应产物的影响。若电解质溶液为酸性溶液,反应式两边不能出现OH-;若电解质溶液为碱性溶液,反应式两边不能出现H+。
3.正、负极反应式相加可得到电池的总反应式;电池的总反应式减去其中一极的电极反应式,可得到另一极的电极反应式。
【纠错训练1】我国科学家研制一种新型锂-石墨双离子电池,以此电池为电源,电解MnSO4溶液制备活性正极材料MnO2,装置如图所示。
下列说法错误的是( )。
A.甲池将化学能转化成电能
B.甲池工作时Li+向石墨极迁移
C.乙池中石墨1极的电极反应式为Mn2++2H2O-2e- MnO2+4H+
D.乙池放出11.2 L(标准状况)气体时,甲池负极减少7 g
C
【解析】甲池是原电池,将化学能转化为电能,A项正确;甲池工作时,石墨极为正极,Li+向正极迁移,B项正确;乙池石墨1为阴极,石墨2为阳极,在阳极上生成MnO2,C项错误;乙池中石墨1极的电极反应式为2H++2e- H2↑,n(H2)=0.5 mol,转移电子n(e-)=1 mol,锂比铝活泼,甲池负极反应式为Li-e- Li+,m(Li)=7 g,D项正确。
返回题目
【纠错训练2】一种基于酸性燃料电池原理设计的酒精检测仪,负极上发生的反应为CH3CH2OH-4e-+H2O CH3COOH+4H+。下列有关说法正确的是( )。
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池总反应的化学方程式为CH3CH2OH+O2 CH3COOH+H2O
D.正极上发生的反应是O2+4e-+2H2O 4OH-
C
解析? 【解析】原电池中H+移向正极,A项错误;O2得电子被还原,化合价由0 -2,若有0.4 mol电子转移,则消耗氧气0.1 mol,标准状况下体积为2.24 L,B项错误;酸性电池中不可能得到OH-,D项错误。
返回题目
易错点二 多装置之间的联系
1.根据装置判断:判断一个装置是原电池还是电解池,关键是看装置是否有外加电源。若有外加电源,两极插入电解质溶液中,则一般是电解池。若无外接电源,可能是原电池;当两池串联时,电极材料的活动性相差较大的为原电池,电极材料活动性相差较小的为电解池。
2.根据反应方向判断:非自发的氧化还原反应一般通过电解池原理实现,如能使Cu+2HCl CuCl2+H2↑发生的装置一定是电解池。原电池中的氧化还原反应一般能自发进行。
【纠错训练3】某高能锂离子电池,以LiPF6·SO(CH3)2为电解质传导Li+。电池反应为4Li+FeS 2Fe+2Li2S。以此电池为电源处理含大量Na+、Cl-和S的废水,装置如图所示。
下列说法正确的是( )。
A.膜1、膜2分别为阳离子、阴离子交换膜
B.电池放电时正极反应式为FeS2+2e-+4Li+ Fe+2Li2S
C.通过两膜的阴离子总数一定等于阳离子总数
D.收集11.2 L(标准状况)Y气体时,理论上原料室左室净增40 g NaOH
A
解析? 根据物质流向,左室中稀氢氧化钠溶液进入,流出浓氢氧化钠溶液,说明Na+从原料室进入左室,X气体为H2,则Y气体为O2。左室为阴极区,电极反应式为2H2O+2e- 2OH-+H2↑,右室为阳极区,电极反应式为2H2O-4e- 4H++O2↑。膜1为阳离子交换膜,膜2为阴离子交换膜,A项正确;放电时正极的电极反应式为FeS2+4e-+4Li+ Fe+2Li2S,B项错误;通过两膜的正电荷总数等于负电荷总数,由于Na+、Cl-、S所带电荷数不完全相等,迁移的阴、阳离子总数不相等,C项错误;n(O2)=0.5 mol,转移电子n(e-)=2 mol,迁移阳离子n(Na+)=2 mol,n(NaOH)=2 mol,m(NaOH)=80 g,D项错误。
返回题目
易错点三 电化学的计算
【纠错本实例】
1.根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等。
2.根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据反应式列比例式计算。
3.根据关系式计算:由得失电子守恒关系建立计算所需的关系式——已知量与未知量之间的桥梁。串联电路中各电极得失电子数相等,即电路中通过的电量(电子总数)相等。通常存在下列物质的量关系:
。
【纠错训练4】约翰·B·古迪纳夫是钴酸锂二次电池的发明人,电解质LiPF6溶于混合有机溶剂,装置如图所示,放电过程反应为xLi+Li1-xCoO2
LiCoO2。
下列说法正确的是( )。
A.放电时,电子由R极流出,经电解质流向Q极
B.放电时,正极反应式为xLi++Li1-xCoO2+xe- LiCoO2
C.充电时,电源b极为负极
D.充电时,R极净增14 g时转移1 mol电子
B
解析? 电子由R极流出,经外电路流向Q极,电子只能在导线上迁移,离子只能在电解质中迁移,A项错误;放电时,Q极上发生还原反应,电极反应式为xLi++Li1-xCoO2+xe-
LiCoO2,B项正确;充电时,Q极为阳极,阳极与电源正极相连,b极为正极,C项错误;充电时,R极的电极反应式为Li++e- Li,R极净增的质量是锂的质量,n(Li)= =2 mol,增加2 mol Li时转移2 mol电子,D项错误。
返回题目
1.一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池如图所示。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应后的产物均为无毒无害的物质。下列说法正确的是( )。
A.电极甲发生还原反应
B.电池内的O2-由电极乙移向电极甲
C.电池总反应为N2H4+2O2 2NO+2H2O
D.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
B
解析? 通O2的一极为正极,通N2H4的一极为负极,即电极甲为负极,电极甲上发生氧化反应,A项错误;O2-从正极移向负极,B项正确;因为反应生成无毒无害物质,即N2H4转化成N2和H2O,C项错误;题目中没有说明条件是否为标准状况下,因此无法计算气体的体积,D项错误。
返回题目
2.某氟离子电池以熔融金属氟化物为电解质,其工作原理为3Mg+2BiF3
3MgF2+2Bi,装置如图所示。充电时,以甲烷燃料电池为电源。
下列说法错误的是( )。
A.放电时,电极a的电势低于电极b
B.放电时,电极a的电极反应式为Mg-2e-+2F- MgF2
C.充电时,甲烷燃料电池中充入甲烷的一极与电极b相连
D.充电时,每转移0.3 mol电子消耗20.9 g Bi
C
解析? 由电池反应式知,放电时镁为负极,即电极a为负极,电极b为正极,正极的电势高于负极,A项正确;放电时,Mg发生氧化反应生成MgF2,B项正确;充电时,电极b为阳极,与电源正极相连,而CH4燃料电池中充入甲烷的一极为负极,与电极a相连,C项错误;充电时,电极b的电极反应式为Bi-3e-+3F-
BiF3,每转移0.3 mol电子消耗0.1 mol(20.9 g)Bi,D项正确。
返回题目
3.一种高能量比的新型干电池以食盐水和氨水的混合液为电解质溶液,电池反应为3MnO2+Al+3H2O 3MnO(OH)+Al(OH)3。下列说法错误的是( )。
A.放电一段时间后,氨水和氯化钠溶液中的浓度均增大
B.若用食盐水和NaOH溶液作电解质溶液,其电池反应相同
C.正极反应式为MnO2+e-+H2O MnO(OH)+OH-
D.若电路中转移0.3 mol电子,理论上消耗26.1 g MnO2
B
解析? 由电池反应知,放电过程中消耗了水,电解质溶液浓度增大,A项正确;氢氧化钠是强碱,氢氧化铝溶于氢氧化钠溶液,若用氢氧化钠溶液代替氨水,电池反应式为3MnO2+Al+H2O+NaOH 3MnO(OH)+NaAlO2,B项错误;正极上二氧化锰发生还原反应,C项正确;转移1 mol电子时理论上消耗1 mol MnO2,转移0.3 mol电子,理论上消耗MnO2的质量为0.3 mol×87 g·mol-1=26.1 g,D项正确。
返回题目
4.某碱性电池的电池反应为Zn+ +OH-+H2O [Zn(OH)4]2-,装置如图所示。
已知:电流效率(η)等于电路通过的电子数与负极失去电子总数之比。
下列说法错误的是( )。
A.电池放电时,负极附近溶液pH升高
B.Pt极的电极反应式为 +2e-+H2O 3OH-
C.负极发生的副反应为Zn+2OH-+2H2O [Zn(OH)4]2-+H2↑
D.若溶解13 g Zn,电流表流过0.24 mol电子,则该电池效率为60%
A
解析? 负极反应式为Zn-2e-+4OH- [Zn(OH)4]2-,负极附近溶液pH下降,A项错误;铂极为正极,发生还原反应,电极反应式为 +2e-+H2O 3OH-,B项正确;锌直接与氢氧化钠反应,C项正确;n(Zn)=0.2 mol,理论上失去0.4 mol电子,电池效率为60%,D项正确。
返回题目
5.重铬酸钾(K2Cr2O7)是一种重要的氧化剂。工业上,常采用电解K2CrO4溶液制备重铬酸钾。某小组拟利用电伏电池为电源制备重铬酸钾,装置如图所示。
下列说法错误的是( )。
A.电极a为正极,不锈钢极产生H2
B.石墨极反应式为2H2O-4e- 4H++O2↑
C.电解过程中交换膜右侧溶液pH升高
D.每转移2 mol电子时理论上有1 mol离子由交换膜左侧向右侧迁移
D
解析? 如图所示,石墨极为阳极,不锈钢极为阴极,电极a为正极,电极b为负极。阴极的电极反应式为2H2O+2e- 2OH-+H2↑,A项正确;阳极上H2O发生氧化反应产生O2,B项正确;电解过程中,交换膜右侧生成了KOH,右侧溶液中KOH浓度增大,pH升高,C项正确;每转移2 mol电子,理论上有2 mol K+由交换膜左侧向右侧迁移,D项错误。
返回题目
6.把物质的量均为0.1 mol的AlCl3、CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。下列叙述正确的是( )。
A.阳极得到的气体中有O2且为0.35 mol
B.铝元素仅以Al(OH)3的形式存在
C.阴极质量增加3.2 g
D.电路中共转移0.9 mol电子
D
解析? 用惰性电极电解,阴极反应式为Cu2++2e- Cu,2H++2e- H2↑;阳极反应式为2Cl--2e- Cl2↑,4OH--4e- 2H2O+O2↑。①当电路中通过0.2 mol e-时,阴极Cu2+放电完毕,析出0.1 mol Cu,阳极产生0.1 mol Cl2。②当电路中通过0.4 mol e-时,阴极H+放电完毕,产生0.1 mol H2,阳极产生0.2 mol Cl2。③当电路中通过0.5 mol e-时,此时相当于电解氯化氢,阴极产生0.15 mol H2,阳极产生0.25 mol Cl2。④当电路中通过大于0.5 mol e-时,实际上是电解水,2H2O 2H2↑+O2↑,因两极收集到的气体体积相等,则电解水时产生的氢气要比氧气多0.1 mol,即电解水时产生0.2 mol H2、0.1 mol O2,转移0.4 mol e-,整个过程转移电子0.9 mol。阳极得到0.25 mol Cl2、0.1 mol O2,A项错误;铝元素以Al3+和Al(OH)3的形式存在,B项错误;阴极质量增加6.4 g,C项错误。
返回题目
延时符
谢
谢
观
赏
同课章节目录
