5.1 硫及其化合物 第三课时 硫酸根离子的检验 课件(26张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 5.1 硫及其化合物 第三课时 硫酸根离子的检验 课件(26张ppt)【新教材】2020-2021学年人教版(2019)高一化学必修二 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-29 00:00:00 | ||
图片预览







文档简介
硫及其化合物
第三课时 硫酸根离子的检验
常德芷兰实验学校
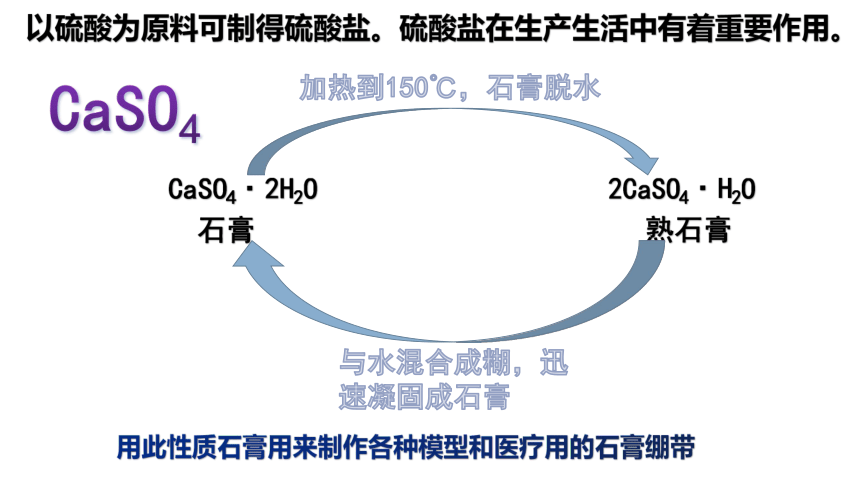
CaSO4·2H2O 2CaSO4·H2O
石膏 熟石膏
加热到150℃,石膏脱水
与水混合成糊,迅速凝固成石膏
用此性质石膏用来制作各种模型和医疗用的石膏绷带
CaSO4
以硫酸为原料可制得硫酸盐。硫酸盐在生产生活中有着重要作用。
BaSO4
钡餐双重造影
硫酸钡不溶于酸和水,且不易被X射线透过
CuSO4
无水硫酸铜用于检测水的存在
CuSO4·5H2O(俗称胆矾)
胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
硫酸亚铁
硫酸亚铁的结晶水合物俗称绿矾(FeSO4·7H2O)。在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化红铁(主要成分为Fe2O3)的原料。
硫酸钠
硫酸钠的结晶水合物Na2SO4·10H2O,又名芒硝,白色、无臭、有苦味的结晶或粉末, 有吸湿性。外形为无色、透明、大的结晶或颗粒性小结晶。主要用于制水玻璃、玻璃、瓷釉、纸浆、致冷混合剂、洗涤剂、干燥剂、染料稀释剂、分析化学试剂、医药品(常用于实热积滞,腹满胀痛,大便燥结,肠痈肿痛等病症的治疗;外治乳痈,痔疮肿痛)等。
硫酸铝钾
硫酸铝钾的结晶水合物KAl(SO4)2·12H2O,俗称明矾。无色结晶或粉末。无气味,微甜而有涩味、有收敛性。在干燥空气中风化失去结晶水,在潮湿空气中溶化淌水。易溶于甘油,能溶于水,水溶液呈酸性反应,水解后有氢氧化铝胶状物沉淀。不溶于醇和丙酮。熔点92.5℃。60~65℃硫酸干燥时失去9分子水,在200℃时十二个结晶水完全失去,更高温度分解出三氧化硫。明矾的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清。所以,明矾是一种较好的净水剂。明矾可由明矾石经煅烧、萃取,结晶而制得。
思考1:如何检验硫酸和硫酸盐中的硫酸根离子?
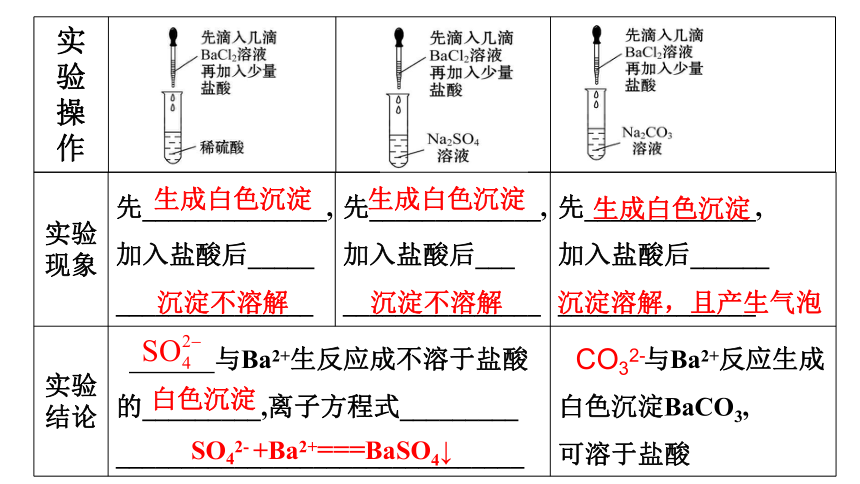
【实验5-4】
在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
实验
操作
实验
现象
先______________,加入盐酸后_____
_______________
先_____________,加入盐酸后___
_______________
先_____________,
加入盐酸后______
_______________
实验
结论
与Ba2+生反应成不溶于盐酸的_________,离子方程式_________
_______________________________
与Ba2+反应生成白色沉淀BaCO3,
可溶于盐酸
生成白色沉淀
沉淀不溶解
白色沉淀
SO42- +Ba2+===BaSO4↓
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且产生气泡
CO32-
【小结】硫酸根离子的检验?
(1)检验方法:
被检液 取清液 有无白色沉淀(判断有无 )
思考与讨论:
能否将盐酸和氯化钡溶液的滴加顺序交换?盐酸的作用?
不能,先加稀盐酸的目的是排除 CO32- 、SO32- 、Ag+干扰
注意事项:酸化时不能用硝酸代替,因为硝酸有氧化性,会将亚硫酸根离子氧化成硫酸根离子
总结:
离子的检验步骤:取×××溶液少量于试管中,加入×××,有(或无)×××现象,则证明有(或无)某离子
思考与讨论2:(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} ?杂质
加入的试剂
离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
?
?
粗盐的提纯
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
引入了Ba2+、CO32-、OH-
试剂的用量和顺序
提纯和除杂的原则
思考与讨论
1、表中所加除杂试剂的用量有何要求?
2、上表中的三种除杂试剂在加入粗盐溶液时的先后顺序
有何要求?
3、经过上述除杂后,溶液中还有哪些杂质离子?如何把这
些杂质离子除去?
为了将杂质充分除去,应加入稍过量的试剂
后面加入的除杂试剂要尽量能把前面加入的过量的除
杂试剂同时除去,所以三种除杂试剂中Na2CO3溶液应在
BaCl2溶液后面滴加,以除去过量的Ba2+。
还有CO32- 和OH-,加入盐酸除去直至无气泡产生
试剂添加顺序必须注意:
①Na2CO3必须在BaCl2之后,
②盐酸必须在Na2CO3和NaOH之后,
③加盐酸前必须过滤
④盐酸除去过量除杂剂,调节溶液酸碱性。
①BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤→滤液加入盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→滤液加入盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤→滤液加入盐酸
几种试剂加入顺序
NaCl
MgCl2
CaCl2
Na2SO4
过量BaCl2
BaSO4↓
NaCl
MgCl2
CaCl2
BaCl2
过量NaOH
Mg(OH)2↓
BaSO4↓
NaCl
CaCl2
BaCl2
NaOH
过量Na2CO3
过滤
Mg(OH)2↓
BaSO4↓
CaCO3 ↓
BaCO3 ↓
NaCl
NaOH
Na2CO3
NaCl
溶液
适量盐酸
食盐水
蒸发结晶
纯净NaCl固体
仪器:烧杯,漏斗,玻璃棒,铁架台
1.过滤
操作要点:一贴、二低、三靠
一贴:滤纸要紧贴漏斗;
二低:滤纸要低于漏斗边缘;溶液要低于滤纸.
三靠:烧杯要紧靠在玻璃棒上;
玻璃棒紧靠在滤纸三层处;
漏斗下端紧靠在烧杯内壁.
过滤:利用物质的溶解性不同分离难溶物与可溶物
仪器:蒸发皿,酒精灯,铁架台,玻璃棒
2.蒸发
操作要点:
①蒸发皿的液体不超过容积的2/3
②加热时,用玻璃棒不断搅拌
③出现较多固体时,应停止加热,利用余热蒸干
④取下未冷却的蒸发皿时,要放在石棉网上
蒸发:利用溶液沸点不同加热使溶剂挥发,分离溶质与溶剂。
1、为了除去粗盐中的Ca2+、Mg2+、SO42- 和泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量稀盐酸
④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
【练习】生产生活中的硫酸盐
D
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
D
四、不同价态含硫物质的转化
1、自然界中硫的存在和转化(教材P7资料卡片)
石膏
黄铁矿
芒硝
黄铜矿
SO2
SO3
H2S
H2SO3
H2SO4
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
黄铜矿(CuFeS2)
黄铁矿(FeS2)
S
1、自然界中硫的存在和转化(教材P7资料卡片)
S
S
S
S
-2
0
+4
+6
【探究】
(1)请根据不同价态硫元素的转化关系,请可能多地列举每种价态的硫元素所对应的物质,并根据硫元素化合价的变化,分析各种物质在氧化还原反应中表现氧化性还是还原性。
最低价,只有还原性
中间价,既有氧化性又有还原性
最高价,只有氧化性
化合价下降,加还原剂
化合价上升,加氧化剂
【归类,构建模型】
含硫物质的连续转化
【探究】
(2)通过小组讨论的形式整理不同价态含硫物质间实现转化的可能方案。
{616DA210-FB5B-4158-B5E0-FEB733F419BA}实验序号
价态变化
转化前的物质
选择试剂
转化后的物质
预期现象
1
+6 → +4
H2SO4
2
+4 → 0
SO2
3
0 → -2
S
4
-2 → 0
H2S
5
0 → +4
S
6
+4 → +6
H2SO3
H2O2
S
生成淡黄色固体
空气
SO2
硫燃烧,发出淡蓝色火焰,产生有刺激气味的气体
H2O2
H2SO4
反应前后用pH试纸测pH,值变小;反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
Cu
SO2
产生有刺激气味的气体,该气体能使品红褪色
H2S
S
生成淡黄色固体
Fe
FeS
剧烈反应,生成黑色固体
【练习】
1、下列不能通过一步反应实现的是( )
A.H2S SO2
B.S SO3
C.SO2 H2SO4
D.H2SO4(浓) SO2
O2
O2
Br2的水溶液
C
B
2.下列有关硫及其化合物的说法正确的是( )
A.SO2、H2SO3均具有还原性,故浓硫酸均能氧化SO2和H2SO3
B.H2S与浓硫酸在不同的条件下反应的氧化产物只能是SO2
C
第三课时 硫酸根离子的检验
常德芷兰实验学校
CaSO4·2H2O 2CaSO4·H2O
石膏 熟石膏
加热到150℃,石膏脱水
与水混合成糊,迅速凝固成石膏
用此性质石膏用来制作各种模型和医疗用的石膏绷带
CaSO4
以硫酸为原料可制得硫酸盐。硫酸盐在生产生活中有着重要作用。
BaSO4
钡餐双重造影
硫酸钡不溶于酸和水,且不易被X射线透过
CuSO4
无水硫酸铜用于检测水的存在
CuSO4·5H2O(俗称胆矾)
胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
硫酸亚铁
硫酸亚铁的结晶水合物俗称绿矾(FeSO4·7H2O)。在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化红铁(主要成分为Fe2O3)的原料。
硫酸钠
硫酸钠的结晶水合物Na2SO4·10H2O,又名芒硝,白色、无臭、有苦味的结晶或粉末, 有吸湿性。外形为无色、透明、大的结晶或颗粒性小结晶。主要用于制水玻璃、玻璃、瓷釉、纸浆、致冷混合剂、洗涤剂、干燥剂、染料稀释剂、分析化学试剂、医药品(常用于实热积滞,腹满胀痛,大便燥结,肠痈肿痛等病症的治疗;外治乳痈,痔疮肿痛)等。
硫酸铝钾
硫酸铝钾的结晶水合物KAl(SO4)2·12H2O,俗称明矾。无色结晶或粉末。无气味,微甜而有涩味、有收敛性。在干燥空气中风化失去结晶水,在潮湿空气中溶化淌水。易溶于甘油,能溶于水,水溶液呈酸性反应,水解后有氢氧化铝胶状物沉淀。不溶于醇和丙酮。熔点92.5℃。60~65℃硫酸干燥时失去9分子水,在200℃时十二个结晶水完全失去,更高温度分解出三氧化硫。明矾的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清。所以,明矾是一种较好的净水剂。明矾可由明矾石经煅烧、萃取,结晶而制得。
思考1:如何检验硫酸和硫酸盐中的硫酸根离子?
【实验5-4】
在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
实验
操作
实验
现象
先______________,加入盐酸后_____
_______________
先_____________,加入盐酸后___
_______________
先_____________,
加入盐酸后______
_______________
实验
结论
与Ba2+生反应成不溶于盐酸的_________,离子方程式_________
_______________________________
与Ba2+反应生成白色沉淀BaCO3,
可溶于盐酸
生成白色沉淀
沉淀不溶解
白色沉淀
SO42- +Ba2+===BaSO4↓
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且产生气泡
CO32-
【小结】硫酸根离子的检验?
(1)检验方法:
被检液 取清液 有无白色沉淀(判断有无 )
思考与讨论:
能否将盐酸和氯化钡溶液的滴加顺序交换?盐酸的作用?
不能,先加稀盐酸的目的是排除 CO32- 、SO32- 、Ag+干扰
注意事项:酸化时不能用硝酸代替,因为硝酸有氧化性,会将亚硫酸根离子氧化成硫酸根离子
总结:
离子的检验步骤:取×××溶液少量于试管中,加入×××,有(或无)×××现象,则证明有(或无)某离子
思考与讨论2:(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} ?杂质
加入的试剂
离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
?
?
粗盐的提纯
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
引入了Ba2+、CO32-、OH-
试剂的用量和顺序
提纯和除杂的原则
思考与讨论
1、表中所加除杂试剂的用量有何要求?
2、上表中的三种除杂试剂在加入粗盐溶液时的先后顺序
有何要求?
3、经过上述除杂后,溶液中还有哪些杂质离子?如何把这
些杂质离子除去?
为了将杂质充分除去,应加入稍过量的试剂
后面加入的除杂试剂要尽量能把前面加入的过量的除
杂试剂同时除去,所以三种除杂试剂中Na2CO3溶液应在
BaCl2溶液后面滴加,以除去过量的Ba2+。
还有CO32- 和OH-,加入盐酸除去直至无气泡产生
试剂添加顺序必须注意:
①Na2CO3必须在BaCl2之后,
②盐酸必须在Na2CO3和NaOH之后,
③加盐酸前必须过滤
④盐酸除去过量除杂剂,调节溶液酸碱性。
①BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤→滤液加入盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→滤液加入盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤→滤液加入盐酸
几种试剂加入顺序
NaCl
MgCl2
CaCl2
Na2SO4
过量BaCl2
BaSO4↓
NaCl
MgCl2
CaCl2
BaCl2
过量NaOH
Mg(OH)2↓
BaSO4↓
NaCl
CaCl2
BaCl2
NaOH
过量Na2CO3
过滤
Mg(OH)2↓
BaSO4↓
CaCO3 ↓
BaCO3 ↓
NaCl
NaOH
Na2CO3
NaCl
溶液
适量盐酸
食盐水
蒸发结晶
纯净NaCl固体
仪器:烧杯,漏斗,玻璃棒,铁架台
1.过滤
操作要点:一贴、二低、三靠
一贴:滤纸要紧贴漏斗;
二低:滤纸要低于漏斗边缘;溶液要低于滤纸.
三靠:烧杯要紧靠在玻璃棒上;
玻璃棒紧靠在滤纸三层处;
漏斗下端紧靠在烧杯内壁.
过滤:利用物质的溶解性不同分离难溶物与可溶物
仪器:蒸发皿,酒精灯,铁架台,玻璃棒
2.蒸发
操作要点:
①蒸发皿的液体不超过容积的2/3
②加热时,用玻璃棒不断搅拌
③出现较多固体时,应停止加热,利用余热蒸干
④取下未冷却的蒸发皿时,要放在石棉网上
蒸发:利用溶液沸点不同加热使溶剂挥发,分离溶质与溶剂。
1、为了除去粗盐中的Ca2+、Mg2+、SO42- 和泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量稀盐酸
④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
【练习】生产生活中的硫酸盐
D
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
D
四、不同价态含硫物质的转化
1、自然界中硫的存在和转化(教材P7资料卡片)
石膏
黄铁矿
芒硝
黄铜矿
SO2
SO3
H2S
H2SO3
H2SO4
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
黄铜矿(CuFeS2)
黄铁矿(FeS2)
S
1、自然界中硫的存在和转化(教材P7资料卡片)
S
S
S
S
-2
0
+4
+6
【探究】
(1)请根据不同价态硫元素的转化关系,请可能多地列举每种价态的硫元素所对应的物质,并根据硫元素化合价的变化,分析各种物质在氧化还原反应中表现氧化性还是还原性。
最低价,只有还原性
中间价,既有氧化性又有还原性
最高价,只有氧化性
化合价下降,加还原剂
化合价上升,加氧化剂
【归类,构建模型】
含硫物质的连续转化
【探究】
(2)通过小组讨论的形式整理不同价态含硫物质间实现转化的可能方案。
{616DA210-FB5B-4158-B5E0-FEB733F419BA}实验序号
价态变化
转化前的物质
选择试剂
转化后的物质
预期现象
1
+6 → +4
H2SO4
2
+4 → 0
SO2
3
0 → -2
S
4
-2 → 0
H2S
5
0 → +4
S
6
+4 → +6
H2SO3
H2O2
S
生成淡黄色固体
空气
SO2
硫燃烧,发出淡蓝色火焰,产生有刺激气味的气体
H2O2
H2SO4
反应前后用pH试纸测pH,值变小;反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
Cu
SO2
产生有刺激气味的气体,该气体能使品红褪色
H2S
S
生成淡黄色固体
Fe
FeS
剧烈反应,生成黑色固体
【练习】
1、下列不能通过一步反应实现的是( )
A.H2S SO2
B.S SO3
C.SO2 H2SO4
D.H2SO4(浓) SO2
O2
O2
Br2的水溶液
C
B
2.下列有关硫及其化合物的说法正确的是( )
A.SO2、H2SO3均具有还原性,故浓硫酸均能氧化SO2和H2SO3
B.H2S与浓硫酸在不同的条件下反应的氧化产物只能是SO2
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
