2020—2021学年人教版高中化学必修2第2章第2节 化学能与电能(23张PPT)
文档属性
| 名称 | 2020—2021学年人教版高中化学必修2第2章第2节 化学能与电能(23张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-29 10:18:37 | ||
图片预览




文档简介
(共23张PPT)
必修二
第二章
化学反应与能量
第二节
化学能与电能
化学能与电能
学习目标
4
1
知识与技能:
初步掌握原电池的概念和形成条件,理解原电池的原理。
2
过程与方法:
通过教师创设问题情境、学生进行实验探究,帮助学生自主建构原电池的概念,理解和掌握原电池的原理。
3
情感态度价值观:
通过对原电池工作
原理及条件的探究,
培养浓厚的学习兴
趣,养成严谨求实
的科学态度。
重点
难点
化学能与电能
原电池的工
作原理和构
成条件。
通过对原电池实验的探究,从电子转移角度理解化学能转化为电能的本质。
重难点
思考与交流:
在你的生活和学习中,或你了解的范围里,还有哪些需要使用电池的产品或器具?各使用什么样的电池?
各种电子产品
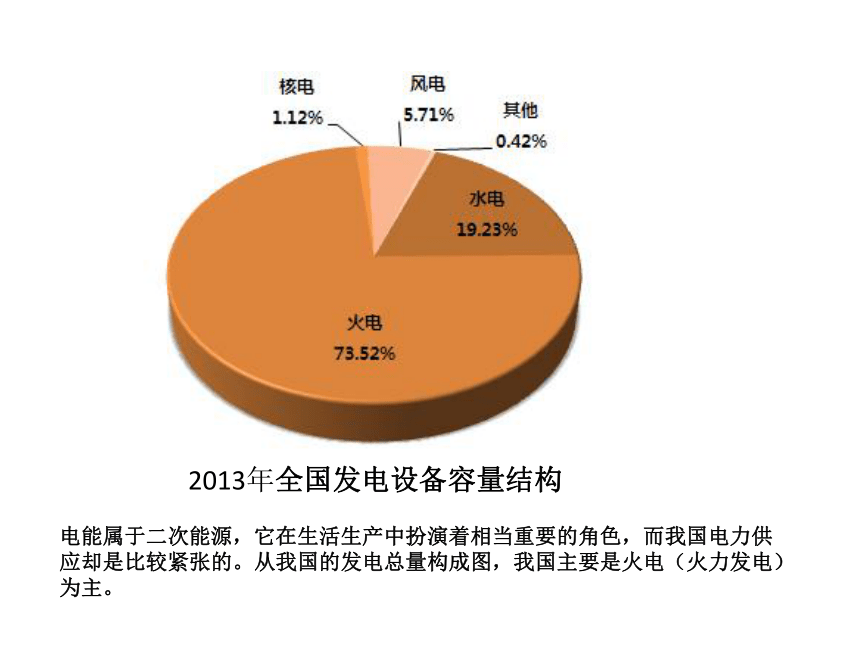
电能属于二次能源,它在生活生产中扮演着相当重要的角色,而我国电力供应却是比较紧张的。从我国的发电总量构成图,我国主要是火电(火力发电)为主。
2013年全国发电设备容量结构
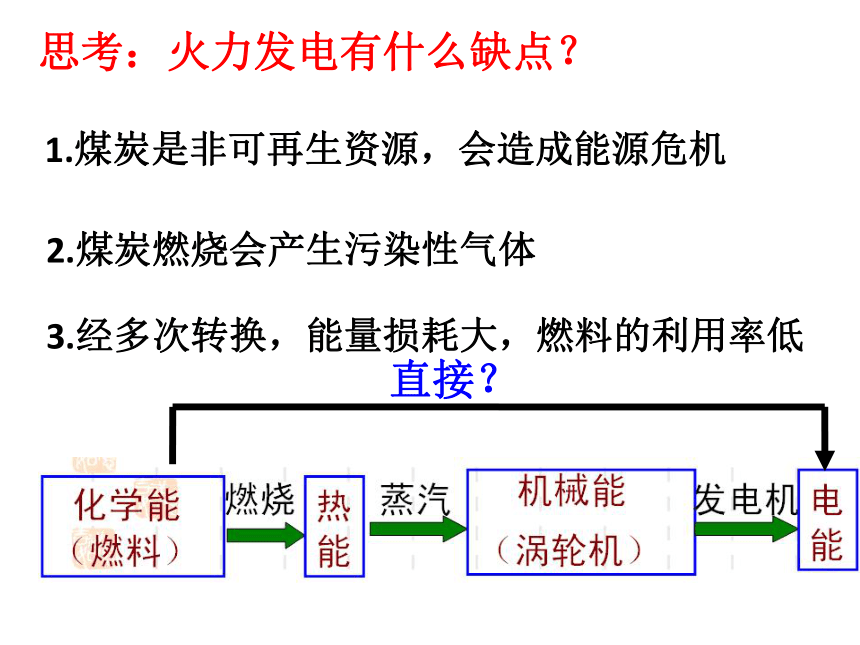
燃烧
蒸汽
发电机
化学能
热能
机械能
电能
一、化学能转化为电能
1、火力发电的原理及过程
燃烧
氧化还原反应
关键:
本质:
注:
思考:火力发电有什么缺点?
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的利用率低
直接?
思考交流
问题1:化学反应中的化学能是否都可以直接转化为电能呢?
问题2
:若将化学能直接转化为电能,所要解决的第一问题是什么?
问题3:怎样架设桥梁使电子从还原剂区域转移到氧化剂区域,同时形成电流?
问题4:怎样知道所架设的桥梁中有电子流过?
电子定向移动形成电流
有电子转移的氧化还原反应
电解质溶液
、导线
灵敏电流计
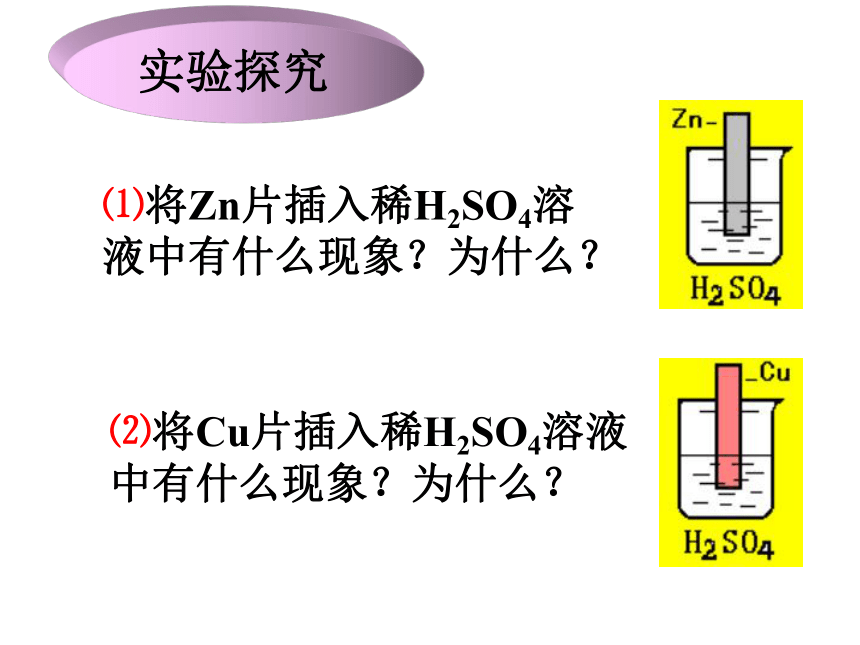
⑴将Zn片插入稀H2SO4溶液中有什么现象?为什么?
⑵将Cu片插入稀H2SO4溶液中有什么现象?为什么?
实验探究
⑷若将Zn片,Cu片用一导线连接再浸在稀H2SO4溶液中,有什么现象?导线间接一电流计有何现象产生?为什么?
⑶将一Zn片,Cu片平行插入稀H2SO4溶液中,有什么现象?为什么?
实验探究
一、化学能与电能的相互转换
1、原电池的定义:
将化学能转变为电能的装置叫做原电池。
3、锌铜原电池的工作原理
电极材料
现象
电子转移
电极反应式
反应类型
电极
Zn片
溶解、质量变小
Cu片
有气泡产生
总离子方程式
Zn-2e-
=Zn2+
2H++2e-
=H2↑
Zn+2H+=Zn2++H2↑
还原反应
失电子
得电子
2、原电池的本质:
氧化还原反应
氧化反应
负极
正极
随堂练习:
1、铜锌和稀硫酸组成的原电池工作时,电解
质溶液的
pH值(
)
A.不变
B.先变大后变小
C.逐渐变大
D.逐渐变小
2
实验探究
16
探究二、原电池构成
条件
如果更换铜-锌原电池中的部分电极材料或电解质,电流计的指针依旧会发生偏转吗?
实验探究二-分别组成下列原电池,记录电流计指
针是否发生偏转
实验仪器
实验
1,2,3
实验装置
能否产生电流
构成原电池条件一
实验探究二-原电池构成的条件之一
不能
能
能
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、
石墨等
实验序号
实验
4,5
实验装置
能
不能
电极必须插在电解质溶液中
能否产生电流
构成原电池的条件二
实验探究二-原电池构成的条件之二
实验仪器
实验
6,7
实验装置
能否产生
电流
构成原电池条件三
能
不能
两极相连形成闭合回路
实验探究二-之三:原电池构成的条件
A
Zn
Cu
H2SO4
A
C
Cu
H2SO4
原电池
右图装置
电流表指针
偏转
区别
结论
不偏转
电极材料不同
电池总反应应该是能自发地发生氧化还原反应
实验探究二-原电池构成的条件之四
4、构成原电池的条件
★活泼性不同的两个电极
★电极材料均插入电解质溶液中(电解液的选择:负极材料一般要能与电解液自行发生氧化还原反应。)
★两极相连形成闭合电路
★能自发发生的氧化还原反应
两极一液一闭合
一自发
负极:较活泼的金属
正极:较不活泼的金属、石墨等
B
2、现将A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。根据上述情况,回答问题:
1)在①中,金属片
发生氧化反应;
2)在②中,金属片
作负极;
3)如果把B、D用导线连接后同时浸入稀硫酸中,则金属片
上有气泡生成;
4)上述四种金属的活动性顺序是:
.
。
B
C
D
B>A>C>D
5、判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电子流出的一极是负极,电子流进的一极是正极
4、根据原电池两极发生的反应来判断:
发生氧化反应的是负极,发生还原反应的是正极
【归纳小结】
5、电极反应现象:
不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极
3、根据内电路离子移动的方向判断:
阳离子移向的一极为正极,阴离子移向的为负极
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
6、原电池原理的应用:
必修二
第二章
化学反应与能量
第二节
化学能与电能
化学能与电能
学习目标
4
1
知识与技能:
初步掌握原电池的概念和形成条件,理解原电池的原理。
2
过程与方法:
通过教师创设问题情境、学生进行实验探究,帮助学生自主建构原电池的概念,理解和掌握原电池的原理。
3
情感态度价值观:
通过对原电池工作
原理及条件的探究,
培养浓厚的学习兴
趣,养成严谨求实
的科学态度。
重点
难点
化学能与电能
原电池的工
作原理和构
成条件。
通过对原电池实验的探究,从电子转移角度理解化学能转化为电能的本质。
重难点
思考与交流:
在你的生活和学习中,或你了解的范围里,还有哪些需要使用电池的产品或器具?各使用什么样的电池?
各种电子产品
电能属于二次能源,它在生活生产中扮演着相当重要的角色,而我国电力供应却是比较紧张的。从我国的发电总量构成图,我国主要是火电(火力发电)为主。
2013年全国发电设备容量结构
燃烧
蒸汽
发电机
化学能
热能
机械能
电能
一、化学能转化为电能
1、火力发电的原理及过程
燃烧
氧化还原反应
关键:
本质:
注:
思考:火力发电有什么缺点?
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的利用率低
直接?
思考交流
问题1:化学反应中的化学能是否都可以直接转化为电能呢?
问题2
:若将化学能直接转化为电能,所要解决的第一问题是什么?
问题3:怎样架设桥梁使电子从还原剂区域转移到氧化剂区域,同时形成电流?
问题4:怎样知道所架设的桥梁中有电子流过?
电子定向移动形成电流
有电子转移的氧化还原反应
电解质溶液
、导线
灵敏电流计
⑴将Zn片插入稀H2SO4溶液中有什么现象?为什么?
⑵将Cu片插入稀H2SO4溶液中有什么现象?为什么?
实验探究
⑷若将Zn片,Cu片用一导线连接再浸在稀H2SO4溶液中,有什么现象?导线间接一电流计有何现象产生?为什么?
⑶将一Zn片,Cu片平行插入稀H2SO4溶液中,有什么现象?为什么?
实验探究
一、化学能与电能的相互转换
1、原电池的定义:
将化学能转变为电能的装置叫做原电池。
3、锌铜原电池的工作原理
电极材料
现象
电子转移
电极反应式
反应类型
电极
Zn片
溶解、质量变小
Cu片
有气泡产生
总离子方程式
Zn-2e-
=Zn2+
2H++2e-
=H2↑
Zn+2H+=Zn2++H2↑
还原反应
失电子
得电子
2、原电池的本质:
氧化还原反应
氧化反应
负极
正极
随堂练习:
1、铜锌和稀硫酸组成的原电池工作时,电解
质溶液的
pH值(
)
A.不变
B.先变大后变小
C.逐渐变大
D.逐渐变小
2
实验探究
16
探究二、原电池构成
条件
如果更换铜-锌原电池中的部分电极材料或电解质,电流计的指针依旧会发生偏转吗?
实验探究二-分别组成下列原电池,记录电流计指
针是否发生偏转
实验仪器
实验
1,2,3
实验装置
能否产生电流
构成原电池条件一
实验探究二-原电池构成的条件之一
不能
能
能
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、
石墨等
实验序号
实验
4,5
实验装置
能
不能
电极必须插在电解质溶液中
能否产生电流
构成原电池的条件二
实验探究二-原电池构成的条件之二
实验仪器
实验
6,7
实验装置
能否产生
电流
构成原电池条件三
能
不能
两极相连形成闭合回路
实验探究二-之三:原电池构成的条件
A
Zn
Cu
H2SO4
A
C
Cu
H2SO4
原电池
右图装置
电流表指针
偏转
区别
结论
不偏转
电极材料不同
电池总反应应该是能自发地发生氧化还原反应
实验探究二-原电池构成的条件之四
4、构成原电池的条件
★活泼性不同的两个电极
★电极材料均插入电解质溶液中(电解液的选择:负极材料一般要能与电解液自行发生氧化还原反应。)
★两极相连形成闭合电路
★能自发发生的氧化还原反应
两极一液一闭合
一自发
负极:较活泼的金属
正极:较不活泼的金属、石墨等
B
2、现将A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。根据上述情况,回答问题:
1)在①中,金属片
发生氧化反应;
2)在②中,金属片
作负极;
3)如果把B、D用导线连接后同时浸入稀硫酸中,则金属片
上有气泡生成;
4)上述四种金属的活动性顺序是:
.
。
B
C
D
B>A>C>D
5、判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电子流出的一极是负极,电子流进的一极是正极
4、根据原电池两极发生的反应来判断:
发生氧化反应的是负极,发生还原反应的是正极
【归纳小结】
5、电极反应现象:
不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极
3、根据内电路离子移动的方向判断:
阳离子移向的一极为正极,阴离子移向的为负极
①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
6、原电池原理的应用:
