第一节 金属的化学性质 第1课时
文档属性
| 名称 | 第一节 金属的化学性质 第1课时 |

|
|
| 格式 | rar | ||
| 文件大小 | 881.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-02-06 00:00:00 | ||
图片预览







文档简介
(共27张PPT)
*
penghuabing
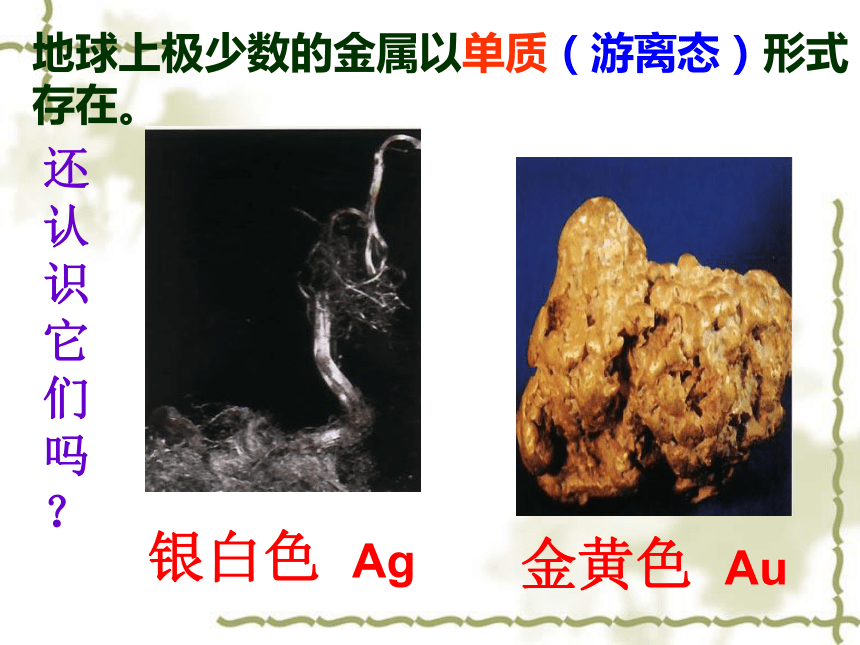
地球上极少数的金属以单质(游离态)形式存在。
银白色 Ag
金黄色 Au
还
认
识
它
们
吗
?
常见的矿石
赤铁矿
主要成分是Fe2O3
黄铁矿
主要成分是FeS2
菱铁矿
主要成分是FeCO3
铝土矿
主要成分是Al2O3
黄铜矿
主要成分是CuFeS2
辉铜矿
主要成分是Cu2S3
地球上绝大多数金属是以化合物(化合态)存在于自然界。
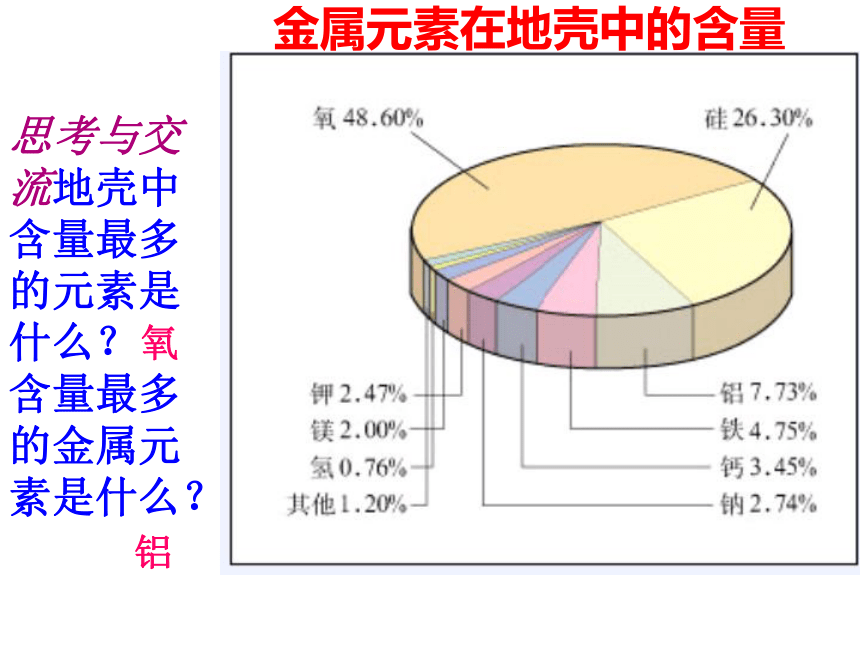
思考与交流地壳中含量最多的元素是什么?
含量最多的金属元素是什么?
金属元素在地壳中的含量
氧
铝
讨论金属有哪些物理共性?
金属的物理共性(通性):除汞以外都是有金属光泽的固体、易导热、易导电,有延展性。
1 、结合初中化学,说明金属能与哪些物质发生化学反应?
(1)金属与
氧气反应
如:Fe 、Al 、Cu等,绝大多数的金属都可以与氧气发生反应
(2)金属与
酸的反应
金属活泼性顺序表中H以前的金属与酸反应生成H2。
越活泼的金属与酸反应越剧烈
(3)金属与一些 盐溶液反应
活泼金属置换较不活泼金属
思考与交流
2.分析下列图片中的反应,写出反应的化学方程式,可以写离子方程式的请写出离子方程式。
①
铝丝与硫酸铜溶液反应
②
镁条燃烧
③
铜丝与硝酸银溶液反应
④
镁条与稀盐酸反应
思考与交流
镁在空气中
的燃烧(引燃)
铁在氧气中
的燃烧(引燃)
铝在氧气中
的燃烧(引燃)
排在金属活动顺序靠前的金属钠跟氧气反应又会如何呢?请一起通过实验探究。
一、金属与非金属的反应
探究实验3-1:用镊子取一小块金属钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,这时可以看到钠的真面目。观察钠表面的光泽和颜色。
钠通常保存在煤油或石蜡油中
1.与氧气的反应
钠的切割:
滤纸吸干煤油,镊子夹取,小刀在玻璃片或表面皿上切割。
注意:剩余的钠放回试剂瓶!特殊
现象:
切开后钠切面呈现银白色光泽但很快地变暗。
反应:
4Na + O2 = 2Na2O (白色)
结论:
★常温下易与空气中的氧气反应
(1)钠与氧气的反应
4Na + O2 = 2Na2O
失去4×e-
得到2×2e-
探究实验3-2:把一小块金属钠放在坩埚里,加热,有什么现象?
钠受热后,先熔成小球,然后与氧气剧烈反应——燃烧,发出黄色火焰,生成一种淡黄色固体——过氧化钠(Na2O2)。
(2)钠在空气中燃烧:
2Na+O2 = Na2O2(淡黄色)
△
2、 Na2O2和 Na2O谁更稳定?
1、过氧化钠中Na的化合价为______,O的化合价______。
思考
点燃
2Na + O2 = Na2O2
失去2×e-
得到2×e-
+1
-1
Na2O2
钠的物理性质:钠具有银白色金属光泽,密度比煤油大比水小。硬度较小,熔点较低(钠的熔点是97.8 ℃,沸点是882.9 ℃)。钠是热和电的良导体。
请你归纳:通过实验3-1、3-2的现象观察,你能不能简单的描述钠的物理性质?
钠保存在煤油中是因为:
钠可以与氧气反应,保存必须隔绝空气。
科学探究:点燃镁条和加热铝箔
活泼金属
空气
表层生成氧化物(氧化膜)
氧化膜
疏松——不能保护内部金属Fe2O3等
致密——能保护内部金属Al2O3等
(2)、其它金属与氧气反应
现象:
镁条剧烈燃烧,产物滴落;而铝箔熔化,失去光泽,熔化的铝不滴落。
解释其原因:
阅读教材P48
资料卡片:氧化膜
反应:
2Mg + O2 = 2MgO 4Al + 3O2 = 2Al2O3
△
点燃
用坩埚钳夹住一小块铝,在酒精灯上加热至熔化,轻轻晃动,仔细观察,你看到了什么现象?为什么会有这种现象?
再取一块铝箔,用砂纸仔细打磨,除去表面的保护膜,在加热至熔化。又有什么现象?呢?
在空气中,铝的表面容易生成一层很稳定的氧化膜,但天然形成的氧化膜很薄,耐磨性和抗蚀性还不够。为了使铝制品适应于不同的用途,可以采用化学方法对铝的表面进行处理,如增加膜的厚度,改变膜的结构和强度,对氧化膜进行着色等。例如,化学氧化(用铬酸作氧化剂)可以使氧化膜产生美丽的颜色;用电化学氧化的方法,可以生成坚硬的氧化膜,还可以用染料使其着色。市场上的铝制品就有不少是经过这样处理的。氧化膜使得性质活泼的金属铝成为一种应用广泛的金属材料。
钠在硫
中研磨
现象:火星四射,发生爆炸。
铁在氯气
中燃烧
现象:铁在氯气中剧烈燃烧,产生棕黄色烟。
3、金属与其它非金属的反应:
2Na + S == Na2S
研磨
2Na + Cl2 == 2NaCl
点燃
2Fe + 3Cl2 == 2FeCl3
点燃
Fe + S == FeS
△
4、金属在反应中容易失去电子被氧化,是还原剂具有还原性。能与非金属如氧气、氯气和硫等反应。
金属
钠
镁
铝
铁
铜
反应条件
化学方程式
产物颜色
常温 加热
常温 加热
加热
加热
常温
加热
4Na + O2==2Na2O
2Mg+O2==2MgO
4Al+3O2==2Al2O3
3Fe+2O2 == Fe3O4
点燃
白色
淡黄色
白色
黑色
黑色
白色
课堂小结:金属与氧气反应
常温
Fe+O2 +H2O —Fe2O3生锈
红色
2Na + O2==Na2O2
△
2Cu+O2==2CuO
△
小结:
1、绝大多数金属都能跟O2反应,活泼性强的金属在常温下就能被O2氧化,活泼性较弱的金属在加热时才能跟O2反应,活泼性很弱的金属(如金、铂等)很难被O2氧化(真金不怕火炼就是个道理)。
2、金属跟O2反应生成的氧化物一般为普通氧化物,如MgO、Al2O3、CuO等。但钠在O2中燃烧生成Na2O2,铁在O2中燃烧生成Fe3O4。
3、镁、 铝易与空气中的氧气反应形成致密的氧化膜而稳定存在于空气中。
4、金属在反应中容易失电子被氧化,是还原剂具有还原性。能与非金属如氧气、氯气和硫等反应。
以下说法错误的是( )
A.钠在常温下就容易被氧化
B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃
D.钠在氧气中燃烧更为激烈
学以致用:
C
作业
完成名师伴你行
1、学案1
2、课内新提升
*
penghuabing
地球上极少数的金属以单质(游离态)形式存在。
银白色 Ag
金黄色 Au
还
认
识
它
们
吗
?
常见的矿石
赤铁矿
主要成分是Fe2O3
黄铁矿
主要成分是FeS2
菱铁矿
主要成分是FeCO3
铝土矿
主要成分是Al2O3
黄铜矿
主要成分是CuFeS2
辉铜矿
主要成分是Cu2S3
地球上绝大多数金属是以化合物(化合态)存在于自然界。
思考与交流地壳中含量最多的元素是什么?
含量最多的金属元素是什么?
金属元素在地壳中的含量
氧
铝
讨论金属有哪些物理共性?
金属的物理共性(通性):除汞以外都是有金属光泽的固体、易导热、易导电,有延展性。
1 、结合初中化学,说明金属能与哪些物质发生化学反应?
(1)金属与
氧气反应
如:Fe 、Al 、Cu等,绝大多数的金属都可以与氧气发生反应
(2)金属与
酸的反应
金属活泼性顺序表中H以前的金属与酸反应生成H2。
越活泼的金属与酸反应越剧烈
(3)金属与一些 盐溶液反应
活泼金属置换较不活泼金属
思考与交流
2.分析下列图片中的反应,写出反应的化学方程式,可以写离子方程式的请写出离子方程式。
①
铝丝与硫酸铜溶液反应
②
镁条燃烧
③
铜丝与硝酸银溶液反应
④
镁条与稀盐酸反应
思考与交流
镁在空气中
的燃烧(引燃)
铁在氧气中
的燃烧(引燃)
铝在氧气中
的燃烧(引燃)
排在金属活动顺序靠前的金属钠跟氧气反应又会如何呢?请一起通过实验探究。
一、金属与非金属的反应
探究实验3-1:用镊子取一小块金属钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,这时可以看到钠的真面目。观察钠表面的光泽和颜色。
钠通常保存在煤油或石蜡油中
1.与氧气的反应
钠的切割:
滤纸吸干煤油,镊子夹取,小刀在玻璃片或表面皿上切割。
注意:剩余的钠放回试剂瓶!特殊
现象:
切开后钠切面呈现银白色光泽但很快地变暗。
反应:
4Na + O2 = 2Na2O (白色)
结论:
★常温下易与空气中的氧气反应
(1)钠与氧气的反应
4Na + O2 = 2Na2O
失去4×e-
得到2×2e-
探究实验3-2:把一小块金属钠放在坩埚里,加热,有什么现象?
钠受热后,先熔成小球,然后与氧气剧烈反应——燃烧,发出黄色火焰,生成一种淡黄色固体——过氧化钠(Na2O2)。
(2)钠在空气中燃烧:
2Na+O2 = Na2O2(淡黄色)
△
2、 Na2O2和 Na2O谁更稳定?
1、过氧化钠中Na的化合价为______,O的化合价______。
思考
点燃
2Na + O2 = Na2O2
失去2×e-
得到2×e-
+1
-1
Na2O2
钠的物理性质:钠具有银白色金属光泽,密度比煤油大比水小。硬度较小,熔点较低(钠的熔点是97.8 ℃,沸点是882.9 ℃)。钠是热和电的良导体。
请你归纳:通过实验3-1、3-2的现象观察,你能不能简单的描述钠的物理性质?
钠保存在煤油中是因为:
钠可以与氧气反应,保存必须隔绝空气。
科学探究:点燃镁条和加热铝箔
活泼金属
空气
表层生成氧化物(氧化膜)
氧化膜
疏松——不能保护内部金属Fe2O3等
致密——能保护内部金属Al2O3等
(2)、其它金属与氧气反应
现象:
镁条剧烈燃烧,产物滴落;而铝箔熔化,失去光泽,熔化的铝不滴落。
解释其原因:
阅读教材P48
资料卡片:氧化膜
反应:
2Mg + O2 = 2MgO 4Al + 3O2 = 2Al2O3
△
点燃
用坩埚钳夹住一小块铝,在酒精灯上加热至熔化,轻轻晃动,仔细观察,你看到了什么现象?为什么会有这种现象?
再取一块铝箔,用砂纸仔细打磨,除去表面的保护膜,在加热至熔化。又有什么现象?呢?
在空气中,铝的表面容易生成一层很稳定的氧化膜,但天然形成的氧化膜很薄,耐磨性和抗蚀性还不够。为了使铝制品适应于不同的用途,可以采用化学方法对铝的表面进行处理,如增加膜的厚度,改变膜的结构和强度,对氧化膜进行着色等。例如,化学氧化(用铬酸作氧化剂)可以使氧化膜产生美丽的颜色;用电化学氧化的方法,可以生成坚硬的氧化膜,还可以用染料使其着色。市场上的铝制品就有不少是经过这样处理的。氧化膜使得性质活泼的金属铝成为一种应用广泛的金属材料。
钠在硫
中研磨
现象:火星四射,发生爆炸。
铁在氯气
中燃烧
现象:铁在氯气中剧烈燃烧,产生棕黄色烟。
3、金属与其它非金属的反应:
2Na + S == Na2S
研磨
2Na + Cl2 == 2NaCl
点燃
2Fe + 3Cl2 == 2FeCl3
点燃
Fe + S == FeS
△
4、金属在反应中容易失去电子被氧化,是还原剂具有还原性。能与非金属如氧气、氯气和硫等反应。
金属
钠
镁
铝
铁
铜
反应条件
化学方程式
产物颜色
常温 加热
常温 加热
加热
加热
常温
加热
4Na + O2==2Na2O
2Mg+O2==2MgO
4Al+3O2==2Al2O3
3Fe+2O2 == Fe3O4
点燃
白色
淡黄色
白色
黑色
黑色
白色
课堂小结:金属与氧气反应
常温
Fe+O2 +H2O —Fe2O3生锈
红色
2Na + O2==Na2O2
△
2Cu+O2==2CuO
△
小结:
1、绝大多数金属都能跟O2反应,活泼性强的金属在常温下就能被O2氧化,活泼性较弱的金属在加热时才能跟O2反应,活泼性很弱的金属(如金、铂等)很难被O2氧化(真金不怕火炼就是个道理)。
2、金属跟O2反应生成的氧化物一般为普通氧化物,如MgO、Al2O3、CuO等。但钠在O2中燃烧生成Na2O2,铁在O2中燃烧生成Fe3O4。
3、镁、 铝易与空气中的氧气反应形成致密的氧化膜而稳定存在于空气中。
4、金属在反应中容易失电子被氧化,是还原剂具有还原性。能与非金属如氧气、氯气和硫等反应。
以下说法错误的是( )
A.钠在常温下就容易被氧化
B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃
D.钠在氧气中燃烧更为激烈
学以致用:
C
作业
完成名师伴你行
1、学案1
2、课内新提升
