金属的化学性质 第二课时
图片预览






文档简介
(共22张PPT)
(第2课时)
*
penghuabing
第一节 金属的化学性质
一、金属的化学性质
复习回顾1:
4Na + O2 === 2Na2O (白色)
1、金属与氧气的反应
2Na + O2 === Na2O2(淡黄色)
点燃
4Al+3O2 == 2Al2O3
金属 + 氧气 = 金属氧化物
Mg、Zn、Fe、Cu分别与稀盐酸反应
反应剧烈程度不同
复习回顾2:
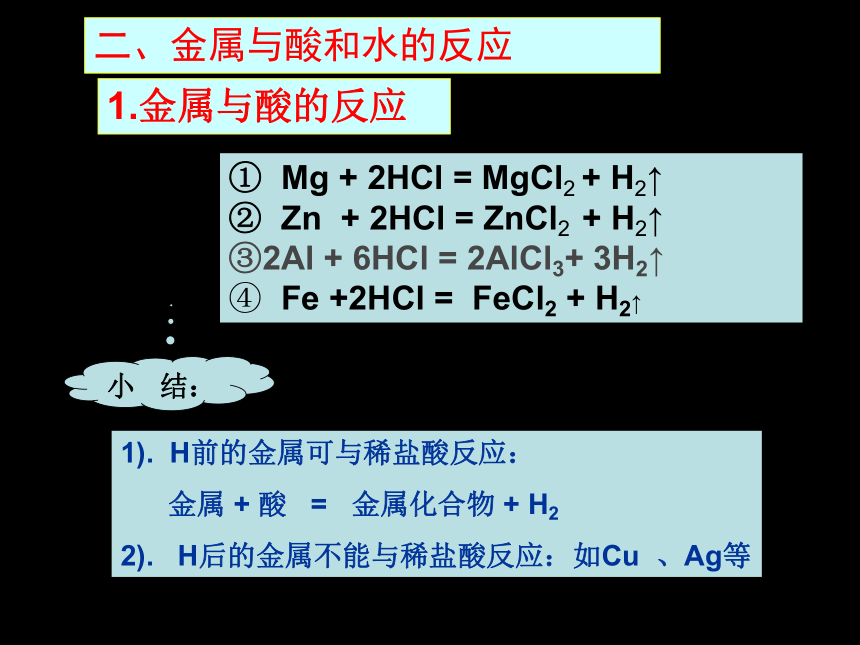
1.金属与酸的反应
① Mg + 2HCl = MgCl2 + H2↑
② Zn + 2HCl = ZnCl2 + H2↑
2Al + 6HCl = 2AlCl3+ 3H2↑
Fe +2HCl = FeCl2 + H2↑
小 结:
1). H前的金属可与稀盐酸反应:
金属 + 酸 = 金属化合物 + H2
2). H后的金属不能与稀盐酸反应:如Cu 、Ag等
二、金属与酸和水的反应
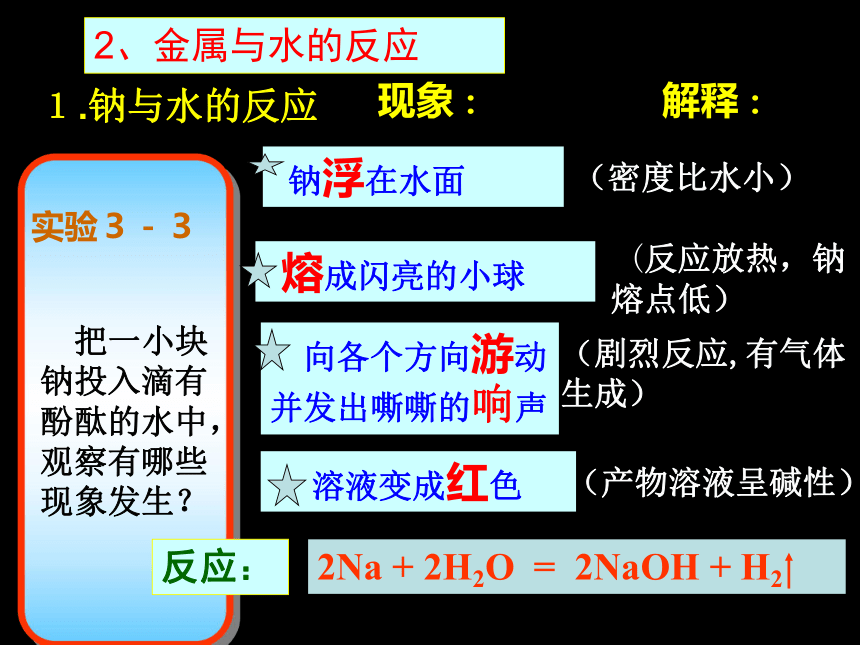
把一小块
钠投入滴有
酚酞的水中,
观察有哪些
现象发生?
实验3-3
现象:
反应:
2Na + 2H2O = 2NaOH + H2
(密度比水小)
(反应放热,钠 熔点低)
(剧烈反应,有气体生成)
(产物溶液呈碱性)
解释:
2、金属与水的反应
1.钠与水的反应
钠浮在水面
熔成闪亮的小球
向各个方向游动并发出嘶嘶的响声
溶液变成红色
1、实验室保存少量的钠的方法
2、其它金属单质与水反应的情况和规律
3、钠单质与一些盐的水溶液反应的情况
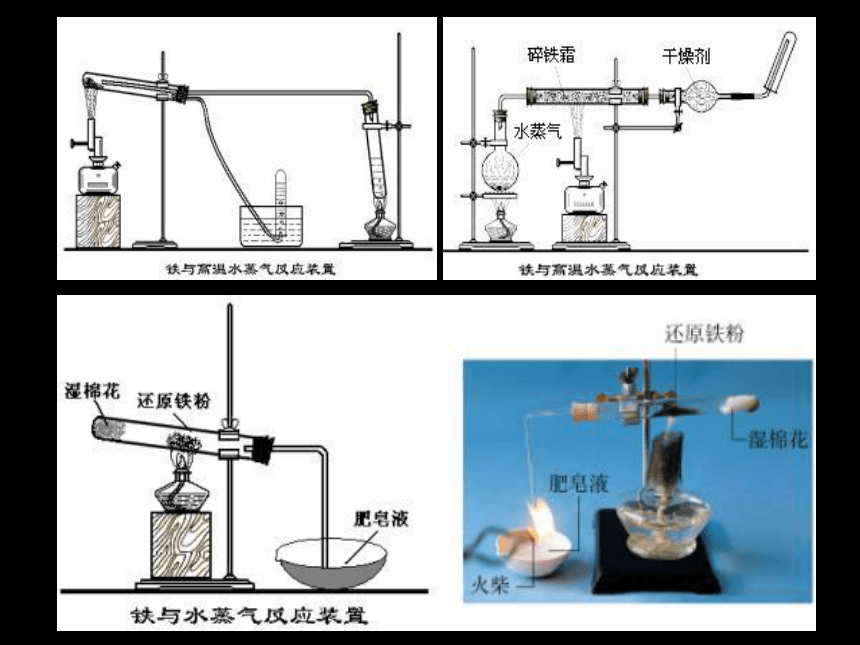
科学探究:铁与水的反应
1、铁不能与冷、热水反应,但能否与水蒸气反应?
2、你能不能设计一套简单的实验装置,使铁粉与水蒸气反应?这套装置应包括水蒸气发生、水蒸气与铁粉反应、检查产生气体等部分
3、与课本的实验相比较,你觉得哪一套更好?
填写下表:
思考与探究:
实验现象 化学方程式
3Fe + 4H2O(g) == Fe3O4 + 4H2
2.Fe与水的反应 :
实验现象 化学方程式
铁丝保持红热,肥皂泡燃烧
3Fe + 4H2O(g) = Fe3O4+ 4H2
(非离子反应)
思
考
2:
将钠投入硫酸铜,会有什么现象?试通过实验验证你的推测是否正确。分析现象,写出钠与硫酸铜反应的化学方程式。实验结果是否违背了金属活动顺序,为什么?
现象:钠浮在水面上,熔化成小球四处游动,
溶液中产生了蓝色沉淀。
反应方程式:2Na+2H2O=2NaOH+H2
没有违反金属活动顺序,钠可以在熔融状态下将铜置换出来。在水溶液中钠更容易与水反应,而不与盐反应。事实上,任何规律都是有条件的,都有一定的适用范围。我们不仅要认识事物的普遍规律,还要认识事物的特殊性。
2NaOH+CuSO4=Na2SO4+Cu(OH)2
小结
二、金属与酸和水的反应
1、金属与酸的反应
2、金属与水的反应
①钠与水的反应
②铁与水蒸气的反应
3、钠与盐溶液的反应
作业
完成名师伴你行
1、学案2
2、课内新提升
[实验3-4]在2支试管里各
加入5mlHCl和5 mL浓NaOH
溶液,再分别放入一小段
铝片,观察实验现象。过
一段时间后,用点燃的木
条分别放在2支试管口,有
什么现象发生?填写下表:
比较 与盐酸的反应 与NaOH溶液反应
实验现象
化学方程式
离子方程式
气泡产生
气泡产生
2Al + 2NaOH + 2H2O =
2NaAlO2 + 3H2↑
2Al + 6HCl = 2AlCl3+ 3H2↑
2Al3++2OH-+2H2O=2AlO2-+3H2O
2Al + 6H+ = 2Al3+ + 3H2 ↑
三、铝与氢氧化钠溶液的反应
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
思考与练习:
①Al与NaOH水溶液的反应中Al显示什么性质?根据是什么?
②上述反应产物中的NaAlO2是如何产的?
③Mg比Al活泼,Mg能否与NaOH水溶液发生反应?
Al显还原性,因其化合价升高。
以上反应不是一步完成的,而是分两步完成 :
2Al + 6H2O =2 Al(OH)3+3 H2↑
Al(OH)3+NaOH=NaAlO2+2H2O
0
Al与碱溶液反应是因为Al(OH)3能与氢氧化钠溶液的原因,Mg(OH)2不能与氢氧化钠溶液反应。
2Al + 6H2O =2 Al(OH)3+3 H2↑
0 +1 +3 0
化合价升高
化合价降低
H2O是氧化剂
练习
1、取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状况下产生的气体体积之比是 。
2、若在加入铝粉能放出氢气的溶液中,肯定不能共存的离子组是( )
A、Fe3+ 、 SO42- 、 Cl- 、 Na+
B 、 Ba2+ 、 Mg2+ 、 HCO3- 、 Cl-
C 、 SO42- 、 Na+ 、 K+ 、 CO32-
D 、 SO42- 、 K+ 、 CO2- 、 OH-
1:1
B
小结:金属的性质与金属活动性顺序表
生 活 思 考
为什么经常看到Al制餐 具不宜
蒸煮或长时 间存放酸、碱性食物?
阅读:
最后一自然段
小结:金属单质具有较强的还原性,自然界中多
以化合态存在。只不少数金属如金可以以
单质形式存在:
本节知识小结
一、钠
1、钠与氧气的反应:
2、钠与水的反应:
(1)化学方程式及离子方程式;
(2)各种现象的解释。
3、钠与酸的反应:
4、钠与盐溶液的反应:
5、钠的保存:
6、钠失火的处理:
本节知识小结
二、铁
1、铁与氧气的反应:
2、铁与酸的反应:
3、铁与水的反应:
本节知识小结
三、铝
1、铝与氧气的反应:
2、铝与酸的反应:
3、铝与氢氧化钠溶液的反应:
(1)化学方程式及离子方程式;
(2)该氧化还原反应的分析。
作业
完成名师伴你行
1、学案3
2、课内新提升
练习:
1、为了收集气体,有位同学用铝箔包住一块0.23克重的Na与水反应,并用排水法在量筒内收集气体。
①请尝试画出装置图。
②量筒要选规格 。
③理论上至少可以收集 mL(标况)气体。
2、4.6gNa与95.4 g水完全反应,所得溶液的质量分数是
%。要使反应后溶液中每10个水分子中含
1个Na+,则须与 g水反应。
挑战!!
作业:
教材P54:
第7、8题
(第2课时)
*
penghuabing
第一节 金属的化学性质
一、金属的化学性质
复习回顾1:
4Na + O2 === 2Na2O (白色)
1、金属与氧气的反应
2Na + O2 === Na2O2(淡黄色)
点燃
4Al+3O2 == 2Al2O3
金属 + 氧气 = 金属氧化物
Mg、Zn、Fe、Cu分别与稀盐酸反应
反应剧烈程度不同
复习回顾2:
1.金属与酸的反应
① Mg + 2HCl = MgCl2 + H2↑
② Zn + 2HCl = ZnCl2 + H2↑
2Al + 6HCl = 2AlCl3+ 3H2↑
Fe +2HCl = FeCl2 + H2↑
小 结:
1). H前的金属可与稀盐酸反应:
金属 + 酸 = 金属化合物 + H2
2). H后的金属不能与稀盐酸反应:如Cu 、Ag等
二、金属与酸和水的反应
把一小块
钠投入滴有
酚酞的水中,
观察有哪些
现象发生?
实验3-3
现象:
反应:
2Na + 2H2O = 2NaOH + H2
(密度比水小)
(反应放热,钠 熔点低)
(剧烈反应,有气体生成)
(产物溶液呈碱性)
解释:
2、金属与水的反应
1.钠与水的反应
钠浮在水面
熔成闪亮的小球
向各个方向游动并发出嘶嘶的响声
溶液变成红色
1、实验室保存少量的钠的方法
2、其它金属单质与水反应的情况和规律
3、钠单质与一些盐的水溶液反应的情况
科学探究:铁与水的反应
1、铁不能与冷、热水反应,但能否与水蒸气反应?
2、你能不能设计一套简单的实验装置,使铁粉与水蒸气反应?这套装置应包括水蒸气发生、水蒸气与铁粉反应、检查产生气体等部分
3、与课本的实验相比较,你觉得哪一套更好?
填写下表:
思考与探究:
实验现象 化学方程式
3Fe + 4H2O(g) == Fe3O4 + 4H2
2.Fe与水的反应 :
实验现象 化学方程式
铁丝保持红热,肥皂泡燃烧
3Fe + 4H2O(g) = Fe3O4+ 4H2
(非离子反应)
思
考
2:
将钠投入硫酸铜,会有什么现象?试通过实验验证你的推测是否正确。分析现象,写出钠与硫酸铜反应的化学方程式。实验结果是否违背了金属活动顺序,为什么?
现象:钠浮在水面上,熔化成小球四处游动,
溶液中产生了蓝色沉淀。
反应方程式:2Na+2H2O=2NaOH+H2
没有违反金属活动顺序,钠可以在熔融状态下将铜置换出来。在水溶液中钠更容易与水反应,而不与盐反应。事实上,任何规律都是有条件的,都有一定的适用范围。我们不仅要认识事物的普遍规律,还要认识事物的特殊性。
2NaOH+CuSO4=Na2SO4+Cu(OH)2
小结
二、金属与酸和水的反应
1、金属与酸的反应
2、金属与水的反应
①钠与水的反应
②铁与水蒸气的反应
3、钠与盐溶液的反应
作业
完成名师伴你行
1、学案2
2、课内新提升
[实验3-4]在2支试管里各
加入5mlHCl和5 mL浓NaOH
溶液,再分别放入一小段
铝片,观察实验现象。过
一段时间后,用点燃的木
条分别放在2支试管口,有
什么现象发生?填写下表:
比较 与盐酸的反应 与NaOH溶液反应
实验现象
化学方程式
离子方程式
气泡产生
气泡产生
2Al + 2NaOH + 2H2O =
2NaAlO2 + 3H2↑
2Al + 6HCl = 2AlCl3+ 3H2↑
2Al3++2OH-+2H2O=2AlO2-+3H2O
2Al + 6H+ = 2Al3+ + 3H2 ↑
三、铝与氢氧化钠溶液的反应
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
思考与练习:
①Al与NaOH水溶液的反应中Al显示什么性质?根据是什么?
②上述反应产物中的NaAlO2是如何产的?
③Mg比Al活泼,Mg能否与NaOH水溶液发生反应?
Al显还原性,因其化合价升高。
以上反应不是一步完成的,而是分两步完成 :
2Al + 6H2O =2 Al(OH)3+3 H2↑
Al(OH)3+NaOH=NaAlO2+2H2O
0
Al与碱溶液反应是因为Al(OH)3能与氢氧化钠溶液的原因,Mg(OH)2不能与氢氧化钠溶液反应。
2Al + 6H2O =2 Al(OH)3+3 H2↑
0 +1 +3 0
化合价升高
化合价降低
H2O是氧化剂
练习
1、取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状况下产生的气体体积之比是 。
2、若在加入铝粉能放出氢气的溶液中,肯定不能共存的离子组是( )
A、Fe3+ 、 SO42- 、 Cl- 、 Na+
B 、 Ba2+ 、 Mg2+ 、 HCO3- 、 Cl-
C 、 SO42- 、 Na+ 、 K+ 、 CO32-
D 、 SO42- 、 K+ 、 CO2- 、 OH-
1:1
B
小结:金属的性质与金属活动性顺序表
生 活 思 考
为什么经常看到Al制餐 具不宜
蒸煮或长时 间存放酸、碱性食物?
阅读:
最后一自然段
小结:金属单质具有较强的还原性,自然界中多
以化合态存在。只不少数金属如金可以以
单质形式存在:
本节知识小结
一、钠
1、钠与氧气的反应:
2、钠与水的反应:
(1)化学方程式及离子方程式;
(2)各种现象的解释。
3、钠与酸的反应:
4、钠与盐溶液的反应:
5、钠的保存:
6、钠失火的处理:
本节知识小结
二、铁
1、铁与氧气的反应:
2、铁与酸的反应:
3、铁与水的反应:
本节知识小结
三、铝
1、铝与氧气的反应:
2、铝与酸的反应:
3、铝与氢氧化钠溶液的反应:
(1)化学方程式及离子方程式;
(2)该氧化还原反应的分析。
作业
完成名师伴你行
1、学案3
2、课内新提升
练习:
1、为了收集气体,有位同学用铝箔包住一块0.23克重的Na与水反应,并用排水法在量筒内收集气体。
①请尝试画出装置图。
②量筒要选规格 。
③理论上至少可以收集 mL(标况)气体。
2、4.6gNa与95.4 g水完全反应,所得溶液的质量分数是
%。要使反应后溶液中每10个水分子中含
1个Na+,则须与 g水反应。
挑战!!
作业:
教材P54:
第7、8题
