2021届高考化学 考前12天 物质结构与元素周期律 课件(39张ppt)
文档属性
| 名称 | 2021届高考化学 考前12天 物质结构与元素周期律 课件(39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-29 00:00:00 | ||
图片预览





文档简介
2021
高考倒计时●化学
物质结构与元素周期律
01
核 心 速 记
02
易 错 剖 析
目录
03
自 我 检 测
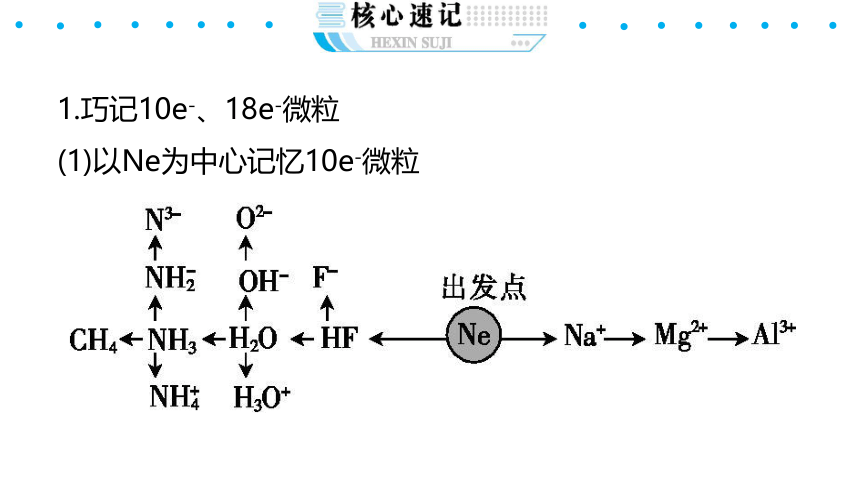
1.巧记10e-、18e-微粒
(1)以Ne为中心记忆10e-微粒
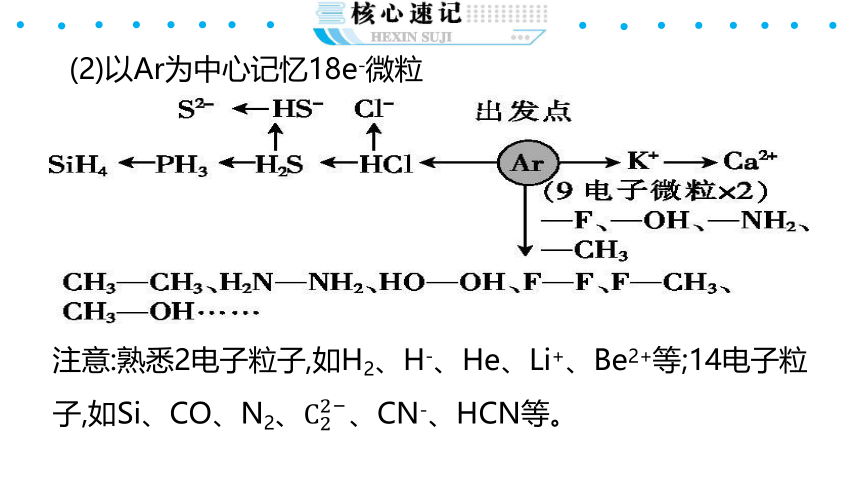
(2)以Ar为中心记忆18e-微粒
注意:熟悉2电子粒子,如H2、H-、He、Li+、Be2+等;14电子粒子,如Si、CO、N2、C22?、CN-、HCN等。
?
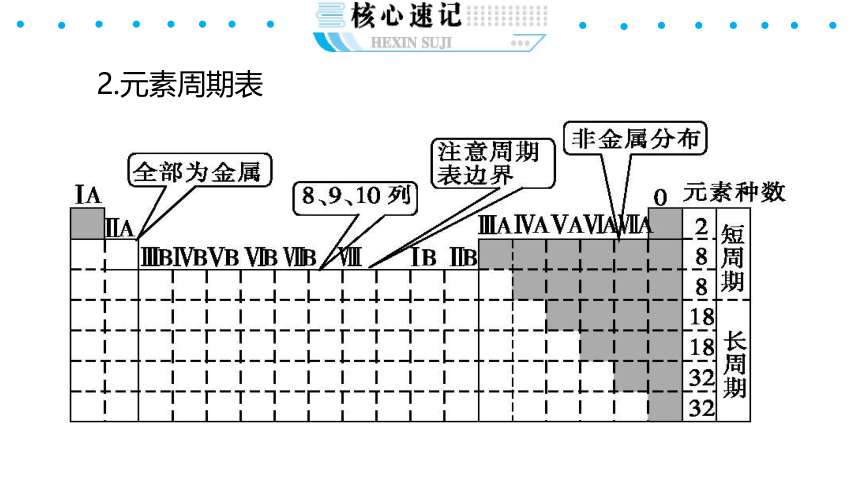
2.元素周期表
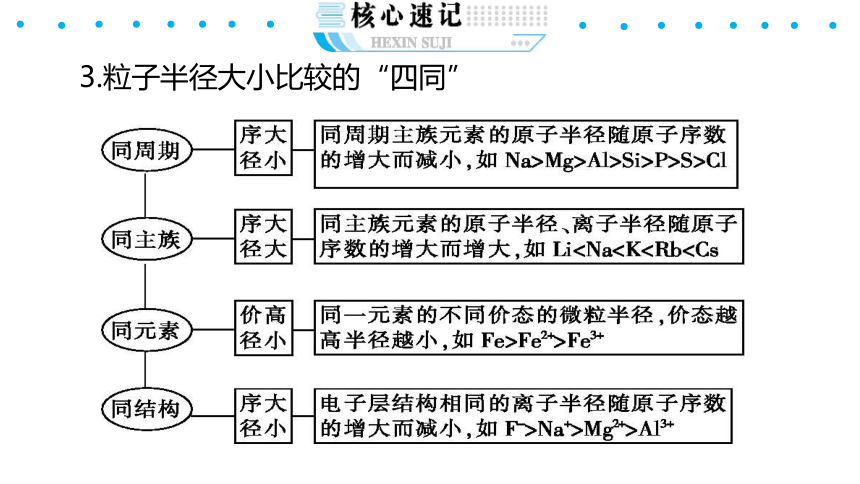
3.粒子半径大小比较的“四同”
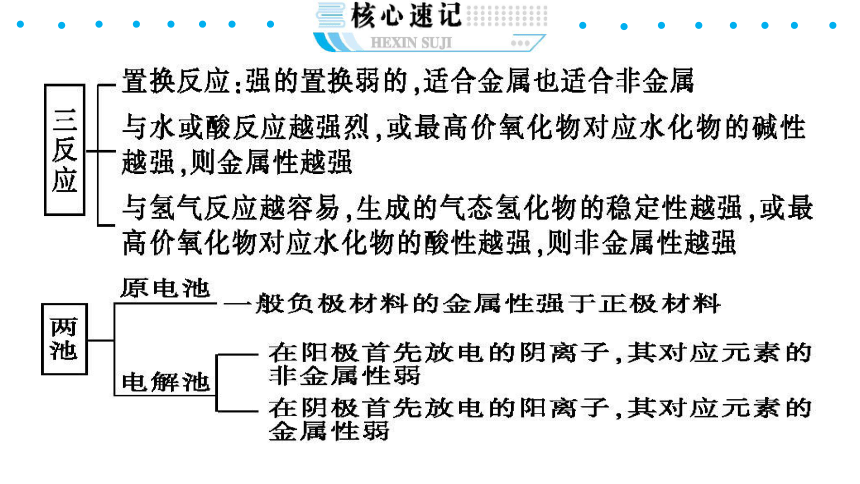
4.金属性、非金属性的判断方法
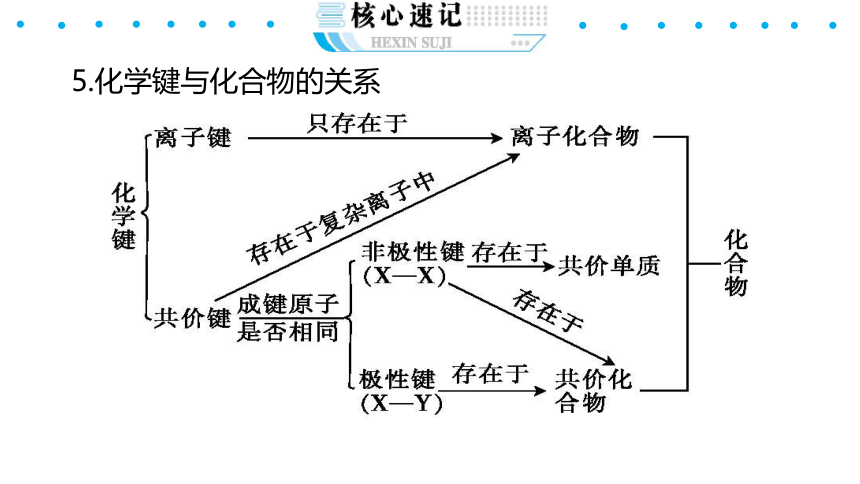
5.化学键与化合物的关系
一、元素推断、元素周期律应用常见误区
1.误认为主族元素的最高正价一定等于族序数。忽视了O、F元素无最高正价。
2.误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强。忽视了关键词“最高价”,如HClO、H2SO3是弱酸。
3.误认为同周期相邻两主族元素原子序数之差等于1。忽视了ⅡA、ⅢA族可能相差11(第四、五周期)或25(第六、七周期)。
4.误认为失电子难的原子得电子的能力一定强。忽视了碳原子、稀有气体元素的原子失电子难,得电子也难。
5.误认为得失电子数多的原子,得失电子的能力一定强。得失电子能力的强弱与得失电子数的多少无关。
6.误认为最高正价和最低负价绝对值相等的元素只有第ⅣA族的某些元素。忽视了第ⅠA族的H元素的最高正价为+1,最低负价为-1。
7.误认为碳的氢化物的沸点一定低于氧、氮的氢化物。忽视了简单的气态氢化物,一些相对分子质量较大的烃在常温常压下呈固态,如石蜡等。
【纠错训练1】短周期元素在周期表中相对位置如图所示。
已知:用Z的氢化物水溶液能在玻璃器皿上刻标记。下列说法正确的是( )。
A.气态氢化物的热稳定性:Z>Y>X
B.简单离子半径:Z>Y
C.最高价氧化物对应水化物的酸性:X>Y
D.Z与其他三种元素都能形成离子化合物
A
【解析】依题意可知,Z为氟,HF溶液能腐蚀玻璃。由此可知,R为碳元素,X为磷元素,Y为硫元素。A项,气态氢化物的热稳定性HF>HCl>H2S>PH3,正确;B项,离子半径r(S2-)>r(F-),错误;C项,酸性H2SO4>H3PO4,错误;D项,CF4、PF3、SF4、SF6都是共价化合物,错误。
返回题目
二、元素推断常涉及的结构和性质
1.主族元素在周期表中的特殊位置
(1)族序数等于周期数的元素:H、Be、Al。
(2)族序数等于周期数2倍的元素:C、S。
(3)族序数等于周期数3倍的元素:O。
(4)周期数是族序数2倍的元素:Li、Ca、Tl。
(5)周期数是族序数3倍的元素:Na、Ba。
(6)最高正价与最低负价代数和为零的短周期元素:H、C、Si。
(7)最高正价是最低负价绝对值3倍的短周期元素:S。
(8)最高正价不等于族序数的短周期元素:O(F无正价)。
【纠错训练2】短周期主族元素X、Y、Z、W、R的原子序数依次增大,X、W同主族,Y、Z相邻,X的原子最外层电子数是内层电子数的2倍,X、Y、W的原子最外层电子数之和为10,R的原子最外层电子数是Z的原子最外层电子数的2倍。下列说法错误的是( )。
A.Y的单质能与X的最高价氧化物发生置换反应
B.同周期元素形成的简单离子中,Z的离子半径最小
C.W的含氧酸钠盐溶液是制备木材防火剂的原料
D.R的单质在纯氧中燃烧生成其最高价氧化物
D
【解析】短周期主族元素X、Y、Z、W、R的原子序数依次增大,X的原子最外层电子数是内层电子数的2倍,故X为C元素;X、W同主族,则W为Si元素;X、Y、W的原子最外层电子数之和为10,Y的原子最外层电子数为10-4-4=2,Y的原子序数大于C,故Y为Mg元素;Y、Z相邻,则Z为Al元素;R的原子最外层电子数是Z的原子最外层电子数的2倍,则R的原子最外层电子数为6,故R为S元素。Mg单质能与CO2反应生成C单质与MgO,属于置换反应,A项正确;第三周期元素形成的简单离子中,Al3+的半径最小,B项正确;W的含氧酸钠盐(硅酸钠)溶液是制备木材防火剂的原料,C项正确;S单质在纯氧中燃烧生成二氧化硫,D项错误。
返回题目
答题提示 已知元素原子或离子的核外电子排布推断元素的基本思路:
2.元素及其化合物的性质
(1)形成化合物种类最多的元素、某种单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素、简单氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)等物质的量的单质最轻的元素:H;最轻的金属单质的元素:Li。
(5)单质在常温下呈液态的非金属元素:Br;金属元素:Hg。
(6)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(7)元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素:N;能发生氧化还原反应的元素:S。
(8)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
【纠错训练3】现有四种短周期元素a、b、c、d的原子序数依次增大。它们组成物质的关系如图所示。已知:M、Z、R、E含有共同的金属元素,R为浅黄色固体,M和Z是厨房中常见的物质。
下列推断正确的是( )。
A.用澄清石灰水可以检验M溶液和Z溶液
B.原子半径:d>c>b>a
C.R、E化合物中既含离子键,又含共价键
D.元素非金属性:c>a>b
D
【解析】本题考查无机物推断,意在考查考生的推理、判断能力。依题意可知,R为过氧化钠,由于M、Z、R都含有共同的金属,M、Z是家庭中常用物质,故M为碳酸氢钠,Z为碳酸钠,Y为二氧化碳,X为水,E为氢氧化钠,F为氧气。A项,碳酸钠、碳酸氢钠都可与澄清石灰水产生白色沉淀,错误;B项,原子半径Na>C>O>H,错误;C项,氢氧化钠、过氧化钠都含离子键和共价键,正确;D项,CH4中氢元素显正化合价,故O、C、H的非金属性依次减弱,错误。
返回题目
三、有关物质中的化学键类型的易错点
1.只含非极性共价键的物质:非金属元素构成的单质(稀有气体除外),如I2、N2、P4、金刚石、晶体硅等。
2.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物,如HCl、NH3、SiO2、CS2等。
3.既有极性键又有非极性键的物质,如H2O2、C2H4、CH3CH3、C6H6等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等。
5.既有离子键又有非极性键的物质,如Na2O2、CaC2等。
6.既有离子键又有极性键的物质,如NaOH、NH4NO3等。
7.由强极性键构成但又不是强电解质的物质,如HF等。
【纠错训练4】X、Y、Z、W四种短周期元素的原子序数依次增大,原子最外层电子数之和为13,X的原子半径比Y的小,X与W同主族,Z的族序数是其周期数的3倍。下列说法中正确的是( )。
A.四种元素简单离子的半径XB.X、Z、W三种元素形成的离子化合物中既含离子键又含共价键
C.W与Z形成的离子化合物中阴、阳离子数之比为1∶1
D.只含X、Y、Z三种元素的化合物一定是共价化合物
B
【解析】由题意可知,Z是氧元素;若X是第二周期元素,则不能同时满足“原子序数依次增大”和“X的原子半径比Y的小”,故X是氢元素,则W是钠元素;结合最外层电子数之和为13知,Y是氮元素。简单离子的半径r(H+)返回题目
1.短周期元素a、b、c、d的原子序数依次增大,在短周期元素中d的金属性最强。由这四种元素组成六种纯净物X、Y、Z、W、G、T,它们之间转化关系如图所示。已知:Y和G是单质,X为氧化物,Z为有机物,在常温下X和Z呈液态。分别在W、T的溶液中滴加酚酞溶液,溶液都变红色。X和Z都是生活中常见的物质,X的摩尔质量小于Z。
下列说法正确的是( )。
A.原子半径:d>c>b>a
B.Z、W、T都含两种化学键
C.c的气态氢化物比b稳定
D.a、b构成的分子中所有原子共平面
C
【解析】短周期元素中,钠的金属性最强,d为钠元素。W和T的溶液呈碱性,联想钠与水、乙醇反应。故X为水,Y为钠,Z为乙醇,W为氢氧化钠,G为氢气,T为乙醇钠。由原子序数大小关系推知,a为氢元素,b为碳元素,c为氧元素,d为钠元素。原子半径d>b>c>a,A项错误;CH3CH2OH只含共价键,B项错误;H2O比CH4稳定,C项正确;C、H构成的分子,如甲烷、丙烯、甲苯等分子中所有原子不共平面,只有少数分子,如乙烯、苯等分子中所有原子共平面,D项错误。
返回题目
2.已知短周期主族元素,X、Y、Z在元素周期表中的相对位置如图,下列说法一定正确的是( )。
D
A.最高正化合价:Y>X
B.简单氢化物的沸点:XC.X、Y、Z的最高价氧化物对应的水化物中,X的酸性最强
D.若X、Y、Z的原子序数之和等于33,三种元素两两之间均能形成共价化合物
【解析】若Y是O元素或F元素,则无最高正价,A项错误;若X是O元素,水分子间存在氢键,沸点最高,B项错误;当X、Y、Z分别为C、N、Si元素时,硝酸的酸性最强,C项错误;若X、Y、Z的原子序数之和等于33,则分别为O、F、S元素,三种元素两两之间均能形成共价化合物(如OF2、SO2、SF6),D项正确。
返回题目
3.短周期元素R、X、Y、Z的原子序数依次增大,R原子最外层电子数等于电子层数的3倍,R的阴离子和Z的简单阳离子的电子层结构相同。工业上,用Y3ZX6作助熔剂,电解Z2R3制备Z的单质。
下列说法正确的是( )。
A.简单的离子半径:Y>Z>R>X
B.气态氢化物的热稳定性:R>X
C.最高价氧化物对应水化物的碱性:Z>Y
D.YX、Y2R都能破坏水的电离平衡
D
【解析】依题意可知,R为氧元素。Z2R3中Z为+3价,Z为铝元素,工业上电解氧化铝制备铝单质,用Na3AlF6作助熔剂。由此推知,R为氧元素,X为氟元素,Y为钠元素,Z为铝元素。O2-、F-、Na+、Al3+的半径依次减小,A项错误;HF的热稳定性比H2O的强,B项错误;NaOH的碱性比Al(OH)3强,C项错误;NaF是强碱弱酸盐,能促进水的电离,Na2O与水反应生成氢氧化钠,抑制了水的电离,二者都打破了水的电离平衡,D项正确。
返回题目
4.短周期元素a、b、c、d、e的原子序数依次增大,a和c位于同主族,d的原子核外电子层数等于最外层电子数,a的阴离子只有一个电子层。常温下,在1 L 0.1 mol·L-1 a2e溶液中通入eb2气体,溶液的pH与通入eb2气体体积(标准状况)的关系如图所示。
B
下列说法正确的是( )。
A.气态氢化物的热稳定性:e>b
B.最高价氧化物对应水化物的碱性:c>d
C.化合物caeb4、cae都能促进水的电离
D.工业上电解c、d对应的氯化物冶炼其单质
【解析】由题意可知,a、b、c、d、e分别为H、O、Na、Al、S元素。A项,H2O的热稳定性比H2S强,错误;B项,氢氧化钠的碱性比氢氧化铝强,正确;C项,NaHS(弱酸盐)促进水的电离,而NaHSO4(相当于一元强酸)抑制水的电离,错误;D项,氯化铝是共价化合物,不能导电,工业上,电解熔融的氧化铝冶炼铝单质,错误。
返回题目
5.部分短周期元素的性质或原子结构如下表:
元素代号
元素的性质或原子结构
W
其单质为良好的半导体材料
X
其单质为双原子分子,其简单氢化物的水溶液呈碱性
Y
最外层电子数为次外层电子数的3倍
Z
元素的最高正化合价是+7
下列叙述不正确的是( )。
A.W的氧化物不溶于水
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WZ4在高温条件下可与氢气发生反应,生成W的单质
D.W、X、Z三种元素的最高价氧化物对应的水化物中酸性最强的是Z
B
返回题目
【解析】由题给信息可推知,W、X、Y、Z分别是Si、N、O、Cl元素。W的单质为晶体硅,其氧化物为二氧化硅,不溶于水,A项正确;由X、Y和氢元素形成的化合物如硝酸铵含有离子键和共价键,B项不正确;SiCl4在高温条件下与氢气反应生成单质硅,C项正确;W、X、Z三种元素的最高价氧化物对应的水化物分别为H2SiO3、HNO3、HClO4,其中HClO4的酸性最强,D项正确。
6.已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法中正确的是( )。
C
A.若四种元素均为非金属元素,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定呈酸性(m、n均为正整数)
C.若四种元素均为金属元素,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属元素,则Z与Y的最高价氧化物对应的水化物相互之间能反应
X
Y
Z
W
【解析】若四种元素均为非金属元素,则W可能是P元素,H3PO4是中强酸,故A项错误;若HmXOn为强酸,则X为氮元素,氨气溶于水呈碱性,故B项错误;若四种元素均为金属元素,则Z是钠元素,氢氧化钠为强碱,故C项正确;若四种元素中只有一种为金属,则Z是铝元素,Y是碳元素,氢氧化铝不与碳酸反应,故D项错误。
返回题目
延时符
谢
谢
观
赏
高考倒计时●化学
物质结构与元素周期律
01
核 心 速 记
02
易 错 剖 析
目录
03
自 我 检 测
1.巧记10e-、18e-微粒
(1)以Ne为中心记忆10e-微粒
(2)以Ar为中心记忆18e-微粒
注意:熟悉2电子粒子,如H2、H-、He、Li+、Be2+等;14电子粒子,如Si、CO、N2、C22?、CN-、HCN等。
?
2.元素周期表
3.粒子半径大小比较的“四同”
4.金属性、非金属性的判断方法
5.化学键与化合物的关系
一、元素推断、元素周期律应用常见误区
1.误认为主族元素的最高正价一定等于族序数。忽视了O、F元素无最高正价。
2.误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强。忽视了关键词“最高价”,如HClO、H2SO3是弱酸。
3.误认为同周期相邻两主族元素原子序数之差等于1。忽视了ⅡA、ⅢA族可能相差11(第四、五周期)或25(第六、七周期)。
4.误认为失电子难的原子得电子的能力一定强。忽视了碳原子、稀有气体元素的原子失电子难,得电子也难。
5.误认为得失电子数多的原子,得失电子的能力一定强。得失电子能力的强弱与得失电子数的多少无关。
6.误认为最高正价和最低负价绝对值相等的元素只有第ⅣA族的某些元素。忽视了第ⅠA族的H元素的最高正价为+1,最低负价为-1。
7.误认为碳的氢化物的沸点一定低于氧、氮的氢化物。忽视了简单的气态氢化物,一些相对分子质量较大的烃在常温常压下呈固态,如石蜡等。
【纠错训练1】短周期元素在周期表中相对位置如图所示。
已知:用Z的氢化物水溶液能在玻璃器皿上刻标记。下列说法正确的是( )。
A.气态氢化物的热稳定性:Z>Y>X
B.简单离子半径:Z>Y
C.最高价氧化物对应水化物的酸性:X>Y
D.Z与其他三种元素都能形成离子化合物
A
【解析】依题意可知,Z为氟,HF溶液能腐蚀玻璃。由此可知,R为碳元素,X为磷元素,Y为硫元素。A项,气态氢化物的热稳定性HF>HCl>H2S>PH3,正确;B项,离子半径r(S2-)>r(F-),错误;C项,酸性H2SO4>H3PO4,错误;D项,CF4、PF3、SF4、SF6都是共价化合物,错误。
返回题目
二、元素推断常涉及的结构和性质
1.主族元素在周期表中的特殊位置
(1)族序数等于周期数的元素:H、Be、Al。
(2)族序数等于周期数2倍的元素:C、S。
(3)族序数等于周期数3倍的元素:O。
(4)周期数是族序数2倍的元素:Li、Ca、Tl。
(5)周期数是族序数3倍的元素:Na、Ba。
(6)最高正价与最低负价代数和为零的短周期元素:H、C、Si。
(7)最高正价是最低负价绝对值3倍的短周期元素:S。
(8)最高正价不等于族序数的短周期元素:O(F无正价)。
【纠错训练2】短周期主族元素X、Y、Z、W、R的原子序数依次增大,X、W同主族,Y、Z相邻,X的原子最外层电子数是内层电子数的2倍,X、Y、W的原子最外层电子数之和为10,R的原子最外层电子数是Z的原子最外层电子数的2倍。下列说法错误的是( )。
A.Y的单质能与X的最高价氧化物发生置换反应
B.同周期元素形成的简单离子中,Z的离子半径最小
C.W的含氧酸钠盐溶液是制备木材防火剂的原料
D.R的单质在纯氧中燃烧生成其最高价氧化物
D
【解析】短周期主族元素X、Y、Z、W、R的原子序数依次增大,X的原子最外层电子数是内层电子数的2倍,故X为C元素;X、W同主族,则W为Si元素;X、Y、W的原子最外层电子数之和为10,Y的原子最外层电子数为10-4-4=2,Y的原子序数大于C,故Y为Mg元素;Y、Z相邻,则Z为Al元素;R的原子最外层电子数是Z的原子最外层电子数的2倍,则R的原子最外层电子数为6,故R为S元素。Mg单质能与CO2反应生成C单质与MgO,属于置换反应,A项正确;第三周期元素形成的简单离子中,Al3+的半径最小,B项正确;W的含氧酸钠盐(硅酸钠)溶液是制备木材防火剂的原料,C项正确;S单质在纯氧中燃烧生成二氧化硫,D项错误。
返回题目
答题提示 已知元素原子或离子的核外电子排布推断元素的基本思路:
2.元素及其化合物的性质
(1)形成化合物种类最多的元素、某种单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素、简单氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)等物质的量的单质最轻的元素:H;最轻的金属单质的元素:Li。
(5)单质在常温下呈液态的非金属元素:Br;金属元素:Hg。
(6)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(7)元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素:N;能发生氧化还原反应的元素:S。
(8)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
【纠错训练3】现有四种短周期元素a、b、c、d的原子序数依次增大。它们组成物质的关系如图所示。已知:M、Z、R、E含有共同的金属元素,R为浅黄色固体,M和Z是厨房中常见的物质。
下列推断正确的是( )。
A.用澄清石灰水可以检验M溶液和Z溶液
B.原子半径:d>c>b>a
C.R、E化合物中既含离子键,又含共价键
D.元素非金属性:c>a>b
D
【解析】本题考查无机物推断,意在考查考生的推理、判断能力。依题意可知,R为过氧化钠,由于M、Z、R都含有共同的金属,M、Z是家庭中常用物质,故M为碳酸氢钠,Z为碳酸钠,Y为二氧化碳,X为水,E为氢氧化钠,F为氧气。A项,碳酸钠、碳酸氢钠都可与澄清石灰水产生白色沉淀,错误;B项,原子半径Na>C>O>H,错误;C项,氢氧化钠、过氧化钠都含离子键和共价键,正确;D项,CH4中氢元素显正化合价,故O、C、H的非金属性依次减弱,错误。
返回题目
三、有关物质中的化学键类型的易错点
1.只含非极性共价键的物质:非金属元素构成的单质(稀有气体除外),如I2、N2、P4、金刚石、晶体硅等。
2.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物,如HCl、NH3、SiO2、CS2等。
3.既有极性键又有非极性键的物质,如H2O2、C2H4、CH3CH3、C6H6等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等。
5.既有离子键又有非极性键的物质,如Na2O2、CaC2等。
6.既有离子键又有极性键的物质,如NaOH、NH4NO3等。
7.由强极性键构成但又不是强电解质的物质,如HF等。
【纠错训练4】X、Y、Z、W四种短周期元素的原子序数依次增大,原子最外层电子数之和为13,X的原子半径比Y的小,X与W同主族,Z的族序数是其周期数的3倍。下列说法中正确的是( )。
A.四种元素简单离子的半径X
C.W与Z形成的离子化合物中阴、阳离子数之比为1∶1
D.只含X、Y、Z三种元素的化合物一定是共价化合物
B
【解析】由题意可知,Z是氧元素;若X是第二周期元素,则不能同时满足“原子序数依次增大”和“X的原子半径比Y的小”,故X是氢元素,则W是钠元素;结合最外层电子数之和为13知,Y是氮元素。简单离子的半径r(H+)
1.短周期元素a、b、c、d的原子序数依次增大,在短周期元素中d的金属性最强。由这四种元素组成六种纯净物X、Y、Z、W、G、T,它们之间转化关系如图所示。已知:Y和G是单质,X为氧化物,Z为有机物,在常温下X和Z呈液态。分别在W、T的溶液中滴加酚酞溶液,溶液都变红色。X和Z都是生活中常见的物质,X的摩尔质量小于Z。
下列说法正确的是( )。
A.原子半径:d>c>b>a
B.Z、W、T都含两种化学键
C.c的气态氢化物比b稳定
D.a、b构成的分子中所有原子共平面
C
【解析】短周期元素中,钠的金属性最强,d为钠元素。W和T的溶液呈碱性,联想钠与水、乙醇反应。故X为水,Y为钠,Z为乙醇,W为氢氧化钠,G为氢气,T为乙醇钠。由原子序数大小关系推知,a为氢元素,b为碳元素,c为氧元素,d为钠元素。原子半径d>b>c>a,A项错误;CH3CH2OH只含共价键,B项错误;H2O比CH4稳定,C项正确;C、H构成的分子,如甲烷、丙烯、甲苯等分子中所有原子不共平面,只有少数分子,如乙烯、苯等分子中所有原子共平面,D项错误。
返回题目
2.已知短周期主族元素,X、Y、Z在元素周期表中的相对位置如图,下列说法一定正确的是( )。
D
A.最高正化合价:Y>X
B.简单氢化物的沸点:X
D.若X、Y、Z的原子序数之和等于33,三种元素两两之间均能形成共价化合物
【解析】若Y是O元素或F元素,则无最高正价,A项错误;若X是O元素,水分子间存在氢键,沸点最高,B项错误;当X、Y、Z分别为C、N、Si元素时,硝酸的酸性最强,C项错误;若X、Y、Z的原子序数之和等于33,则分别为O、F、S元素,三种元素两两之间均能形成共价化合物(如OF2、SO2、SF6),D项正确。
返回题目
3.短周期元素R、X、Y、Z的原子序数依次增大,R原子最外层电子数等于电子层数的3倍,R的阴离子和Z的简单阳离子的电子层结构相同。工业上,用Y3ZX6作助熔剂,电解Z2R3制备Z的单质。
下列说法正确的是( )。
A.简单的离子半径:Y>Z>R>X
B.气态氢化物的热稳定性:R>X
C.最高价氧化物对应水化物的碱性:Z>Y
D.YX、Y2R都能破坏水的电离平衡
D
【解析】依题意可知,R为氧元素。Z2R3中Z为+3价,Z为铝元素,工业上电解氧化铝制备铝单质,用Na3AlF6作助熔剂。由此推知,R为氧元素,X为氟元素,Y为钠元素,Z为铝元素。O2-、F-、Na+、Al3+的半径依次减小,A项错误;HF的热稳定性比H2O的强,B项错误;NaOH的碱性比Al(OH)3强,C项错误;NaF是强碱弱酸盐,能促进水的电离,Na2O与水反应生成氢氧化钠,抑制了水的电离,二者都打破了水的电离平衡,D项正确。
返回题目
4.短周期元素a、b、c、d、e的原子序数依次增大,a和c位于同主族,d的原子核外电子层数等于最外层电子数,a的阴离子只有一个电子层。常温下,在1 L 0.1 mol·L-1 a2e溶液中通入eb2气体,溶液的pH与通入eb2气体体积(标准状况)的关系如图所示。
B
下列说法正确的是( )。
A.气态氢化物的热稳定性:e>b
B.最高价氧化物对应水化物的碱性:c>d
C.化合物caeb4、cae都能促进水的电离
D.工业上电解c、d对应的氯化物冶炼其单质
【解析】由题意可知,a、b、c、d、e分别为H、O、Na、Al、S元素。A项,H2O的热稳定性比H2S强,错误;B项,氢氧化钠的碱性比氢氧化铝强,正确;C项,NaHS(弱酸盐)促进水的电离,而NaHSO4(相当于一元强酸)抑制水的电离,错误;D项,氯化铝是共价化合物,不能导电,工业上,电解熔融的氧化铝冶炼铝单质,错误。
返回题目
5.部分短周期元素的性质或原子结构如下表:
元素代号
元素的性质或原子结构
W
其单质为良好的半导体材料
X
其单质为双原子分子,其简单氢化物的水溶液呈碱性
Y
最外层电子数为次外层电子数的3倍
Z
元素的最高正化合价是+7
下列叙述不正确的是( )。
A.W的氧化物不溶于水
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WZ4在高温条件下可与氢气发生反应,生成W的单质
D.W、X、Z三种元素的最高价氧化物对应的水化物中酸性最强的是Z
B
返回题目
【解析】由题给信息可推知,W、X、Y、Z分别是Si、N、O、Cl元素。W的单质为晶体硅,其氧化物为二氧化硅,不溶于水,A项正确;由X、Y和氢元素形成的化合物如硝酸铵含有离子键和共价键,B项不正确;SiCl4在高温条件下与氢气反应生成单质硅,C项正确;W、X、Z三种元素的最高价氧化物对应的水化物分别为H2SiO3、HNO3、HClO4,其中HClO4的酸性最强,D项正确。
6.已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法中正确的是( )。
C
A.若四种元素均为非金属元素,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定呈酸性(m、n均为正整数)
C.若四种元素均为金属元素,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属元素,则Z与Y的最高价氧化物对应的水化物相互之间能反应
X
Y
Z
W
【解析】若四种元素均为非金属元素,则W可能是P元素,H3PO4是中强酸,故A项错误;若HmXOn为强酸,则X为氮元素,氨气溶于水呈碱性,故B项错误;若四种元素均为金属元素,则Z是钠元素,氢氧化钠为强碱,故C项正确;若四种元素中只有一种为金属,则Z是铝元素,Y是碳元素,氢氧化铝不与碳酸反应,故D项错误。
返回题目
延时符
谢
谢
观
赏
同课章节目录
