芳香烃
图片预览







文档简介
(共33张PPT)
第二节 芳香烃
高二化学选修5 第一章 烃和卤代烃
化学家预言第一次世界大战
1912-1913年,德国在国际市场上大量收
购石油。由于有利可图,许多国家的石油商都
不惜压低价格争着与德国人做生意,但令人不
可理解的是,德国人只要婆罗洲的石油,其他
的一概不要,并急急忙忙地把收购到婆罗洲的
石油运到德国本土去。在石油商人感一以百思
不得其解时,一位化学家提醒世人说:“德国人
在准备发动战争了!”果然不出化学家所料,
德国于1914年发动了第一次世界大战。
这位化学家为何知道德国将发动战争
呢?这一奇怪现象引起了一位化学家的注意他
经过化验,发现婆罗洲的石油成分与其他地区
的不同,它含有很少的直链烃,它含有大量的
苯和甲苯等芳香烃,正是适宜制造“TNT”烈性炸药的三硝基甲苯的基础成分。这位化学家们就是在对婆罗洲石油的化学成分进行分析之后才向世人提出历史性预言的。
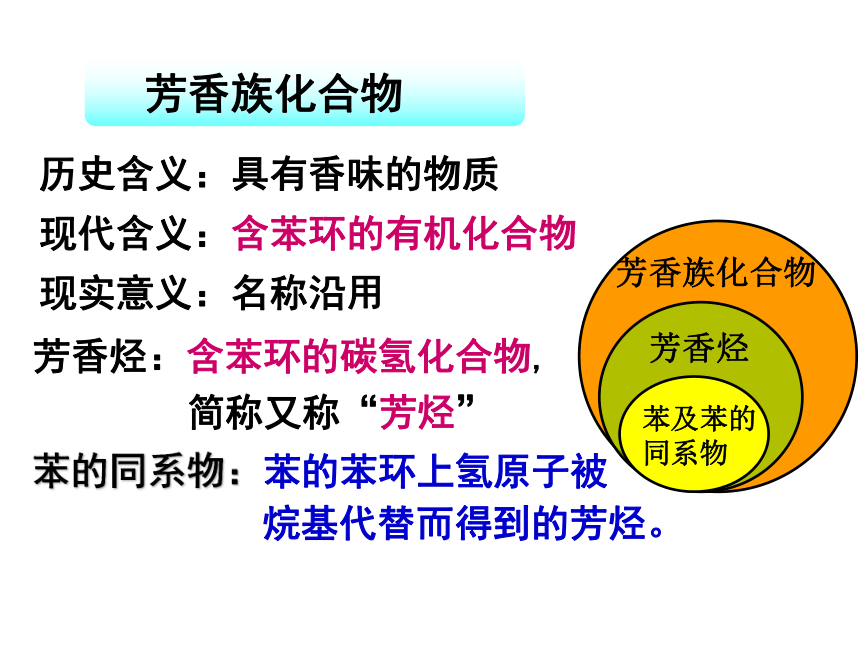
历史含义:具有香味的物质
现代含义:含苯环的有机化合物
现实意义:名称沿用
芳香烃:含苯环的碳氢化合物,
简称又称“芳烃”
苯的同系物:苯的苯环上氢原子被
烷基代替而得到的芳烃。
芳香族化合物
芳香族化合物
芳香烃
苯及苯的同系物
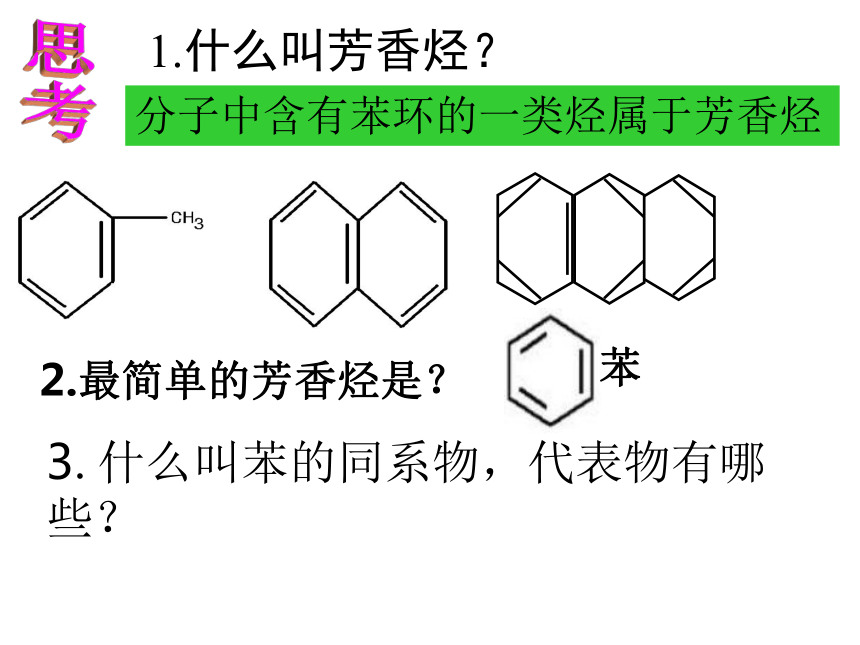
1.什么叫芳香烃?
分子中含有苯环的一类烃属于芳香烃
2.最简单的芳香烃是?
苯
3.什么叫苯的同系物,代表物有哪些?
一、苯的物理性质
1.无色,有特殊芳香气味的液体
2.密度小于水
3.不溶于水易溶于有机溶剂
4.熔点5.5℃, 沸点80.1℃
5.易挥发(密封保存)
6.苯蒸气有毒
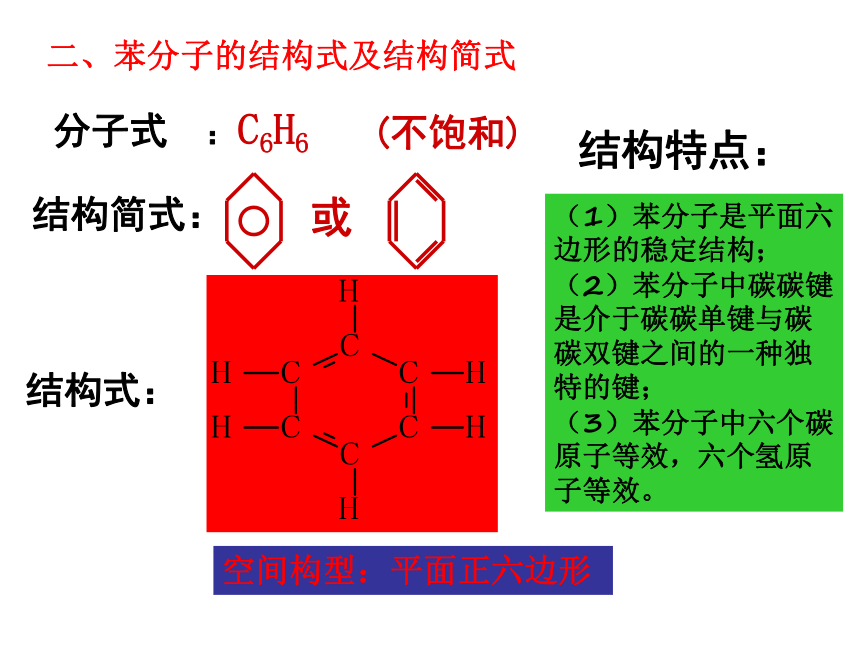
二、苯分子的结构式及结构简式
分子式 :C6H6
(不饱和)
结构简式:
或
结构式:
(1)苯分子是平面六边形的稳定结构;
(2)苯分子中碳碳键是介于碳碳单键与碳碳双键之间的一种独特的键;
(3)苯分子中六个碳原子等效,六个氢原子等效。
结构特点:
空间构型:平面正六边形
练习:(1)1866年凯库勒提出了苯的单双键交替的正六边形平面结构(如图所示),解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是
A、苯不能使溴水褪色
B、苯能与H2发生加成反应
C、溴苯没有同分异构体
D、邻二溴苯只有一种
A、D
(2)现代化学认为苯分子碳碳之间的键是
是介于单键和双键之间的一种独特的键
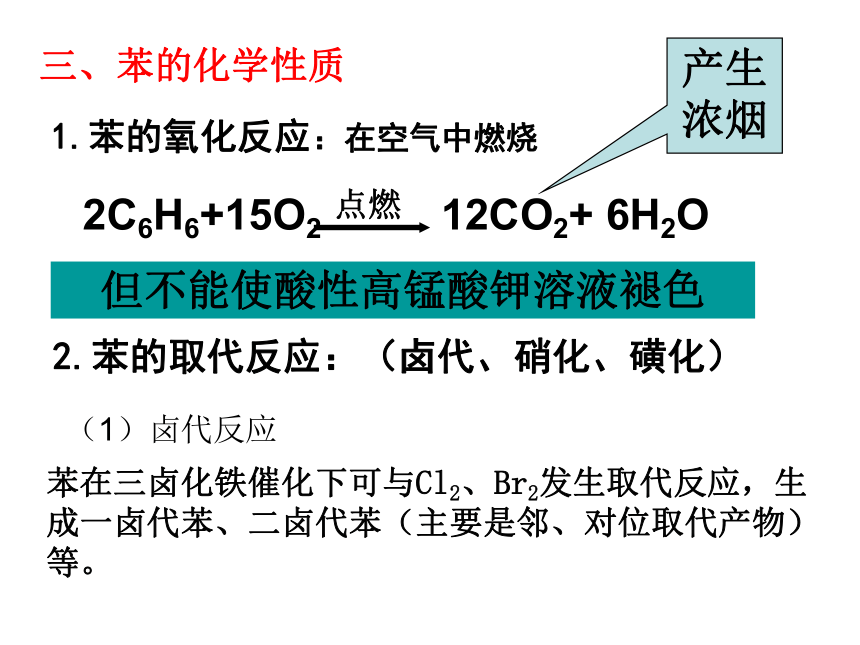
2C6H6+15O2 12CO2+ 6H2O
点燃
产生浓烟
三、苯的化学性质
1.苯的氧化反应:在空气中燃烧
但不能使酸性高锰酸钾溶液褪色
2.苯的取代反应:(卤代、硝化、磺化)
(1)卤代反应
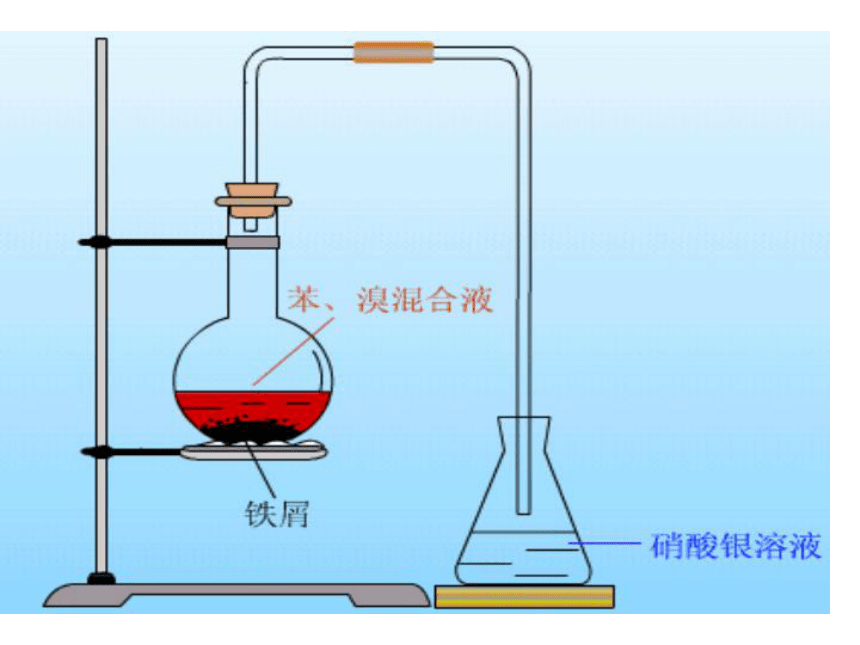
苯在三卤化铁催化下可与Cl2、Br2发生取代反应,生成一卤代苯、二卤代苯(主要是邻、对位取代产物)等。
2Fe+3Br2=2FeBr3
+ Br2
— Br
+ HBr
FeBr3
纯溴苯是无色液体,密度大于水。
实验思考题:
1.实验开始后,可以看到哪些现象
2.Fe屑的作用是什么?
3.长导管的作用是什么?
4.为什么导管末端不插入液面下?
5.哪些现象说明发生了取代反应而不是加成反应?
6.纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样使之恢复本来的面目?
与溴反应生成催化剂
反应剧烈,有气体逸出.导管口有白雾,溶液中生成浅黄色沉淀。烧瓶底部有褐色不溶于水的液体
用于导气和冷凝回流
溴化氢易溶于水,防止倒吸。
苯与溴反应生成溴苯的同时有溴化氢生成,说明它们发生了取代反应而非加成反应。因加成反应不会生成溴化氢。
因为未发生反应的溴和反应中的催化剂FeBr3溶解在生成的溴苯中。用水和碱溶液反复洗涤可以使褐色褪去,还溴苯以本来的面目。
(2)硝化反应
苯与浓硝酸、浓硫酸的混合物在50 ~ 60℃时生成一取代硝基苯;当温度升高至100~110℃时则生成二取代产物间二硝基苯。
+ HNO3
— NO2
+ H2O
浓硫酸
50~60℃
硝基苯是一种带有苦杏仁味的、无色的油状液体,密度比水大。难溶于水,易溶于乙醇和乙醚。硝基苯有毒(硝基苯与皮肤接触或它的蒸气被人体吸收,都能引起中毒),是制造染料的重要原料。
实验步骤:①先将1.5mL浓硝酸注入大试管中,再慢慢注入2mL浓硫酸,并及时摇匀和冷却.
②向冷却后的酸中逐滴加入1mL苯,充分振荡,混和均匀.
③将混合物控制在50-60℃的条件下约10min,实验装置如左图.
④将反应后的液体到入盛冷水的烧杯中,可以看到烧杯底部有黄色油状物生成,经过分离得到粗硝基苯.
⑤粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
注意:
①浓硝酸和浓硫酸的混合酸要冷却到50-60℃以下,再慢慢滴入苯,边加边振荡,因为反应放热,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸在70-80℃时会发生反应。
②什么时候采用水浴加热:需要加热,而且一定要控制在100℃以下,均可采用水浴加热。如果超过100 ℃,还可采用油浴(0~300 ℃)、沙浴温度更高。
⑤为提纯硝基苯,一般将粗产品依次用
蒸馏水和NaOH溶液洗涤。
④不纯的硝基苯显黄色
③温度计的位置,必须悬挂在水浴中。
(因为溶有NO2)而纯净硝基苯是无色,有苦杏仁味,比水重,油状液体。
3.加成反应
——工业制取环己烷的主要方法
+ 3Cl2
催化剂
Cl
Cl
Cl
Cl
Cl
Cl
H
H
H
H
H
H
+ H2
Ni
环己烷
苯的化学性质小结
苯环结构比较稳定,易发生取代反应,
而破坏结构的加成反应和氧化反应比较困难。
(易取代、 能氧化、难加成)
二、苯的同系物
1.定义:
通式:
结构特点:
只含有一个苯环,苯环上连结烷基.
苯环上的氢原子被烷基取代的产物
CnH2n-6(n≥6)
常见的苯的同系物
一
CH3
一
一
CH3
CH3
C7H8
C8H10
邻二甲苯
甲苯
一
C2H5
乙苯
C8H10
下列属于苯的同系物的是( )
D
1.比较苯和甲苯结构的异同点,推测甲苯的化学性质.
2.设计实验证明你的推测.
1.取苯、甲苯各2分别注入2支试管中,各加入3滴KMnO4酸性溶液,充分振荡,观察现象。
现象:甲苯能使酸性KMnO4溶液褪色
甲苯被氧化的是侧链,即甲基被氧化,该反应可简单表示为:
CH3
KMnO4、H+
COOH
(苯甲酸)
这样的氧化反应,都是苯环上的烷烃基被氧化,说明了苯环上的烷烃基比烷烃性质活泼。这活泼性是苯环对烷烃基影响的结果。
②苯的同系物的氧化反应
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
烷基上与苯环直接相连的碳直接连氢原子
H
|
—C—H
|
H
H
| |
—C—C—
| |
H
C
|
—C—C
|
C
×
CH3
|
—C—CH3
|
CH3
CH3
|
|
CH2—R
CH3
|
CH3—CH—
CH3
|
—C—CH3
|
CH3
HOOC
|
|
COOH
HOOC—
KMnO4/H+
思考:产物是什么?
可用KMnO4酸性溶液作试剂鉴别苯的同系物和苯、苯的同系物和烷烃。
阅读课本P38实验2-2以下的内容
思考:1.甲苯与硝酸的反应和苯与硝酸的反应有什么不同
2.比较苯和甲苯与KMnO4溶液的作用,以及硝化 反应的条件产物等,你从中得到什么启示
2、化学性质:
1)取代反应(可与卤素、硝酸、硫酸等反应)
—CH3对苯环的影响使取代反应更易进行
浓硫酸
△
+ 3HNO3
+ 3H2O
淡黄色针状晶体,不溶于水。不稳定,易爆炸。
TNT
小结:
(1)侧链对苯环的影响
①苯的同系物比苯更容易发生苯环上的取代反应,苯主要发生一元取代,而苯的同系物能发生邻、对位取代,如苯与浓H2SO4、浓HNO3混合加热主要生成硝基苯,甲苯与浓HNO3、浓H2SO4,在一定条件下易生成2,4,6 三硝基甲苯(TNT).
②苯的同系物发生卤代反应时,在光照和催化剂条件下,卤素原子取代氢的位置不同:
2)氧化反应
⑴可燃性
⑵可使酸性高锰酸钾溶液褪色(可鉴别苯和甲苯等苯的同系物)
苯环对甲基的影响使甲基可以被酸性高锰酸钾溶液氧化
小结
(2)苯环对侧链的影响
烷烃不易被氧化,但苯环上的烷基易被氧化.苯的同系物能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色,用此法可鉴别苯和苯的同系物.
催化剂
△
+ 3H2
3)加成反应
三、芳香烃的来源及其应用
1、来源:a、煤的干馏 b、石油的催化重整
2、应用:简单的芳香烃是基本的有机 化工原料。
有机物 烷烃 烯烃 炔烃 芳香烃
代表物 CH4 C2H4 C2H2 C6H6
结构特点 全部单键
饱和烃 含碳碳双键不饱和 含碳碳叁键不饱和 特殊的键不饱和
空间结构
物理性质
燃烧
与溴水
KMnO4
主要反应类型
烷烃、烯烃、炔烃、芳香烃的比较
正四面体
平面型
直线型
平面正六边形
无色气体,难溶于水
无色液体
易燃,完全燃烧时生成CO2和H2O
不反应
不反应
取代
加成反应
氧化反应
加成、聚合
加成反应
氧化反应
加成、聚合
不反应
侧链可氧化
取代、加成
总结
第二节 芳香烃
高二化学选修5 第一章 烃和卤代烃
化学家预言第一次世界大战
1912-1913年,德国在国际市场上大量收
购石油。由于有利可图,许多国家的石油商都
不惜压低价格争着与德国人做生意,但令人不
可理解的是,德国人只要婆罗洲的石油,其他
的一概不要,并急急忙忙地把收购到婆罗洲的
石油运到德国本土去。在石油商人感一以百思
不得其解时,一位化学家提醒世人说:“德国人
在准备发动战争了!”果然不出化学家所料,
德国于1914年发动了第一次世界大战。
这位化学家为何知道德国将发动战争
呢?这一奇怪现象引起了一位化学家的注意他
经过化验,发现婆罗洲的石油成分与其他地区
的不同,它含有很少的直链烃,它含有大量的
苯和甲苯等芳香烃,正是适宜制造“TNT”烈性炸药的三硝基甲苯的基础成分。这位化学家们就是在对婆罗洲石油的化学成分进行分析之后才向世人提出历史性预言的。
历史含义:具有香味的物质
现代含义:含苯环的有机化合物
现实意义:名称沿用
芳香烃:含苯环的碳氢化合物,
简称又称“芳烃”
苯的同系物:苯的苯环上氢原子被
烷基代替而得到的芳烃。
芳香族化合物
芳香族化合物
芳香烃
苯及苯的同系物
1.什么叫芳香烃?
分子中含有苯环的一类烃属于芳香烃
2.最简单的芳香烃是?
苯
3.什么叫苯的同系物,代表物有哪些?
一、苯的物理性质
1.无色,有特殊芳香气味的液体
2.密度小于水
3.不溶于水易溶于有机溶剂
4.熔点5.5℃, 沸点80.1℃
5.易挥发(密封保存)
6.苯蒸气有毒
二、苯分子的结构式及结构简式
分子式 :C6H6
(不饱和)
结构简式:
或
结构式:
(1)苯分子是平面六边形的稳定结构;
(2)苯分子中碳碳键是介于碳碳单键与碳碳双键之间的一种独特的键;
(3)苯分子中六个碳原子等效,六个氢原子等效。
结构特点:
空间构型:平面正六边形
练习:(1)1866年凯库勒提出了苯的单双键交替的正六边形平面结构(如图所示),解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是
A、苯不能使溴水褪色
B、苯能与H2发生加成反应
C、溴苯没有同分异构体
D、邻二溴苯只有一种
A、D
(2)现代化学认为苯分子碳碳之间的键是
是介于单键和双键之间的一种独特的键
2C6H6+15O2 12CO2+ 6H2O
点燃
产生浓烟
三、苯的化学性质
1.苯的氧化反应:在空气中燃烧
但不能使酸性高锰酸钾溶液褪色
2.苯的取代反应:(卤代、硝化、磺化)
(1)卤代反应
苯在三卤化铁催化下可与Cl2、Br2发生取代反应,生成一卤代苯、二卤代苯(主要是邻、对位取代产物)等。
2Fe+3Br2=2FeBr3
+ Br2
— Br
+ HBr
FeBr3
纯溴苯是无色液体,密度大于水。
实验思考题:
1.实验开始后,可以看到哪些现象
2.Fe屑的作用是什么?
3.长导管的作用是什么?
4.为什么导管末端不插入液面下?
5.哪些现象说明发生了取代反应而不是加成反应?
6.纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样使之恢复本来的面目?
与溴反应生成催化剂
反应剧烈,有气体逸出.导管口有白雾,溶液中生成浅黄色沉淀。烧瓶底部有褐色不溶于水的液体
用于导气和冷凝回流
溴化氢易溶于水,防止倒吸。
苯与溴反应生成溴苯的同时有溴化氢生成,说明它们发生了取代反应而非加成反应。因加成反应不会生成溴化氢。
因为未发生反应的溴和反应中的催化剂FeBr3溶解在生成的溴苯中。用水和碱溶液反复洗涤可以使褐色褪去,还溴苯以本来的面目。
(2)硝化反应
苯与浓硝酸、浓硫酸的混合物在50 ~ 60℃时生成一取代硝基苯;当温度升高至100~110℃时则生成二取代产物间二硝基苯。
+ HNO3
— NO2
+ H2O
浓硫酸
50~60℃
硝基苯是一种带有苦杏仁味的、无色的油状液体,密度比水大。难溶于水,易溶于乙醇和乙醚。硝基苯有毒(硝基苯与皮肤接触或它的蒸气被人体吸收,都能引起中毒),是制造染料的重要原料。
实验步骤:①先将1.5mL浓硝酸注入大试管中,再慢慢注入2mL浓硫酸,并及时摇匀和冷却.
②向冷却后的酸中逐滴加入1mL苯,充分振荡,混和均匀.
③将混合物控制在50-60℃的条件下约10min,实验装置如左图.
④将反应后的液体到入盛冷水的烧杯中,可以看到烧杯底部有黄色油状物生成,经过分离得到粗硝基苯.
⑤粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
注意:
①浓硝酸和浓硫酸的混合酸要冷却到50-60℃以下,再慢慢滴入苯,边加边振荡,因为反应放热,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸在70-80℃时会发生反应。
②什么时候采用水浴加热:需要加热,而且一定要控制在100℃以下,均可采用水浴加热。如果超过100 ℃,还可采用油浴(0~300 ℃)、沙浴温度更高。
⑤为提纯硝基苯,一般将粗产品依次用
蒸馏水和NaOH溶液洗涤。
④不纯的硝基苯显黄色
③温度计的位置,必须悬挂在水浴中。
(因为溶有NO2)而纯净硝基苯是无色,有苦杏仁味,比水重,油状液体。
3.加成反应
——工业制取环己烷的主要方法
+ 3Cl2
催化剂
Cl
Cl
Cl
Cl
Cl
Cl
H
H
H
H
H
H
+ H2
Ni
环己烷
苯的化学性质小结
苯环结构比较稳定,易发生取代反应,
而破坏结构的加成反应和氧化反应比较困难。
(易取代、 能氧化、难加成)
二、苯的同系物
1.定义:
通式:
结构特点:
只含有一个苯环,苯环上连结烷基.
苯环上的氢原子被烷基取代的产物
CnH2n-6(n≥6)
常见的苯的同系物
一
CH3
一
一
CH3
CH3
C7H8
C8H10
邻二甲苯
甲苯
一
C2H5
乙苯
C8H10
下列属于苯的同系物的是( )
D
1.比较苯和甲苯结构的异同点,推测甲苯的化学性质.
2.设计实验证明你的推测.
1.取苯、甲苯各2分别注入2支试管中,各加入3滴KMnO4酸性溶液,充分振荡,观察现象。
现象:甲苯能使酸性KMnO4溶液褪色
甲苯被氧化的是侧链,即甲基被氧化,该反应可简单表示为:
CH3
KMnO4、H+
COOH
(苯甲酸)
这样的氧化反应,都是苯环上的烷烃基被氧化,说明了苯环上的烷烃基比烷烃性质活泼。这活泼性是苯环对烷烃基影响的结果。
②苯的同系物的氧化反应
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
烷基上与苯环直接相连的碳直接连氢原子
H
|
—C—H
|
H
H
| |
—C—C—
| |
H
C
|
—C—C
|
C
×
CH3
|
—C—CH3
|
CH3
CH3
|
|
CH2—R
CH3
|
CH3—CH—
CH3
|
—C—CH3
|
CH3
HOOC
|
|
COOH
HOOC—
KMnO4/H+
思考:产物是什么?
可用KMnO4酸性溶液作试剂鉴别苯的同系物和苯、苯的同系物和烷烃。
阅读课本P38实验2-2以下的内容
思考:1.甲苯与硝酸的反应和苯与硝酸的反应有什么不同
2.比较苯和甲苯与KMnO4溶液的作用,以及硝化 反应的条件产物等,你从中得到什么启示
2、化学性质:
1)取代反应(可与卤素、硝酸、硫酸等反应)
—CH3对苯环的影响使取代反应更易进行
浓硫酸
△
+ 3HNO3
+ 3H2O
淡黄色针状晶体,不溶于水。不稳定,易爆炸。
TNT
小结:
(1)侧链对苯环的影响
①苯的同系物比苯更容易发生苯环上的取代反应,苯主要发生一元取代,而苯的同系物能发生邻、对位取代,如苯与浓H2SO4、浓HNO3混合加热主要生成硝基苯,甲苯与浓HNO3、浓H2SO4,在一定条件下易生成2,4,6 三硝基甲苯(TNT).
②苯的同系物发生卤代反应时,在光照和催化剂条件下,卤素原子取代氢的位置不同:
2)氧化反应
⑴可燃性
⑵可使酸性高锰酸钾溶液褪色(可鉴别苯和甲苯等苯的同系物)
苯环对甲基的影响使甲基可以被酸性高锰酸钾溶液氧化
小结
(2)苯环对侧链的影响
烷烃不易被氧化,但苯环上的烷基易被氧化.苯的同系物能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色,用此法可鉴别苯和苯的同系物.
催化剂
△
+ 3H2
3)加成反应
三、芳香烃的来源及其应用
1、来源:a、煤的干馏 b、石油的催化重整
2、应用:简单的芳香烃是基本的有机 化工原料。
有机物 烷烃 烯烃 炔烃 芳香烃
代表物 CH4 C2H4 C2H2 C6H6
结构特点 全部单键
饱和烃 含碳碳双键不饱和 含碳碳叁键不饱和 特殊的键不饱和
空间结构
物理性质
燃烧
与溴水
KMnO4
主要反应类型
烷烃、烯烃、炔烃、芳香烃的比较
正四面体
平面型
直线型
平面正六边形
无色气体,难溶于水
无色液体
易燃,完全燃烧时生成CO2和H2O
不反应
不反应
取代
加成反应
氧化反应
加成、聚合
加成反应
氧化反应
加成、聚合
不反应
侧链可氧化
取代、加成
总结
