高中生物人教版选修1专题5.3 血红蛋白的提取和分离 课件(43张PPT)
文档属性
| 名称 | 高中生物人教版选修1专题5.3 血红蛋白的提取和分离 课件(43张PPT) | 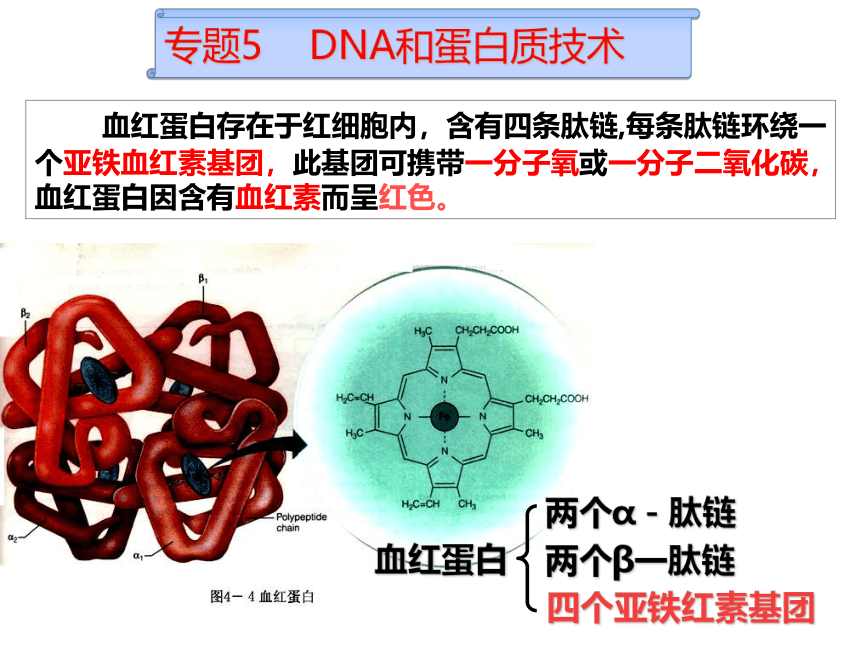 | |
| 格式 | ppt | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2021-03-29 21:39:52 | ||
图片预览




文档简介
(共43张PPT)
专题5
DNA和蛋白质技术
课题3:血红蛋白的提取和分离
血红蛋白存在于红细胞内,含有四条肽链,每条肽链环绕一个亚铁血红素基团,此基团可携带一分子氧或一分子二氧化碳,血红蛋白因含有血红素而呈红色。
血红蛋白
两个α-肽链
两个β一肽链
四个亚铁红素基团
一.
基
础
知
识
蛋白质分离和提取的原理:
蛋白质提取与分离的依据
不同蛋白质的形状、大小、电荷性质和多少、溶解度、吸附性质、亲和力等等各不相同。
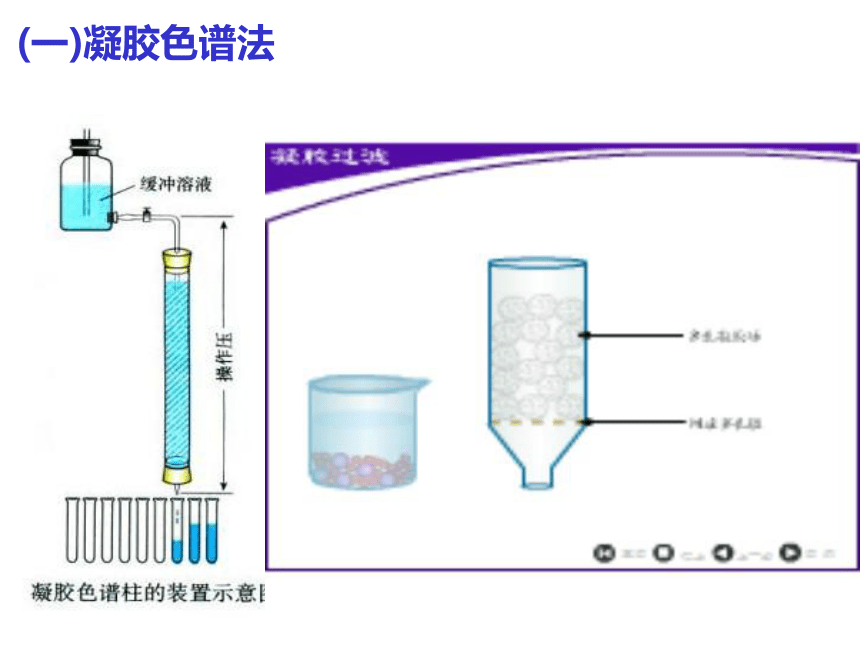
(一)凝胶色谱法
1.凝胶:
根据被分离物质的相对分子质量的大小,利用具有网状结构的凝胶(分子筛作用),来进行分离。
一些微小多孔的球体(内含许多贯穿的孔隙,由多糖类构成,如葡聚糖、琼脂糖)
由葡萄糖通过不同方式形成的聚糖。
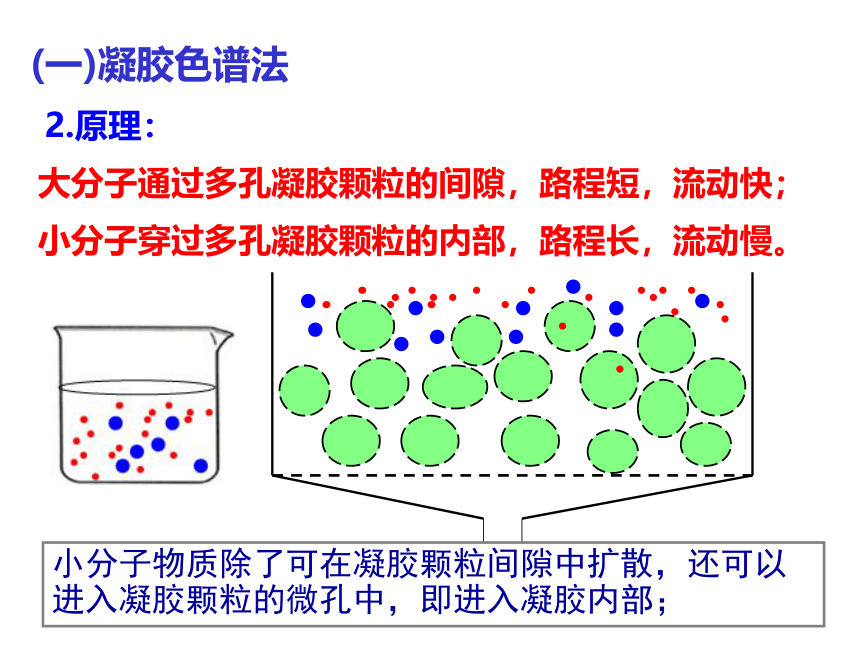
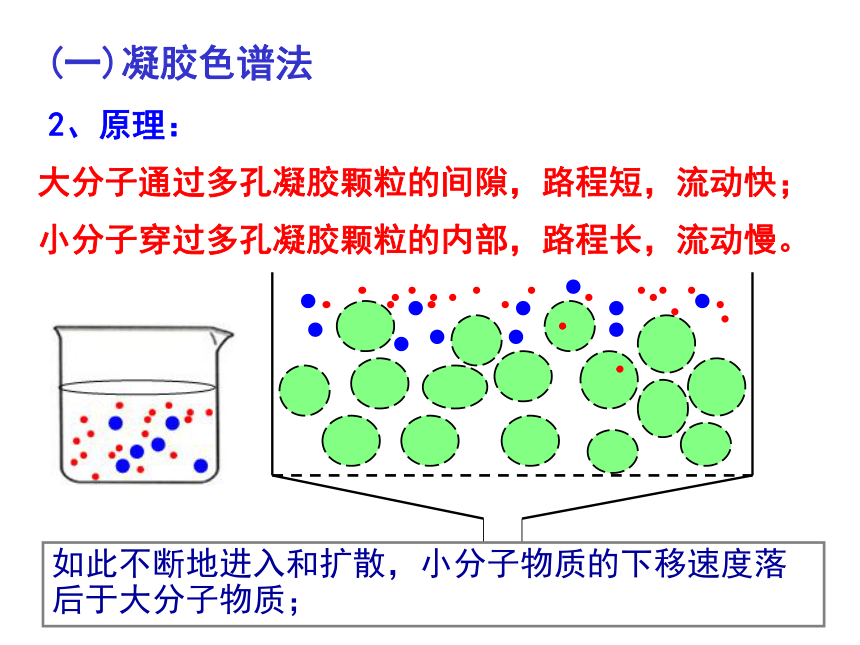
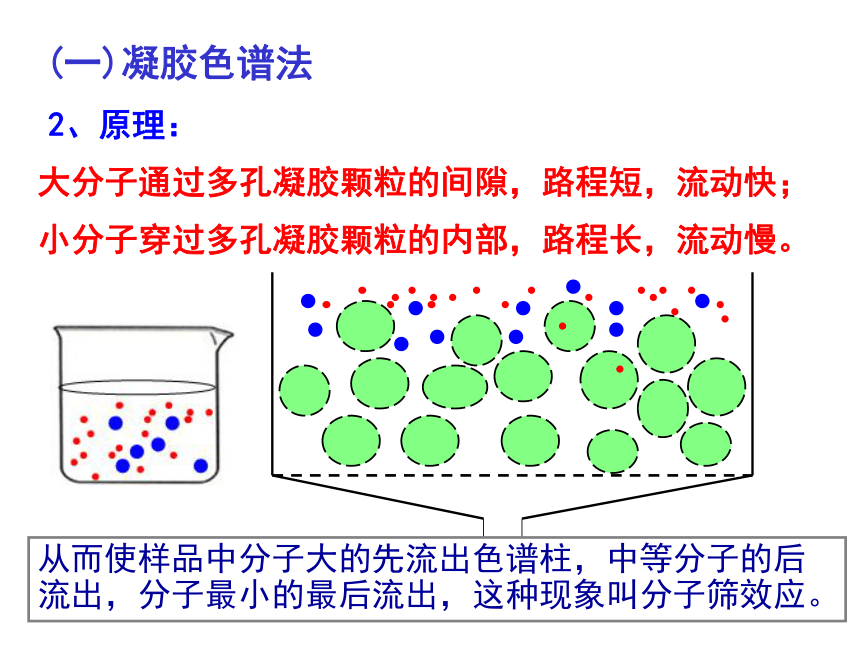
2.原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
小分子物质除了可在凝胶颗粒间隙中扩散,还可以进入凝胶颗粒的微孔中,即进入凝胶内部;
2、原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
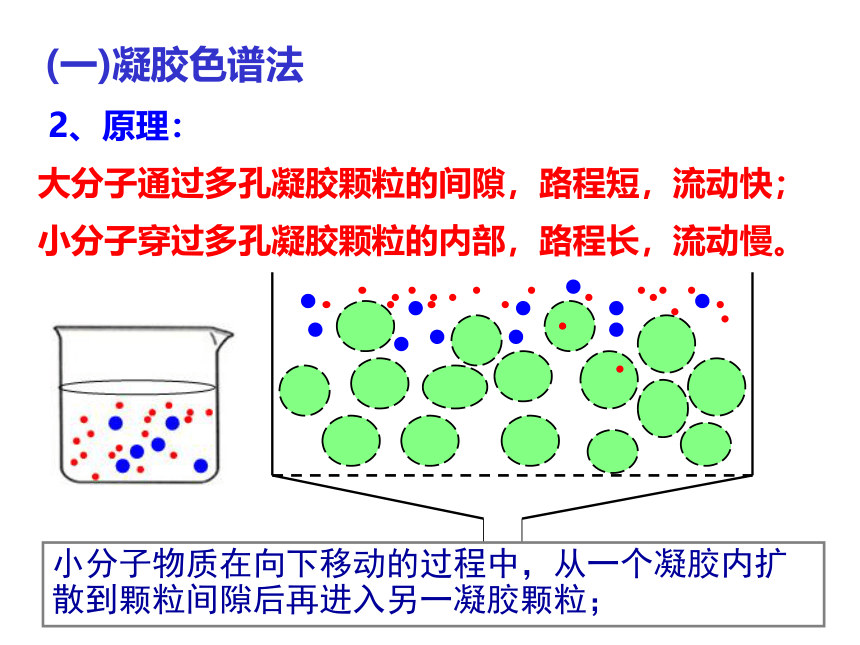
小分子物质在向下移动的过程中,从一个凝胶内扩散到颗粒间隙后再进入另一凝胶颗粒;
2、原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
如此不断地进入和扩散,小分子物质的下移速度落后于大分子物质;
2、原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
从而使样品中分子大的先流出色谱柱,中等分子的后流出,分子最小的最后流出,这种现象叫分子筛效应。
(一)凝胶色谱法
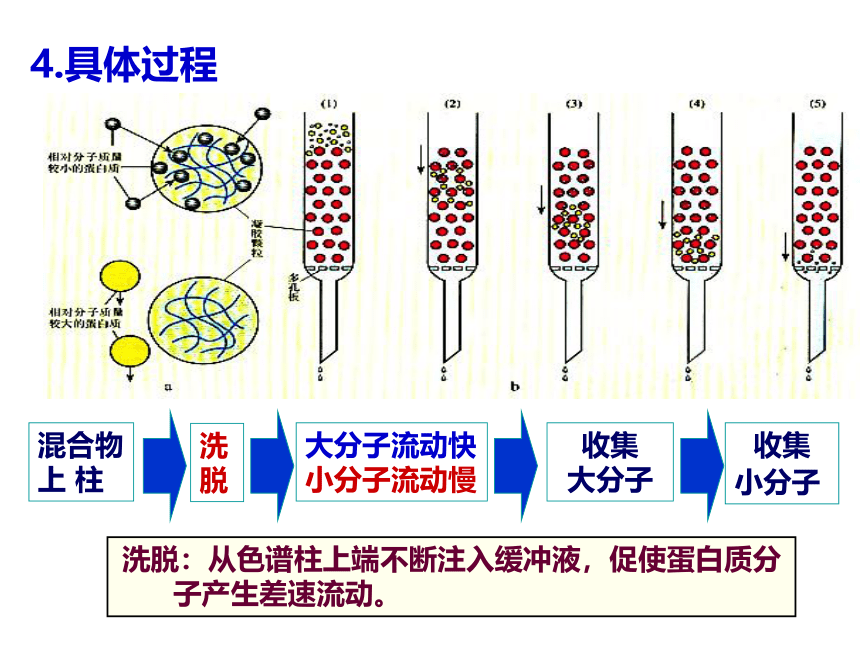
4.具体过程
混合物
上
柱
洗
脱
大分子流动快
小分子流动慢
收集
大分子
收集
小分子
洗脱:从色谱柱上端不断注入缓冲液,促使蛋白质分
子产生差速流动。
1
.缓冲液是什么?
2.
缓冲液的作用
(二)缓冲溶液----
在一定的范围内,凡是能够抵制外来少量强酸或强碱的影响,并使原来溶液PH值基本保持不变的混合溶液。
由弱酸和相应的强碱弱酸盐组成。如H2CO3/NaHCO3,NaH2PO4/Na2HPO4等
能够抵制外界的酸和碱对溶液PH值的影响,维持PH基本不变。
洗脱剂
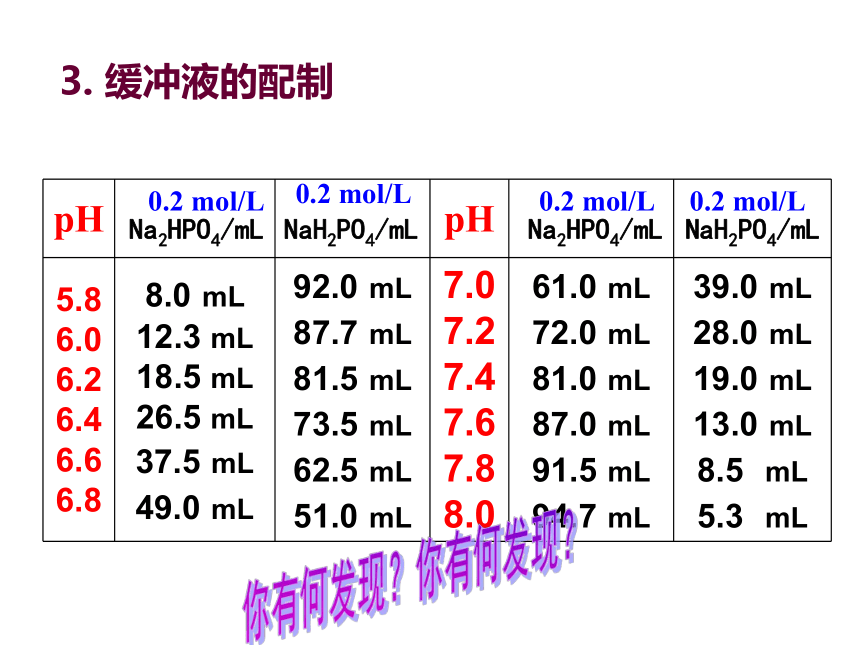
3.
缓冲液的配制
pH
pH
5.8
6.0
6.2
6.4
6.6
6.8
8.0
mL
12.3
mL
18.5
mL
26.5
mL
37.5
mL
49.0
mL
92.0
mL
87.7
mL
81.5
mL
73.5
mL
62.5
mL
51.0
mL
7.0
7.2
7.4
7.6
7.8
8.0
61.0
mL
72.0
mL
81.0
mL
87.0
mL
91.5
mL
94.7
mL
39.0
mL
28.0
mL
19.0
mL
13.0
mL
8.5
mL
5.3
mL
0.2
mol/L
NaH2PO4/mL
0.2
mol/L
Na2HPO4/mL
0.2
mol/L
0.2
mol/L
NaH2PO4/mL
Na2HPO4/mL
你有何发现?
3.缓冲液是如何配制的?
通常由1-2
种缓冲剂溶解于水中配制而成。
通过调节缓冲剂的使用比例就可以制得不同pH的缓冲液。
4.本实验加的是什么缓冲液?为何要加缓冲液?
在本课题中使用的缓冲液是:________________
,其目的是:
利用缓冲液模拟细胞内的pH环境,保证血红蛋白的正常结构和功能,便于观察(红色)和科学研究(活性)
磷酸缓冲液
(三)电
泳
1.概念:
带电粒子在电场作用下发生迁移的过程。
2.原理:
◆
电泳利用了待分离样品中各种分子带电性质的差异以及
分子本身的大小,形状的不同,使带电分子产生不同的
迁移速度,从而实现样品中各种分子的分离。
◆
许多重要的生物大分子,如多肽、核酸等都具有可解离
的基团,在一定的pH下,这些基团会带上正电或负电。
◆
在电场的作用下,这些带电分子会向着与其所带电荷相反
的电极移动。
3.分类:
琼脂糖凝胶电泳和聚丙稀酰胺凝胶电泳
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
电泳原理图解
相对分子质量等不同,其移动速度不同,从而实现了各种分子的分离。
◆
各种分子大小、
带电性质、
分子形状、
+
+
+
+
+
+
+
+
不同大小DNA
片段的混合液
蛋白质提取和分离一般分四步:
样品处理
粗分离
纯
化
纯度鉴定
二、实验操作
为什么提取DNA时用的是鸡的红细胞、
而提取血红蛋白却用哺乳动物的红细胞?
鸡的红细胞具有细胞核,含有DNA,便于进行DNA的提取;
人的红细胞无细胞核,结构简单,血红蛋白含量丰富,便于提取血红蛋白。
二、实验操作
二、实验操作
(一)样品处理
知识回忆—血液的组成
二、实验操作
1.红细胞的洗涤
血液
100mL
3g柠檬酸钠
低速离心
2
min
红细胞
血
浆
吸出血浆
5倍体积生理盐水
搅拌10min
重复洗涤3次,直至上清液没有黄色
红细胞
(一)样品处理
初次离心
3次洗涤后
1.红细胞的洗涤
(1)
为什么要进行红细胞的洗涤,洗涤的目的是什么?
(2)
怎样洗涤红细胞?能用蒸馏水代替生理盐水吗?
(3)
红细胞洗涤干净的标志是什么?
除去其中的杂质蛋白,以利于后续血红蛋白的分离纯化
直至上清液中无黄色,表明洗涤干净。
低速短时离心,去血浆,加生理盐水慢慢搅拌,
再低速短时离心,去上清液,如此重复洗涤三次。
提示:不能用蒸馏水代替,因为蒸馏水会导致红细胞破裂,
与血浆蛋白等混在一起,从而增加了分离的难度。
(一)样品处理
2.血红蛋白的释放:
(1)怎样让红细胞中的血红蛋白释放出来?
(2)加入甲苯的目的是什么?
(3)加入甲苯后搅拌的目的是什么?
加入蒸馏水和甲苯,使红细胞破裂,释放出血红蛋白
加速细胞破裂
点拨:细胞膜的主要成分是脂质,易溶于甲苯等
有机溶剂中,加入甲苯可加速红细胞的破裂
溶解细胞膜
(一)样品处理
红细胞
破碎液
高速离心
10min
离心管
3.分离血红蛋白溶液:
出现分层
2000r/min
(一)样品处理
有机溶剂
无色透明的甲苯层
脂类物质
白色脂溶性物质沉淀层
血红蛋白溶液
红色透明液体
红细胞破碎物沉淀
暗红色沉淀物
离心管
3.分离血红蛋白溶液:
(一)样品处理
红细胞
破碎液
高速离心
10min
离心管
滤纸
过滤
烧杯
3.分离血红蛋白溶液
去除脂溶性沉淀层
出现分层
分液漏斗中静置片刻后,分出下层的红色透明液体
2000r/min
(一)样品处理
1.原理:
透析袋能使小分子自由进出,而大分子保留在袋内。
2.过程:
取1ml的血红蛋白溶液装入透析袋中,
(除去样品中分子量较小的杂质)
二、实验操作
(二)粗提取—透析
将透析袋放入盛有300ml的物质的量浓度为20mmol/l的磷酸缓冲液中(pH为7.0),
透析12小时。
(二)粗提取—透析
二、实验操作
二、实验操作
阅读教材相关部分内容,回答:
1.凝胶色谱操作分为哪几个步骤?
凝胶色谱柱的制作
凝胶色谱柱的装填
样品的加入和洗脱
(三)纯化--凝胶色谱法
将分子量较大的杂质蛋白质除去
二、实验操作
1、凝胶色谱柱的制作:
①取长40厘米,内径1.6厘米的玻璃管,两
端需用砂纸磨平。
(三)纯化--凝胶色谱法
②底塞的制作:打孔→挖出凹穴→安装移液管头部→覆盖尼龙网,再用100目尼龙纱包好,插到玻璃管的一端。
二、实验操作
1、凝胶色谱柱的制作:
(三)纯化--凝胶色谱法
指筛网在1英寸线段内的孔数为100
二、实验操作
1、凝胶色谱柱的制作:
注意事项:底塞中插入的玻璃管的上部不得超出橡皮塞的凹穴底面,否则难以铺实尼龙网,还会导致液体残留,蛋白质分离不彻底。
(三)纯化--凝胶色谱法
二、实验操作
1、凝胶色谱柱的制作:
③顶塞的制作:打孔→安装玻璃管。
(三)纯化--凝胶色谱法
二、实验操作
1、凝胶色谱柱的制作:
(三)纯化--凝胶色谱法
④组装:将上述三者按相应位置组装成一个整体。
+
+
2、凝胶色谱柱的装填:
材料:交联葡聚糖凝胶颗粒G-75;20mmol/L磷酸缓冲液
装填:
步骤
操作要求
①
②
③
④
根据色谱柱体积计算凝胶用量
色谱柱垂直固定在支架上
计算称量凝胶
固定色谱柱
“G”表示凝胶的交联程度。75表示凝胶的得水值,即每克凝胶膨胀时吸水7.5克。
二、实验操作
(三)纯化--凝胶色谱法
配制悬浮液
装填悬浮液
或者凝胶颗粒+洗脱液→沸水浴
凝胶颗粒+蒸馏水→充分溶胀
一次性缓慢倒入;轻轻敲动色谱柱,使凝胶填装均匀。
商品凝胶是干燥的颗粒可直接在洗脱液中膨胀。为了加速膨胀,可在沸水浴使其快速膨胀
2、凝胶色谱柱的装填:
二、实验操作
(三)纯化--凝胶色谱法
步骤
操作要求
⑤
洗涤平衡
立刻用磷酸缓冲液洗涤12h,使凝胶装填紧密。
3.样品加入与洗脱:
二、实验操作
(三)纯化--凝胶色谱法
①调节缓冲液面:打开下端出口,使柱内缓冲液缓慢下降到与凝胶面平齐,关闭出口。
②滴加透析样品:吸管吸1ml样品加到色谱柱的顶端,滴加样品时,吸管管口贴着管壁环绕移动加样,同时注意不要破坏凝胶面。
注意:
1、不要触及并破坏凝胶面
2、贴壁加样
3、使吸管管口沿管壁环绕移动
③样品渗入凝胶床:加样后打开下端出口,使样品渗入凝胶床内,等样品完全进入凝胶层后,关闭下端出口。
3.样品加入与洗脱:
二、实验操作
(三)纯化--凝胶色谱法
④洗脱:小心加入pH=7.0
的20mmol/l的磷酸缓冲液到适当高度,连接缓冲液洗脱瓶,打开下端出口进行洗脱。
⑤收集:待红色的蛋白质接近色谱柱底端时,用试管收集流出液,每5ml收集一试管,连续收集。
收集得到的纯化后的血红蛋白
二、实验操作
(四)纯度鉴定--凝胶电泳
使用最多的是:
十二烷基磺酸钠(SDS)—聚丙烯酰胺凝胶电泳
蛋白质在聚丙烯酰胺凝胶中的迁移率取决于它所带静电荷的多少以及分子的大小等因素。
1.为了消除静电荷对迁移率的影响可以在凝胶中加入SDS。
2.SDS能使蛋白质发生完全变性。由几条肽链组成的血红蛋白在SDS的作用下会解聚成单条肽链,因此测定的结果只是单条肽链的分子量。
十二烷基磺酸钠(SDS)的作用:
二、实验操作
(四)纯度鉴定--凝胶电泳
正常
异常
观察你处理的血液样品离心后是否分层,如果分层不明显,可能是洗涤次数少、未能除去血浆蛋白的原因。此外,离心速度过高和时间过长,会使白细胞和淋巴细胞一同沉淀,也得不到纯净的红细胞,影响后续血红蛋白的提取纯度。
四、实验结果分析与评价
1.你是否完成了对血液样品的处理?你能描述处理后的样品发生了哪些变化吗?
四、实验结果分析与评价
2.你装填的凝胶色谱柱是否有气泡产生?你的色谱柱装填得成功吗?你是如何判断的?
由于凝胶是一种半透明的介质,因此可以在凝胶柱旁放一支与凝胶柱垂直的日光灯,检查凝胶是否装填得均匀。此外,还可以加入大分子的有色物质,例如蓝色葡聚糖—2000或红色葡聚糖,观察色带移动的情况。如果色带均匀、狭窄、平整,说明凝胶色谱柱的性能良好。如果色谱柱出现纹路或气泡,轻轻敲打柱体以消除气泡,消除不了时要重新装柱。
如果凝胶色谱柱装填成功、分离操作也正确的话,能清楚地看到血红蛋白的红色区带均匀、狭窄、平整,随着洗脱液缓慢流出;
如果红色区带歪曲、散乱、变宽,说明分离的效果不好,这与凝胶色谱柱的装填有关。
3.你能观察到蛋白质的分离过程中,红色区带的移动吗?请描述红色区带的移动情况,并据此判断分离效果?
四、实验结果分析与评价
专题5
DNA和蛋白质技术
课题3:血红蛋白的提取和分离
血红蛋白存在于红细胞内,含有四条肽链,每条肽链环绕一个亚铁血红素基团,此基团可携带一分子氧或一分子二氧化碳,血红蛋白因含有血红素而呈红色。
血红蛋白
两个α-肽链
两个β一肽链
四个亚铁红素基团
一.
基
础
知
识
蛋白质分离和提取的原理:
蛋白质提取与分离的依据
不同蛋白质的形状、大小、电荷性质和多少、溶解度、吸附性质、亲和力等等各不相同。
(一)凝胶色谱法
1.凝胶:
根据被分离物质的相对分子质量的大小,利用具有网状结构的凝胶(分子筛作用),来进行分离。
一些微小多孔的球体(内含许多贯穿的孔隙,由多糖类构成,如葡聚糖、琼脂糖)
由葡萄糖通过不同方式形成的聚糖。
2.原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
小分子物质除了可在凝胶颗粒间隙中扩散,还可以进入凝胶颗粒的微孔中,即进入凝胶内部;
2、原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
小分子物质在向下移动的过程中,从一个凝胶内扩散到颗粒间隙后再进入另一凝胶颗粒;
2、原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
如此不断地进入和扩散,小分子物质的下移速度落后于大分子物质;
2、原理:
小分子穿过多孔凝胶颗粒的内部,路程长,流动慢。
大分子通过多孔凝胶颗粒的间隙,路程短,流动快;
(一)凝胶色谱法
从而使样品中分子大的先流出色谱柱,中等分子的后流出,分子最小的最后流出,这种现象叫分子筛效应。
(一)凝胶色谱法
4.具体过程
混合物
上
柱
洗
脱
大分子流动快
小分子流动慢
收集
大分子
收集
小分子
洗脱:从色谱柱上端不断注入缓冲液,促使蛋白质分
子产生差速流动。
1
.缓冲液是什么?
2.
缓冲液的作用
(二)缓冲溶液----
在一定的范围内,凡是能够抵制外来少量强酸或强碱的影响,并使原来溶液PH值基本保持不变的混合溶液。
由弱酸和相应的强碱弱酸盐组成。如H2CO3/NaHCO3,NaH2PO4/Na2HPO4等
能够抵制外界的酸和碱对溶液PH值的影响,维持PH基本不变。
洗脱剂
3.
缓冲液的配制
pH
pH
5.8
6.0
6.2
6.4
6.6
6.8
8.0
mL
12.3
mL
18.5
mL
26.5
mL
37.5
mL
49.0
mL
92.0
mL
87.7
mL
81.5
mL
73.5
mL
62.5
mL
51.0
mL
7.0
7.2
7.4
7.6
7.8
8.0
61.0
mL
72.0
mL
81.0
mL
87.0
mL
91.5
mL
94.7
mL
39.0
mL
28.0
mL
19.0
mL
13.0
mL
8.5
mL
5.3
mL
0.2
mol/L
NaH2PO4/mL
0.2
mol/L
Na2HPO4/mL
0.2
mol/L
0.2
mol/L
NaH2PO4/mL
Na2HPO4/mL
你有何发现?
3.缓冲液是如何配制的?
通常由1-2
种缓冲剂溶解于水中配制而成。
通过调节缓冲剂的使用比例就可以制得不同pH的缓冲液。
4.本实验加的是什么缓冲液?为何要加缓冲液?
在本课题中使用的缓冲液是:________________
,其目的是:
利用缓冲液模拟细胞内的pH环境,保证血红蛋白的正常结构和功能,便于观察(红色)和科学研究(活性)
磷酸缓冲液
(三)电
泳
1.概念:
带电粒子在电场作用下发生迁移的过程。
2.原理:
◆
电泳利用了待分离样品中各种分子带电性质的差异以及
分子本身的大小,形状的不同,使带电分子产生不同的
迁移速度,从而实现样品中各种分子的分离。
◆
许多重要的生物大分子,如多肽、核酸等都具有可解离
的基团,在一定的pH下,这些基团会带上正电或负电。
◆
在电场的作用下,这些带电分子会向着与其所带电荷相反
的电极移动。
3.分类:
琼脂糖凝胶电泳和聚丙稀酰胺凝胶电泳
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
电泳原理图解
相对分子质量等不同,其移动速度不同,从而实现了各种分子的分离。
◆
各种分子大小、
带电性质、
分子形状、
+
+
+
+
+
+
+
+
不同大小DNA
片段的混合液
蛋白质提取和分离一般分四步:
样品处理
粗分离
纯
化
纯度鉴定
二、实验操作
为什么提取DNA时用的是鸡的红细胞、
而提取血红蛋白却用哺乳动物的红细胞?
鸡的红细胞具有细胞核,含有DNA,便于进行DNA的提取;
人的红细胞无细胞核,结构简单,血红蛋白含量丰富,便于提取血红蛋白。
二、实验操作
二、实验操作
(一)样品处理
知识回忆—血液的组成
二、实验操作
1.红细胞的洗涤
血液
100mL
3g柠檬酸钠
低速离心
2
min
红细胞
血
浆
吸出血浆
5倍体积生理盐水
搅拌10min
重复洗涤3次,直至上清液没有黄色
红细胞
(一)样品处理
初次离心
3次洗涤后
1.红细胞的洗涤
(1)
为什么要进行红细胞的洗涤,洗涤的目的是什么?
(2)
怎样洗涤红细胞?能用蒸馏水代替生理盐水吗?
(3)
红细胞洗涤干净的标志是什么?
除去其中的杂质蛋白,以利于后续血红蛋白的分离纯化
直至上清液中无黄色,表明洗涤干净。
低速短时离心,去血浆,加生理盐水慢慢搅拌,
再低速短时离心,去上清液,如此重复洗涤三次。
提示:不能用蒸馏水代替,因为蒸馏水会导致红细胞破裂,
与血浆蛋白等混在一起,从而增加了分离的难度。
(一)样品处理
2.血红蛋白的释放:
(1)怎样让红细胞中的血红蛋白释放出来?
(2)加入甲苯的目的是什么?
(3)加入甲苯后搅拌的目的是什么?
加入蒸馏水和甲苯,使红细胞破裂,释放出血红蛋白
加速细胞破裂
点拨:细胞膜的主要成分是脂质,易溶于甲苯等
有机溶剂中,加入甲苯可加速红细胞的破裂
溶解细胞膜
(一)样品处理
红细胞
破碎液
高速离心
10min
离心管
3.分离血红蛋白溶液:
出现分层
2000r/min
(一)样品处理
有机溶剂
无色透明的甲苯层
脂类物质
白色脂溶性物质沉淀层
血红蛋白溶液
红色透明液体
红细胞破碎物沉淀
暗红色沉淀物
离心管
3.分离血红蛋白溶液:
(一)样品处理
红细胞
破碎液
高速离心
10min
离心管
滤纸
过滤
烧杯
3.分离血红蛋白溶液
去除脂溶性沉淀层
出现分层
分液漏斗中静置片刻后,分出下层的红色透明液体
2000r/min
(一)样品处理
1.原理:
透析袋能使小分子自由进出,而大分子保留在袋内。
2.过程:
取1ml的血红蛋白溶液装入透析袋中,
(除去样品中分子量较小的杂质)
二、实验操作
(二)粗提取—透析
将透析袋放入盛有300ml的物质的量浓度为20mmol/l的磷酸缓冲液中(pH为7.0),
透析12小时。
(二)粗提取—透析
二、实验操作
二、实验操作
阅读教材相关部分内容,回答:
1.凝胶色谱操作分为哪几个步骤?
凝胶色谱柱的制作
凝胶色谱柱的装填
样品的加入和洗脱
(三)纯化--凝胶色谱法
将分子量较大的杂质蛋白质除去
二、实验操作
1、凝胶色谱柱的制作:
①取长40厘米,内径1.6厘米的玻璃管,两
端需用砂纸磨平。
(三)纯化--凝胶色谱法
②底塞的制作:打孔→挖出凹穴→安装移液管头部→覆盖尼龙网,再用100目尼龙纱包好,插到玻璃管的一端。
二、实验操作
1、凝胶色谱柱的制作:
(三)纯化--凝胶色谱法
指筛网在1英寸线段内的孔数为100
二、实验操作
1、凝胶色谱柱的制作:
注意事项:底塞中插入的玻璃管的上部不得超出橡皮塞的凹穴底面,否则难以铺实尼龙网,还会导致液体残留,蛋白质分离不彻底。
(三)纯化--凝胶色谱法
二、实验操作
1、凝胶色谱柱的制作:
③顶塞的制作:打孔→安装玻璃管。
(三)纯化--凝胶色谱法
二、实验操作
1、凝胶色谱柱的制作:
(三)纯化--凝胶色谱法
④组装:将上述三者按相应位置组装成一个整体。
+
+
2、凝胶色谱柱的装填:
材料:交联葡聚糖凝胶颗粒G-75;20mmol/L磷酸缓冲液
装填:
步骤
操作要求
①
②
③
④
根据色谱柱体积计算凝胶用量
色谱柱垂直固定在支架上
计算称量凝胶
固定色谱柱
“G”表示凝胶的交联程度。75表示凝胶的得水值,即每克凝胶膨胀时吸水7.5克。
二、实验操作
(三)纯化--凝胶色谱法
配制悬浮液
装填悬浮液
或者凝胶颗粒+洗脱液→沸水浴
凝胶颗粒+蒸馏水→充分溶胀
一次性缓慢倒入;轻轻敲动色谱柱,使凝胶填装均匀。
商品凝胶是干燥的颗粒可直接在洗脱液中膨胀。为了加速膨胀,可在沸水浴使其快速膨胀
2、凝胶色谱柱的装填:
二、实验操作
(三)纯化--凝胶色谱法
步骤
操作要求
⑤
洗涤平衡
立刻用磷酸缓冲液洗涤12h,使凝胶装填紧密。
3.样品加入与洗脱:
二、实验操作
(三)纯化--凝胶色谱法
①调节缓冲液面:打开下端出口,使柱内缓冲液缓慢下降到与凝胶面平齐,关闭出口。
②滴加透析样品:吸管吸1ml样品加到色谱柱的顶端,滴加样品时,吸管管口贴着管壁环绕移动加样,同时注意不要破坏凝胶面。
注意:
1、不要触及并破坏凝胶面
2、贴壁加样
3、使吸管管口沿管壁环绕移动
③样品渗入凝胶床:加样后打开下端出口,使样品渗入凝胶床内,等样品完全进入凝胶层后,关闭下端出口。
3.样品加入与洗脱:
二、实验操作
(三)纯化--凝胶色谱法
④洗脱:小心加入pH=7.0
的20mmol/l的磷酸缓冲液到适当高度,连接缓冲液洗脱瓶,打开下端出口进行洗脱。
⑤收集:待红色的蛋白质接近色谱柱底端时,用试管收集流出液,每5ml收集一试管,连续收集。
收集得到的纯化后的血红蛋白
二、实验操作
(四)纯度鉴定--凝胶电泳
使用最多的是:
十二烷基磺酸钠(SDS)—聚丙烯酰胺凝胶电泳
蛋白质在聚丙烯酰胺凝胶中的迁移率取决于它所带静电荷的多少以及分子的大小等因素。
1.为了消除静电荷对迁移率的影响可以在凝胶中加入SDS。
2.SDS能使蛋白质发生完全变性。由几条肽链组成的血红蛋白在SDS的作用下会解聚成单条肽链,因此测定的结果只是单条肽链的分子量。
十二烷基磺酸钠(SDS)的作用:
二、实验操作
(四)纯度鉴定--凝胶电泳
正常
异常
观察你处理的血液样品离心后是否分层,如果分层不明显,可能是洗涤次数少、未能除去血浆蛋白的原因。此外,离心速度过高和时间过长,会使白细胞和淋巴细胞一同沉淀,也得不到纯净的红细胞,影响后续血红蛋白的提取纯度。
四、实验结果分析与评价
1.你是否完成了对血液样品的处理?你能描述处理后的样品发生了哪些变化吗?
四、实验结果分析与评价
2.你装填的凝胶色谱柱是否有气泡产生?你的色谱柱装填得成功吗?你是如何判断的?
由于凝胶是一种半透明的介质,因此可以在凝胶柱旁放一支与凝胶柱垂直的日光灯,检查凝胶是否装填得均匀。此外,还可以加入大分子的有色物质,例如蓝色葡聚糖—2000或红色葡聚糖,观察色带移动的情况。如果色带均匀、狭窄、平整,说明凝胶色谱柱的性能良好。如果色谱柱出现纹路或气泡,轻轻敲打柱体以消除气泡,消除不了时要重新装柱。
如果凝胶色谱柱装填成功、分离操作也正确的话,能清楚地看到血红蛋白的红色区带均匀、狭窄、平整,随着洗脱液缓慢流出;
如果红色区带歪曲、散乱、变宽,说明分离的效果不好,这与凝胶色谱柱的装填有关。
3.你能观察到蛋白质的分离过程中,红色区带的移动吗?请描述红色区带的移动情况,并据此判断分离效果?
四、实验结果分析与评价
同课章节目录
- 专题1 传统发酵技术的应用
- 课题1 果酒和果醋的制作
- 课题2 腐乳的制作
- 课题3 制作泡菜并检测亚硝酸盐含量
- 专题2 微生物的培养与应用
- 课题1 微生物的实验室培养
- 课题2 土壤中分解尿素的细菌的分离与计数
- 课题3 分解纤维素的微生物的分离
- 专题3 植物的组织培养技术
- 课题1 菊花的组织培养
- 课题2 月季的花药培养
- 专题4 酶的研究与应用
- 课题1 果胶酶在果汁生产中的作用
- 课题2 探讨加酶洗衣粉的洗涤效果
- 课题3 酵母细胞的固定化
- 专题5 DNA和蛋白质技术
- 课题1 DNA的粗提取与鉴定
- 课题2 多聚酶链式反应扩增DNA片段
- 课题3 血红蛋白的提取和分离
- 专题6 植物有效成分的提取
- 课题1 植物芳香油的提取
- 课题2 胡萝卜素的提取
