华师版九年级下册科学课件 第3章 3.1.1 金属的氧化和金属氧化物的还原同步练习(44张PPT)
文档属性
| 名称 | 华师版九年级下册科学课件 第3章 3.1.1 金属的氧化和金属氧化物的还原同步练习(44张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 461.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-03-30 14:28:16 | ||
图片预览










文档简介
第1节 物质的转化
第1课时 金属的氧化和金属氧化物的还原
第3章 物质的转化和元素的循环
华师版 九年级
1
2
3
4
5
6
7
8
提示:点击 进入习题
答案显示
习题链接
C
B
B
C
C
A
9
10
11
12
A
D
13
14
15
16
1.我国是最早冶炼和使用铜的文明古国之一。古人通常将木炭跟铜矿石放在一起高温熔炼:C+2CuO =====2Cu+CO2↑,则下列说法正确的是( )
A.反应中,氧化铜是还原剂
B.反应中,氧化铜具有还原性
C.反应中,木炭具有还原性
D.反应中,铜是还原剂
C
高温
【点拨】在该反应中碳得到氧,发生氧化反应,是还原剂,具有还原性,故C选项说法正确。
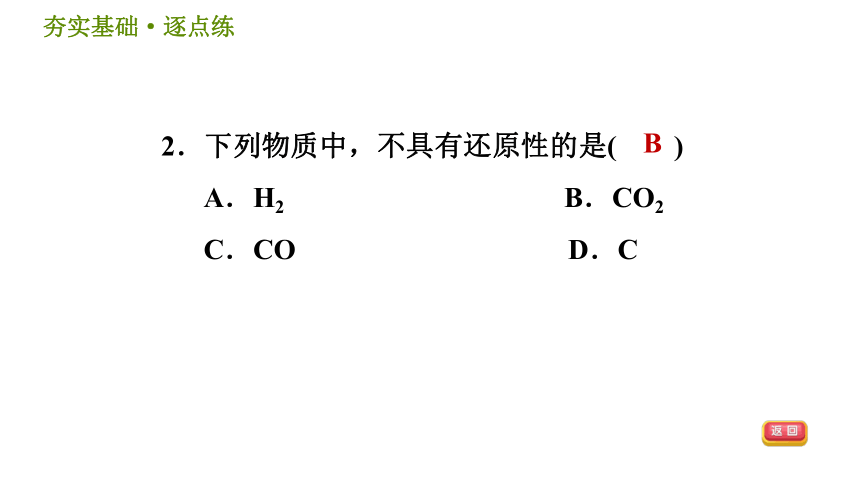
2.下列物质中,不具有还原性的是( )
A.H2 B.CO2
C.CO D.C
B
3.将燃着的镁带伸入盛有二氧化碳的集气瓶中,镁带继续剧烈燃烧,反应的化学方程式为:2Mg+CO2 ===== 2MgO+C,下列叙述错误的是( )
A.该反应中镁发生了氧化反应
B.该反应中二氧化碳是还原剂
C.该反应属于置换反应
D.镁着火时不能用二氧化碳扑灭
B
点燃
【点拨】该反应中镁得到氧,做还原剂。
4.用一氧化碳在加热的条件下还原氧化铜,发现已制得的铜又很快变黑了,你推测产生这种现象的原因是( )
A.反应开始时,没有把试管内的空气排干净
B.温度太低
C.铜没有在一氧化碳气流中冷却,又被空气中氧气所氧化
D.试管口倾斜了
C
【点拨】用一氧化碳还原氧化铜的实验结束时,应先撤酒精灯,待试管冷却后再停止通一氧化碳,以免被还原出的铜又与空气中的氧气反应生成黑色的氧化铜,故C正确。
5.用氢气还原氧化铜实验应包括以下几个步骤,正确的操作顺序是( )
①加热盛有氧化铜粉末的试管 ②通入氢气
③撤去酒精灯 ④停止通入氢气
A.①②③④ B.②①④③
C.②①③④ D.①②④③
C
【点拨】用氢气还原氧化铜的步骤为:①通入氢气,排尽试管内原有空气;②加热氧化铜;③停止加热;④停止通氢气。第③④步不能颠倒,防止刚还原出的铜又被氧化。
6.某学习小组在做氢气还原氧化铜的实验时,在试管内加入氧化铜固体10 g,通入氢气一会儿后再给氧化铜加热,反应完全后撤去酒精灯并停止通入氢气,在空气中将试管冷却,发现部分红色固体又变回黑色。称得试管中剩余固体质量为8.32 g。
(1)“在空气中将试管冷却”会导致__________________,使“部分红色固体又变回黑色”。
生成的铜又被氧化
(2)按此实验操作及获得的数据,可知试管内剩余固体中有氧化铜________ g。
1.6
【点拨】(1)铜在较高温度时易被空气中的氧气氧化;
(2)根据题干提供的数据,固体质量减少了10 g-8.32 g=1.68 g,则被还原的氧化铜的质量为1.68 g÷16/80=8.4 g,故剩余的氧化铜的质量为10 g-8.4 g=1.6 g。
7.如图为某同学设计的氢气还原氧化铜的微型实验装置,微型滴管内装稀硫酸。
(1)实验时应先挤压微型滴管,还是先点燃微型酒精灯?_____________________。
(2)写出CuO发生变化的化学方程式_________________________。
先挤压微型滴管
CuO+H2=====Cu+H2O
△
8.某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )
A.c、b、a
B.c、d、a
C.c、b、d
D.b、c、a
A
【点拨】一氧化碳和氢气等体积混合后还原氧化铁,要想知道哪个还原氧化铁的量更多,我们要根据生成的二氧化碳和水的质量进一步求出。要知道生成二氧化碳和水的质量,我们要先用浓硫酸的质量变化测出生成水的质量,再用氢氧化钠溶液的质量变化测出生成二氧化碳的质量。
9.用锌、氧化铜、稀硫酸制取铜,有下列两种途径:
(1)Zn――→H2――→Cu
(2)CuO――→CuSO4――→Cu
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
A.消耗相同质量的氧化铜 B.消耗相同质量的锌
C.消耗相同质量的硫酸 D.生成硫酸锌的质量相同
A
稀硫酸
氧化铜
锌
稀硫酸
10.(图形信息题)A、B、X、Y是初中科学常见的四种气体,它们之间有如图所示的转化关系(反应条件已略去)。请写出:
(1)X、Y的化学式:X____________、Y ____________。
CO
H2
(2)CuO→B的化学方程式:________________________________________________________________________________。
C+ 2CuO ===== 2Cu + CO2↑(或CO+ CuO =====Cu + CO2 )
高温
△
【点拨】根据A、Y是气体,CuO+Y→H2O,推知Y为H2;依据A+Y(H2) →H2O,可推知A为O2。X、B也为气体,根据图中的转化关系,则可推得X、B分别为CO、CO2,且CO+O2→CO2(反应条件略)符合A+X→B。
11.如图是初中科学常见的一些氧化物和单质之间的相互转化关系。
其中单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,氧化物Ⅲ能使澄清石灰水变浑浊。则:
(1)反应①中________(填化学式)发生了还原反应。
(2)氧化物Ⅱ除图中所示的化学性质外,还具有______性,对人体有危害。
CuO
毒
(3)根据题意,写出反应④的化学方程式________________________________。
CO2+C=====2CO
高温
【点拨】单质Ⅰ为红色固体,则为铜,而氧化物Ⅰ和单质Ⅲ均为黑色固体,黑色固体单质应是碳,而黑色氧化物应为氧化铜;氧化物Ⅲ能使澄清石灰水变浑浊,则氧化物Ⅲ为二氧化碳。
12.(中考?成都)按图进行实验,有关说法及分析不正确的是( )
A.烘干的木炭粉末与CuO粉末需混合均匀
B.网罩的作用是集中火焰,提高温度
C.可观察到澄清石灰水变浑浊
D.产生的气体一定没有CO
D
13.实验室有一瓶纯净的氢气和一小段光亮的粗铜丝,某同学用坩埚钳夹住铜丝进行实验:将铜丝放在酒精灯上加热一段时间,然后迅速将热铜丝伸入盛有氢气的集气瓶中。请回答:
(1)铜丝加热时逐渐变黑,其原因是__________________
_____________________________。
铜丝在加热时与氧
气反应生成了黑色的氧化铜
(2)将变黑的热铜丝迅速伸入盛有氢气的集气瓶中,可观察到的现象是______________________;如果将变黑的热铜丝伸入盛有少量稀硫酸的试管中,发生反应的化学方程式为________________________________。
黑色的铜丝变成了红色
CuO+H2SO4===CuSO4+H2O
14.(中考?上海改编)甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验。
(1)B中反应的化学方程式是_________________________,该反应的还原剂是_________。
CO+CuO=====Cu+CO2
△
CO
(2)实验过程中,C中的现象是_____________________,D处放置点燃的酒精灯的目的是______________________
______________________________________________。
澄清石灰水变浑浊
点燃尾气,防止有毒
气体CO逸散到空气中污染环境
(3)对该实验的分析正确的是________(填编号)。
a.实验结束时应先熄灭B处酒精灯
b. C中增加的质量与B中固体减少的质量相等
c.反应开始后通入2.8 g一氧化碳可生成6.4 g铜
d.反应结束后继续通入一氧化碳的目的是防止铜被氧化
a、d
(4)甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是__________________________________________________________________________________________。
为了排尽装置中的空气,反应前已通入一段时间的CO
【点拨】(1)在CO+CuO=====Cu+CO2中,CO作还原剂,CuO作氧化剂。(2)气体经B后生成二氧化碳气体,所以C中澄清石灰水变浑浊,由于尾气中含有CO气体,会对空气造成污染,因此尾气应采用点燃等方法处理。(3)在此实验中为了防止生成的铜又被氧化,在反应结束后应先撤酒精灯,继续通CO一段时间,直至玻璃管冷却;
△
根据反应的方程式可知固体减少的是氧元素的质量,不等于生成的二氧化碳的质量,所以C中增加的质量大于B中固体减少的质量。(4)为了排尽装置中的空气,反应前已通入一段时间的CO,所以省略A可达到同样的目的。
15.某学生对过量炭粉与氧化铁反应产物中气体的成分进行了研究。
(1)假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:使一定量的氧化铁在隔绝氧气的条件下与过量的炭粉完全反应,测得参加反应的碳元素和氧元素的质量比。
(3)查阅资料:氮气不与炭粉、氧化铁反应,可用来隔绝氧气。
(4)实验:如图所示(已检查气密性)。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}操作步骤与实验现象
1.称取3.2 g氧化铁与2 g炭粉,混合均匀,放入质量为48.48 g的玻璃管中,按图所示装置连接仪器
2.加热前先通一段时间纯净的氮气
3.夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊
4.完全反应后冷却至室温,称得玻璃管和固体的总质量为52.24 g
(5)数据处理:参加反应的碳元素的质量为________g,氧元素的质量为________g。
(6)结论:根据对数据的处理结果得知,原假设________ (填“成立”或“不成立”),理由是__________________________________________________________________________________________。
0.48
0.96
不成立
生成物中碳元素与氧元素的质量比不等于二氧化碳中碳元素与氧元素的质量比
【点拨】反应前玻璃管和药品的总质量为3.2 g+2 g+48.48 g=53.68 g,反应后质量减少了53.68 g-52.24 g=1.44 g,说明炭粉有剩余,而氧化铁完全反应。生成物中氧元素的质量等于氧化铁中氧元素的质量,3.2 g×30%=0.96 g,所以参加反应的碳元素质量是1.44 g-0.96 g=0.48 g,根据质量守恒定律可知生成物中碳元素与氧元素的质量比为0.48 g:0.96 g=1:2,而二氧化碳中碳元素与氧元素的质量比为12: (16×2)=3:8≠1:2,所以气体产物不只有二氧化碳。
16.某学校课外活动小组用3 g含少量CO2的CO气体做CO还原CuO实验。实验装置如下图:
实验数据记录如下表:
假定每个反应都完全进行,试计算该实验参加反应的CO的质量分数。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验装置代号
A
B
D
实验前总质量(g)
100
100
100
实验后总质量(g)
100.5
100.5
102.2
解:A装置增加的质量为100.5 g-100 g=0.5 g,故混合气体中一氧化碳的质量为3 g-0.5 g=2.5 g,生成二氧化碳的质量为102.2 g-100 g=2.2 g,设参加反应的一氧化碳的质量为x
CuO+CO=====Cu+CO2
28 44
x 2.2 g
△
x=1.4 g
该实验参加反应的CO的质量分数为1.4 g/2.5 g ×100%=56%
答:略。
第1课时 金属的氧化和金属氧化物的还原
第3章 物质的转化和元素的循环
华师版 九年级
1
2
3
4
5
6
7
8
提示:点击 进入习题
答案显示
习题链接
C
B
B
C
C
A
9
10
11
12
A
D
13
14
15
16
1.我国是最早冶炼和使用铜的文明古国之一。古人通常将木炭跟铜矿石放在一起高温熔炼:C+2CuO =====2Cu+CO2↑,则下列说法正确的是( )
A.反应中,氧化铜是还原剂
B.反应中,氧化铜具有还原性
C.反应中,木炭具有还原性
D.反应中,铜是还原剂
C
高温
【点拨】在该反应中碳得到氧,发生氧化反应,是还原剂,具有还原性,故C选项说法正确。
2.下列物质中,不具有还原性的是( )
A.H2 B.CO2
C.CO D.C
B
3.将燃着的镁带伸入盛有二氧化碳的集气瓶中,镁带继续剧烈燃烧,反应的化学方程式为:2Mg+CO2 ===== 2MgO+C,下列叙述错误的是( )
A.该反应中镁发生了氧化反应
B.该反应中二氧化碳是还原剂
C.该反应属于置换反应
D.镁着火时不能用二氧化碳扑灭
B
点燃
【点拨】该反应中镁得到氧,做还原剂。
4.用一氧化碳在加热的条件下还原氧化铜,发现已制得的铜又很快变黑了,你推测产生这种现象的原因是( )
A.反应开始时,没有把试管内的空气排干净
B.温度太低
C.铜没有在一氧化碳气流中冷却,又被空气中氧气所氧化
D.试管口倾斜了
C
【点拨】用一氧化碳还原氧化铜的实验结束时,应先撤酒精灯,待试管冷却后再停止通一氧化碳,以免被还原出的铜又与空气中的氧气反应生成黑色的氧化铜,故C正确。
5.用氢气还原氧化铜实验应包括以下几个步骤,正确的操作顺序是( )
①加热盛有氧化铜粉末的试管 ②通入氢气
③撤去酒精灯 ④停止通入氢气
A.①②③④ B.②①④③
C.②①③④ D.①②④③
C
【点拨】用氢气还原氧化铜的步骤为:①通入氢气,排尽试管内原有空气;②加热氧化铜;③停止加热;④停止通氢气。第③④步不能颠倒,防止刚还原出的铜又被氧化。
6.某学习小组在做氢气还原氧化铜的实验时,在试管内加入氧化铜固体10 g,通入氢气一会儿后再给氧化铜加热,反应完全后撤去酒精灯并停止通入氢气,在空气中将试管冷却,发现部分红色固体又变回黑色。称得试管中剩余固体质量为8.32 g。
(1)“在空气中将试管冷却”会导致__________________,使“部分红色固体又变回黑色”。
生成的铜又被氧化
(2)按此实验操作及获得的数据,可知试管内剩余固体中有氧化铜________ g。
1.6
【点拨】(1)铜在较高温度时易被空气中的氧气氧化;
(2)根据题干提供的数据,固体质量减少了10 g-8.32 g=1.68 g,则被还原的氧化铜的质量为1.68 g÷16/80=8.4 g,故剩余的氧化铜的质量为10 g-8.4 g=1.6 g。
7.如图为某同学设计的氢气还原氧化铜的微型实验装置,微型滴管内装稀硫酸。
(1)实验时应先挤压微型滴管,还是先点燃微型酒精灯?_____________________。
(2)写出CuO发生变化的化学方程式_________________________。
先挤压微型滴管
CuO+H2=====Cu+H2O
△
8.某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )
A.c、b、a
B.c、d、a
C.c、b、d
D.b、c、a
A
【点拨】一氧化碳和氢气等体积混合后还原氧化铁,要想知道哪个还原氧化铁的量更多,我们要根据生成的二氧化碳和水的质量进一步求出。要知道生成二氧化碳和水的质量,我们要先用浓硫酸的质量变化测出生成水的质量,再用氢氧化钠溶液的质量变化测出生成二氧化碳的质量。
9.用锌、氧化铜、稀硫酸制取铜,有下列两种途径:
(1)Zn――→H2――→Cu
(2)CuO――→CuSO4――→Cu
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
A.消耗相同质量的氧化铜 B.消耗相同质量的锌
C.消耗相同质量的硫酸 D.生成硫酸锌的质量相同
A
稀硫酸
氧化铜
锌
稀硫酸
10.(图形信息题)A、B、X、Y是初中科学常见的四种气体,它们之间有如图所示的转化关系(反应条件已略去)。请写出:
(1)X、Y的化学式:X____________、Y ____________。
CO
H2
(2)CuO→B的化学方程式:________________________________________________________________________________。
C+ 2CuO ===== 2Cu + CO2↑(或CO+ CuO =====Cu + CO2 )
高温
△
【点拨】根据A、Y是气体,CuO+Y→H2O,推知Y为H2;依据A+Y(H2) →H2O,可推知A为O2。X、B也为气体,根据图中的转化关系,则可推得X、B分别为CO、CO2,且CO+O2→CO2(反应条件略)符合A+X→B。
11.如图是初中科学常见的一些氧化物和单质之间的相互转化关系。
其中单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,氧化物Ⅲ能使澄清石灰水变浑浊。则:
(1)反应①中________(填化学式)发生了还原反应。
(2)氧化物Ⅱ除图中所示的化学性质外,还具有______性,对人体有危害。
CuO
毒
(3)根据题意,写出反应④的化学方程式________________________________。
CO2+C=====2CO
高温
【点拨】单质Ⅰ为红色固体,则为铜,而氧化物Ⅰ和单质Ⅲ均为黑色固体,黑色固体单质应是碳,而黑色氧化物应为氧化铜;氧化物Ⅲ能使澄清石灰水变浑浊,则氧化物Ⅲ为二氧化碳。
12.(中考?成都)按图进行实验,有关说法及分析不正确的是( )
A.烘干的木炭粉末与CuO粉末需混合均匀
B.网罩的作用是集中火焰,提高温度
C.可观察到澄清石灰水变浑浊
D.产生的气体一定没有CO
D
13.实验室有一瓶纯净的氢气和一小段光亮的粗铜丝,某同学用坩埚钳夹住铜丝进行实验:将铜丝放在酒精灯上加热一段时间,然后迅速将热铜丝伸入盛有氢气的集气瓶中。请回答:
(1)铜丝加热时逐渐变黑,其原因是__________________
_____________________________。
铜丝在加热时与氧
气反应生成了黑色的氧化铜
(2)将变黑的热铜丝迅速伸入盛有氢气的集气瓶中,可观察到的现象是______________________;如果将变黑的热铜丝伸入盛有少量稀硫酸的试管中,发生反应的化学方程式为________________________________。
黑色的铜丝变成了红色
CuO+H2SO4===CuSO4+H2O
14.(中考?上海改编)甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验。
(1)B中反应的化学方程式是_________________________,该反应的还原剂是_________。
CO+CuO=====Cu+CO2
△
CO
(2)实验过程中,C中的现象是_____________________,D处放置点燃的酒精灯的目的是______________________
______________________________________________。
澄清石灰水变浑浊
点燃尾气,防止有毒
气体CO逸散到空气中污染环境
(3)对该实验的分析正确的是________(填编号)。
a.实验结束时应先熄灭B处酒精灯
b. C中增加的质量与B中固体减少的质量相等
c.反应开始后通入2.8 g一氧化碳可生成6.4 g铜
d.反应结束后继续通入一氧化碳的目的是防止铜被氧化
a、d
(4)甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是__________________________________________________________________________________________。
为了排尽装置中的空气,反应前已通入一段时间的CO
【点拨】(1)在CO+CuO=====Cu+CO2中,CO作还原剂,CuO作氧化剂。(2)气体经B后生成二氧化碳气体,所以C中澄清石灰水变浑浊,由于尾气中含有CO气体,会对空气造成污染,因此尾气应采用点燃等方法处理。(3)在此实验中为了防止生成的铜又被氧化,在反应结束后应先撤酒精灯,继续通CO一段时间,直至玻璃管冷却;
△
根据反应的方程式可知固体减少的是氧元素的质量,不等于生成的二氧化碳的质量,所以C中增加的质量大于B中固体减少的质量。(4)为了排尽装置中的空气,反应前已通入一段时间的CO,所以省略A可达到同样的目的。
15.某学生对过量炭粉与氧化铁反应产物中气体的成分进行了研究。
(1)假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:使一定量的氧化铁在隔绝氧气的条件下与过量的炭粉完全反应,测得参加反应的碳元素和氧元素的质量比。
(3)查阅资料:氮气不与炭粉、氧化铁反应,可用来隔绝氧气。
(4)实验:如图所示(已检查气密性)。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}操作步骤与实验现象
1.称取3.2 g氧化铁与2 g炭粉,混合均匀,放入质量为48.48 g的玻璃管中,按图所示装置连接仪器
2.加热前先通一段时间纯净的氮气
3.夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊
4.完全反应后冷却至室温,称得玻璃管和固体的总质量为52.24 g
(5)数据处理:参加反应的碳元素的质量为________g,氧元素的质量为________g。
(6)结论:根据对数据的处理结果得知,原假设________ (填“成立”或“不成立”),理由是__________________________________________________________________________________________。
0.48
0.96
不成立
生成物中碳元素与氧元素的质量比不等于二氧化碳中碳元素与氧元素的质量比
【点拨】反应前玻璃管和药品的总质量为3.2 g+2 g+48.48 g=53.68 g,反应后质量减少了53.68 g-52.24 g=1.44 g,说明炭粉有剩余,而氧化铁完全反应。生成物中氧元素的质量等于氧化铁中氧元素的质量,3.2 g×30%=0.96 g,所以参加反应的碳元素质量是1.44 g-0.96 g=0.48 g,根据质量守恒定律可知生成物中碳元素与氧元素的质量比为0.48 g:0.96 g=1:2,而二氧化碳中碳元素与氧元素的质量比为12: (16×2)=3:8≠1:2,所以气体产物不只有二氧化碳。
16.某学校课外活动小组用3 g含少量CO2的CO气体做CO还原CuO实验。实验装置如下图:
实验数据记录如下表:
假定每个反应都完全进行,试计算该实验参加反应的CO的质量分数。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验装置代号
A
B
D
实验前总质量(g)
100
100
100
实验后总质量(g)
100.5
100.5
102.2
解:A装置增加的质量为100.5 g-100 g=0.5 g,故混合气体中一氧化碳的质量为3 g-0.5 g=2.5 g,生成二氧化碳的质量为102.2 g-100 g=2.2 g,设参加反应的一氧化碳的质量为x
CuO+CO=====Cu+CO2
28 44
x 2.2 g
△
x=1.4 g
该实验参加反应的CO的质量分数为1.4 g/2.5 g ×100%=56%
答:略。
同课章节目录
- 第一章 宇宙的起源与演化
- 1 我们的宇宙
- 2 热大爆炸宇宙模型
- 3 恒星的一生
- 4 星际航行和空间技术
- 第二章 地球的演化和生物圈的形成
- 1 地球的演化
- 2 生命起源
- 3 生物进化
- 4 生态平衡
- 第三章 物质的转化和元素的循环
- 1 物质的转化
- 2 自然界中的碳循环和氧循环
- 3 自然界中的氮循环
- 第四章 健康与保健
- 1 健康、亚健康和疾病
- 2 运动与健康
- 3 免疫与健康
- 4 营养与健康
- 5 卫生与健康
- 6 环境与健康
- 第五章 生物的遗传和变异
- 1 生物的遗传
- 2 生物的变异
- 第六章 能源与社会
- 1 能源和能源的分类
- 2 太阳能的利用
- 3 核能的开发与放射性防护
- 4 新能源与可持续发展
- 第七章 科学与社会发展
- 1 科学就是力量
- 2 科学推动技术发展
- 3 科学技术推动经济增长
- 4 科学技术与可持续发展
