鲁教版九年级下册化学 7.4酸碱中和反应 课件(27张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 7.4酸碱中和反应 课件(27张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-30 09:52:31 | ||
图片预览






文档简介
课题4 酸和碱的中和反应
第七单元 常见的酸和碱
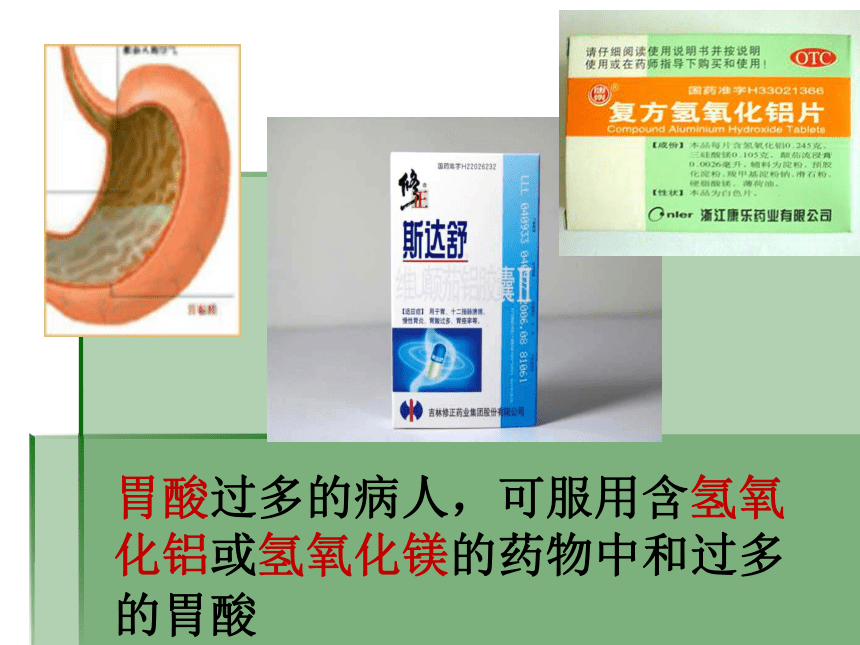
胃酸过多的病人,可服用含氢氧化铝或氢氧化镁的药物中和过多的胃酸
活动与探究
酸和碱混合在一起,会怎样呢?
会发生化学反应吗?
学习目标
通过实验,探究酸和碱之间能否发生反应
知道盐、中和反应的定义。
理解中和反应的实质,能够熟练书写方程式。
了解中和反应在实际中的应用。
用滴管向盛有盐酸的试管中滴加氢氧化钠溶液,观察现象。
提出问题:盐酸和氢氧化钠溶液发生了化学反应了吗?
猜想假设:你的猜想是什么?
设计实验:你怎样设计实验证明你的猜想?
讨论互动:哪种实验方案最简便易行?
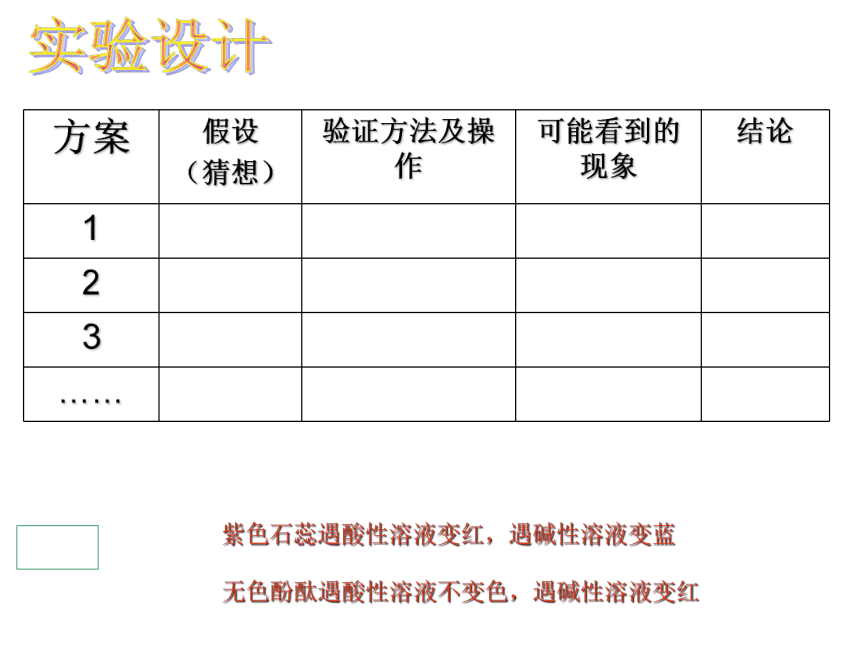
方案
假设
(猜想)
验证方法及操作
可能看到的现象
结论
1
2
3
……
紫色石蕊遇酸性溶液变红,遇碱性溶液变蓝
无色酚酞遇酸性溶液不变色,遇碱性溶液变红
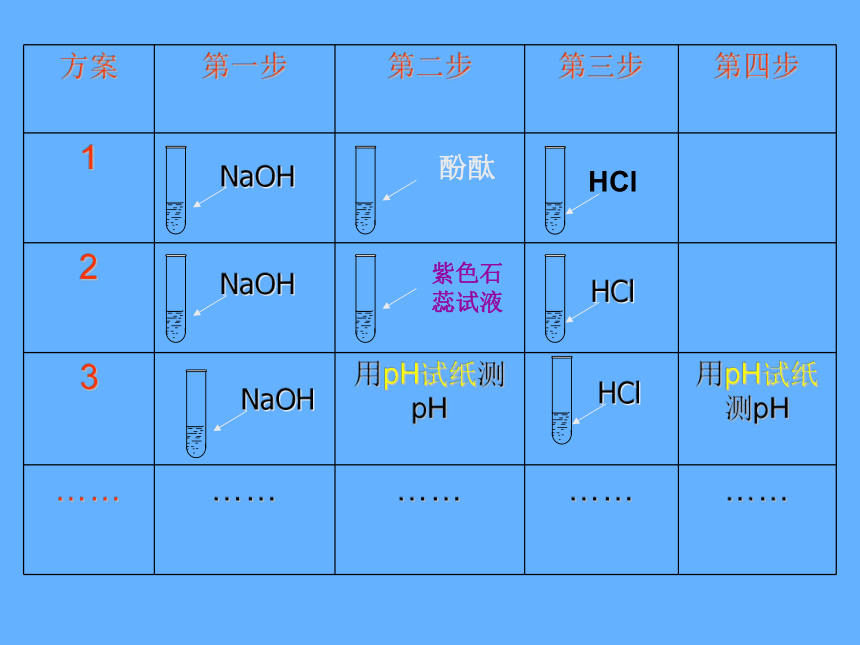
方案
第一步
第二步
第三步
第四步
1
2
3
用pH试纸测pH
用pH试纸测pH
……
……
……
……
……
HCl
酚酞
NaOH
HCl
紫色石蕊试液
NaOH
HCl
NaOH
实验一实验步骤:
1、向试管中滴加氢氧化钠溶液,继续滴加2滴酚酞试液震荡试管观察现象;
2、接着向试管中逐滴滴加稀盐酸观察现象
讨论问题
上述实验中你观察到酚酞试液颜色的变化说明了什么问题?
通过以上实验,我们证明了稀盐酸和氢氧化钠溶液的确发生了化学反应,那它们反应后的生成物是什么呢?化学方程式该如何书写?
HCl→H+ + Cl-
NaOH→ OH-+ Na+
HCl和NaOH在水中电离出离子
H2O
NaCl
NaOH + HCl == H2O + NaCl
化学方程式:
+1 -1
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2= CuSO4 + 2H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
酸与碱作用生成盐和水的反应,
叫做中和反应
中和反应的本质
H + OH = H2O
+
—
二、中和反应在实际中的应用
1.改良土壤的酸碱性
加入酸 性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
1.改变土壤的酸碱性
植物需要在一定酸碱性的土壤中生长,
但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,
应怎样去改变酸性土壤?
能用生石灰代替熟石灰吗?为什么?
用熟石灰中和。
当然可以。
因为 CaO + H2O === Ca(OH)2
⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
答:是酸雨或化肥。
⑵ 导致土壤显酸性的主要原因是什么?
讨论:
2.中和硫酸工厂废水
2. 处理工厂的废水
⑴ 如何处理硫酸厂生产中形成的含硫酸的污水?
⑵ 请写出有关反应的化学方程式:
H2
Ca
SO4
(OH)2
2 H2O
⑶用CaO来中和污水行不行?
H2SO4+?Ca(OH)2?=?CaSO4?+?2 H2O
H2SO4+?Ca(OH)2?=?CaSO4?+?2 H2O
CaO?+?H2O?=Ca(OH)2
3. 用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
蜜蜂与马蜂
蜜蜂
被蜜蜂这蛰后,用肥皂水或氨水清洗
马蜂
被马蜂蛰后,用食醋止痛止痒
被同样属于蜂的两种蜂蜇,为什么一种用碱液处理,一种用酸液处理?
蜜蜂毒液显酸性,马蜂毒液显碱性。
氨水是一种弱碱 ,肥皂水也是显碱性的 ;食醋是一种酸溶液。
原因:
肥皂水或氨水与蜜蜂的酸性毒液发生中和反应,食醋与马蜂的碱性毒液发生中和反应。
吃碱面时,放点醋,味道会更美。
中和反应在实际中有哪些应用?
其他应用
(1)醋去除热水瓶水垢
(2)厨房清洁剂(显碱性)去油污
(3)肥皂清洗衣服油渍
(4)用醋降低或除去皮蛋涩味等
名称
氢氧化钠
硫酸
氧化铁
化学式
CuSO4
类别
1.下列物质属于盐的是( )
A CuO B Cu(OH)2 C CuSO4 D HCl
2.填写下表(类别按酸、碱、盐、氧化物填写)
C
NaOH
碱
硫酸铜
盐
H2SO4
酸
Fe2O3
氧化物
学以致用
1.下列反应,属于中和反应的是( )
A Zn +2HCl == ZnCl2 + H2
B CuO + 2HCl == CuCl2 + H2O
C Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D AgNO3 + HCl == AgCl + HNO3
学以致用
C
复习巩固:1.用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。
2.如果将实验室残留的盐酸直接倒入下水道,会造成什么危害?应如何处理废盐酸?
Mg(OH)2+2HCl=MgCl2+2H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。
下水道若为金属管道,盐酸会使其腐蚀;并污染水。应将废盐酸倒入废液缸统一处理。
本节收获
1、酸和碱能发生中和反应,生成盐和水。
酸 + 碱 → 盐 + 水
2.盐:由金属离子和酸根离子组成的化合物
3.中和反应的实质 H++OH- H2O
4.酸碱中和反应在生活和生产中有广泛的应用。
第七单元 常见的酸和碱
胃酸过多的病人,可服用含氢氧化铝或氢氧化镁的药物中和过多的胃酸
活动与探究
酸和碱混合在一起,会怎样呢?
会发生化学反应吗?
学习目标
通过实验,探究酸和碱之间能否发生反应
知道盐、中和反应的定义。
理解中和反应的实质,能够熟练书写方程式。
了解中和反应在实际中的应用。
用滴管向盛有盐酸的试管中滴加氢氧化钠溶液,观察现象。
提出问题:盐酸和氢氧化钠溶液发生了化学反应了吗?
猜想假设:你的猜想是什么?
设计实验:你怎样设计实验证明你的猜想?
讨论互动:哪种实验方案最简便易行?
方案
假设
(猜想)
验证方法及操作
可能看到的现象
结论
1
2
3
……
紫色石蕊遇酸性溶液变红,遇碱性溶液变蓝
无色酚酞遇酸性溶液不变色,遇碱性溶液变红
方案
第一步
第二步
第三步
第四步
1
2
3
用pH试纸测pH
用pH试纸测pH
……
……
……
……
……
HCl
酚酞
NaOH
HCl
紫色石蕊试液
NaOH
HCl
NaOH
实验一实验步骤:
1、向试管中滴加氢氧化钠溶液,继续滴加2滴酚酞试液震荡试管观察现象;
2、接着向试管中逐滴滴加稀盐酸观察现象
讨论问题
上述实验中你观察到酚酞试液颜色的变化说明了什么问题?
通过以上实验,我们证明了稀盐酸和氢氧化钠溶液的确发生了化学反应,那它们反应后的生成物是什么呢?化学方程式该如何书写?
HCl→H+ + Cl-
NaOH→ OH-+ Na+
HCl和NaOH在水中电离出离子
H2O
NaCl
NaOH + HCl == H2O + NaCl
化学方程式:
+1 -1
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2= CuSO4 + 2H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
酸与碱作用生成盐和水的反应,
叫做中和反应
中和反应的本质
H + OH = H2O
+
—
二、中和反应在实际中的应用
1.改良土壤的酸碱性
加入酸 性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
1.改变土壤的酸碱性
植物需要在一定酸碱性的土壤中生长,
但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,
应怎样去改变酸性土壤?
能用生石灰代替熟石灰吗?为什么?
用熟石灰中和。
当然可以。
因为 CaO + H2O === Ca(OH)2
⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
答:是酸雨或化肥。
⑵ 导致土壤显酸性的主要原因是什么?
讨论:
2.中和硫酸工厂废水
2. 处理工厂的废水
⑴ 如何处理硫酸厂生产中形成的含硫酸的污水?
⑵ 请写出有关反应的化学方程式:
H2
Ca
SO4
(OH)2
2 H2O
⑶用CaO来中和污水行不行?
H2SO4+?Ca(OH)2?=?CaSO4?+?2 H2O
H2SO4+?Ca(OH)2?=?CaSO4?+?2 H2O
CaO?+?H2O?=Ca(OH)2
3. 用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
蜜蜂与马蜂
蜜蜂
被蜜蜂这蛰后,用肥皂水或氨水清洗
马蜂
被马蜂蛰后,用食醋止痛止痒
被同样属于蜂的两种蜂蜇,为什么一种用碱液处理,一种用酸液处理?
蜜蜂毒液显酸性,马蜂毒液显碱性。
氨水是一种弱碱 ,肥皂水也是显碱性的 ;食醋是一种酸溶液。
原因:
肥皂水或氨水与蜜蜂的酸性毒液发生中和反应,食醋与马蜂的碱性毒液发生中和反应。
吃碱面时,放点醋,味道会更美。
中和反应在实际中有哪些应用?
其他应用
(1)醋去除热水瓶水垢
(2)厨房清洁剂(显碱性)去油污
(3)肥皂清洗衣服油渍
(4)用醋降低或除去皮蛋涩味等
名称
氢氧化钠
硫酸
氧化铁
化学式
CuSO4
类别
1.下列物质属于盐的是( )
A CuO B Cu(OH)2 C CuSO4 D HCl
2.填写下表(类别按酸、碱、盐、氧化物填写)
C
NaOH
碱
硫酸铜
盐
H2SO4
酸
Fe2O3
氧化物
学以致用
1.下列反应,属于中和反应的是( )
A Zn +2HCl == ZnCl2 + H2
B CuO + 2HCl == CuCl2 + H2O
C Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D AgNO3 + HCl == AgCl + HNO3
学以致用
C
复习巩固:1.用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。
2.如果将实验室残留的盐酸直接倒入下水道,会造成什么危害?应如何处理废盐酸?
Mg(OH)2+2HCl=MgCl2+2H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。
下水道若为金属管道,盐酸会使其腐蚀;并污染水。应将废盐酸倒入废液缸统一处理。
本节收获
1、酸和碱能发生中和反应,生成盐和水。
酸 + 碱 → 盐 + 水
2.盐:由金属离子和酸根离子组成的化合物
3.中和反应的实质 H++OH- H2O
4.酸碱中和反应在生活和生产中有广泛的应用。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
