高中化学鲁科版(2019)选择性必修2 第1章第1节 原子结构模型 同步练习(含解析)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修2 第1章第1节 原子结构模型 同步练习(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-30 14:58:14 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
高中化学鲁科版(2019)选择性必修2 第1章第1节 原子结构模型
一、单选题
1.下列不同时期原子结构模型的提出时间排列正确的是(?? )
①电子分层排布模型?? ②“葡萄干布丁”模型?? ③量子力学模型?? ④道尔顿原子学说?? ⑤核式模型
A.?①③②⑤④????????????????????????B.?④②③①⑤?????????????????????C.?④②⑤①③????????????????????????D.?④⑤②①③
2.自从1803年英国_??????????????????_学家道尔顿提出原子假说以来,人类对原子结构的研究不断深入、不断发展,通过实验事实不断地丰富、完善原子结构理论。请判断下列关于原子结构的说法正确的是( ??)
A.?所有的原子都含有质子、_??????????????????_种基本构成微粒
B.?所有的原子中的质子、中子和电子三种基本构成微粒的个数都是相等的
C.?原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引
D.?原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更小的微粒
3.下列能级符号表示错误的是( ??)
A.?2p?????????????????????????????????????????B.?3f?????????????????????????????????????????C.?4s?????????????????????????????????????????D.?5d
4.下列图像中所发生的现象与电子的跃迁无关的是(?? )
A.?燃放烟花 ???????????????????????????B.?霓虹灯广告
C.?燃烧蜡烛 ???????????????????????????????D.?平面镜成像
5.有关磷原子最外层电子的描述正确的是( ??)
A.?有2种不同运动状态????????B.?有5种不同能量????????C.?有4种不同的伸展方向????????D.?只有1种自旋方向
6.在对电子运动状态的描述中,确定一个“轨道”应选择以下四项中的(?? )
①能层②能级③电子云的伸展方向④电子的自旋状态
A.?①②③④??????????????????????????????????B.?①②③??????????????????????????????????C.?①②??????????????????????????????????D.?①
7.下列原子的电子跃迁能释放光能形成发射光谱的是(?? )
A.?1s22s22p63s2→1s22s22p63p2???????????????????????????B.?1s22s22p33s1→1s22s22p4
C.?1s22s2→1s22s12p1????????????????????????????????????????????D.?1s22s22p1x →1s22s22p1 y21教育网
8.下列说法中正确的是(?? )
A.?处于最低能_é?????????????????_基态原子
B.?3p2表示3p能级有两个轨道
C.?同一原子中,1s、2s、3s电子的能量逐渐减小
D.?同一原子中,2p、3p、4p能级的轨道数依次增多21·cn·jy·com
9.第N能层所含能级数、原子轨道数和最多容纳电子数分别为(?? )
A.?3、9、18????????????????????????B.?4、12、24????????????????????????C.?5、16、32????????????????????????D.?4、16、32
10.构造原理揭示的_????????????è????§_顺序,实质是各能级能量高低顺序,若以E表示某能级的能量,下列能量大小顺序中正确的是 (???? ) 2·1·c·n·j·y
A.?E(3s)>E(3p)>E(3d)??????????????????????????????????????????B.?E(3s)>E(2s)>E(1s)
C.?E(4f)>E(4s)>E(3d)???????????????????????????????????????????D.?E(5s)>E(4s)>E(4f)21·世纪*教育网
二、填空题
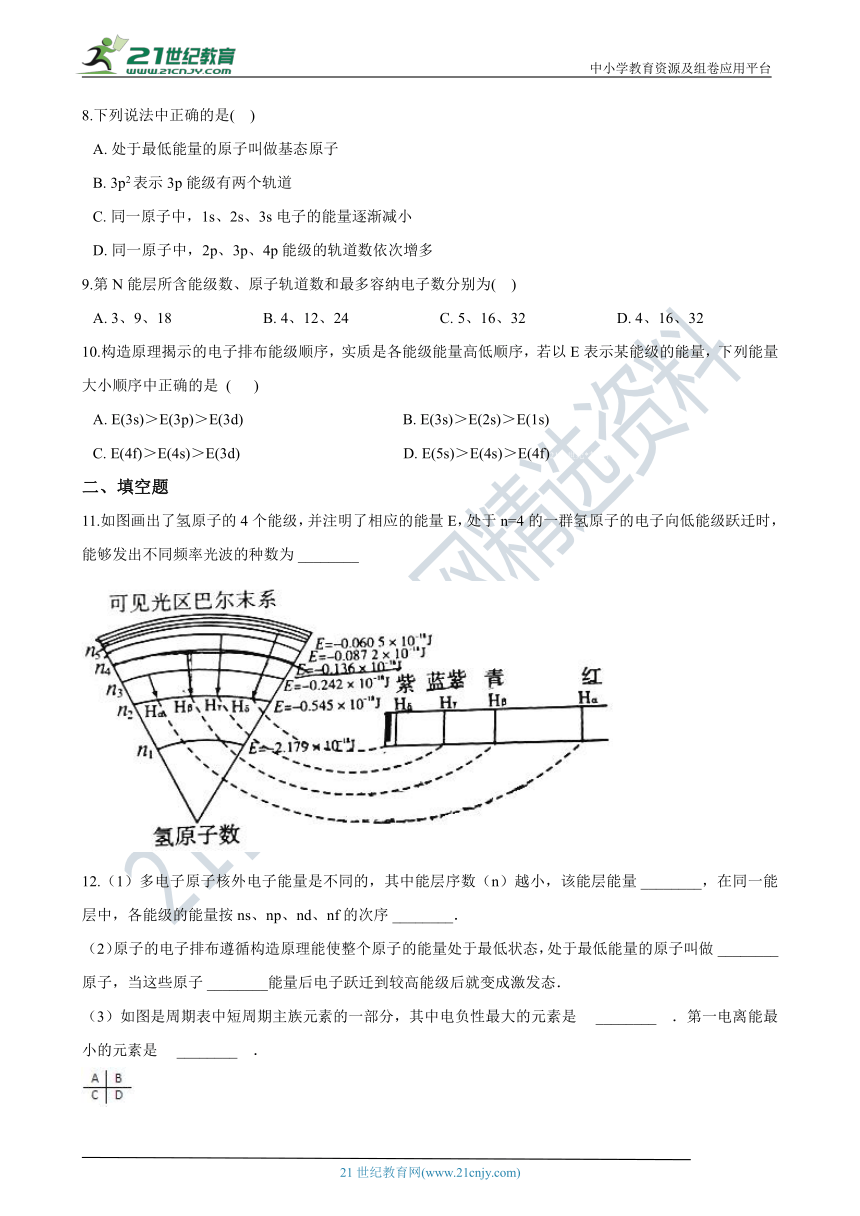
11.如图画出了氢原子的4个能级,并注明了相应的能量E,处于n=4的一群氢原子的电子向低能级跃迁时,能够发出不同频率光波的种数为?________
2-1-c-n-j-y
12.(1)多电子原子核外电子能量是不同的,其中能层序数(n)越小,该能层能量?________,在同一能层中,各能级的能量按ns、np、nd、nf的次序?________.
(2)原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做?________原子,当这些原子?________能量后电子跃迁到较高能级后就变成激发态.
(3)如图是周期表中短周期主族元素的一部分,其中电负性最大的元素是 ?________ .第一电离能最小的元素是 ?________ .
? www.21-cn-jy.com
三、综合题
13.写出符合下列要求的符号。
(1)第二电子层 s能级________。
(2)n=3? p能级________。
(3)第五电子层? d能级________。
(4)n=4? p能级________。
(5)铜氨络离子的结构式________。
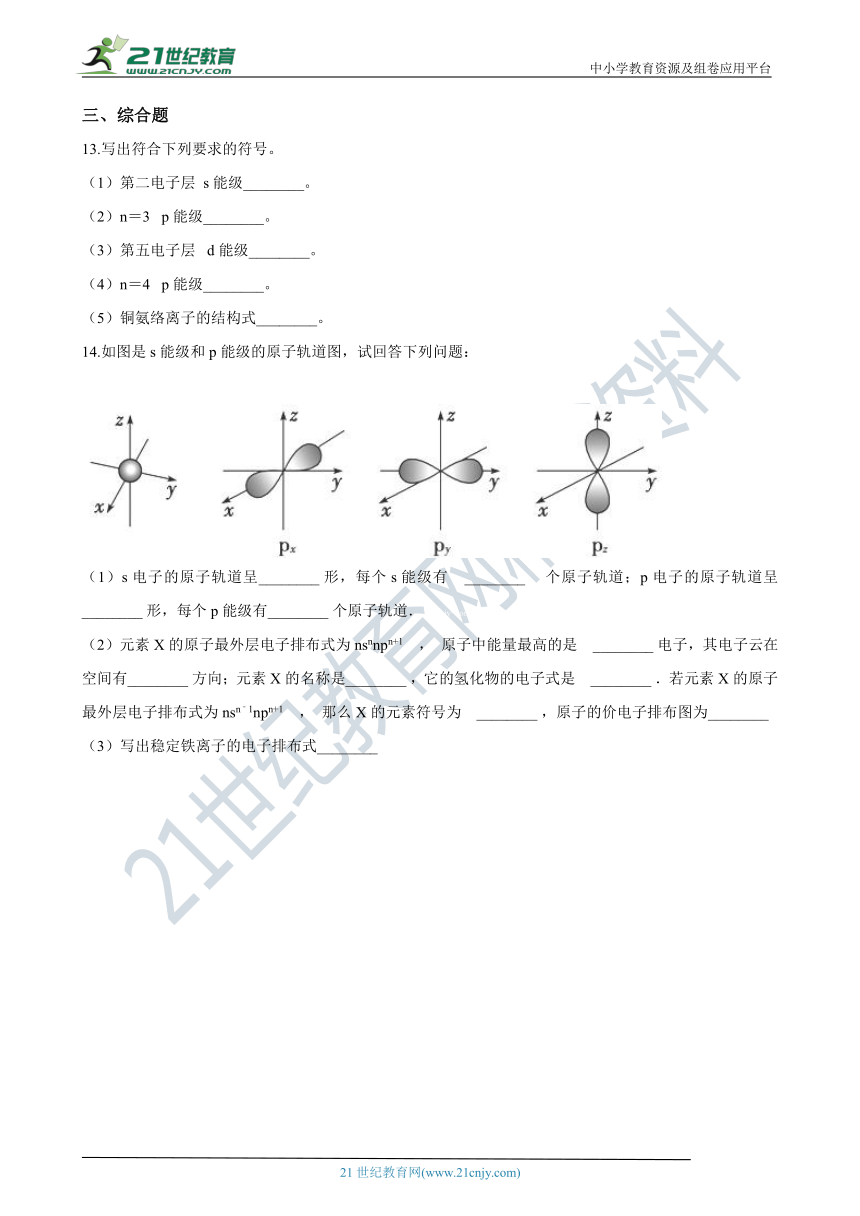
14.如图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈________?形,每个s能级有 ________? 个原子轨道;p电子的原子轨道呈________?形,每个p能级有________?个原子轨道.21*cnjy*com
(2)元素X的_??????????¤??±????_子排布式为nsnnpn+1 , 原子中能量最高的是 ________?电子,其电子云在空间有________?方向;元素X的名称是________?,它的氢化物的电子式是 ________?.若元素X的原子最外层电子排布式为nsn﹣1npn+1 , 那么X的元素符号为 ________?,原子的价电子排布图为________?
(3)写出稳定铁离子的电子排布式________?
答案解析部分
一、单选题
1. C
【解析】①电子分层_???????¨??????±???_尔1913年提出;②“葡萄干布丁”模型由汤姆逊1903年提出;③量子力学模型于1926年提出;④道尔顿原子学说于1803年提出;⑤核式模型由卢瑟福于1911年提出,
故答案为:C。
解决本题的关键在于熟练掌握原子结构模型的发展时期,需要一定的记忆。
2. C
【解析】A.普通H没有中子,多数原子都含有质子、中子和电子三种基本构成微粒,故A不符合题意;
B.原子中质子数等于电子数,但中子数不确定,所以不是都相等,故B不符合题意;
C.质子带正电,电子带负电,则原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引,故C符合题意;【版权所有:21教育】
D.随科学的发展,可认识到微粒可以再分成更小的微粒,故D不符合题意;
故答案为:C。
本题考查原子_??????????????¨???_普通H的构成及微粒的电性即可解答,选项D为解答的易错点,明确人类对原子结构的研究不断深入、不断发展即可解答,需要注意的是,并不是所有原子都含有中子,如11H中就只含一个质子和一个电子而没有中子,多数原子的中子数和质子数比较接近但并没有必然的数量关系。21
3. B
【解析】A.第二能层含有2个能级,分别是2s、2p能级,含有2p能级, A不符合题意;
B.第三能层含有3个能级,分别是3s、3p、3d能级,不含3f能级,B符合题意;
C.第四能层含有4个能级,分别是4s、4p、4d、4f能级,含有4s能级,C不符合题意;
D.第五能层含有5个能级,分别是5s、5p、5d、5f、5g能级,含有5d能级,D不符合题意;
故答案为:B。
能层含有的能_??§??°??????è???±?_序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,据此即可解答。21*cnjy*com
4. D
【解析】平面镜_??????????????????_射的结果,与电子跃迁无关,霓虹灯广告、燃烧蜡烛、节日里燃放的焰火是原子的发射光谱,与原子核外电子发生跃迁有关,D符合题意; 【来源:21·世纪·教育·网】
故答案为:D
平面镜成像是利用光的反射原理形成的,与原子核外电子的跃迁无关。
5. C
【解析】A.处_?????????è????§???_的电子具有的能量不同,同一能级上的电子自旋方向相反,磷原子最外层电子构型为3s23p3 , 则最外层电子有5种不同的运动状态,故A不符合题意;
B.处于不同能级上的电子具有的能_é?????????????????_能级上的电子的能量相同,磷原子最外层电子构型为3s23p3 , 则最外层电子有2种不同能量,故B不符合题意;
C.s轨道是球形的,在_???é??????±???????_为1,p轨道是纺锤形,在空间的伸展方向为3,磷原子最外层电子构型为3s23p3 , 则最外层电子有4种不同的伸展方向,故C符合题意;
D.电子排布在同_???è?¨é???????????_自旋方向相反,电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,磷原子最外层电子构型为3s23p3 , 则最外层电子有2种自旋方向,故D不符合题意;
故答案为:C。
电子排布在同_???è?¨é???????????_自旋方向相反,电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同是解答关键,也是易错点。
6. B
【解析】在对电_???è????¨?????????_描述中,确定一个“轨道”的方面包括:①能层,即电子层;?②能级,即电子亚层;??③电子云的伸展方向,①②③三个方面对电子运动状态确定一个“轨道”,④电子的自旋状态,与电子运动轨道无关,描述的是电子自旋的方向,
故答案为B。
决定核外_??????è????¨??????_的四个量:①主量子数(n)-描述各电子层能量的高低和离核的远近;②副(角)量子数(l)-描述同一电子层内还存在着能量差别很小的若干个亚层;③磁量子数(m)-用来描述原子轨道或电子云在空间的伸展方向;④自旋量子数(ms):描述电子自旋的方向,与电子运动轨道无关。
7. B
【解析】A.原子中的电子从能量较高的轨道(激发态)跃迁到能量较低的轨道(基态或者低能态),多余的能量以光的形式出现,即形成发射光谱, 3s2→3p2 ,吸收能量,形成吸收光谱,A选项不符合题意;
B.在1s22s22p33s1→1s22s22p4中,3s1→2p4从高能态到低能态,释放能量,形成发射光谱,B选项符合题意;
C.从2s2→2p1 吸收能量,形成吸收光谱,C选项不符合题意;
D.2p →2p ,2Px与2Py空间伸展方向不同,轨道的能量相同, D选项不符合题意;
故答案为:B。
原子的电子跃迁能释放光能形成发射光谱需要的是电子由较高能级向较低能级跃迁,据此判断即可。21
8. A
【解析】A.处于最低能量的原子叫做基态原子,故A符合题意;
B. 3p2表示3p能级容纳2个电子,p能级有3个原子轨道,故B不符合题意;
C.能级符号相同,能层越大,电子能量越高,所以1s、2s、3s电子的能量逐渐增大,故C不符合题意;
D.同一原子中,2p、3p、4p能级的轨道数相等,都为3,故D不符合题意,
故答案为:A。
A、_??????????????????_的特征分析;
B、P能级有3个轨道,据此分析;
C、根据能级与电子能量的关系分析;
D、同一能级的轨道数相同。21cnjy.com
9. D
【解析】第_Nè????§??????4_层,含有的轨道能级分别为s、p、d、f 的顺序依次为1、3、5、7,共有16个轨道,每一个轨道可容纳2个电子,可以最多容纳32个电子,D符合题意;
故答案为:D
第N能级上含有4个能级、16个原子轨道和32个电子。
10. B
【解析】各能级_è??é??é?????é?????_为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s 2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f…。A、由以上分析可知相同能层不同能级的电子能量E(3d)>E(3p)>E(3s),故A不符合题意;
B、不同能层相同能级的电子能量E(3s)>E(2s)>E(1s),故B符合题意;
C、由以上分析可知E(4f)>E(3d)>E(4s),故C不符合题意;
D、应为E(4f)>E(5s)>E(4s),故D不符合题意,
故答案为:B。
_è????§è??é???¤§_小可以用n+0.7l进行计算比较,其中n表示能层(n=1,2,3,4,5,6,7),s表示能级(s=0,1,2,3,4......)www-2-1-cnjy-com
二、填空题
11.6
【解析】处于n=4的一群氢原子的电子向低能级跃迁时,发射光子能量是不连续的,光子能量为2个能级之差,4个能级进行组合共有C42种不同频率的光子,即有=6种能够发出不同频率光波,
故答案为:6.
处于n=4的一群氢原子的电子向低能级跃迁时,发射光子能量是不连续的,光子能量为2个能级之差,4个能级进行组合共有C42种不同频率的光子.
12.越低;递增;基态;吸收;B;C或D
【解析】(_1???è???±??????°_(n)越小,电子离核越近,能量越低,在同一能层中,各能级的能量按ns、np、nd、nf的次序递增,故答案为:越低;递增;
(2)处于最低能量的原子叫做基态原子,激发态能量较高,基态电子跃迁到激发态,需要吸收能量,故答案为:基态;吸收;
(3)同周期:从左到右,元素的电负性逐渐增大.同主族:从上到下,元素的电负性逐渐减小则B的电负性最大,第一电离能的变化与元素原子的核外电子排布有关,通常情况下,当原子核外的电子排布的能量相等的轨道上形成全空,半满,全满的结构时,原子的能量较低,原子较稳定,则该原子比较难失去电子,故第一电离能较大,N的第一电离能大于O,由于元素的种类没有确定,则第一电离能最小的元素可能为C或D,
故答案为:B;C或D.
(1)能层序数(n)越小,电子离核越近,能量越低;
(2)处于最低能量的原子叫做基态原子,吸收能量可达到激发态;
(3)根据电负性第一电离能在周期表中的变化进行判断,注意第一电离能的反常现象.
三、综合题
13. (1)2s
(2)3p
(3)5d
(4)4p
(5)
【解析】_(1)???_二能层,含有2个能级,分别是2s、2p能级,s能级符号为2s,故答案为2s;(2) n=3,说明电子处于第三能层,含有3个能级,分别是3s、3p、3d能级,p能级表示为3p,故答案为3p;(3)第五能层,含有5个能级,d能级为5d,故答案为5d;(4) n=4,说明电子处于第四能层,含有4个能级,分别是4s、4p、4
D、4f能级,p能级可表示为4p,故答案为4p;(5) 铜氨络离子中,[Cu(NH3)4]2+为配合物,Cu2+为中心离子,电荷数为+2,NH3为配体,N原子是配位原子,配位数为4,其结构式为 。
能层_?????????è????§??°_等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,s电子的原子轨道呈球形;p电子的原子轨道呈哑铃形,据此即可解答。
14. (1)球;1;纺锤;3
(2)2p;三个互相垂直的伸展;氮;;S;
(3)1s2 2s2 2p6 3s23p63d5
【解析】_???1??????_据图片,s电子的原子轨道呈球形,含有1个原子轨道;p电子的原子轨道呈纺锤形,每个p能级有3个原子轨道,且这三个轨道相互垂直,
故答案为:球,1;纺锤,3;
(2)因为元素X的原子最外层电子排布式为nsnnn+1 , np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3 , 是氮元素,原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向,氢化物的电子式是;当元素X的原子最外层电子排布式为nsn﹣1npn+1时,有n﹣1=2,则n=3,则X元素的原子核外电子排布式为1s22s22p63s23p4 , 是硫元素,原子的电子排布图为【出处:21教育名师】
;故答案为:2p; 三个互相垂直的伸展; 氮; ;S;?;
(3)写出稳定铁离子的_??????????????????_1s2 2s2 2p6 3s23p63d5 , 故答案为:1s2 2s2 2p6 3s23p63d5 .
(1)根据图片中轨道的形状进行分析解答,注意p能级有3个轨道;
(2)元素X的原子最外_?±????????????????_为nsnnpn+1 , s能级最多排2个电子,该元素排列了p能级,说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3 , 则该元素是N元素;
(3)写出稳定铁离子的电子排布式为1s2 2s2 2p6 3s23p63d5;
_21?????????è?????(www.21cnjy.com)_
高中化学鲁科版(2019)选择性必修2 第1章第1节 原子结构模型
一、单选题
1.下列不同时期原子结构模型的提出时间排列正确的是(?? )
①电子分层排布模型?? ②“葡萄干布丁”模型?? ③量子力学模型?? ④道尔顿原子学说?? ⑤核式模型
A.?①③②⑤④????????????????????????B.?④②③①⑤?????????????????????C.?④②⑤①③????????????????????????D.?④⑤②①③
2.自从1803年英国_??????????????????_学家道尔顿提出原子假说以来,人类对原子结构的研究不断深入、不断发展,通过实验事实不断地丰富、完善原子结构理论。请判断下列关于原子结构的说法正确的是( ??)
A.?所有的原子都含有质子、_??????????????????_种基本构成微粒
B.?所有的原子中的质子、中子和电子三种基本构成微粒的个数都是相等的
C.?原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引
D.?原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更小的微粒
3.下列能级符号表示错误的是( ??)
A.?2p?????????????????????????????????????????B.?3f?????????????????????????????????????????C.?4s?????????????????????????????????????????D.?5d
4.下列图像中所发生的现象与电子的跃迁无关的是(?? )
A.?燃放烟花 ???????????????????????????B.?霓虹灯广告
C.?燃烧蜡烛 ???????????????????????????????D.?平面镜成像
5.有关磷原子最外层电子的描述正确的是( ??)
A.?有2种不同运动状态????????B.?有5种不同能量????????C.?有4种不同的伸展方向????????D.?只有1种自旋方向
6.在对电子运动状态的描述中,确定一个“轨道”应选择以下四项中的(?? )
①能层②能级③电子云的伸展方向④电子的自旋状态
A.?①②③④??????????????????????????????????B.?①②③??????????????????????????????????C.?①②??????????????????????????????????D.?①
7.下列原子的电子跃迁能释放光能形成发射光谱的是(?? )
A.?1s22s22p63s2→1s22s22p63p2???????????????????????????B.?1s22s22p33s1→1s22s22p4
C.?1s22s2→1s22s12p1????????????????????????????????????????????D.?1s22s22p1x →1s22s22p1 y21教育网
8.下列说法中正确的是(?? )
A.?处于最低能_é?????????????????_基态原子
B.?3p2表示3p能级有两个轨道
C.?同一原子中,1s、2s、3s电子的能量逐渐减小
D.?同一原子中,2p、3p、4p能级的轨道数依次增多21·cn·jy·com
9.第N能层所含能级数、原子轨道数和最多容纳电子数分别为(?? )
A.?3、9、18????????????????????????B.?4、12、24????????????????????????C.?5、16、32????????????????????????D.?4、16、32
10.构造原理揭示的_????????????è????§_顺序,实质是各能级能量高低顺序,若以E表示某能级的能量,下列能量大小顺序中正确的是 (???? ) 2·1·c·n·j·y
A.?E(3s)>E(3p)>E(3d)??????????????????????????????????????????B.?E(3s)>E(2s)>E(1s)
C.?E(4f)>E(4s)>E(3d)???????????????????????????????????????????D.?E(5s)>E(4s)>E(4f)21·世纪*教育网
二、填空题
11.如图画出了氢原子的4个能级,并注明了相应的能量E,处于n=4的一群氢原子的电子向低能级跃迁时,能够发出不同频率光波的种数为?________
2-1-c-n-j-y
12.(1)多电子原子核外电子能量是不同的,其中能层序数(n)越小,该能层能量?________,在同一能层中,各能级的能量按ns、np、nd、nf的次序?________.
(2)原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做?________原子,当这些原子?________能量后电子跃迁到较高能级后就变成激发态.
(3)如图是周期表中短周期主族元素的一部分,其中电负性最大的元素是 ?________ .第一电离能最小的元素是 ?________ .
? www.21-cn-jy.com
三、综合题
13.写出符合下列要求的符号。
(1)第二电子层 s能级________。
(2)n=3? p能级________。
(3)第五电子层? d能级________。
(4)n=4? p能级________。
(5)铜氨络离子的结构式________。
14.如图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈________?形,每个s能级有 ________? 个原子轨道;p电子的原子轨道呈________?形,每个p能级有________?个原子轨道.21*cnjy*com
(2)元素X的_??????????¤??±????_子排布式为nsnnpn+1 , 原子中能量最高的是 ________?电子,其电子云在空间有________?方向;元素X的名称是________?,它的氢化物的电子式是 ________?.若元素X的原子最外层电子排布式为nsn﹣1npn+1 , 那么X的元素符号为 ________?,原子的价电子排布图为________?
(3)写出稳定铁离子的电子排布式________?
答案解析部分
一、单选题
1. C
【解析】①电子分层_???????¨??????±???_尔1913年提出;②“葡萄干布丁”模型由汤姆逊1903年提出;③量子力学模型于1926年提出;④道尔顿原子学说于1803年提出;⑤核式模型由卢瑟福于1911年提出,
故答案为:C。
解决本题的关键在于熟练掌握原子结构模型的发展时期,需要一定的记忆。
2. C
【解析】A.普通H没有中子,多数原子都含有质子、中子和电子三种基本构成微粒,故A不符合题意;
B.原子中质子数等于电子数,但中子数不确定,所以不是都相等,故B不符合题意;
C.质子带正电,电子带负电,则原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引,故C符合题意;【版权所有:21教育】
D.随科学的发展,可认识到微粒可以再分成更小的微粒,故D不符合题意;
故答案为:C。
本题考查原子_??????????????¨???_普通H的构成及微粒的电性即可解答,选项D为解答的易错点,明确人类对原子结构的研究不断深入、不断发展即可解答,需要注意的是,并不是所有原子都含有中子,如11H中就只含一个质子和一个电子而没有中子,多数原子的中子数和质子数比较接近但并没有必然的数量关系。21
3. B
【解析】A.第二能层含有2个能级,分别是2s、2p能级,含有2p能级, A不符合题意;
B.第三能层含有3个能级,分别是3s、3p、3d能级,不含3f能级,B符合题意;
C.第四能层含有4个能级,分别是4s、4p、4d、4f能级,含有4s能级,C不符合题意;
D.第五能层含有5个能级,分别是5s、5p、5d、5f、5g能级,含有5d能级,D不符合题意;
故答案为:B。
能层含有的能_??§??°??????è???±?_序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,据此即可解答。21*cnjy*com
4. D
【解析】平面镜_??????????????????_射的结果,与电子跃迁无关,霓虹灯广告、燃烧蜡烛、节日里燃放的焰火是原子的发射光谱,与原子核外电子发生跃迁有关,D符合题意; 【来源:21·世纪·教育·网】
故答案为:D
平面镜成像是利用光的反射原理形成的,与原子核外电子的跃迁无关。
5. C
【解析】A.处_?????????è????§???_的电子具有的能量不同,同一能级上的电子自旋方向相反,磷原子最外层电子构型为3s23p3 , 则最外层电子有5种不同的运动状态,故A不符合题意;
B.处于不同能级上的电子具有的能_é?????????????????_能级上的电子的能量相同,磷原子最外层电子构型为3s23p3 , 则最外层电子有2种不同能量,故B不符合题意;
C.s轨道是球形的,在_???é??????±???????_为1,p轨道是纺锤形,在空间的伸展方向为3,磷原子最外层电子构型为3s23p3 , 则最外层电子有4种不同的伸展方向,故C符合题意;
D.电子排布在同_???è?¨é???????????_自旋方向相反,电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,磷原子最外层电子构型为3s23p3 , 则最外层电子有2种自旋方向,故D不符合题意;
故答案为:C。
电子排布在同_???è?¨é???????????_自旋方向相反,电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同是解答关键,也是易错点。
6. B
【解析】在对电_???è????¨?????????_描述中,确定一个“轨道”的方面包括:①能层,即电子层;?②能级,即电子亚层;??③电子云的伸展方向,①②③三个方面对电子运动状态确定一个“轨道”,④电子的自旋状态,与电子运动轨道无关,描述的是电子自旋的方向,
故答案为B。
决定核外_??????è????¨??????_的四个量:①主量子数(n)-描述各电子层能量的高低和离核的远近;②副(角)量子数(l)-描述同一电子层内还存在着能量差别很小的若干个亚层;③磁量子数(m)-用来描述原子轨道或电子云在空间的伸展方向;④自旋量子数(ms):描述电子自旋的方向,与电子运动轨道无关。
7. B
【解析】A.原子中的电子从能量较高的轨道(激发态)跃迁到能量较低的轨道(基态或者低能态),多余的能量以光的形式出现,即形成发射光谱, 3s2→3p2 ,吸收能量,形成吸收光谱,A选项不符合题意;
B.在1s22s22p33s1→1s22s22p4中,3s1→2p4从高能态到低能态,释放能量,形成发射光谱,B选项符合题意;
C.从2s2→2p1 吸收能量,形成吸收光谱,C选项不符合题意;
D.2p →2p ,2Px与2Py空间伸展方向不同,轨道的能量相同, D选项不符合题意;
故答案为:B。
原子的电子跃迁能释放光能形成发射光谱需要的是电子由较高能级向较低能级跃迁,据此判断即可。21
8. A
【解析】A.处于最低能量的原子叫做基态原子,故A符合题意;
B. 3p2表示3p能级容纳2个电子,p能级有3个原子轨道,故B不符合题意;
C.能级符号相同,能层越大,电子能量越高,所以1s、2s、3s电子的能量逐渐增大,故C不符合题意;
D.同一原子中,2p、3p、4p能级的轨道数相等,都为3,故D不符合题意,
故答案为:A。
A、_??????????????????_的特征分析;
B、P能级有3个轨道,据此分析;
C、根据能级与电子能量的关系分析;
D、同一能级的轨道数相同。21cnjy.com
9. D
【解析】第_Nè????§??????4_层,含有的轨道能级分别为s、p、d、f 的顺序依次为1、3、5、7,共有16个轨道,每一个轨道可容纳2个电子,可以最多容纳32个电子,D符合题意;
故答案为:D
第N能级上含有4个能级、16个原子轨道和32个电子。
10. B
【解析】各能级_è??é??é?????é?????_为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s 2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,绝大多数基态原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f…。A、由以上分析可知相同能层不同能级的电子能量E(3d)>E(3p)>E(3s),故A不符合题意;
B、不同能层相同能级的电子能量E(3s)>E(2s)>E(1s),故B符合题意;
C、由以上分析可知E(4f)>E(3d)>E(4s),故C不符合题意;
D、应为E(4f)>E(5s)>E(4s),故D不符合题意,
故答案为:B。
_è????§è??é???¤§_小可以用n+0.7l进行计算比较,其中n表示能层(n=1,2,3,4,5,6,7),s表示能级(s=0,1,2,3,4......)www-2-1-cnjy-com
二、填空题
11.6
【解析】处于n=4的一群氢原子的电子向低能级跃迁时,发射光子能量是不连续的,光子能量为2个能级之差,4个能级进行组合共有C42种不同频率的光子,即有=6种能够发出不同频率光波,
故答案为:6.
处于n=4的一群氢原子的电子向低能级跃迁时,发射光子能量是不连续的,光子能量为2个能级之差,4个能级进行组合共有C42种不同频率的光子.
12.越低;递增;基态;吸收;B;C或D
【解析】(_1???è???±??????°_(n)越小,电子离核越近,能量越低,在同一能层中,各能级的能量按ns、np、nd、nf的次序递增,故答案为:越低;递增;
(2)处于最低能量的原子叫做基态原子,激发态能量较高,基态电子跃迁到激发态,需要吸收能量,故答案为:基态;吸收;
(3)同周期:从左到右,元素的电负性逐渐增大.同主族:从上到下,元素的电负性逐渐减小则B的电负性最大,第一电离能的变化与元素原子的核外电子排布有关,通常情况下,当原子核外的电子排布的能量相等的轨道上形成全空,半满,全满的结构时,原子的能量较低,原子较稳定,则该原子比较难失去电子,故第一电离能较大,N的第一电离能大于O,由于元素的种类没有确定,则第一电离能最小的元素可能为C或D,
故答案为:B;C或D.
(1)能层序数(n)越小,电子离核越近,能量越低;
(2)处于最低能量的原子叫做基态原子,吸收能量可达到激发态;
(3)根据电负性第一电离能在周期表中的变化进行判断,注意第一电离能的反常现象.
三、综合题
13. (1)2s
(2)3p
(3)5d
(4)4p
(5)
【解析】_(1)???_二能层,含有2个能级,分别是2s、2p能级,s能级符号为2s,故答案为2s;(2) n=3,说明电子处于第三能层,含有3个能级,分别是3s、3p、3d能级,p能级表示为3p,故答案为3p;(3)第五能层,含有5个能级,d能级为5d,故答案为5d;(4) n=4,说明电子处于第四能层,含有4个能级,分别是4s、4p、4
D、4f能级,p能级可表示为4p,故答案为4p;(5) 铜氨络离子中,[Cu(NH3)4]2+为配合物,Cu2+为中心离子,电荷数为+2,NH3为配体,N原子是配位原子,配位数为4,其结构式为 。
能层_?????????è????§??°_等于能层序数,即第n能层含有n个能级,每一能层总是从s能级开始,同一能层中能级ns、np、nd、nf的能量依次增大,s电子的原子轨道呈球形;p电子的原子轨道呈哑铃形,据此即可解答。
14. (1)球;1;纺锤;3
(2)2p;三个互相垂直的伸展;氮;;S;
(3)1s2 2s2 2p6 3s23p63d5
【解析】_???1??????_据图片,s电子的原子轨道呈球形,含有1个原子轨道;p电子的原子轨道呈纺锤形,每个p能级有3个原子轨道,且这三个轨道相互垂直,
故答案为:球,1;纺锤,3;
(2)因为元素X的原子最外层电子排布式为nsnnn+1 , np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3 , 是氮元素,原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向,氢化物的电子式是;当元素X的原子最外层电子排布式为nsn﹣1npn+1时,有n﹣1=2,则n=3,则X元素的原子核外电子排布式为1s22s22p63s23p4 , 是硫元素,原子的电子排布图为【出处:21教育名师】
;故答案为:2p; 三个互相垂直的伸展; 氮; ;S;?;
(3)写出稳定铁离子的_??????????????????_1s2 2s2 2p6 3s23p63d5 , 故答案为:1s2 2s2 2p6 3s23p63d5 .
(1)根据图片中轨道的形状进行分析解答,注意p能级有3个轨道;
(2)元素X的原子最外_?±????????????????_为nsnnpn+1 , s能级最多排2个电子,该元素排列了p能级,说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3 , 则该元素是N元素;
(3)写出稳定铁离子的电子排布式为1s2 2s2 2p6 3s23p63d5;
_21?????????è?????(www.21cnjy.com)_
