高中化学鲁科版(2019)选择性必修2 第1章 原子结构与元素性质 单元测试卷(含解析)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修2 第1章 原子结构与元素性质 单元测试卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-31 09:48:59 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
高中化学试高中化学鲁科版(2019)选择性必修2 第1章测试卷
一、单选题
1.人类社会的发展离不开科学家的贡献,下列说法中不正确的是(??? )
A.?舍勒——研究软锰矿_????????°????°??°?_
B.?汤姆生——根据α粒子散射实验提出原子的葡萄干面包模型
C.?维勒——合成尿素实现了无机物向有机物的转化
D.?玻尔——研究氢原子光谱提出核外电子分层排布模型21教育网
2.以下是一些同学书写的某些原子的2p能级或3d能级中的电子排布情况,其中违反了洪特规则的是(?? )
A.???????????????????B.???????????????????C.???????????????????D.?
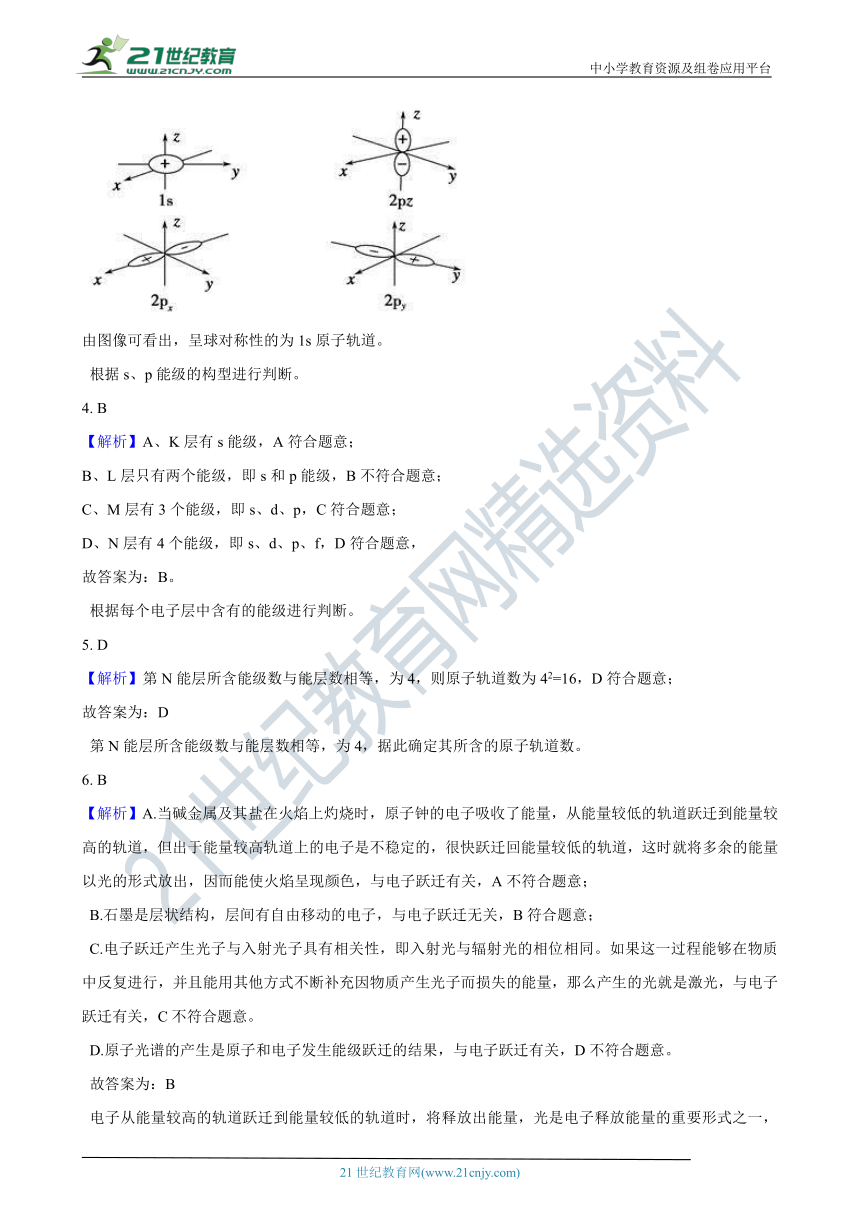
3.在1s、2px、2py、2pz轨道中,具有球对称性的是(?? )。
A.?1s???????????????????????????????????????B.?2px???????????????????????????????????????C.?2py???????????????????????????????????????D.?2pz
4.下列能级符号不正确的是(?? )
A.?1s?????????????????????????????????????????B.?2d?????????????????????????????????????????C.?3p?????????????????????????????????????????D.?4f
5.第N能层所含能级数、原子轨道数分别是(?? )
A.?2、9??????????????????????????????????B.?4、12??????????????????????????????????C.?5、16??????????????????????????????????D.?4、16
6.下列现象和应用与电子跃迁无关的是(? ?)
A.?焰色反应??????????????????????????????B.?石墨导电??????????????????????????????C.?激光??????????????????????????????D.?原子光谱
7.2019年10月1日晚,_???????¤????é?¨???_场烟花燃放和特殊烟花装置表演配合联欢活动,形成地空一体的绚丽画卷。烟花燃放的色彩与锂、钠等金属原子核外电子跃迁有关。下列Li原子电子排布图表示的状态中,能量最高的为(??? ) 2·1·c·n·j·y
A.????????????????????????????????????B.?
C.???????????????????????????????????????D.?【来源:21·世纪·教育·网】
8.下列各离子或原子的电子排布式错误的是(?? )
A.?Ca2+:1s22s22p63s23p6???????????????????????????????????B.?O2-:1s22s22p4
C.?K: 1s22s22p63s23p64s1???????????????????????????????????D.?Fe3+:1s22s22p63s23p63d52-1-c-n-j-y
9.下列说法中正确的是(?? )
A.?氢原子中只有1个电子,故氢原子只有一个轨道
B.?在d轨道中电子排布成 而不能排布成 ,其最直接的根据是泡利不相容原理
C.?原子轨道与电子云都是用来描述电子运动状态的
D.?原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子,其对应元素一定位于同一周期【来源:21cnj*y.co*m】
10.下列关于元素电负性大小的比较中,不正确的是(?? )
A.?P<S<O<F????????????????B.?C<N<O<F????????????????C.?O<S<Se<Te????????????????D.?K<Na<Mg<Al
二、综合题
11.??(1)M能层上有_________???è????§_,有________个轨道,作为内层最多可容纳________个电子,作为最外层时,最多可含有________个未成对电子。 21cnjy.com
(2)E原子核外电子占有9个轨道,且具有1个未成对电子,E离子结构示意图是________。
(3)F、G都是短周期元素_???F2??????G_3+的电子层结构相同,则G元素的原子序数是________,F2-的电子排布式是________。 21*cnjy*com
12.?(1)以下列出的是一些原_??????2pè????§_和3d能级中电子排布的情况。试判断,违反了泡利原理的是________,违反了洪特规则的是________。【出处:21教育名师】
?
(2)某元素的激发态(不稳定_??????)?????????_电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。 【版权所有:21教育】
13.金属锰是含量仅次于铁的重金属,其在合金、催化剂等方面应用广泛.
(1)以下是一些同学绘制的基态_é?°??????????¤????_子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是 ________? .
(2)根据价层电子排布推测铁和锰的第三电离能的大小,I3(Fe)________?I3(Mn)(填“>”或“<”).
(3)过渡金属配合物Mn2(C_O???n?????????_原子价电子数与配体提供电子总数之和为34,则?? n=________?.CO与N2为等电子体,CO分子内σ键与π键个数之比为________?
(4)常用作陶瓷着色剂的硝酸锰是一种粉红色晶体Mn(NO3)2?4H2O,NO3的空间构型是________?(用文字描述).
(5)MnO2可用于催化_?°§?????????è??é??_制羟基苯甲醛,用结构式说明对羟基苯甲醛的沸点比邻羟基苯甲醛高的原因________?.(画出邻羟基苯甲醛分子内(间)的作用情况)________?
(6)金属锰晶体_????????????é?????_积方式为体心立方堆积,则其二维平面放置方式为________?,金属原子在二维平面里另一种放置方式的空隙为________?,经计算每个金属原子所分摊的空隙的数目为 ________?.查表可知锰的原子半径为117pm,相对原子质量为55,列式计算锰密度 ________? g/cm3(列出计算式即可).
14.下图是s能级和p能级的原子轨道图,试回答问题:
(1)s电子的_??????è?¨é?????_________状,每个s能级有________个原子轨道;p电子的原子轨道呈________状,每个p能级有________个原子轨道。21世纪教育网版权所有
(2)元素X的原子最_?¤??±?????????????_式为nsnnpn+1 , 原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是________,它的氢化物的电子式是________。若元素X的原子最外层电子排布式为nsn-1npn+1 , 那么X的元素符号应为________,核外电子排布图为________。
答案解析部分
一、单选题
1. B
【解析】A.舍勒在研究软锰矿时发现了氯气,选项正确,A不符合题意;
B.1911年,英国物理学家卢瑟福进行α粒子散射实验后,提出了带核的原子结构模型,选项错误,B符合题意;21教育名师原创作品
C.1828年,德国_??????????????????_破了生命力学术的束缚,在实验室里将无机物氰酸铵溶液蒸发,得到了有机物尿素,实现了无机物向有机物的转化,选项正确,C不符合题意;21*cnjy*com
D.波尔研究氢原子光谱,提出了核外电子分层排布模型,选项正确,D不符合题意;
故答案为:B
此题是对化学史的考查, 结合科学家在化学研究中做出的共享进行分析即可。
2. C
【解析】A. 违反泡利不相容原理,每个轨道最多只能容纳两个电子,且自旋相反配对,故A不选;
B. 遵循原子核外电子排布规律,故B不选;
C. 5个电子应先各占1个3d轨道,违反洪特规则:在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,故C选;
D.同一轨道电子自旋方向应相反, 违反了泡利不相容原理,故D不选;
故答案为C。
洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同,以此进行判断。
3. A
【解析】1s轨道和2p轨道的图像分别为:
由图像可看出,呈球对称性的为1s原子轨道。
根据s、p能级的构型进行判断。
4. B
【解析】A、K层有s能级,A符合题意;
B、L层只有两个能级,即s和p能级,B不符合题意;
C、M层有3个能级,即s、d、p,C符合题意;
D、N层有4个能级,即s、d、p、f,D符合题意,
故答案为:B。
根据每个电子层中含有的能级进行判断。
5. D
【解析】第N能层所含能级数与能层数相等,为4,则原子轨道数为42=16,D符合题意;
故答案为:D
第N能层所含能级数与能层数相等,为4,据此确定其所含的原子轨道数。
6. B
【解析】A._?????±é???±???????_盐在火焰上灼烧时,原子钟的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但出于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,A不符合题意;
B.石墨是层状结构,层间有自由移动的电子,与电子跃迁无关,B符合题意;
C.电子跃迁产生光子与入射光子具有相关性,即入射光与辐射光的相位相同。如果这一过程能够在物质中反复进行,并且能用其他方式不断补充因物质产生光子而损失的能量,那么产生的光就是激光,与电子跃迁有关,C不符合题意。
D.原子光谱的产生是原子和电子发生能级跃迁的结果,与电子跃迁有关,D不符合题意。
故答案为:B
电子从能量较高的轨道跃迁到能量较低的轨道时,将释放出能量,光是电子释放能量的重要形式之一,日常生活中的霓虹灯管,激光,焰火,以及实验中用到的原子光谱,均和电子的跃迁有关;
7. C
【解析】原子核外电_??????????????????_果电子所占的轨道能级越高,该原子能量越高,根据图知,电子排布能量最低的是1s、2s能级,能量最高的是2s、2p能级, www-2-1-cnjy-com
故故答案为:C。
原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高,以此解答该题。
8. B
【解析】A.Ca2+核外电子数为18,其电子排布式为1s22s22p63s23p6 , A不符合题意;
B.O2-核外电子数为10,电子排布式为1s22s22p6 , B符合题意;
C.K原子核外电子数为19,电子排布式为1s22s22p63s23p64s1 , C不符合题意;
D.Fe3+核外电子数为23,电子排布式为1s22s22p63s23p63d5 , D不符合题意;
故答案为:B。
根据排布原理,能量最低原理、保利不相容原理、和洪特规则来书写即可。
9. C
【解析】A.氢原子中只有一个电子,但轨道是人们规定的,只是空轨道而已,因此氢原子中不止一个轨道,A不符合题意;
B.电子在轨道中的排布,优先占据一个轨道,且自旋方向相同,体现了洪特规则,不是泡利不相容原理,B不符合题意;
C.原子轨道与电子云是电子出现频率高的区域,都是用来形象描述电子运动状态的,C符合题意;
D.原子核外M层上的s、_pè?¨é???????????_子,而d轨道上没有电子,符合条件的原子的核外电子排布式有:1s22s22p63s23p6为氩原子,1s22s22p63s23p64s1为钾原子,1s22s22p63s23p64s2为钙原子,不一定处于同一周期,D不符合题意;21·世纪*教育网
故答案为:C
A.氢原子只有一个电子,但不是只有一个轨道;
B.电子优先占据一个轨道,且自旋方向相同,体现了洪特规则;
C.原子轨道与电子云是电子出现频率高的区域;
D.原子核外M层上的s、p轨道充满电子,而d轨道上没有电子,不嗯呢确定N层是否有电子排布;
10. C
【解析】A.同一_??¨?????????????·?_到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P,故A不符合题意;
B.同周期自左而右电负性增大,则电负性C<N<O<F,故B不符合题意;
C.元素的非金属性越强,电负性越强,元素的非金属性:Te<Se<S<O,则电负性为Te<Se<S<O,故C符合题意;21·cn·jy·com
D.一般来说,元素的金属性越强,电负性越小,即K<Na<Mg<Al,故D不符合题意。
故答案为:C。
元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小。www.21-cn-jy.com
二、综合题
11. (1)3;9;18;3
(2)
(3)13;1s22s22p6
【解析】(1)M能层有3个能级,分别是 、 和 ,一共有 个轨道,作为内层时,根据 的规则能容纳18个电子,而作为最外层时,最多能有3个未成对电子,即 中有3个未成对的p电子;(2)占有九个轨道且有1个未成对电子,只能是 的电子排布,即氯元素,其离子结构为 ;(3)G是正三价的,则考虑为铝元素,其原子序数为13,而F只能是氧, 的电子排布式为 。
(1)每个能层上的能级数等于能层序数,s、p、d能级分别有1、3、5个轨道;每个能层最多能容纳2n2个电子,但最外层不能超过8个电子;
(2)s、p、d能级分别有1、3、5个轨道,9个轨道可从1s排布到3p,有1个未成对电子,说明该原子有17个电子;
(3)F为-2价,则F为第VIA元素,G为+3价,则G为第IIIA元素。
12. (1)②;③⑤
(2)1s22s22p63s23p4;H2SO4
【解析】(1)泡利原_???????????¨??????_中不能容纳运动状态完全相同的电子。所以在②的中间轨道上有两个自旋方向相同的电子,其运动状态完全相同,违反了泡利原理。洪特规则为:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同。所以③中5个电子应该以自旋方向相同的方式分别占据5个轨道,⑤中前四个单电子应该自旋方向相同,都违反了洪特规则。(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2 , 该元素原子核外有16个电子,为S元素,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p4;其最高价氧化物对应水化物是硫酸,化学式为H2SO4。
(1)按泡利_???????????????è§?_则、构造原理填充的原子能量低,稳定。
(2) 元素基态原子的电子排布式 是按泡利原理、洪特规则、构造原理填充的。
13. (1)D
(2)<
(3)10;1:2
(4)平面三角形
(5)对羟基苯甲醛分子间存在氢键;?
(6)非密置层;三角形;2;
【解析】(1)锰是25号元素,其原子核外有25个电子,
A.违反洪特规则,故A错误;
B.违反泡利原理,故B错误;
C.违反洪特规则,故C错误;
D.符合泡利原理和洪特规则,故D正确;
故答案为:D;
(2)由Mn_2+è????????M_n3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
故答案为:<;
(3)中心原子是锰原子,其价电子数是7,每个配体提供的电子数是2,则7×2+2n=34,得n=10;
CO与N2互为等电子体,所以含有一条σ键和两条π键,比值为1:2;
故答案为:10;1:2;
(4)NO3中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:平面三角形;
(5)对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛分子间不存在氢键,则对羟基苯甲醛的沸点比邻羟基苯甲醛的高;邻羟基苯甲醛分子中氢键如图所示:, 故答案为:对羟基苯甲醛分子间存在氢键;;
(6)由于金属锰晶体的三维空间堆积方式为体心立方堆积,故其其二维平面放置方式为非密置层,金属原子在二维平面里另一种放置方式的空隙为三角形;
由于金属锰晶体的三维空间堆积方式为体心立方堆积,每个晶胞中含有的原子数=8× +1=2,则每个晶胞的质量m=55g/mol× = g,每个晶胞的体积V=(117×4×10﹣10)3cm3 , 则锰密度ρ= = = g?cm﹣3 .
故答案为:非密置层;三角形;2; .
(1)洪特_è§????????????????_布在同一能级的不同轨道时优先单独占据一个轨道,且自旋方向相同;泡利原理:一个原子轨道里最多可容纳2个电子,且自旋方向相反,据此分析解答;
(2)由Mn2+转化为M_n3+??????3_d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态;
(3)利用Mn的价电子_??°???CO??????_电子对数计算得出,中心原子是锰原子,其价电子数是7,每个配体提供的电子数是2;CO与N2互为等电子体,所以含有一条σ键和两条π键;
(4)NO3中N原子形成3个δ键,没有孤电子对,则应为平面三角形;
(5)由于氢键的作用力远大于范德华力,则含有氢键的物质熔沸点较高,易溶于水;对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛分子间不存在氢键;
(6)由于金属锰晶体的三维空间堆积方式为体心立方堆积,故其其二维平面放置方式为非密置层,金属原子在二维平面里另一种放置方式的空隙为三角形;
计算出每个晶胞的体积的质量,根据密度公式ρ= ?计算.
14. (1)球;1;哑铃;3
(2)2p;三个互相垂直的伸展;氮;;S;
【解析】(1)ns能级_??????1???è?¨é??_,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃状的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。(2)因为元素X的原子最外层电子排布式为nsnnpn+1 , np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3 , X是氮元素;当元素X的原子最外层电子排布式为nsn-1npn+1时,有n-1=2,则n=3,那么X元素的原子核外电子排布式为1s22s22p63s23p4 , X是硫元素。
本题考查元素原子核外电子的排布、能层与能级、轨道表示式等。
_21?????????è?????(www.21cnjy.com)_
高中化学试高中化学鲁科版(2019)选择性必修2 第1章测试卷
一、单选题
1.人类社会的发展离不开科学家的贡献,下列说法中不正确的是(??? )
A.?舍勒——研究软锰矿_????????°????°??°?_
B.?汤姆生——根据α粒子散射实验提出原子的葡萄干面包模型
C.?维勒——合成尿素实现了无机物向有机物的转化
D.?玻尔——研究氢原子光谱提出核外电子分层排布模型21教育网
2.以下是一些同学书写的某些原子的2p能级或3d能级中的电子排布情况,其中违反了洪特规则的是(?? )
A.???????????????????B.???????????????????C.???????????????????D.?
3.在1s、2px、2py、2pz轨道中,具有球对称性的是(?? )。
A.?1s???????????????????????????????????????B.?2px???????????????????????????????????????C.?2py???????????????????????????????????????D.?2pz
4.下列能级符号不正确的是(?? )
A.?1s?????????????????????????????????????????B.?2d?????????????????????????????????????????C.?3p?????????????????????????????????????????D.?4f
5.第N能层所含能级数、原子轨道数分别是(?? )
A.?2、9??????????????????????????????????B.?4、12??????????????????????????????????C.?5、16??????????????????????????????????D.?4、16
6.下列现象和应用与电子跃迁无关的是(? ?)
A.?焰色反应??????????????????????????????B.?石墨导电??????????????????????????????C.?激光??????????????????????????????D.?原子光谱
7.2019年10月1日晚,_???????¤????é?¨???_场烟花燃放和特殊烟花装置表演配合联欢活动,形成地空一体的绚丽画卷。烟花燃放的色彩与锂、钠等金属原子核外电子跃迁有关。下列Li原子电子排布图表示的状态中,能量最高的为(??? ) 2·1·c·n·j·y
A.????????????????????????????????????B.?
C.???????????????????????????????????????D.?【来源:21·世纪·教育·网】
8.下列各离子或原子的电子排布式错误的是(?? )
A.?Ca2+:1s22s22p63s23p6???????????????????????????????????B.?O2-:1s22s22p4
C.?K: 1s22s22p63s23p64s1???????????????????????????????????D.?Fe3+:1s22s22p63s23p63d52-1-c-n-j-y
9.下列说法中正确的是(?? )
A.?氢原子中只有1个电子,故氢原子只有一个轨道
B.?在d轨道中电子排布成 而不能排布成 ,其最直接的根据是泡利不相容原理
C.?原子轨道与电子云都是用来描述电子运动状态的
D.?原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子,其对应元素一定位于同一周期【来源:21cnj*y.co*m】
10.下列关于元素电负性大小的比较中,不正确的是(?? )
A.?P<S<O<F????????????????B.?C<N<O<F????????????????C.?O<S<Se<Te????????????????D.?K<Na<Mg<Al
二、综合题
11.??(1)M能层上有_________???è????§_,有________个轨道,作为内层最多可容纳________个电子,作为最外层时,最多可含有________个未成对电子。 21cnjy.com
(2)E原子核外电子占有9个轨道,且具有1个未成对电子,E离子结构示意图是________。
(3)F、G都是短周期元素_???F2??????G_3+的电子层结构相同,则G元素的原子序数是________,F2-的电子排布式是________。 21*cnjy*com
12.?(1)以下列出的是一些原_??????2pè????§_和3d能级中电子排布的情况。试判断,违反了泡利原理的是________,违反了洪特规则的是________。【出处:21教育名师】
?
(2)某元素的激发态(不稳定_??????)?????????_电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。 【版权所有:21教育】
13.金属锰是含量仅次于铁的重金属,其在合金、催化剂等方面应用广泛.
(1)以下是一些同学绘制的基态_é?°??????????¤????_子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是 ________? .
(2)根据价层电子排布推测铁和锰的第三电离能的大小,I3(Fe)________?I3(Mn)(填“>”或“<”).
(3)过渡金属配合物Mn2(C_O???n?????????_原子价电子数与配体提供电子总数之和为34,则?? n=________?.CO与N2为等电子体,CO分子内σ键与π键个数之比为________?
(4)常用作陶瓷着色剂的硝酸锰是一种粉红色晶体Mn(NO3)2?4H2O,NO3的空间构型是________?(用文字描述).
(5)MnO2可用于催化_?°§?????????è??é??_制羟基苯甲醛,用结构式说明对羟基苯甲醛的沸点比邻羟基苯甲醛高的原因________?.(画出邻羟基苯甲醛分子内(间)的作用情况)________?
(6)金属锰晶体_????????????é?????_积方式为体心立方堆积,则其二维平面放置方式为________?,金属原子在二维平面里另一种放置方式的空隙为________?,经计算每个金属原子所分摊的空隙的数目为 ________?.查表可知锰的原子半径为117pm,相对原子质量为55,列式计算锰密度 ________? g/cm3(列出计算式即可).
14.下图是s能级和p能级的原子轨道图,试回答问题:
(1)s电子的_??????è?¨é?????_________状,每个s能级有________个原子轨道;p电子的原子轨道呈________状,每个p能级有________个原子轨道。21世纪教育网版权所有
(2)元素X的原子最_?¤??±?????????????_式为nsnnpn+1 , 原子中能量最高的是________电子,其电子云在空间有________方向;元素X的名称是________,它的氢化物的电子式是________。若元素X的原子最外层电子排布式为nsn-1npn+1 , 那么X的元素符号应为________,核外电子排布图为________。
答案解析部分
一、单选题
1. B
【解析】A.舍勒在研究软锰矿时发现了氯气,选项正确,A不符合题意;
B.1911年,英国物理学家卢瑟福进行α粒子散射实验后,提出了带核的原子结构模型,选项错误,B符合题意;21教育名师原创作品
C.1828年,德国_??????????????????_破了生命力学术的束缚,在实验室里将无机物氰酸铵溶液蒸发,得到了有机物尿素,实现了无机物向有机物的转化,选项正确,C不符合题意;21*cnjy*com
D.波尔研究氢原子光谱,提出了核外电子分层排布模型,选项正确,D不符合题意;
故答案为:B
此题是对化学史的考查, 结合科学家在化学研究中做出的共享进行分析即可。
2. C
【解析】A. 违反泡利不相容原理,每个轨道最多只能容纳两个电子,且自旋相反配对,故A不选;
B. 遵循原子核外电子排布规律,故B不选;
C. 5个电子应先各占1个3d轨道,违反洪特规则:在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,故C选;
D.同一轨道电子自旋方向应相反, 违反了泡利不相容原理,故D不选;
故答案为C。
洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同,以此进行判断。
3. A
【解析】1s轨道和2p轨道的图像分别为:
由图像可看出,呈球对称性的为1s原子轨道。
根据s、p能级的构型进行判断。
4. B
【解析】A、K层有s能级,A符合题意;
B、L层只有两个能级,即s和p能级,B不符合题意;
C、M层有3个能级,即s、d、p,C符合题意;
D、N层有4个能级,即s、d、p、f,D符合题意,
故答案为:B。
根据每个电子层中含有的能级进行判断。
5. D
【解析】第N能层所含能级数与能层数相等,为4,则原子轨道数为42=16,D符合题意;
故答案为:D
第N能层所含能级数与能层数相等,为4,据此确定其所含的原子轨道数。
6. B
【解析】A._?????±é???±???????_盐在火焰上灼烧时,原子钟的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但出于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,A不符合题意;
B.石墨是层状结构,层间有自由移动的电子,与电子跃迁无关,B符合题意;
C.电子跃迁产生光子与入射光子具有相关性,即入射光与辐射光的相位相同。如果这一过程能够在物质中反复进行,并且能用其他方式不断补充因物质产生光子而损失的能量,那么产生的光就是激光,与电子跃迁有关,C不符合题意。
D.原子光谱的产生是原子和电子发生能级跃迁的结果,与电子跃迁有关,D不符合题意。
故答案为:B
电子从能量较高的轨道跃迁到能量较低的轨道时,将释放出能量,光是电子释放能量的重要形式之一,日常生活中的霓虹灯管,激光,焰火,以及实验中用到的原子光谱,均和电子的跃迁有关;
7. C
【解析】原子核外电_??????????????????_果电子所占的轨道能级越高,该原子能量越高,根据图知,电子排布能量最低的是1s、2s能级,能量最高的是2s、2p能级, www-2-1-cnjy-com
故故答案为:C。
原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高,以此解答该题。
8. B
【解析】A.Ca2+核外电子数为18,其电子排布式为1s22s22p63s23p6 , A不符合题意;
B.O2-核外电子数为10,电子排布式为1s22s22p6 , B符合题意;
C.K原子核外电子数为19,电子排布式为1s22s22p63s23p64s1 , C不符合题意;
D.Fe3+核外电子数为23,电子排布式为1s22s22p63s23p63d5 , D不符合题意;
故答案为:B。
根据排布原理,能量最低原理、保利不相容原理、和洪特规则来书写即可。
9. C
【解析】A.氢原子中只有一个电子,但轨道是人们规定的,只是空轨道而已,因此氢原子中不止一个轨道,A不符合题意;
B.电子在轨道中的排布,优先占据一个轨道,且自旋方向相同,体现了洪特规则,不是泡利不相容原理,B不符合题意;
C.原子轨道与电子云是电子出现频率高的区域,都是用来形象描述电子运动状态的,C符合题意;
D.原子核外M层上的s、_pè?¨é???????????_子,而d轨道上没有电子,符合条件的原子的核外电子排布式有:1s22s22p63s23p6为氩原子,1s22s22p63s23p64s1为钾原子,1s22s22p63s23p64s2为钙原子,不一定处于同一周期,D不符合题意;21·世纪*教育网
故答案为:C
A.氢原子只有一个电子,但不是只有一个轨道;
B.电子优先占据一个轨道,且自旋方向相同,体现了洪特规则;
C.原子轨道与电子云是电子出现频率高的区域;
D.原子核外M层上的s、p轨道充满电子,而d轨道上没有电子,不嗯呢确定N层是否有电子排布;
10. C
【解析】A.同一_??¨?????????????·?_到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P,故A不符合题意;
B.同周期自左而右电负性增大,则电负性C<N<O<F,故B不符合题意;
C.元素的非金属性越强,电负性越强,元素的非金属性:Te<Se<S<O,则电负性为Te<Se<S<O,故C符合题意;21·cn·jy·com
D.一般来说,元素的金属性越强,电负性越小,即K<Na<Mg<Al,故D不符合题意。
故答案为:C。
元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小。www.21-cn-jy.com
二、综合题
11. (1)3;9;18;3
(2)
(3)13;1s22s22p6
【解析】(1)M能层有3个能级,分别是 、 和 ,一共有 个轨道,作为内层时,根据 的规则能容纳18个电子,而作为最外层时,最多能有3个未成对电子,即 中有3个未成对的p电子;(2)占有九个轨道且有1个未成对电子,只能是 的电子排布,即氯元素,其离子结构为 ;(3)G是正三价的,则考虑为铝元素,其原子序数为13,而F只能是氧, 的电子排布式为 。
(1)每个能层上的能级数等于能层序数,s、p、d能级分别有1、3、5个轨道;每个能层最多能容纳2n2个电子,但最外层不能超过8个电子;
(2)s、p、d能级分别有1、3、5个轨道,9个轨道可从1s排布到3p,有1个未成对电子,说明该原子有17个电子;
(3)F为-2价,则F为第VIA元素,G为+3价,则G为第IIIA元素。
12. (1)②;③⑤
(2)1s22s22p63s23p4;H2SO4
【解析】(1)泡利原_???????????¨??????_中不能容纳运动状态完全相同的电子。所以在②的中间轨道上有两个自旋方向相同的电子,其运动状态完全相同,违反了泡利原理。洪特规则为:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同。所以③中5个电子应该以自旋方向相同的方式分别占据5个轨道,⑤中前四个单电子应该自旋方向相同,都违反了洪特规则。(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2 , 该元素原子核外有16个电子,为S元素,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p4;其最高价氧化物对应水化物是硫酸,化学式为H2SO4。
(1)按泡利_???????????????è§?_则、构造原理填充的原子能量低,稳定。
(2) 元素基态原子的电子排布式 是按泡利原理、洪特规则、构造原理填充的。
13. (1)D
(2)<
(3)10;1:2
(4)平面三角形
(5)对羟基苯甲醛分子间存在氢键;?
(6)非密置层;三角形;2;
【解析】(1)锰是25号元素,其原子核外有25个电子,
A.违反洪特规则,故A错误;
B.违反泡利原理,故B错误;
C.违反洪特规则,故C错误;
D.符合泡利原理和洪特规则,故D正确;
故答案为:D;
(2)由Mn_2+è????????M_n3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
故答案为:<;
(3)中心原子是锰原子,其价电子数是7,每个配体提供的电子数是2,则7×2+2n=34,得n=10;
CO与N2互为等电子体,所以含有一条σ键和两条π键,比值为1:2;
故答案为:10;1:2;
(4)NO3中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:平面三角形;
(5)对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛分子间不存在氢键,则对羟基苯甲醛的沸点比邻羟基苯甲醛的高;邻羟基苯甲醛分子中氢键如图所示:, 故答案为:对羟基苯甲醛分子间存在氢键;;
(6)由于金属锰晶体的三维空间堆积方式为体心立方堆积,故其其二维平面放置方式为非密置层,金属原子在二维平面里另一种放置方式的空隙为三角形;
由于金属锰晶体的三维空间堆积方式为体心立方堆积,每个晶胞中含有的原子数=8× +1=2,则每个晶胞的质量m=55g/mol× = g,每个晶胞的体积V=(117×4×10﹣10)3cm3 , 则锰密度ρ= = = g?cm﹣3 .
故答案为:非密置层;三角形;2; .
(1)洪特_è§????????????????_布在同一能级的不同轨道时优先单独占据一个轨道,且自旋方向相同;泡利原理:一个原子轨道里最多可容纳2个电子,且自旋方向相反,据此分析解答;
(2)由Mn2+转化为M_n3+??????3_d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态;
(3)利用Mn的价电子_??°???CO??????_电子对数计算得出,中心原子是锰原子,其价电子数是7,每个配体提供的电子数是2;CO与N2互为等电子体,所以含有一条σ键和两条π键;
(4)NO3中N原子形成3个δ键,没有孤电子对,则应为平面三角形;
(5)由于氢键的作用力远大于范德华力,则含有氢键的物质熔沸点较高,易溶于水;对羟基苯甲醛分子间存在氢键,而邻羟基苯甲醛分子间不存在氢键;
(6)由于金属锰晶体的三维空间堆积方式为体心立方堆积,故其其二维平面放置方式为非密置层,金属原子在二维平面里另一种放置方式的空隙为三角形;
计算出每个晶胞的体积的质量,根据密度公式ρ= ?计算.
14. (1)球;1;哑铃;3
(2)2p;三个互相垂直的伸展;氮;;S;
【解析】(1)ns能级_??????1???è?¨é??_,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃状的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。(2)因为元素X的原子最外层电子排布式为nsnnpn+1 , np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3 , X是氮元素;当元素X的原子最外层电子排布式为nsn-1npn+1时,有n-1=2,则n=3,那么X元素的原子核外电子排布式为1s22s22p63s23p4 , X是硫元素。
本题考查元素原子核外电子的排布、能层与能级、轨道表示式等。
_21?????????è?????(www.21cnjy.com)_
