5-3-3 羧酸 酯(1)酸 课件(36张ppt) 2020-2021学年人教版高二化学选修5有机化学基础
文档属性
| 名称 | 5-3-3 羧酸 酯(1)酸 课件(36张ppt) 2020-2021学年人教版高二化学选修5有机化学基础 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-31 21:57:13 | ||
图片预览









文档简介
第三章
烃的含氧衍生物
2021.04: W
学习
目标
第三节
羧酸 酯
1.掌握乙酸的结构特点和性质,学会简单实验方案的设计、评价及优选。
2.深入研究酯化反应的基本规律,并将乙酸的结构和性质 迁移到羧酸类化合物。
蚁酸(甲酸)
HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
草酸
(乙二酸)
COOH
COOH
安息香酸(苯甲酸)
COOH
自然界中的有机酸
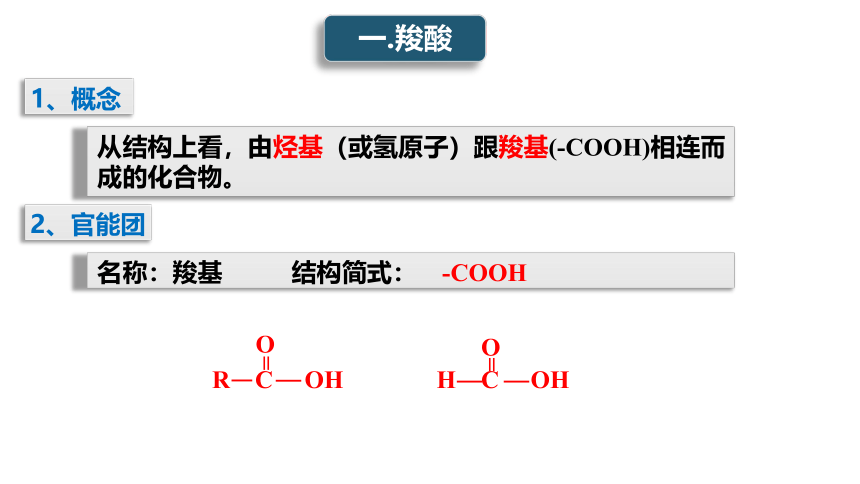
一.羧酸
1、概念
从结构上看,由烃基(或氢原子)跟羧基(-COOH)相连而成的化合物。
2、官能团
名称:羧基 结构简式: -COOH
R C OH
=
O
H C OH
=
O
3、分类
(1)按羧基的数目分:
(2)按烃基种类:
一元羧酸:如CH3COOH
乙酸
二元羧酸:COOH
COOH
乙二酸
多元羧酸:
脂肪酸
芳香酸
C
OOH
饱和一元羧酸通式:
CnH2nO2 (n≥1 )或CnH2n+1COOH
CH2-COOH
CH-COOH
CH2-COOH
CH3CH2COOH(丙酸)
低级脂肪酸
硬脂酸C17H35COOH
软脂酸 C15H31COOH
油酸 C17H33COOH
(3)按碳原子数目:
高级脂肪酸
创新方案36页左分类
醋酸 乙酸CH3COOH
新课引入
1、物理性质
常温下为无色有强烈刺激性气味的液体,熔点:16.6℃ ,沸点:117.9℃,易结成冰一样的晶体。(无水乙酸又称为冰醋酸)与水、酒精以任意比互溶。
二.乙酸
阅读教材60页第二段,熟悉乙酸的物理性质。
纯净物
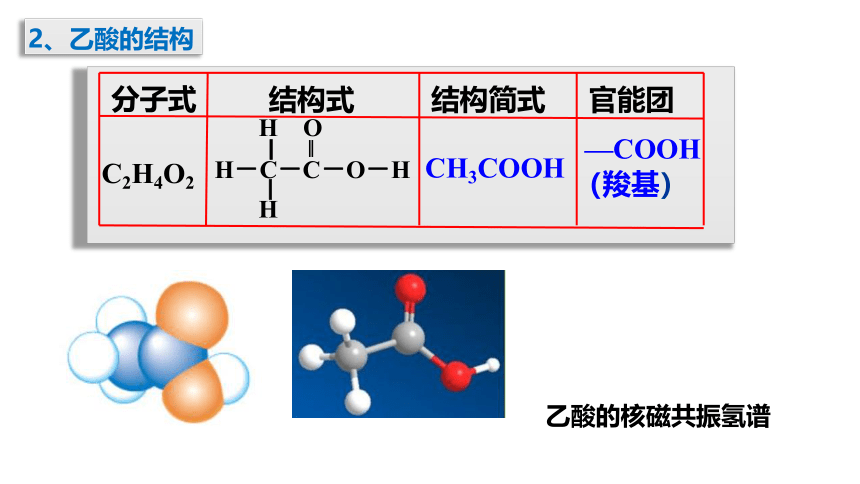
2、乙酸的结构
C2H4O2
CH3COOH
—COOH(羧基)
分子式
结构式
结构简式
官能团
H O
▏ ‖
H-C-C-O-H
▏
H
乙酸的核磁共振氢谱
羧基
受C=O的影响: -O-H更易断
受-O-H的影响: C=O不易断
(弱酸性)
(酯化反应)
结构分析
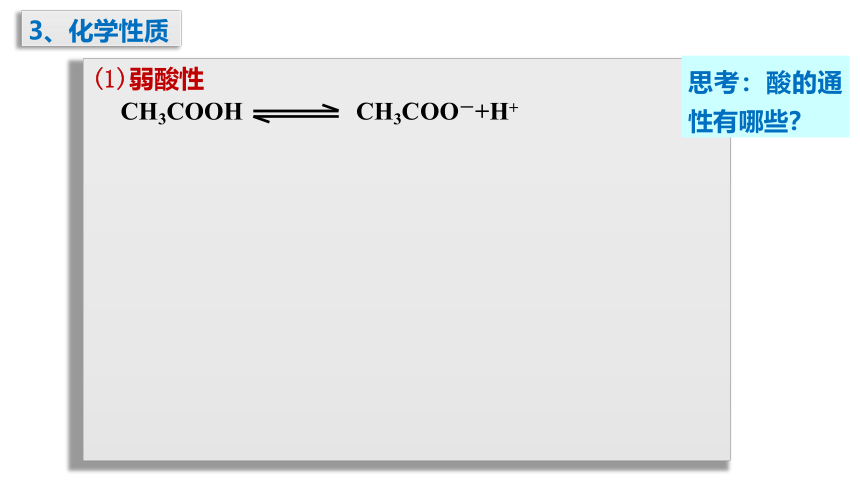
3、化学性质
(1)弱酸性
CH3COOH CH3COO-+H+
思考:酸的通性有哪些?
观察学习
3、化学性质
(1)弱酸性
CH3COOH CH3COO-+H+
2CH3COOH + Na2CO3 = 2CH3COONa +H2O+CO2↑
2CH3COOH + 2Na= 2CH3COONa + H2↑
CH3COOH + NaOH = CH3COONa+ H2O
⑤与某些盐反应:
①使紫色石蕊试液变红色:
②与活泼金属反应:
④与碱反应:
③与碱性氧化物反应:
2CH3COOH+Na2O=2CH3COONa+2H2O
2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O
CH3COOH + NaHCO3 = CH3COONa +H2O+CO2↑
NaHCO3只与羧基反应
乙酸酐
O
CH3—C—O—H
+ H2O
O
O
CH3—C
CH3—C
O
O
CH3—C—O—H
乙酸
补充:酸的分子间脱水
思考交流
2. 教材60页【科学探究1】设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液酸性的酸性强弱。
2CH3COONa+CO2↑+H2O
2CH3COOH+Na2CO3→
①
CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
②
实验装置图
①
②
酸性:盐酸 > CH3COOH > H2CO3 >
OH
归纳小结
代表物
结构简式
羟基氢的活泼性
酸性
与钠反应
与NaOH的反应
与Na2CO3的反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增强
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
{5940675A-B579-460E-94D1-54222C63F5DA}与NaHCO3的反应
不能
不能
能
1.确定乙酸是弱酸的依据是( )
A.乙酸可以和乙醇发生酯化反应
B.乙酸钠的水溶液显碱性
C.乙酸能使石蕊试液变红
D.Na2CO3中加入乙酸产生CO2
B
课堂练习
2、完成创新方案36页右中的【对点演练】1.
(1) NaHCO3
(2) NaOH或Na2CO3
(3) Na
3.填写下列反应中相应位置的物质化学式
①
②
③
⑤
④
① NaHCO3 ② NaOH(或Na2CO3)③ Na
④ CO2
⑤ HCl(较强酸)
课堂练习
3、化学性质
(2)酯化反应
观察学习
3、化学性质
(2)酯化反应
酸和醇起反应生成酯和水的反应,叫做酯化反应。
CH3COOH+HOC2H5 H2O+CH3COOC2H5
浓H2SO4
乙酸乙酯
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
酸脱羟基醇脱氢
硝酸乙酯
无机含氧酸与醇可以形成无机酸酯
硝化甘油
观察学习
浓硫酸
加热
+ 3HO-NO2
+3H2O
CH2O-H
CHO -H
CH2O-H
CH2O- NO2
CHO- NO2
CH2O- NO2
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
思考交流
3、根据该实验思考以下为题:
(1)浓硫酸的作用是?
(2)试剂加入的顺序是?
(3)得到的反应产物是否纯净?主要杂质有哪些?
(4)导管末端为什么不伸入液面以下?饱和Na2CO3
溶液有什么作用?
催化剂、吸水剂
乙醇-浓硫酸-冰醋酸
(3)不纯净;主要含乙酸、乙醇。
(4)防止受热不均发生倒吸。
饱和Na2CO3作用:吸收乙醇,反应乙酸,降低酯在水中的溶解度,以便使酯分层析出。
常见防倒吸装置
4.乙酸与乙醇的酯化反应是可逆的,在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?
根据化学平衡原理,提高乙酸乙酯产率的措施有:
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化率。
(3)使用浓H2SO4作吸水剂,提高反应转化率。
思考交流
化学性质:
俗名蚁酸,是具
有刺激性气味的
无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。
C
H
O-H
=
O
其它几种羧酸
甲酸
酸性、酯化、氧化(包括银镜反应和新制Cu(OH)2悬浊液的反应)。
被浓硫酸脱水 HCOOH CO? + H2O
浓H2SO4
了解:
——俗称草酸
其它几种羧酸
【化性】草酸是最简单的饱和二元羧酸,是二元羧酸中酸性最强的,它具有一些特殊的化学性质。能使酸性高锰酸钾溶液褪色、可作漂白剂。
乙二酸
乳酸
CH3CHCOOH
OH
化学性质:酸性、酯化
丙烯酸
CH2=CHCOOH
化学性质:
酸性、酯化、加聚、加成 、氧化。
常见羧酸酸性:草酸 > 甲酸 > 苯甲酸 > 乙酸
高级脂肪酸是指含碳原子数较多的脂肪酸,它们的酸性很弱,在水中溶解度不大甚至难溶于水,常见高级脂肪酸有:
C17H35COOH
硬脂酸
C17H33COOH
油 酸
C15H31COOH
软脂酸
C17H31COOH
亚油酸
高级脂肪酸
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
乙酸甲酯
足量
浓H2SO4
浓H2SO4
二乙酸乙二酯
乙二酸二乙酯
课堂练习
4.写出下列反应方程式:
2
COOH
COOH
+ HOC2H5
足量
2
COOH
COOH
COOC2H5
COOC2H5
+H2O
浓H2SO4
+ 2H2O
环乙二酸乙二酯
课堂练习
5.写出下列反应方程式:
HOOCCOOCH2CH2OH + H2O
O O
HO—C—C—OCH2CH2O —H
=
=
n
+ (2n-1)H2O
2CH3CHCOOH
OH
浓H2SO4
创新方案37页左下和右上【名师点拨】。
CH3 O
H—O-CH—C—OH
=
n
+ (n-1)H2O
CH2CH2CH2CH2C—OH
O
OH
︱
浓H2SO4
C
6.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
A 1种 B 2种 C 3 种 D 4种
生成物中水的相对分子质量为 。
20
课堂练习
7.某有机物的结构简式为
它在一定条件下可能发生的反应有
①加成 ②水解 ③酯化 ④氧化
⑤中和 ⑥消去
课堂练习
8. 1mol有机物 与足量NaOH 溶
液充分反应,消耗NaOH 的物质的量为( )
A.5mol B.4mol
C.3mol D.2mol
COOCH3
CH3COO
COOH
B
课堂练习
(1) Na
(2) NaOH
(3) NaHCO3
9. 1mol有机物
最多能消耗下列各物质多少 mol?
HO
CH-CH2
OH
COOH
CH2OH
4
2
1
课堂练习
10. 能用来鉴别乙醇、乙醛、甲酸、乙酸四种无色溶液的试剂是 ( )
A.FeCl3溶液 B.溴水
C.金属钠 D.新制Cu(OH)2
D
甲酸中含有醛基和羧基
课堂练习
11、如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是 ( )
A.①蒸馏、②过滤、③分液
B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液
D.①分液、②蒸馏、③结晶、过滤
B
谢谢欣赏
烃的含氧衍生物
2021.04: W
学习
目标
第三节
羧酸 酯
1.掌握乙酸的结构特点和性质,学会简单实验方案的设计、评价及优选。
2.深入研究酯化反应的基本规律,并将乙酸的结构和性质 迁移到羧酸类化合物。
蚁酸(甲酸)
HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
草酸
(乙二酸)
COOH
COOH
安息香酸(苯甲酸)
COOH
自然界中的有机酸
一.羧酸
1、概念
从结构上看,由烃基(或氢原子)跟羧基(-COOH)相连而成的化合物。
2、官能团
名称:羧基 结构简式: -COOH
R C OH
=
O
H C OH
=
O
3、分类
(1)按羧基的数目分:
(2)按烃基种类:
一元羧酸:如CH3COOH
乙酸
二元羧酸:COOH
COOH
乙二酸
多元羧酸:
脂肪酸
芳香酸
C
OOH
饱和一元羧酸通式:
CnH2nO2 (n≥1 )或CnH2n+1COOH
CH2-COOH
CH-COOH
CH2-COOH
CH3CH2COOH(丙酸)
低级脂肪酸
硬脂酸C17H35COOH
软脂酸 C15H31COOH
油酸 C17H33COOH
(3)按碳原子数目:
高级脂肪酸
创新方案36页左分类
醋酸 乙酸CH3COOH
新课引入
1、物理性质
常温下为无色有强烈刺激性气味的液体,熔点:16.6℃ ,沸点:117.9℃,易结成冰一样的晶体。(无水乙酸又称为冰醋酸)与水、酒精以任意比互溶。
二.乙酸
阅读教材60页第二段,熟悉乙酸的物理性质。
纯净物
2、乙酸的结构
C2H4O2
CH3COOH
—COOH(羧基)
分子式
结构式
结构简式
官能团
H O
▏ ‖
H-C-C-O-H
▏
H
乙酸的核磁共振氢谱
羧基
受C=O的影响: -O-H更易断
受-O-H的影响: C=O不易断
(弱酸性)
(酯化反应)
结构分析
3、化学性质
(1)弱酸性
CH3COOH CH3COO-+H+
思考:酸的通性有哪些?
观察学习
3、化学性质
(1)弱酸性
CH3COOH CH3COO-+H+
2CH3COOH + Na2CO3 = 2CH3COONa +H2O+CO2↑
2CH3COOH + 2Na= 2CH3COONa + H2↑
CH3COOH + NaOH = CH3COONa+ H2O
⑤与某些盐反应:
①使紫色石蕊试液变红色:
②与活泼金属反应:
④与碱反应:
③与碱性氧化物反应:
2CH3COOH+Na2O=2CH3COONa+2H2O
2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O
CH3COOH + NaHCO3 = CH3COONa +H2O+CO2↑
NaHCO3只与羧基反应
乙酸酐
O
CH3—C—O—H
+ H2O
O
O
CH3—C
CH3—C
O
O
CH3—C—O—H
乙酸
补充:酸的分子间脱水
思考交流
2. 教材60页【科学探究1】设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液酸性的酸性强弱。
2CH3COONa+CO2↑+H2O
2CH3COOH+Na2CO3→
①
CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
②
实验装置图
①
②
酸性:盐酸 > CH3COOH > H2CO3 >
OH
归纳小结
代表物
结构简式
羟基氢的活泼性
酸性
与钠反应
与NaOH的反应
与Na2CO3的反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增强
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
{5940675A-B579-460E-94D1-54222C63F5DA}与NaHCO3的反应
不能
不能
能
1.确定乙酸是弱酸的依据是( )
A.乙酸可以和乙醇发生酯化反应
B.乙酸钠的水溶液显碱性
C.乙酸能使石蕊试液变红
D.Na2CO3中加入乙酸产生CO2
B
课堂练习
2、完成创新方案36页右中的【对点演练】1.
(1) NaHCO3
(2) NaOH或Na2CO3
(3) Na
3.填写下列反应中相应位置的物质化学式
①
②
③
⑤
④
① NaHCO3 ② NaOH(或Na2CO3)③ Na
④ CO2
⑤ HCl(较强酸)
课堂练习
3、化学性质
(2)酯化反应
观察学习
3、化学性质
(2)酯化反应
酸和醇起反应生成酯和水的反应,叫做酯化反应。
CH3COOH+HOC2H5 H2O+CH3COOC2H5
浓H2SO4
乙酸乙酯
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
酸脱羟基醇脱氢
硝酸乙酯
无机含氧酸与醇可以形成无机酸酯
硝化甘油
观察学习
浓硫酸
加热
+ 3HO-NO2
+3H2O
CH2O-H
CHO -H
CH2O-H
CH2O- NO2
CHO- NO2
CH2O- NO2
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
思考交流
3、根据该实验思考以下为题:
(1)浓硫酸的作用是?
(2)试剂加入的顺序是?
(3)得到的反应产物是否纯净?主要杂质有哪些?
(4)导管末端为什么不伸入液面以下?饱和Na2CO3
溶液有什么作用?
催化剂、吸水剂
乙醇-浓硫酸-冰醋酸
(3)不纯净;主要含乙酸、乙醇。
(4)防止受热不均发生倒吸。
饱和Na2CO3作用:吸收乙醇,反应乙酸,降低酯在水中的溶解度,以便使酯分层析出。
常见防倒吸装置
4.乙酸与乙醇的酯化反应是可逆的,在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?
根据化学平衡原理,提高乙酸乙酯产率的措施有:
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化率。
(3)使用浓H2SO4作吸水剂,提高反应转化率。
思考交流
化学性质:
俗名蚁酸,是具
有刺激性气味的
无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。
C
H
O-H
=
O
其它几种羧酸
甲酸
酸性、酯化、氧化(包括银镜反应和新制Cu(OH)2悬浊液的反应)。
被浓硫酸脱水 HCOOH CO? + H2O
浓H2SO4
了解:
——俗称草酸
其它几种羧酸
【化性】草酸是最简单的饱和二元羧酸,是二元羧酸中酸性最强的,它具有一些特殊的化学性质。能使酸性高锰酸钾溶液褪色、可作漂白剂。
乙二酸
乳酸
CH3CHCOOH
OH
化学性质:酸性、酯化
丙烯酸
CH2=CHCOOH
化学性质:
酸性、酯化、加聚、加成 、氧化。
常见羧酸酸性:草酸 > 甲酸 > 苯甲酸 > 乙酸
高级脂肪酸是指含碳原子数较多的脂肪酸,它们的酸性很弱,在水中溶解度不大甚至难溶于水,常见高级脂肪酸有:
C17H35COOH
硬脂酸
C17H33COOH
油 酸
C15H31COOH
软脂酸
C17H31COOH
亚油酸
高级脂肪酸
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
乙酸甲酯
足量
浓H2SO4
浓H2SO4
二乙酸乙二酯
乙二酸二乙酯
课堂练习
4.写出下列反应方程式:
2
COOH
COOH
+ HOC2H5
足量
2
COOH
COOH
COOC2H5
COOC2H5
+H2O
浓H2SO4
+ 2H2O
环乙二酸乙二酯
课堂练习
5.写出下列反应方程式:
HOOCCOOCH2CH2OH + H2O
O O
HO—C—C—OCH2CH2O —H
=
=
n
+ (2n-1)H2O
2CH3CHCOOH
OH
浓H2SO4
创新方案37页左下和右上【名师点拨】。
CH3 O
H—O-CH—C—OH
=
n
+ (n-1)H2O
CH2CH2CH2CH2C—OH
O
OH
︱
浓H2SO4
C
6.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
A 1种 B 2种 C 3 种 D 4种
生成物中水的相对分子质量为 。
20
课堂练习
7.某有机物的结构简式为
它在一定条件下可能发生的反应有
①加成 ②水解 ③酯化 ④氧化
⑤中和 ⑥消去
课堂练习
8. 1mol有机物 与足量NaOH 溶
液充分反应,消耗NaOH 的物质的量为( )
A.5mol B.4mol
C.3mol D.2mol
COOCH3
CH3COO
COOH
B
课堂练习
(1) Na
(2) NaOH
(3) NaHCO3
9. 1mol有机物
最多能消耗下列各物质多少 mol?
HO
CH-CH2
OH
COOH
CH2OH
4
2
1
课堂练习
10. 能用来鉴别乙醇、乙醛、甲酸、乙酸四种无色溶液的试剂是 ( )
A.FeCl3溶液 B.溴水
C.金属钠 D.新制Cu(OH)2
D
甲酸中含有醛基和羧基
课堂练习
11、如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是 ( )
A.①蒸馏、②过滤、③分液
B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液
D.①分液、②蒸馏、③结晶、过滤
B
谢谢欣赏
