5-3-1 醇酚 (1)醇 课件(40张ppt) 2020-2021学年人教版高二化学选修5有机化学基础
文档属性
| 名称 | 5-3-1 醇酚 (1)醇 课件(40张ppt) 2020-2021学年人教版高二化学选修5有机化学基础 |  | |
| 格式 | pptx | ||
| 文件大小 | 48.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-31 21:58:32 | ||
图片预览










文档简介
第三章
烃的含氧衍生物
2021.04: W
学习
目标
第一节
醇酚
1.掌握乙醇的组成、结构和主要化学性质。
2.掌握醇类的取 代反应、消去反应和氧化反应的原理。
3.了解醇类的结构特征、一般通性和几种典型醇的用途。
借 问 酒家何 处 有 ?
牧 童 遥 指 杏 花 村。
明 月 几 时 有 ?
把 酒 问 青 天 !
何以解忧
唯有杜康
(1)
(2)
(3)
新课导入
新课导入
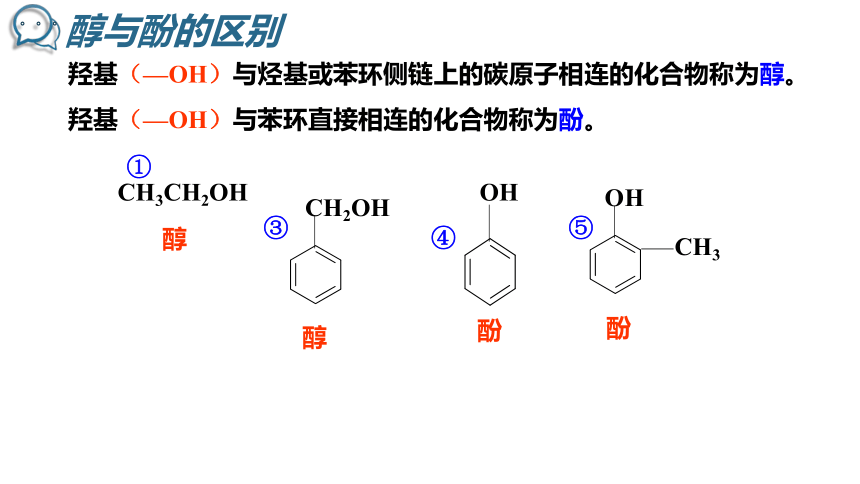
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
醇
酚
醇
OH
CH3CH2OH
CH2OH
OH
CH3
酚
①
③
④
⑤
醇与酚的区别
CH3—CH—CH2—OH
CH3
2—甲基—1—丙醇
CH3—CH—C—OH
CH3
CH2—CH3
CH3
2,3—二甲基—3—戊醇
课堂练习
1.写出下列醇的名称
一.醇类
1、概念
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
2、官能团
名称:羟基 符号: -OH
3、分类
(1)按羟基的数目分:
(2)按烃基是否饱和分:
(3)按烃基种类:
一元醇:如CH3OH
甲醇
二元醇:CH2OH
CH2OH
乙二醇
多元醇:CH2OH
CHOH
CH2OH
丙三醇
饱和醇
不饱和醇
C
H
2
=
C
H
C
H
2
O
H
C
H
3
C
H
2
O
H
脂肪醇
芳香醇
C
H
2
O
H
饱和一元醇通式:
CnH2n+1OH或CnH2n+2O
名称
相对分子质量
沸点/℃
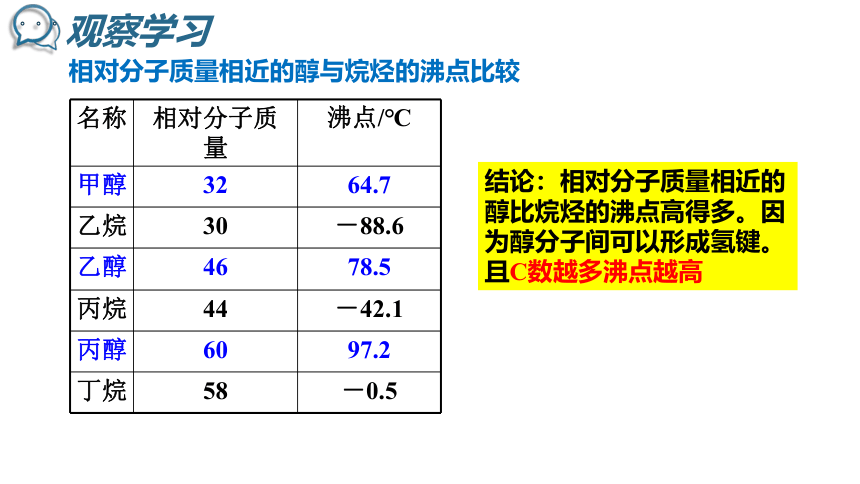
甲醇
32
64.7
乙烷
30
-88.6
乙醇
46
78.5
丙烷
44
-42.1
丙醇
60
97.2
丁烷
58
-0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
观察学习
醇分子间形成氢键
R R R
O O O
H H H H H H
O O O
R R R
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。)
H H
O O
H H H
O
C2H5
表3-2 含相同碳原子数不同羟基数的醇的沸点比较
名称
分子中羟基数目
沸点/℃
乙醇
1
78.5
乙二醇
2
197.3
1-丙醇
1
97.2
1,2-丙二醇
2
188
1,2,3-丙三醇
3
259
结论:相同碳原子数羟基数目越多沸点越高
观察学习
4、物理性质
(1)溶解性:
(2)沸点:
(3)密度:
三个碳以下的醇能与水以任意比互溶,4-11个碳原子的醇为油状液体,部分能溶于水,12个碳以上的醇为无色无味蜡状固体,不溶于水。
饱和一元醇随碳原子数增多,沸点增大。由于醇间能形成氢键,醇的沸点远高于相对分子质量相近的烷。
醇的密度小于水。
二.乙醇
1、物理性质
乙醇是一种无色、有特殊香味的液体,密度比水小,易挥发,易溶于水(跟水以任意比互溶),是一种良好的有机溶剂,俗称酒精。 200C时的密度是0.7893g/cm3
检验C2H5OH(H2O) 。
除杂C2H5OH(H2O) 。
CuSO4
先加CaO后蒸馏
思考交流1:
2、乙醇的结构
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
分子式
结构式
结构简式
官能团
O—H C—O 键的极性较大,易断键。
结构分析
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移,因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
【思考交流2:】试比较乙醇和水的酸性强弱?
能否通过此反应测定有机物的羟基数目?
断①号键
置换反应
观察学习
比较Na与水及乙醇的反应
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
仍是块状
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2 NaOH +H2↑
[结论]乙醇羟基上的氢原子比水中氢原子不活泼。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
每2mol 羟基与足量的Na反应生成1mol H2
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
断①号键
RO—H + Na →
醇钠
2 2 2 RONa + H2↑
置换反应
1.甲醇?乙二醇?丙三醇中分别加入足量的金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
2.22g某醇与足量的金属钠反应收集到标况下的气体336ml,则该醇是( )
A.甲醇 B.异丙醇 C.2-甲基-2-丙醇
C
结论:2-OH——H2可用于快速确定醇中羟基数目
课堂练习
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
思考:
反应条件
结构条件?
思考交流
3.(1)放入几片碎瓷片作用是什么?
(2)浓硫酸的作用是什么?
(3)酒精与浓硫酸体积比为何要为1∶3?
(4)温度计的位置?
(5)为何使液体温度迅速升到170℃并保持在170℃ ?
(6)有何杂质气体,如何除去?
(7)为何可用排水集气法收集?
防止暴沸
催化剂和脱水剂
保证浓硫酸的浓度才能脱水。
水银球置于反应液中测反应物的温度。
(5)在140℃时乙醇将生成乙醚,而温度过高浓硫酸会将乙醇碳化。
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3+H2O
浓H2SO4
140 ℃
C + 2H2SO4 == CO2 + 2SO2 + 2H2O
(7)乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
乙烯难溶于水,密度比空气密度略小。
C2H5OH+2H2SO4(浓)→ 2C+2SO2↑+5H2O
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
③净化装置:
氢氧化钠除去CO2、SO2
NaOH
H2SO4
④干燥装置:
浓硫酸
⑤收集方法:
排水法
2.判断下列物质中那些能发生消去反应
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
OH
CH3
H-OH
CH3—C—CH2—Br
CH3
Cl
CH3-C-CH2-CH3
CH3
Cl
课堂练习
√
?
√
?
√
?
√
?
√
?
3.写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
课堂练习
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ H2O
3、化学性质
(3)取代反应
断②号键
①和浓HX反应:
C2H5 OH + H Br C2H5Br + H2O
△
断①②号键
②分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
+H2O
浓H2SO4
140 ℃
和卤代烃的水解是两个互逆过程
断①号键
③酯化反应:
CH3CH2OH+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
酸脱羟基醇脱氢
3、化学性质
(4)氧化反应
①燃烧:
②与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应。
2CO2 ?+3H2O
C2H5OH +3 O2
点燃
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为灰绿色检验酒驾
酸性高锰酸钾紫红色褪去
焊接银器、铜器时,表面会生成发黑的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初!这是何原理?
观察学习
3、化学性质
(4)氧化反应
③催化氧化:
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:本C有H
下列醇在Cu或Ag的作用下将如何发生催化氧化反应?
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛。
与-OH相连的C原子上有1个H原子的,氧化成酮。
与-OH相连的C原子上没有H原子的,不能催化氧化。
观察分析
4.写出下列方程式
课堂练习
无
2
2CH3—C —CH3
+ 2 H2O
O
CH3
CH3
2CH3—C —CHO
+ 2 H2O
2
有机反应中加氧去氢的叫氧化反应;加氢去氧的成为还原反应
5.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
A.CH3OH B.CH2OHCH2CH3
C.(CH3)3OH D.(CH3)2COHCH2CH3
B
课堂练习
乙醇的化学性质与其结构的关系
课堂小结
有机框图推断中醇的地位
CH3CH2OH CH3CHO CH3COOH
①
②
③
④
⑤
CH3COOCH2CH3
课堂练习
A
课堂练习
C
驾驶员正在接受酒精检查
K2Cr2O7
(橙红色)
Cr2(SO4)3
(绿色)
乙醇
观察学习
谢谢欣赏
烃的含氧衍生物
2021.04: W
学习
目标
第一节
醇酚
1.掌握乙醇的组成、结构和主要化学性质。
2.掌握醇类的取 代反应、消去反应和氧化反应的原理。
3.了解醇类的结构特征、一般通性和几种典型醇的用途。
借 问 酒家何 处 有 ?
牧 童 遥 指 杏 花 村。
明 月 几 时 有 ?
把 酒 问 青 天 !
何以解忧
唯有杜康
(1)
(2)
(3)
新课导入
新课导入
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
醇
酚
醇
OH
CH3CH2OH
CH2OH
OH
CH3
酚
①
③
④
⑤
醇与酚的区别
CH3—CH—CH2—OH
CH3
2—甲基—1—丙醇
CH3—CH—C—OH
CH3
CH2—CH3
CH3
2,3—二甲基—3—戊醇
课堂练习
1.写出下列醇的名称
一.醇类
1、概念
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
2、官能团
名称:羟基 符号: -OH
3、分类
(1)按羟基的数目分:
(2)按烃基是否饱和分:
(3)按烃基种类:
一元醇:如CH3OH
甲醇
二元醇:CH2OH
CH2OH
乙二醇
多元醇:CH2OH
CHOH
CH2OH
丙三醇
饱和醇
不饱和醇
C
H
2
=
C
H
C
H
2
O
H
C
H
3
C
H
2
O
H
脂肪醇
芳香醇
C
H
2
O
H
饱和一元醇通式:
CnH2n+1OH或CnH2n+2O
名称
相对分子质量
沸点/℃
甲醇
32
64.7
乙烷
30
-88.6
乙醇
46
78.5
丙烷
44
-42.1
丙醇
60
97.2
丁烷
58
-0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
观察学习
醇分子间形成氢键
R R R
O O O
H H H H H H
O O O
R R R
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。)
H H
O O
H H H
O
C2H5
表3-2 含相同碳原子数不同羟基数的醇的沸点比较
名称
分子中羟基数目
沸点/℃
乙醇
1
78.5
乙二醇
2
197.3
1-丙醇
1
97.2
1,2-丙二醇
2
188
1,2,3-丙三醇
3
259
结论:相同碳原子数羟基数目越多沸点越高
观察学习
4、物理性质
(1)溶解性:
(2)沸点:
(3)密度:
三个碳以下的醇能与水以任意比互溶,4-11个碳原子的醇为油状液体,部分能溶于水,12个碳以上的醇为无色无味蜡状固体,不溶于水。
饱和一元醇随碳原子数增多,沸点增大。由于醇间能形成氢键,醇的沸点远高于相对分子质量相近的烷。
醇的密度小于水。
二.乙醇
1、物理性质
乙醇是一种无色、有特殊香味的液体,密度比水小,易挥发,易溶于水(跟水以任意比互溶),是一种良好的有机溶剂,俗称酒精。 200C时的密度是0.7893g/cm3
检验C2H5OH(H2O) 。
除杂C2H5OH(H2O) 。
CuSO4
先加CaO后蒸馏
思考交流1:
2、乙醇的结构
C2H6O
H—C—C—O—H
H
H
H
H
CH3CH2OH
或C2H5OH
—OH(羟基)
分子式
结构式
结构简式
官能团
O—H C—O 键的极性较大,易断键。
结构分析
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移,因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
【思考交流2:】试比较乙醇和水的酸性强弱?
能否通过此反应测定有机物的羟基数目?
断①号键
置换反应
观察学习
比较Na与水及乙醇的反应
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
仍是块状
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2 NaOH +H2↑
[结论]乙醇羟基上的氢原子比水中氢原子不活泼。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
每2mol 羟基与足量的Na反应生成1mol H2
3、化学性质
(1)与活泼金属如Na的反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
断①号键
RO—H + Na →
醇钠
2 2 2 RONa + H2↑
置换反应
1.甲醇?乙二醇?丙三醇中分别加入足量的金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
2.22g某醇与足量的金属钠反应收集到标况下的气体336ml,则该醇是( )
A.甲醇 B.异丙醇 C.2-甲基-2-丙醇
C
结论:2-OH——H2可用于快速确定醇中羟基数目
课堂练习
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
思考:
反应条件
结构条件?
思考交流
3.(1)放入几片碎瓷片作用是什么?
(2)浓硫酸的作用是什么?
(3)酒精与浓硫酸体积比为何要为1∶3?
(4)温度计的位置?
(5)为何使液体温度迅速升到170℃并保持在170℃ ?
(6)有何杂质气体,如何除去?
(7)为何可用排水集气法收集?
防止暴沸
催化剂和脱水剂
保证浓硫酸的浓度才能脱水。
水银球置于反应液中测反应物的温度。
(5)在140℃时乙醇将生成乙醚,而温度过高浓硫酸会将乙醇碳化。
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3+H2O
浓H2SO4
140 ℃
C + 2H2SO4 == CO2 + 2SO2 + 2H2O
(7)乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
乙烯难溶于水,密度比空气密度略小。
C2H5OH+2H2SO4(浓)→ 2C+2SO2↑+5H2O
3、化学性质
(2)消去反应-实验室制乙烯
断②⑤号键
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
①反应原理:
②发生装置:
液+液→气
③净化装置:
氢氧化钠除去CO2、SO2
NaOH
H2SO4
④干燥装置:
浓硫酸
⑤收集方法:
排水法
2.判断下列物质中那些能发生消去反应
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
OH
CH3
H-OH
CH3—C—CH2—Br
CH3
Cl
CH3-C-CH2-CH3
CH3
Cl
课堂练习
√
?
√
?
√
?
√
?
√
?
3.写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
课堂练习
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ H2O
3、化学性质
(3)取代反应
断②号键
①和浓HX反应:
C2H5 OH + H Br C2H5Br + H2O
△
断①②号键
②分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
+H2O
浓H2SO4
140 ℃
和卤代烃的水解是两个互逆过程
断①号键
③酯化反应:
CH3CH2OH+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
酸脱羟基醇脱氢
3、化学性质
(4)氧化反应
①燃烧:
②与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应。
2CO2 ?+3H2O
C2H5OH +3 O2
点燃
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为灰绿色检验酒驾
酸性高锰酸钾紫红色褪去
焊接银器、铜器时,表面会生成发黑的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初!这是何原理?
观察学习
3、化学性质
(4)氧化反应
③催化氧化:
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:本C有H
下列醇在Cu或Ag的作用下将如何发生催化氧化反应?
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛。
与-OH相连的C原子上有1个H原子的,氧化成酮。
与-OH相连的C原子上没有H原子的,不能催化氧化。
观察分析
4.写出下列方程式
课堂练习
无
2
2CH3—C —CH3
+ 2 H2O
O
CH3
CH3
2CH3—C —CHO
+ 2 H2O
2
有机反应中加氧去氢的叫氧化反应;加氢去氧的成为还原反应
5.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
A.CH3OH B.CH2OHCH2CH3
C.(CH3)3OH D.(CH3)2COHCH2CH3
B
课堂练习
乙醇的化学性质与其结构的关系
课堂小结
有机框图推断中醇的地位
CH3CH2OH CH3CHO CH3COOH
①
②
③
④
⑤
CH3COOCH2CH3
课堂练习
A
课堂练习
C
驾驶员正在接受酒精检查
K2Cr2O7
(橙红色)
Cr2(SO4)3
(绿色)
乙醇
观察学习
谢谢欣赏
