5-3-2 醛 课件(44张ppt) 2020-2021学年人教版高二化学选修5有机化学基础
文档属性
| 名称 | 5-3-2 醛 课件(44张ppt) 2020-2021学年人教版高二化学选修5有机化学基础 |  | |
| 格式 | pptx | ||
| 文件大小 | 55.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-31 22:00:47 | ||
图片预览








文档简介
第三章
烃的含氧衍生物
2021.04: W
学习
目标
第二节
醛
1. 了解醛类的物理性质、用途、和一些常见的醛。
2.理解乙醛的氧化反应和还原反应的原理,掌握乙醛的化学性质。
3.了解银氨溶液的配制方法。
为求延长保质期 不良奸商竟然给冰鲜鱼浸甲醛保鲜,食用甲醛过量会休克和致癌 。
花20多万元买辆轿车 开了一周后嗓子发炎、人发烧 经检测车内甲醛含量高
新装修的房子,甲醛超标易诱发儿童白血病
生活中的醛
茴香醛
对甲氧基苯甲醛;
主要用作山楂、葵花、紫丁香等香精的香基。
视黄醛也称维生素A醛,分子式:C20H28O;
视黄醛是眼球发育中重要的信号转导分子,其在脊椎动物的眼球发育中具有多种不同的重要作用。
视黄醛
【生活常识】由“酒后不要立即饮茶”
(本草纲目记载:酒后饮茶伤肾,腰腿坠重,膀胱冷痛,兼患痰饮水肿)。
【原因】酒精在肝脏中→乙醛→乙酸→CO2和H2O。但是,浓茶中含有较多茶碱会使尚未分解的乙醛过早进入肾脏,损害很大。
生活中的醛
室内去除甲醛植物高手
吊兰
绿萝
白掌
袖珍椰子
生活知识
一.醛类
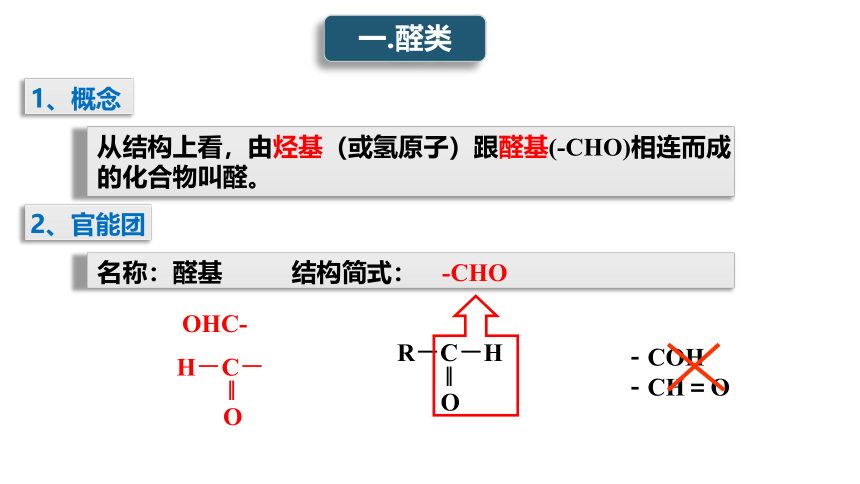
1、概念
从结构上看,由烃基(或氢原子)跟醛基(-CHO)相连而成的化合物叫醛。
2、官能团
名称:醛基 结构简式: -CHO
R-C-H
‖
O
OHC-
H-C-
‖
O
-COH
-CH=O
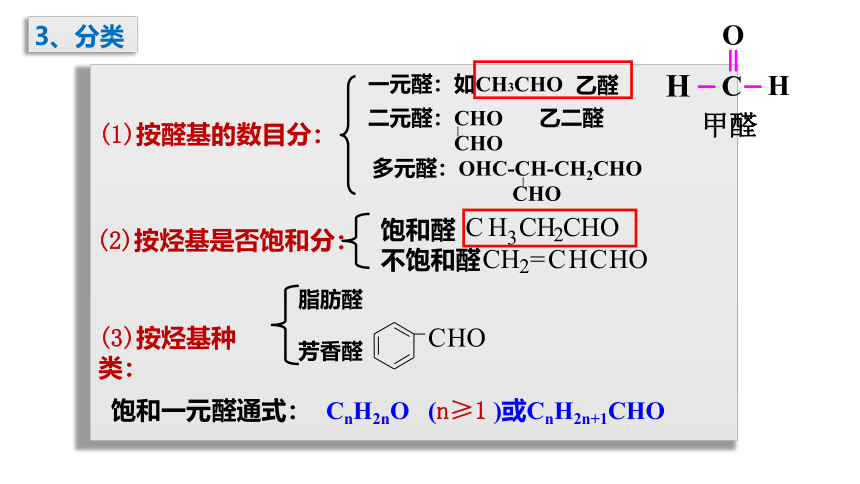
3、分类
(1)按醛基的数目分:
(2)按烃基是否饱和分:
(3)按烃基种类:
一元醛:如CH3CHO
乙醛
二元醛:CHO
CHO
乙二醛
多元醛:OHC-CH-CH2CHO
CHO
饱和醛
不饱和醛
C
H
2
=
C
H
C
HO
C
H
3
C
H
2
CHO
脂肪醛
芳香醛
C
HO
饱和一元醛通式:
CnH2nO (n≥1 )或CnH2n+1CHO
C
O
H
H
甲醛
4、物理性质
醛基是亲水基,三个碳以下的醛能与水以任意比互溶。
醛类一般有刺激性气味,除甲醛是气体外,其余均为无色液体或固体,熔沸点随C原子数增加而升高,密度一般比水小。
醛与哪些类别的物质是同分异构体?
按要求写同分异构体:
(1)C5H10O属于醛的同分异构体有 种,分别为?
(2) 写出C3H6O的同分异构体?
思考交流
醛、酮、烯醇、环醇、环醚等
C-C-C-C
C-C-C
C
“→” 表示醛基的位置
4
C4H9?CHO
CH3-CH2-C-H
O
CH3-C-CH3
O
CH2=CH-CH2-OH
—OH
CH2=C-O-CH3
O
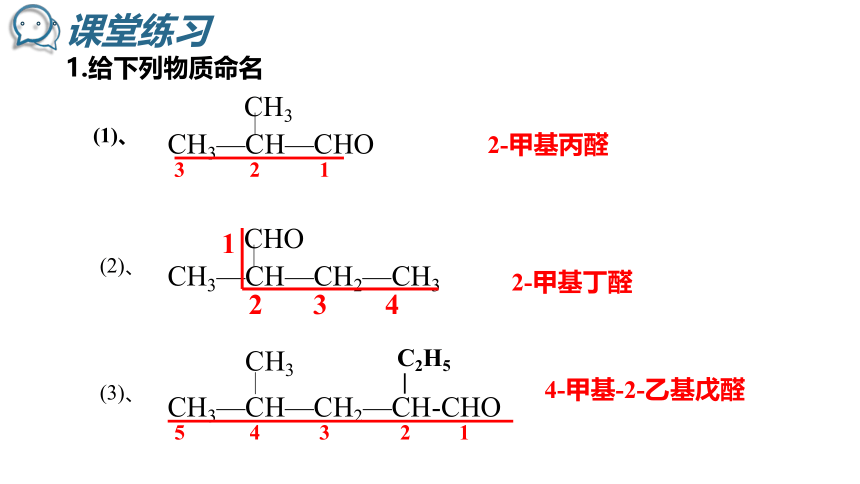
1.给下列物质命名
(1)、
CH3—CH—CHO
CH3
(2)、
CH3—CH—CH2—CH3
CHO
2-甲基丙醛
2-甲基丁醛
(3)、
4-甲基-2-乙基戊醛
CH3—CH—CH2—CH-CHO
CH3
C2H5
5 4 3 2 1
1
2 3 4
3 2 1
课堂练习
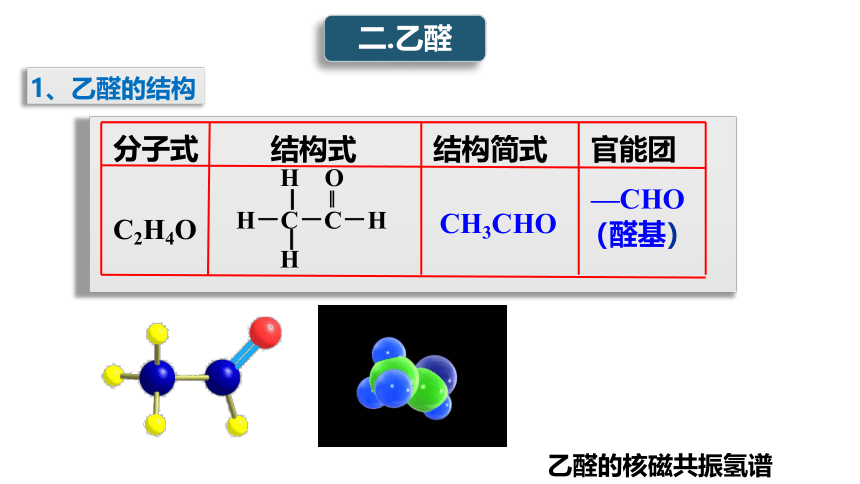
1、乙醛的结构
C2H4O
CH3CHO
—CHO(醛基)
分子式
结构式
结构简式
官能团
二.乙醛
H O
▏ ‖
H-C-C-H
▏
H
乙醛的核磁共振氢谱
2、物理性质
常温下为无色有刺激性气味的液体,密度比水小,沸点:20.8℃,易挥发,易燃烧,能与水、乙醇、乙醚、氯仿等互溶。
乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
用H2O
思考交流2:
3.对比乙醇和乙醛的结构,从键的饱和程度和键的极性预测乙醛的化学性质。
CH3—CH2—O—H
CH3—C—H
O
思考交流
CH3CH2OH
CH3CHO
CH3COOH
乙醇
乙醛
乙酸
被还原
被氧化
加氢
加氧
3、化学性质
(1)加成反应
这类加成反应在有机合成中可用于增长碳链
与-CHO加成的物质有:H2、HCN
CH3CHO+H2 CH3CH2OH
催化剂
CH3-C-H
O
+ H—H
CH3-C-H
O-H
H
催化剂
+
d–
d+
催化剂
d–
d+
有机物得氢或去氧, 发生还原反应
有机物得氧或去氢, 发生氧化反应
(还原反应)
课堂练习
2.写出下列反应的化学方程式
H-C-C-H和 分别与H2加成
O
‖
O
‖
H-C-C-H+2H2
O
‖
O
‖
CH2-CH2
OH
OH
催化剂
△
C
HO
C
HO
+4H2
催化剂
△
C
H2OH
3、化学性质
(2)氧化反应
①燃烧
O
2CH3—C—H
+ O2 2CH3C-O-H
催化剂
△
O
2CH3CHO + 5O2 4CO2 + 4H2O
点燃
②催化氧化
乙醛能使KMnO4/H+褪色吗?能使溴水褪色吗?
乙醛可使溴水和酸性KMnO4溶液褪色
③与强氧化剂反应:乙醛具有还原性
CH3CHO+Br2+H2O → CH3COOH+ 2HBr
5CH3CHO+2KMnO4+3H2SO4 →5CH3COOH+2MnSO4+
K2SO4+3H2O
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
银镜反应
—与银氨溶液的反应
观察学习
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
银镜反应
—与银氨溶液的反应
银氨溶液的配置:教材57页实验3-5
向AgNO3溶液中逐滴滴加稀氨水至最初产生的沉淀恰好溶解为止。
AgNO3 + NH3·H2O = AgOH↓+ NH4NO3
AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O
氢氧化二氨合银
[Ag(NH3)2]+-银氨络(合)离子
CH3CHO + 2[Ag(NH3)2]OH
H2O+ 2Ag↓+3NH3 +CH3COONH4
水浴
现象:
试管内有光亮的银镜产生
巧记方程式:水银氨,一二三,再加一摩乙酸铵
定量:
R-CHO~2Ag(1个醛基2个银)
思考交流
4.银镜反应有什么用途? 怎样清洗做过银镜反应的试管?
银镜反应的应用:
(1)检验醛基,并测定醛基的个数
实验后:银镜用HNO3浸泡,再用水洗。
(-CHO—2Ag)
(2)制镜或水瓶胆(用含醛基的葡萄糖)
实验前:洁净的试管——热NaOH溶液洗,再水洗
1.试管内壁应洁净
2.必须用水浴加热,不能用酒精灯加热。
3.加热时不能振荡试管和摇动试管。
4.配制银氨溶液时,氨水不能过多或过少只能加到AgOH (Ag2O)沉淀刚好消失。
5.碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵。
6.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质叠氮化银(AgN3)。
银镜反应的注意事项
课堂练习
3.写出下列反应的化学方程式
H-C-C-H和 及葡萄糖分别发生银镜反应的方程式
O
‖
O
‖
H-C-C-H
O
‖
O
‖
C
HO
C
HO
+4[Ag(NH3)2]OH 2H2O+ 4Ag↓+6NH3 +
水浴
H4NO-C-C-ONH4
O
‖
O
‖
+2[Ag(NH3)2]OH H2O+ 2Ag↓+3NH3 +
水浴
COONH4
CH2OH(CHOH)4CHO+2Ag(NH3)2OH H2O +
CH2OH(CHOH)4COONH4 + 2Ag↓+ 3NH3
水浴
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
与新制Cu(OH)2悬浊液反应
观察学习
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
银镜反应
—与银氨溶液的反应
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
氧化亚铜
CH3CHO + 2Cu(OH)2+OH- CH3COO- + Cu2O↓ + 3H2O
△
现象:
溶液中有砖红色的沉淀产生
CH3CHO+2Cu(OH)2+NaOH
CH3COONa+3H2O+Cu2O↓
△
注意:a.Cu(OH)2应现配现用;
b.成功条件:碱性环境(碱过量)、加热.
b.医院里,利用这一反应原理检查尿糖是否正(检查
葡萄糖的醛基)
-CHO ~ Cu2O
应用:a.检验醛基并测定醛基的个数
课堂练习
4.写出下列反应的化学方程式
H-C-C-H和 分别与新制Cu(OH)2反应的方程式
O
‖
O
‖
H-C-C-H
O
‖
O
‖
C
HO
C
HO
NaO-C-C-ONa
O
‖
O
‖
COONa
+4Cu(OH)2+NaOH +3H2O+Cu2O↓
△
+ 4Cu(OH)2+NaOH +3H2O+Cu2O↓
△
4、乙醛的制备
(1)乙炔水化法
CH≡CH+H2O → CH3CHO
催化剂
△
(2)乙烯氧化法:
2CH2=CH2+O2 → 2CH3CHO
(3)乙醇氧化法:
2CH3CH2OH+O2 → 2CH3CHO+2H2O
催化剂
△
催化剂
△
课堂小结
上的氧化反应,在
C-H之间插入O
上的加成反应
发生在
发生在
醛基
燃烧
催化氧化
被弱氧化剂氧化
银氨溶液
新制的Cu(OH)2
O
CH3 C OH
得[O]
得H
CH3 CH2OH
氧化性
还原性
使酸性高锰酸钾溶液、溴水褪色
2
CH3CHO CH3COOH
[O]
1
-CHO— 2 Ag(NH3)2OH — 2 Ag
1
2
2
-CHO—2 Cu(OH)2—Cu2O
1
乙醛在氧化反应中的计量关系
1、物理性质
(1)甲醛又叫蚁醛,是一种无色具有强烈刺激性气味的气体(含氧衍生物唯一常温为气体的物质),易溶于水。
(2)福尔马林是质量分数含35%~40%的甲醛水溶液。甲醛的水溶液具有杀菌和防腐能力,是一种良好的杀菌剂。
(3)居室污染的主要气体之一。
三.甲醛
2、甲醛的结构
CH2O
HCHO
四个原子共平面,分子中有两个醛基
分子式
结构式
结构简式
结构特点
O
‖
H-C-H
H-C-H
‖
O
相当于含两个醛基
3、化学性质
同乙醛
课堂练习
5.写出甲醛与H2、O2催化氧化、银氨溶液、新制Cu(OH)2的反应方程式。
O=
H—C—H + H—H CH3OH
Ni
△
(H2CO3)
2HCHO+O2 2HCOOH
催化剂
或:HCHO+O2
H-O-C-O-H
O
催化剂
H—C—O-H
O=
HCHO+4[Ag(NH3)2]++4OH-
△
(NH4)2CO3 +4Ag↓+6NH3+2H2O
HCHO+4Cu(OH)2+2OH-
△
CO32-+2Cu2O↓+6H2O
注意:甲醛分子中相当于含有2个醛基,1mol甲醛反应最多可生成4molAg或2molCu2O。
3、化学性质
同乙醛
n + n +nH2O
—
OH
O=
H—C—H
[ ]n
—
OH
CH2
HCl
100℃
酚醛树脂
缩聚反应
丙酮是最简单的酮类化合物。无色透明的液体,沸点56.5 ℃,易挥发,易燃,具有微香气味,能与水、有机物混溶,是一种重要的有机溶剂和化工原料。
加成
反应
O=
H3C—C—CH3 + H-H CH3CHOHCH3
Ni
△
C
R’
O
R
酮类
官能团:
—C—
O
丙酮不能被银氨溶液、新制氢氧化铜等弱氧化剂氧化,可催化加氢成醇。
知识归纳
1、哪些有机物能发生银镜反应?
2、哪些物质能使酸性KMnO4溶液褪色?
⑴烯、炔烃、裂化汽油等不饱和烃;⑵苯的同系物;⑶含羟基(-OH),醛基(-CHO)等还原性有机物;⑷SO2、H2S、FeCl2等还原性物质。
醛类、HCOOH、甲酸盐、HCOOR、葡萄糖、麦芽糖
3、哪些物质能溴水溶液褪色?
⑴烯、炔烃、裂化汽油等不饱和烃;
⑵含醛基(-CHO)等还原性有机物;
⑶发生取代反应的苯酚的同系物;
(4)萃取
烯、炔、酚、醛、苯的同系物、醇
烯、炔、酚、醛
6、判断下列哪些不能使酸性KMnO4溶液褪色?
乙烯、甲烷、苯、 乙酸、甲苯、乙醛、葡萄糖、SO2、H2S、苯酚、聚异戊二烯、裂化汽油
7、用一种试剂鉴别乙醇、乙醛、乙酸、甲酸四种无色液体。
新制的Cu(OH)2
课堂练习
课堂练习
8.丙烯醛的结构简式为CH2=CH-CHO,下列有关它的性质叙述中错误的是( )
A.能使溴水褪色,也能使酸性高锰酸钾褪色
B.在一定条件下与H2充分反应生成1—丙醇
C.能发生银镜反应,表现氧化性
D.在一定条件下能被空气氧化
C
9、已知柠檬醛的结构简式为:CH3C=CHCH2CH2CH=CHCHO
CH3
若要检验出其中的碳碳双键,其方法?
先加足量的银氨溶液(或新制的Cu(OH)2)使醛基氧化(排除醛基干扰)。然后再用酸性KMnO4溶液(或溴水)检验碳碳双键,碳碳双键能使酸性KMnO4溶液(或溴水)褪色
课堂练习
课堂练习
10.已知烯烃在一定条件下氧化时,C=C键断裂,RCH=CHR’可氧化成RCHO和R’CHO。下列烯烃中,经氧化可得到乙醛和丁醛的是:
A.1—己烯 B. 2—己烯
C.2—甲基—2—戊烯 D. 3—己烯
B
(1)现有一化合物A,是由B、C两物质通过上述反应生成的。试根据A的结构式写出B、C的结构式。
CH3 H
A:CH3-C-CH2-C=O
OH
B:
C:
CH3CHO
O
CH3-C-CH3
11、信息迁移应用
已知:
RC=O +H-CH2CHO
OH
→ R-CH-CH2-CHO
课堂练习
H
(2)根据上述信息,用乙炔合成1-丁醇。
CH≡CH→CH3CHO→CH3CHCH2CHO
OH
→CH3CH=CHCHO→CH3CH2CH2CH2OH
课堂练习
11、信息迁移应用
已知:
RC=O +H-CH2CHO
OH
→ R-CH-CH2-CHO
H
12.分子式为C9H10O2的有机物有多种同分异构体,其中某些物质有下列特征:
①其水溶液遇FeCl3溶液呈紫色;
②与新制备的Cu(OH)2共热有红色沉淀生成
③分子中有苯环结构,苯环上有两个取代基且苯环上的一溴代物有两种。
写出符合上述条件的G物质所有可能的结构简式:
课堂练习
谢谢欣赏
烃的含氧衍生物
2021.04: W
学习
目标
第二节
醛
1. 了解醛类的物理性质、用途、和一些常见的醛。
2.理解乙醛的氧化反应和还原反应的原理,掌握乙醛的化学性质。
3.了解银氨溶液的配制方法。
为求延长保质期 不良奸商竟然给冰鲜鱼浸甲醛保鲜,食用甲醛过量会休克和致癌 。
花20多万元买辆轿车 开了一周后嗓子发炎、人发烧 经检测车内甲醛含量高
新装修的房子,甲醛超标易诱发儿童白血病
生活中的醛
茴香醛
对甲氧基苯甲醛;
主要用作山楂、葵花、紫丁香等香精的香基。
视黄醛也称维生素A醛,分子式:C20H28O;
视黄醛是眼球发育中重要的信号转导分子,其在脊椎动物的眼球发育中具有多种不同的重要作用。
视黄醛
【生活常识】由“酒后不要立即饮茶”
(本草纲目记载:酒后饮茶伤肾,腰腿坠重,膀胱冷痛,兼患痰饮水肿)。
【原因】酒精在肝脏中→乙醛→乙酸→CO2和H2O。但是,浓茶中含有较多茶碱会使尚未分解的乙醛过早进入肾脏,损害很大。
生活中的醛
室内去除甲醛植物高手
吊兰
绿萝
白掌
袖珍椰子
生活知识
一.醛类
1、概念
从结构上看,由烃基(或氢原子)跟醛基(-CHO)相连而成的化合物叫醛。
2、官能团
名称:醛基 结构简式: -CHO
R-C-H
‖
O
OHC-
H-C-
‖
O
-COH
-CH=O
3、分类
(1)按醛基的数目分:
(2)按烃基是否饱和分:
(3)按烃基种类:
一元醛:如CH3CHO
乙醛
二元醛:CHO
CHO
乙二醛
多元醛:OHC-CH-CH2CHO
CHO
饱和醛
不饱和醛
C
H
2
=
C
H
C
HO
C
H
3
C
H
2
CHO
脂肪醛
芳香醛
C
HO
饱和一元醛通式:
CnH2nO (n≥1 )或CnH2n+1CHO
C
O
H
H
甲醛
4、物理性质
醛基是亲水基,三个碳以下的醛能与水以任意比互溶。
醛类一般有刺激性气味,除甲醛是气体外,其余均为无色液体或固体,熔沸点随C原子数增加而升高,密度一般比水小。
醛与哪些类别的物质是同分异构体?
按要求写同分异构体:
(1)C5H10O属于醛的同分异构体有 种,分别为?
(2) 写出C3H6O的同分异构体?
思考交流
醛、酮、烯醇、环醇、环醚等
C-C-C-C
C-C-C
C
“→” 表示醛基的位置
4
C4H9?CHO
CH3-CH2-C-H
O
CH3-C-CH3
O
CH2=CH-CH2-OH
—OH
CH2=C-O-CH3
O
1.给下列物质命名
(1)、
CH3—CH—CHO
CH3
(2)、
CH3—CH—CH2—CH3
CHO
2-甲基丙醛
2-甲基丁醛
(3)、
4-甲基-2-乙基戊醛
CH3—CH—CH2—CH-CHO
CH3
C2H5
5 4 3 2 1
1
2 3 4
3 2 1
课堂练习
1、乙醛的结构
C2H4O
CH3CHO
—CHO(醛基)
分子式
结构式
结构简式
官能团
二.乙醛
H O
▏ ‖
H-C-C-H
▏
H
乙醛的核磁共振氢谱
2、物理性质
常温下为无色有刺激性气味的液体,密度比水小,沸点:20.8℃,易挥发,易燃烧,能与水、乙醇、乙醚、氯仿等互溶。
乙醛、苯、CCl4均为无色液体,如何用最简便的方法鉴别?
用H2O
思考交流2:
3.对比乙醇和乙醛的结构,从键的饱和程度和键的极性预测乙醛的化学性质。
CH3—CH2—O—H
CH3—C—H
O
思考交流
CH3CH2OH
CH3CHO
CH3COOH
乙醇
乙醛
乙酸
被还原
被氧化
加氢
加氧
3、化学性质
(1)加成反应
这类加成反应在有机合成中可用于增长碳链
与-CHO加成的物质有:H2、HCN
CH3CHO+H2 CH3CH2OH
催化剂
CH3-C-H
O
+ H—H
CH3-C-H
O-H
H
催化剂
+
d–
d+
催化剂
d–
d+
有机物得氢或去氧, 发生还原反应
有机物得氧或去氢, 发生氧化反应
(还原反应)
课堂练习
2.写出下列反应的化学方程式
H-C-C-H和 分别与H2加成
O
‖
O
‖
H-C-C-H+2H2
O
‖
O
‖
CH2-CH2
OH
OH
催化剂
△
C
HO
C
HO
+4H2
催化剂
△
C
H2OH
3、化学性质
(2)氧化反应
①燃烧
O
2CH3—C—H
+ O2 2CH3C-O-H
催化剂
△
O
2CH3CHO + 5O2 4CO2 + 4H2O
点燃
②催化氧化
乙醛能使KMnO4/H+褪色吗?能使溴水褪色吗?
乙醛可使溴水和酸性KMnO4溶液褪色
③与强氧化剂反应:乙醛具有还原性
CH3CHO+Br2+H2O → CH3COOH+ 2HBr
5CH3CHO+2KMnO4+3H2SO4 →5CH3COOH+2MnSO4+
K2SO4+3H2O
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
银镜反应
—与银氨溶液的反应
观察学习
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
银镜反应
—与银氨溶液的反应
银氨溶液的配置:教材57页实验3-5
向AgNO3溶液中逐滴滴加稀氨水至最初产生的沉淀恰好溶解为止。
AgNO3 + NH3·H2O = AgOH↓+ NH4NO3
AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O
氢氧化二氨合银
[Ag(NH3)2]+-银氨络(合)离子
CH3CHO + 2[Ag(NH3)2]OH
H2O+ 2Ag↓+3NH3 +CH3COONH4
水浴
现象:
试管内有光亮的银镜产生
巧记方程式:水银氨,一二三,再加一摩乙酸铵
定量:
R-CHO~2Ag(1个醛基2个银)
思考交流
4.银镜反应有什么用途? 怎样清洗做过银镜反应的试管?
银镜反应的应用:
(1)检验醛基,并测定醛基的个数
实验后:银镜用HNO3浸泡,再用水洗。
(-CHO—2Ag)
(2)制镜或水瓶胆(用含醛基的葡萄糖)
实验前:洁净的试管——热NaOH溶液洗,再水洗
1.试管内壁应洁净
2.必须用水浴加热,不能用酒精灯加热。
3.加热时不能振荡试管和摇动试管。
4.配制银氨溶液时,氨水不能过多或过少只能加到AgOH (Ag2O)沉淀刚好消失。
5.碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵。
6.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质叠氮化银(AgN3)。
银镜反应的注意事项
课堂练习
3.写出下列反应的化学方程式
H-C-C-H和 及葡萄糖分别发生银镜反应的方程式
O
‖
O
‖
H-C-C-H
O
‖
O
‖
C
HO
C
HO
+4[Ag(NH3)2]OH 2H2O+ 4Ag↓+6NH3 +
水浴
H4NO-C-C-ONH4
O
‖
O
‖
+2[Ag(NH3)2]OH H2O+ 2Ag↓+3NH3 +
水浴
COONH4
CH2OH(CHOH)4CHO+2Ag(NH3)2OH H2O +
CH2OH(CHOH)4COONH4 + 2Ag↓+ 3NH3
水浴
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
与新制Cu(OH)2悬浊液反应
观察学习
3、化学性质
(2)氧化反应
④被弱氧化剂氧化(检验醛基)
银镜反应
—与银氨溶液的反应
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
氧化亚铜
CH3CHO + 2Cu(OH)2+OH- CH3COO- + Cu2O↓ + 3H2O
△
现象:
溶液中有砖红色的沉淀产生
CH3CHO+2Cu(OH)2+NaOH
CH3COONa+3H2O+Cu2O↓
△
注意:a.Cu(OH)2应现配现用;
b.成功条件:碱性环境(碱过量)、加热.
b.医院里,利用这一反应原理检查尿糖是否正(检查
葡萄糖的醛基)
-CHO ~ Cu2O
应用:a.检验醛基并测定醛基的个数
课堂练习
4.写出下列反应的化学方程式
H-C-C-H和 分别与新制Cu(OH)2反应的方程式
O
‖
O
‖
H-C-C-H
O
‖
O
‖
C
HO
C
HO
NaO-C-C-ONa
O
‖
O
‖
COONa
+4Cu(OH)2+NaOH +3H2O+Cu2O↓
△
+ 4Cu(OH)2+NaOH +3H2O+Cu2O↓
△
4、乙醛的制备
(1)乙炔水化法
CH≡CH+H2O → CH3CHO
催化剂
△
(2)乙烯氧化法:
2CH2=CH2+O2 → 2CH3CHO
(3)乙醇氧化法:
2CH3CH2OH+O2 → 2CH3CHO+2H2O
催化剂
△
催化剂
△
课堂小结
上的氧化反应,在
C-H之间插入O
上的加成反应
发生在
发生在
醛基
燃烧
催化氧化
被弱氧化剂氧化
银氨溶液
新制的Cu(OH)2
O
CH3 C OH
得[O]
得H
CH3 CH2OH
氧化性
还原性
使酸性高锰酸钾溶液、溴水褪色
2
CH3CHO CH3COOH
[O]
1
-CHO— 2 Ag(NH3)2OH — 2 Ag
1
2
2
-CHO—2 Cu(OH)2—Cu2O
1
乙醛在氧化反应中的计量关系
1、物理性质
(1)甲醛又叫蚁醛,是一种无色具有强烈刺激性气味的气体(含氧衍生物唯一常温为气体的物质),易溶于水。
(2)福尔马林是质量分数含35%~40%的甲醛水溶液。甲醛的水溶液具有杀菌和防腐能力,是一种良好的杀菌剂。
(3)居室污染的主要气体之一。
三.甲醛
2、甲醛的结构
CH2O
HCHO
四个原子共平面,分子中有两个醛基
分子式
结构式
结构简式
结构特点
O
‖
H-C-H
H-C-H
‖
O
相当于含两个醛基
3、化学性质
同乙醛
课堂练习
5.写出甲醛与H2、O2催化氧化、银氨溶液、新制Cu(OH)2的反应方程式。
O=
H—C—H + H—H CH3OH
Ni
△
(H2CO3)
2HCHO+O2 2HCOOH
催化剂
或:HCHO+O2
H-O-C-O-H
O
催化剂
H—C—O-H
O=
HCHO+4[Ag(NH3)2]++4OH-
△
(NH4)2CO3 +4Ag↓+6NH3+2H2O
HCHO+4Cu(OH)2+2OH-
△
CO32-+2Cu2O↓+6H2O
注意:甲醛分子中相当于含有2个醛基,1mol甲醛反应最多可生成4molAg或2molCu2O。
3、化学性质
同乙醛
n + n +nH2O
—
OH
O=
H—C—H
[ ]n
—
OH
CH2
HCl
100℃
酚醛树脂
缩聚反应
丙酮是最简单的酮类化合物。无色透明的液体,沸点56.5 ℃,易挥发,易燃,具有微香气味,能与水、有机物混溶,是一种重要的有机溶剂和化工原料。
加成
反应
O=
H3C—C—CH3 + H-H CH3CHOHCH3
Ni
△
C
R’
O
R
酮类
官能团:
—C—
O
丙酮不能被银氨溶液、新制氢氧化铜等弱氧化剂氧化,可催化加氢成醇。
知识归纳
1、哪些有机物能发生银镜反应?
2、哪些物质能使酸性KMnO4溶液褪色?
⑴烯、炔烃、裂化汽油等不饱和烃;⑵苯的同系物;⑶含羟基(-OH),醛基(-CHO)等还原性有机物;⑷SO2、H2S、FeCl2等还原性物质。
醛类、HCOOH、甲酸盐、HCOOR、葡萄糖、麦芽糖
3、哪些物质能溴水溶液褪色?
⑴烯、炔烃、裂化汽油等不饱和烃;
⑵含醛基(-CHO)等还原性有机物;
⑶发生取代反应的苯酚的同系物;
(4)萃取
烯、炔、酚、醛、苯的同系物、醇
烯、炔、酚、醛
6、判断下列哪些不能使酸性KMnO4溶液褪色?
乙烯、甲烷、苯、 乙酸、甲苯、乙醛、葡萄糖、SO2、H2S、苯酚、聚异戊二烯、裂化汽油
7、用一种试剂鉴别乙醇、乙醛、乙酸、甲酸四种无色液体。
新制的Cu(OH)2
课堂练习
课堂练习
8.丙烯醛的结构简式为CH2=CH-CHO,下列有关它的性质叙述中错误的是( )
A.能使溴水褪色,也能使酸性高锰酸钾褪色
B.在一定条件下与H2充分反应生成1—丙醇
C.能发生银镜反应,表现氧化性
D.在一定条件下能被空气氧化
C
9、已知柠檬醛的结构简式为:CH3C=CHCH2CH2CH=CHCHO
CH3
若要检验出其中的碳碳双键,其方法?
先加足量的银氨溶液(或新制的Cu(OH)2)使醛基氧化(排除醛基干扰)。然后再用酸性KMnO4溶液(或溴水)检验碳碳双键,碳碳双键能使酸性KMnO4溶液(或溴水)褪色
课堂练习
课堂练习
10.已知烯烃在一定条件下氧化时,C=C键断裂,RCH=CHR’可氧化成RCHO和R’CHO。下列烯烃中,经氧化可得到乙醛和丁醛的是:
A.1—己烯 B. 2—己烯
C.2—甲基—2—戊烯 D. 3—己烯
B
(1)现有一化合物A,是由B、C两物质通过上述反应生成的。试根据A的结构式写出B、C的结构式。
CH3 H
A:CH3-C-CH2-C=O
OH
B:
C:
CH3CHO
O
CH3-C-CH3
11、信息迁移应用
已知:
RC=O +H-CH2CHO
OH
→ R-CH-CH2-CHO
课堂练习
H
(2)根据上述信息,用乙炔合成1-丁醇。
CH≡CH→CH3CHO→CH3CHCH2CHO
OH
→CH3CH=CHCHO→CH3CH2CH2CH2OH
课堂练习
11、信息迁移应用
已知:
RC=O +H-CH2CHO
OH
→ R-CH-CH2-CHO
H
12.分子式为C9H10O2的有机物有多种同分异构体,其中某些物质有下列特征:
①其水溶液遇FeCl3溶液呈紫色;
②与新制备的Cu(OH)2共热有红色沉淀生成
③分子中有苯环结构,苯环上有两个取代基且苯环上的一溴代物有两种。
写出符合上述条件的G物质所有可能的结构简式:
课堂练习
谢谢欣赏
