6.2.2化学反应的限度 化学平衡 课件(21张)【新教材】2020-2021学年人教版(2019)高一化学必修第二册
文档属性
| 名称 | 6.2.2化学反应的限度 化学平衡 课件(21张)【新教材】2020-2021学年人教版(2019)高一化学必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 809.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-31 00:00:00 | ||
图片预览







文档简介
第2课时 化学反应的限度
化学反应条件的控制
第六章 第二节 化学反应的速率与限度
本节课学习目标
1.了解可逆反应的概念及特征。
2.理解化学平衡概念及特征。
3.能够判断一个化学反应是否处于平衡状态。
4.知道条件改变时化学平衡可能会发生移动。
5.了解控制反应条件在生产、生活和科学研究中的作用。
思考与交流:
一个化学反应在实际进行时,反应物能否完全转变为生成物?
炼制1 t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
要解开这个谜底,必须得学习可逆反应
一个化学反应在实际进行时,反应物能否完全转变为生成物?
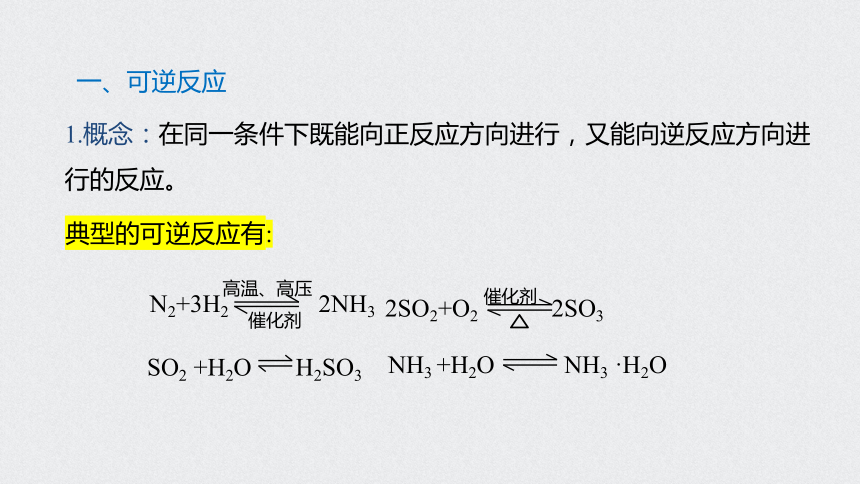
一、可逆反应
1.概念:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
典型的可逆反应有:
N2+3H2 2NH3
催化剂
2SO2+O2 2SO3
催化剂
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
高温、高压
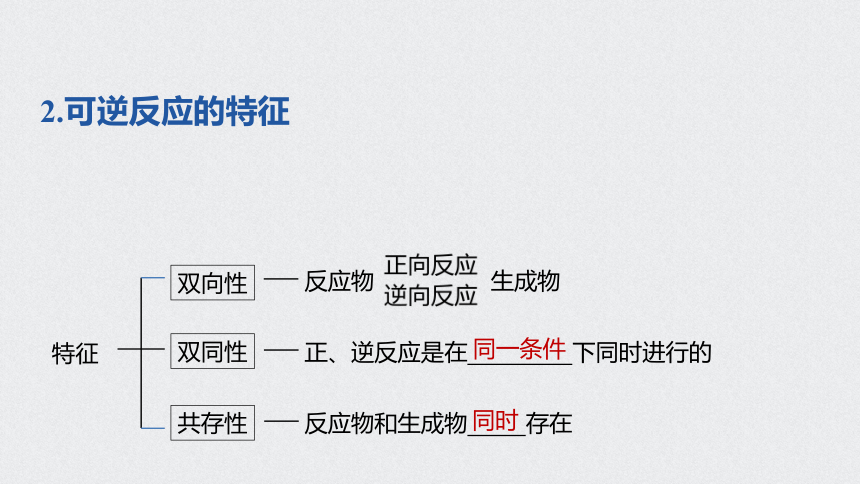
2.可逆反应的特征
双向性
双同性
共存性
反应物 生成物
正、逆反应是在 下同时进行的
反应物和生成物 存在
特征
同一条件
同时
3.可逆反应的实验室证据
实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O同时存在于SO2、O2、SO3中
这说明,在SO2与O2 反应生成SO3 同时,SO3 也在分解生成SO2和O2
从微观角度理解可逆反应
O-O键的断裂、S-O的断裂;O-O键的形成、S-O的形成在同时进行。
从宏观速率角度理解可逆反应:
若在恒容密闭容器中加入2 mol SO2和1 mol O2发生反应,过程中速率随时间的图像如下所示:
开始时,反应物浓度最大,v(正) 最大;生成物浓度为零,最小,v(逆)为零。
反应过程中,反应物减少,导致v(正) 逐渐减小;生成物
由无到有逐渐增多,导致v(逆) 从零逐渐增大。
一段时间后,v(正)=v(逆);各反应物和生成物的浓度不再发生变化
二、化学平衡状态
概念:
一定条件下的可逆反应,当其正反应速率和逆反应速率相等时,各反应物浓度既不增加、也不减少,,反应混合物中各组分的含量保持不变的状态称为化学平衡状态,简称化学平衡。
平衡状态
如何判断可逆反应已达到平衡状态了呢?
思考:
如何判断可逆反应已达到平衡状态了呢?
微观判断依据:v(正)=v(逆)。
宏观判断依据:各物质的浓度保持不变。(物质的量浓度或者质量分数不变。)
化学平衡状态的特征:
逆:指建立化学平衡的前提是可逆反应。
等:指该状态下,v(正)=v(逆)。
动:指该状态是动态平衡,v(正)=v(逆)≠0。
定:指平衡状态时,在外界条件不变的前提下,反应速率一定,混合 物中各组分的浓度一定,混合物中各组分的百分含量一定。
变:指若外界条件改变,则化学平衡就可能发生移动,各物质的浓度或者含量就会随之发生变化。
【课堂小练】1. 可逆反应2NO+O2 2NO2 在体积不变的密闭容器中反应,其达到平衡状态的标志是( )
①混合气体的颜色不再改变
②混合气体的密度不再改变
③用NO、O2、NO2的物质的量浓度变化表示的反应速率之比为
2∶1∶2的状态
④单位时间内生成n mol O2的同时生成2n mol NO
⑤单位时间内生成n mol O2的同时生成2n mol NO2
A.①④ B.②④ C.①③④ D.①⑤
D
2.下列哪种说法可以证明反应
N2 + 3H2 2NH3达到平衡状态( )
A.1个 氮氮键断裂的同时,有3个 氢氢键形成
B.1个 氮氮键断裂的同时,有3个 氢氢键断裂
C.1个氮氮键断裂的同时,有6个 氮氢 键断裂
D.1个 氮氮键断裂的同时,有6个 氮氢键形成
AC
3.对于在一定条件下的可逆反应:
判断以下哪些叙述说明v(正)=v(逆)? 。
(1)单位时间内,消耗1 mol N2,同时生成1 mol N2
(2)单位时间内,消耗3 mol H2,同时消耗2 mol NH3
(3)单位时间内,生成1 mol N2,同时有2 mol NH3生成
(4)单位时间内,消耗1 mol N2,同时有2 mol NH3生成
N2+3H2 2NH3
(1)(2)(3)
促进
抑制
三、化学反应条件的控制
1、控制化学反应条件的意义
2、影响煤燃烧效率的条件
(1)煤的状态。 (2)空气用量。
(3)炉(灶)膛材料的选择。 (4)燃烧后烟道废气中热量的利用。
3、提高燃料燃烧效率的措施
(1)尽可能使燃料 ,提高能量的转化率。关键是燃料与空气或氧气尽可能 ,且空气要 。
(2)尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。
充分燃烧
充分接触
适当过量
课堂小结:
一、可逆反应
二、化学平衡状态
三、化学反应条件的控制
课堂演练
1.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是( )
①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A.①②③ B.②③④
C.①③④ D.①②③④
A
2.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保
持不变
A
?
B
化学反应条件的控制
第六章 第二节 化学反应的速率与限度
本节课学习目标
1.了解可逆反应的概念及特征。
2.理解化学平衡概念及特征。
3.能够判断一个化学反应是否处于平衡状态。
4.知道条件改变时化学平衡可能会发生移动。
5.了解控制反应条件在生产、生活和科学研究中的作用。
思考与交流:
一个化学反应在实际进行时,反应物能否完全转变为生成物?
炼制1 t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
要解开这个谜底,必须得学习可逆反应
一个化学反应在实际进行时,反应物能否完全转变为生成物?
一、可逆反应
1.概念:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
典型的可逆反应有:
N2+3H2 2NH3
催化剂
2SO2+O2 2SO3
催化剂
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
高温、高压
2.可逆反应的特征
双向性
双同性
共存性
反应物 生成物
正、逆反应是在 下同时进行的
反应物和生成物 存在
特征
同一条件
同时
3.可逆反应的实验室证据
实验发现,一定条件下向一密闭容器中充入SO2与18O2,反应一段时间后,核素18O同时存在于SO2、O2、SO3中
这说明,在SO2与O2 反应生成SO3 同时,SO3 也在分解生成SO2和O2
从微观角度理解可逆反应
O-O键的断裂、S-O的断裂;O-O键的形成、S-O的形成在同时进行。
从宏观速率角度理解可逆反应:
若在恒容密闭容器中加入2 mol SO2和1 mol O2发生反应,过程中速率随时间的图像如下所示:
开始时,反应物浓度最大,v(正) 最大;生成物浓度为零,最小,v(逆)为零。
反应过程中,反应物减少,导致v(正) 逐渐减小;生成物
由无到有逐渐增多,导致v(逆) 从零逐渐增大。
一段时间后,v(正)=v(逆);各反应物和生成物的浓度不再发生变化
二、化学平衡状态
概念:
一定条件下的可逆反应,当其正反应速率和逆反应速率相等时,各反应物浓度既不增加、也不减少,,反应混合物中各组分的含量保持不变的状态称为化学平衡状态,简称化学平衡。
平衡状态
如何判断可逆反应已达到平衡状态了呢?
思考:
如何判断可逆反应已达到平衡状态了呢?
微观判断依据:v(正)=v(逆)。
宏观判断依据:各物质的浓度保持不变。(物质的量浓度或者质量分数不变。)
化学平衡状态的特征:
逆:指建立化学平衡的前提是可逆反应。
等:指该状态下,v(正)=v(逆)。
动:指该状态是动态平衡,v(正)=v(逆)≠0。
定:指平衡状态时,在外界条件不变的前提下,反应速率一定,混合 物中各组分的浓度一定,混合物中各组分的百分含量一定。
变:指若外界条件改变,则化学平衡就可能发生移动,各物质的浓度或者含量就会随之发生变化。
【课堂小练】1. 可逆反应2NO+O2 2NO2 在体积不变的密闭容器中反应,其达到平衡状态的标志是( )
①混合气体的颜色不再改变
②混合气体的密度不再改变
③用NO、O2、NO2的物质的量浓度变化表示的反应速率之比为
2∶1∶2的状态
④单位时间内生成n mol O2的同时生成2n mol NO
⑤单位时间内生成n mol O2的同时生成2n mol NO2
A.①④ B.②④ C.①③④ D.①⑤
D
2.下列哪种说法可以证明反应
N2 + 3H2 2NH3达到平衡状态( )
A.1个 氮氮键断裂的同时,有3个 氢氢键形成
B.1个 氮氮键断裂的同时,有3个 氢氢键断裂
C.1个氮氮键断裂的同时,有6个 氮氢 键断裂
D.1个 氮氮键断裂的同时,有6个 氮氢键形成
AC
3.对于在一定条件下的可逆反应:
判断以下哪些叙述说明v(正)=v(逆)? 。
(1)单位时间内,消耗1 mol N2,同时生成1 mol N2
(2)单位时间内,消耗3 mol H2,同时消耗2 mol NH3
(3)单位时间内,生成1 mol N2,同时有2 mol NH3生成
(4)单位时间内,消耗1 mol N2,同时有2 mol NH3生成
N2+3H2 2NH3
(1)(2)(3)
促进
抑制
三、化学反应条件的控制
1、控制化学反应条件的意义
2、影响煤燃烧效率的条件
(1)煤的状态。 (2)空气用量。
(3)炉(灶)膛材料的选择。 (4)燃烧后烟道废气中热量的利用。
3、提高燃料燃烧效率的措施
(1)尽可能使燃料 ,提高能量的转化率。关键是燃料与空气或氧气尽可能 ,且空气要 。
(2)尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。
充分燃烧
充分接触
适当过量
课堂小结:
一、可逆反应
二、化学平衡状态
三、化学反应条件的控制
课堂演练
1.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是( )
①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A.①②③ B.②③④
C.①③④ D.①②③④
A
2.下列关于化学平衡的说法中,不正确的是( )
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保
持不变
A
?
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
