3.2.1 醇、酚 醇 课件(25张ppt)【新教材】2020-2021学年高二化学(人教版(2019)选择性必修三)
文档属性
| 名称 | 3.2.1 醇、酚 醇 课件(25张ppt)【新教材】2020-2021学年高二化学(人教版(2019)选择性必修三) |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-01 00:00:00 | ||
图片预览





文档简介
第三章 烃的衍生物
第二节 醇、酚
第1课时 醇
国酒茅台
中国的酒文化源远流长,你能想起哪些与酒相关的诗句吗?
【学习任务一】认识 醇
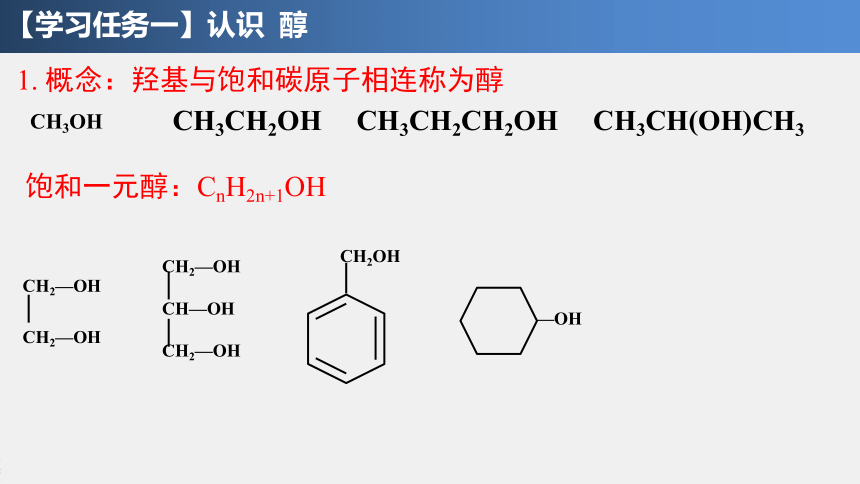
1. 概念:羟基与饱和碳原子相连称为醇
CH3OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH3CH2OH
CH3CH2CH2OH
CH3CH(OH)CH3
CH2OH
—OH
饱和一元醇:CnH2n+1OH
【学习任务一】认识 醇
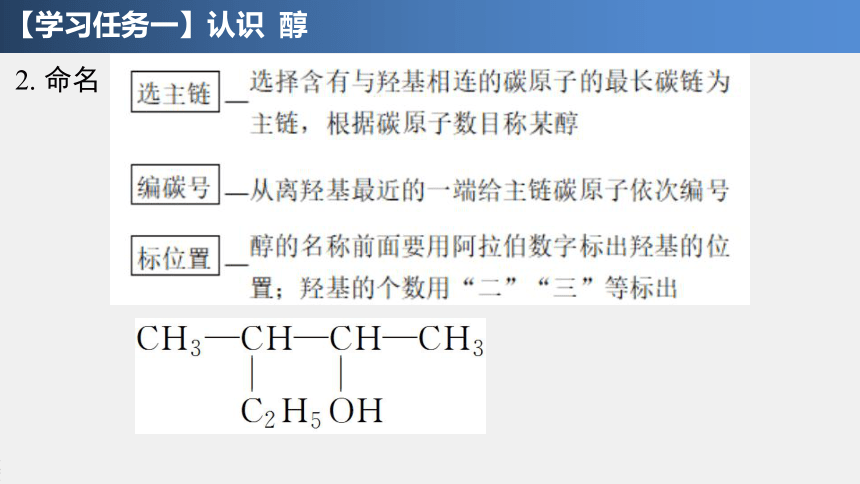
2. 命名
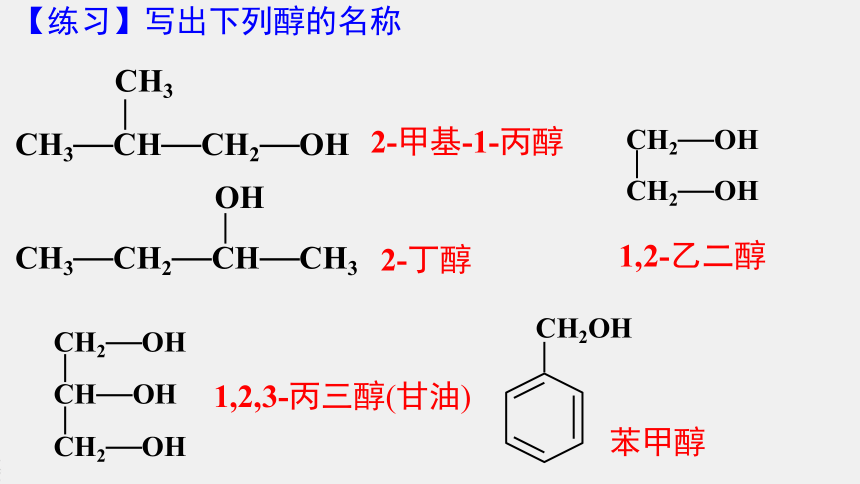
【练习】写出下列醇的名称
2-甲基-1-丙醇
2-丁醇
1,2-乙二醇
1,2,3-丙三醇(甘油)
苯甲醇
CH3—CH—CH2—OH
CH3
CH3—CH2—CH—CH3
OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH2OH
【学习任务一】认识 醇
3. 分类:根据分子中羟基的数目对醇进行分类
一元醇
二元醇
多元醇
CH3OH
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
配制化妆品
汽车防冻剂
工业酒精有毒!
损伤视神经,甚至死亡
煮酒论英雄
汽车燃料
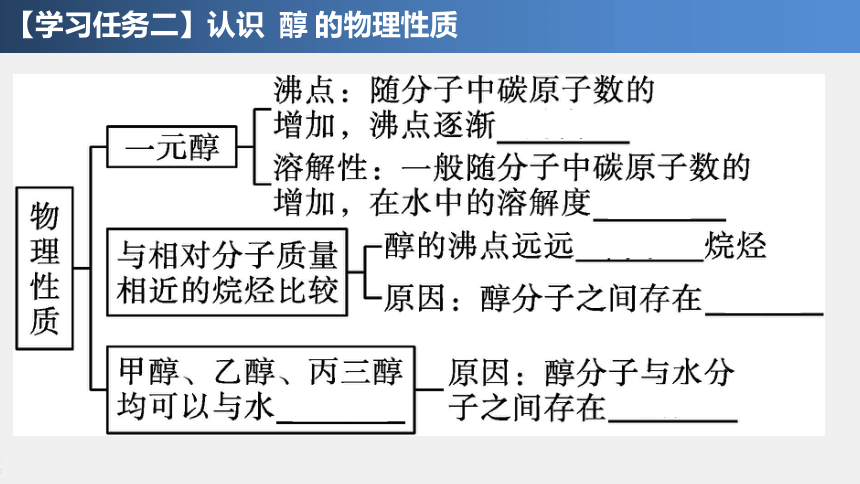
【学习任务二】认识 醇 的物理性质
分析P58的表3-2、表3-3,回答下列问题
(1)随着碳原子数的增加,醇的水溶性和沸点呈现怎样的递变规律?
(2)对比相对分子质量相近的醇与烷烃的沸点,你能得出什么结论?造成这种结果的原因是什么?
【学习任务二】认识 醇 的物理性质
【学习任务二】认识 醇 的物理性质
R
R
O
O
H
H
R
R
O
O
H
H
R
R
O
O
H
H
【学习任务三】探究乙醇的化学性质
醇的化学性质主要是由羟基所决定。根据乙醇的结构式,分析其极性键的位置,预测乙醇可能发生的反应类型
置换反应
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
现象:先沉后浮,不熔、不游、不响,反应缓慢
【学习任务三】探究乙醇的化学性质
【实验过程】
a. 如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
b. 放入几片碎瓷片,以避免混合液在受热时暴沸;
c. 加热混合液,使液体温度迅速升到170℃;
d. 将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
酸性KMnO4溶液
NaOH溶液
溴的四氯化碳溶液
混合液
碎瓷片
温度计
【实验装置】
【学习任务三】探究乙醇的化学性质
1.消去反应
C=C
H
H
H
H
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
断2、4
a. 浓硫酸的作用——
b. 温度计的位置——
催化剂和脱水剂
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
【学习任务三】探究乙醇的化学性质
c. 酒精与浓硫酸体积比为何要为1∶3?
浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,
酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
d. 混合液颜色逐渐变黑,为什么?
在加热的条件下,无水乙醇和浓硫酸除可生成乙烯外,浓硫酸还能将无水乙醇氧化生成碳的单质等,碳的单质使烧瓶内的液体带上了黑色。
e. 装置中氢氧化钠溶液有什么作用?它们是如何产生的?
由于无水乙醇和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体,还有挥发的乙醇,干扰实验。可将气体通过NaOH溶液。
e. 为何使液体温度迅速升到170℃?
因为无水乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
乙醚
C2H5—OH+H—O—C2H5 C2H5—O—C2H5+H2O
浓硫酸
140℃
无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物
分子间脱水
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
【学习任务三】探究乙醇的化学性质
CH3CH2Br
CH3CH2OH
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH醇溶液、加热
C—Br、C—H
C—O、C—H
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸加热到170℃
溴乙烷与乙醇都能发生消去反应,它们有什么异同?
C=C
C=C
练习1. (双选)下列醇发生消去反应后,产物为2种的是( )
思考:是不是所有的醇都可以发生消去反应生成烯?
醇分子中,连有羟基(—OH)的碳原子必须有相邻的碳原子且该相邻碳原子上必须连有氢原子时,才可发生消去反应而形成不饱和键。
【学习任务三】探究乙醇的化学性质
2.取代反应
O
CH3?C?OH + H?OC2H5 CH3COOC2H5 + H2O
浓H2SO4
△
C2H5—OH+H—O—C2H5 C2H5—O—C2H5+H2O
浓硫酸
140℃
C2H5?OH + H?Br C2H5?Br + H2O
△
浓氢溴酸
【学习任务三】探究乙醇的化学性质
3.氧化反应
(淡蓝色火焰)
a. 燃烧
b. 催化氧化
2Cu+O2 2CuO
△
CH3CH2OH+CuO → CH3CHO+Cu+H2O
△
红色变为黑色
Cu丝黑色又变为红色,液体产生特殊气味(乙醛的气味)
现象:
总: 2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
△
Cu是催化剂,但实际起氧化作用的是O2。
CH3CH2OH+3O2 2CO2+3H2O
点燃
CH3CH2CH2OH
练习2写出下列有机物催化氧化的反应方程式:
CH3CHCH3
OH
CH2OH
CH2OH
(CH3)3COH
【学习任务三】探究乙醇的化学性质
练习3. 某饱和一元醇的分子式为C5H12O的同分异构体中,能被催化氧化
成醛的有( )???
A.2种?????????? ?? B.3种??????????? ?C.4种??????????? ? D.5种
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
紫红色 无色
常见的强氧化剂:
KMnO4酸性溶液
重铬酸钾(K2Cr2O7)酸性溶液
Cr2O72- Cr3+
(橙红色) (绿色)
c. 强氧化剂氧化
氧化反应:有机分子中失去H或加入O的反应
还原反应:有机分子中加入H或失去O的反应
醇类物质被强氧化剂氧化的一般规律
【课堂小结】乙醇的化学性质
有来有往为取代,
有来无往为加成,
有往无来为消去,
得氧失氢为氧化,
得氢失氧为还原。
第二节 醇、酚
第1课时 醇
国酒茅台
中国的酒文化源远流长,你能想起哪些与酒相关的诗句吗?
【学习任务一】认识 醇
1. 概念:羟基与饱和碳原子相连称为醇
CH3OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH3CH2OH
CH3CH2CH2OH
CH3CH(OH)CH3
CH2OH
—OH
饱和一元醇:CnH2n+1OH
【学习任务一】认识 醇
2. 命名
【练习】写出下列醇的名称
2-甲基-1-丙醇
2-丁醇
1,2-乙二醇
1,2,3-丙三醇(甘油)
苯甲醇
CH3—CH—CH2—OH
CH3
CH3—CH2—CH—CH3
OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH2OH
【学习任务一】认识 醇
3. 分类:根据分子中羟基的数目对醇进行分类
一元醇
二元醇
多元醇
CH3OH
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
配制化妆品
汽车防冻剂
工业酒精有毒!
损伤视神经,甚至死亡
煮酒论英雄
汽车燃料
【学习任务二】认识 醇 的物理性质
分析P58的表3-2、表3-3,回答下列问题
(1)随着碳原子数的增加,醇的水溶性和沸点呈现怎样的递变规律?
(2)对比相对分子质量相近的醇与烷烃的沸点,你能得出什么结论?造成这种结果的原因是什么?
【学习任务二】认识 醇 的物理性质
【学习任务二】认识 醇 的物理性质
R
R
O
O
H
H
R
R
O
O
H
H
R
R
O
O
H
H
【学习任务三】探究乙醇的化学性质
醇的化学性质主要是由羟基所决定。根据乙醇的结构式,分析其极性键的位置,预测乙醇可能发生的反应类型
置换反应
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
现象:先沉后浮,不熔、不游、不响,反应缓慢
【学习任务三】探究乙醇的化学性质
【实验过程】
a. 如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
b. 放入几片碎瓷片,以避免混合液在受热时暴沸;
c. 加热混合液,使液体温度迅速升到170℃;
d. 将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
酸性KMnO4溶液
NaOH溶液
溴的四氯化碳溶液
混合液
碎瓷片
温度计
【实验装置】
【学习任务三】探究乙醇的化学性质
1.消去反应
C=C
H
H
H
H
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
断2、4
a. 浓硫酸的作用——
b. 温度计的位置——
催化剂和脱水剂
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
【学习任务三】探究乙醇的化学性质
c. 酒精与浓硫酸体积比为何要为1∶3?
浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,
酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
d. 混合液颜色逐渐变黑,为什么?
在加热的条件下,无水乙醇和浓硫酸除可生成乙烯外,浓硫酸还能将无水乙醇氧化生成碳的单质等,碳的单质使烧瓶内的液体带上了黑色。
e. 装置中氢氧化钠溶液有什么作用?它们是如何产生的?
由于无水乙醇和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体,还有挥发的乙醇,干扰实验。可将气体通过NaOH溶液。
e. 为何使液体温度迅速升到170℃?
因为无水乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
乙醚
C2H5—OH+H—O—C2H5 C2H5—O—C2H5+H2O
浓硫酸
140℃
无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物
分子间脱水
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
【学习任务三】探究乙醇的化学性质
CH3CH2Br
CH3CH2OH
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH醇溶液、加热
C—Br、C—H
C—O、C—H
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸加热到170℃
溴乙烷与乙醇都能发生消去反应,它们有什么异同?
C=C
C=C
练习1. (双选)下列醇发生消去反应后,产物为2种的是( )
思考:是不是所有的醇都可以发生消去反应生成烯?
醇分子中,连有羟基(—OH)的碳原子必须有相邻的碳原子且该相邻碳原子上必须连有氢原子时,才可发生消去反应而形成不饱和键。
【学习任务三】探究乙醇的化学性质
2.取代反应
O
CH3?C?OH + H?OC2H5 CH3COOC2H5 + H2O
浓H2SO4
△
C2H5—OH+H—O—C2H5 C2H5—O—C2H5+H2O
浓硫酸
140℃
C2H5?OH + H?Br C2H5?Br + H2O
△
浓氢溴酸
【学习任务三】探究乙醇的化学性质
3.氧化反应
(淡蓝色火焰)
a. 燃烧
b. 催化氧化
2Cu+O2 2CuO
△
CH3CH2OH+CuO → CH3CHO+Cu+H2O
△
红色变为黑色
Cu丝黑色又变为红色,液体产生特殊气味(乙醛的气味)
现象:
总: 2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
△
Cu是催化剂,但实际起氧化作用的是O2。
CH3CH2OH+3O2 2CO2+3H2O
点燃
CH3CH2CH2OH
练习2写出下列有机物催化氧化的反应方程式:
CH3CHCH3
OH
CH2OH
CH2OH
(CH3)3COH
【学习任务三】探究乙醇的化学性质
练习3. 某饱和一元醇的分子式为C5H12O的同分异构体中,能被催化氧化
成醛的有( )???
A.2种?????????? ?? B.3种??????????? ?C.4种??????????? ? D.5种
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
紫红色 无色
常见的强氧化剂:
KMnO4酸性溶液
重铬酸钾(K2Cr2O7)酸性溶液
Cr2O72- Cr3+
(橙红色) (绿色)
c. 强氧化剂氧化
氧化反应:有机分子中失去H或加入O的反应
还原反应:有机分子中加入H或失去O的反应
醇类物质被强氧化剂氧化的一般规律
【课堂小结】乙醇的化学性质
有来有往为取代,
有来无往为加成,
有往无来为消去,
得氧失氢为氧化,
得氢失氧为还原。
