2021届高中化学考前三个月专项复习课件题型二 “7+化工流程”特训 课件(61张ppt)
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件题型二 “7+化工流程”特训 课件(61张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-01 11:11:18 | ||
图片预览









文档简介
“7+化工流程”特训
题型二 无机综合——化工流程综合题的研究
A组(25分钟)
1.化学与生产、生活和科技密切相关。下列说法错误的是
A.N95型口罩的核心材料聚丙烯属于有机高分子材料
B.将“84消毒液”与75%的酒精混合使用,消毒效果更好
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.葡萄酒中通常含有微量SO2,既可以杀菌又可以防止营养成分被氧化
1
2
3
4
5
6
√
解析 84消毒液中的NaClO具有强氧化性,能与乙醇反应,生成有毒的Cl2,不仅降低消毒效果,还能引发中毒,故B项错误。
7
8
2.下列说法正确的是
A.铜锌原电池中,盐桥中的K+和 分别移向负极和正极
B.SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C.室温下,将Na2CO3和NaHCO3的混合溶液加水稀释, 减小
D.电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
1
2
3
4
5
6
√
7
8
D项,电解精炼铜时,阴极只发生Cu2++2e-===Cu,3.2 g Cu为0.05 mol,依据得失电子守恒,阳极失去电子的物质的量应为0.1 mol。
1
2
3
4
5
6
7
8
3.一种新型的合成氨的方法如图所示,下列说法错误的是
1
2
3
4
5
6
A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总结果为2N2+6H2O
===4NH3+3O2
√
7
8
解析 反应①是N2与Li反应生成Li3N,属于“氮的固定”,故A项正确;
反应②是Li3N与H2O反应生成NH3和LiOH,该反应中元素的化合价没有发生变化,属于非氧化还原反应,故B项正确;
1
2
3
4
5
6
电解LiOH水溶液时阴极上是H+得电子生成氢气而不是Li+得电子,故C项错误;
根据图中信息可知:上述三步循环的总结果为2N2+6H2O===4NH3+3O2,故D项正确。
7
8
4.乳酸乙酯( )是一种食用香料,常用于调制果香型、乳酸型食用
和酒用香精。乳酸乙酯的同分异构体M有如下性质:0.1 mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A.8种 B.9种 C.10种 D.12种
1
2
3
4
5
6
√
7
8
解析 乳酸乙酯的分子式为C5H10O3,由题意可判断,M中含有两个官能团,一个是羧基、一个是羟基,则M可视作两个官能团分别取代丁烷上
的氢原子后的产物, 、 。
若羧基在1号碳上,羟基可以在1号、2号、3号、4号碳四种情况;
若羧基在2号碳上,羟基可以在1号、2号、3号、4号碳四种情况;
若羧基在6号碳上,羟基可以在5号(同7号、8号)碳一种情况;
若羧基在5号碳上,羟基可以在5号、6号、7号(同8号)碳三种情况,因此共有12种。
1
2
3
4
5
6
7
8
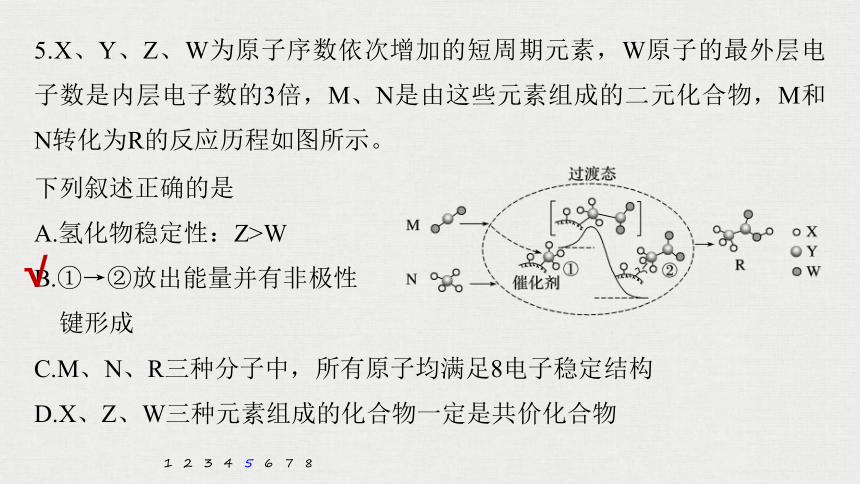
5.X、Y、Z、W为原子序数依次增加的短周期元素,W原子的最外层电子数是内层电子数的3倍,M、N是由这些元素组成的二元化合物,M和N转化为R的反应历程如图所示。
1
2
3
4
5
6
下列叙述正确的是
A.氢化物稳定性:Z>W
B.①→②放出能量并有非极性
键形成
C.M、N、R三种分子中,所有原子均满足8电子稳定结构
D.X、Z、W三种元素组成的化合物一定是共价化合物
√
7
8
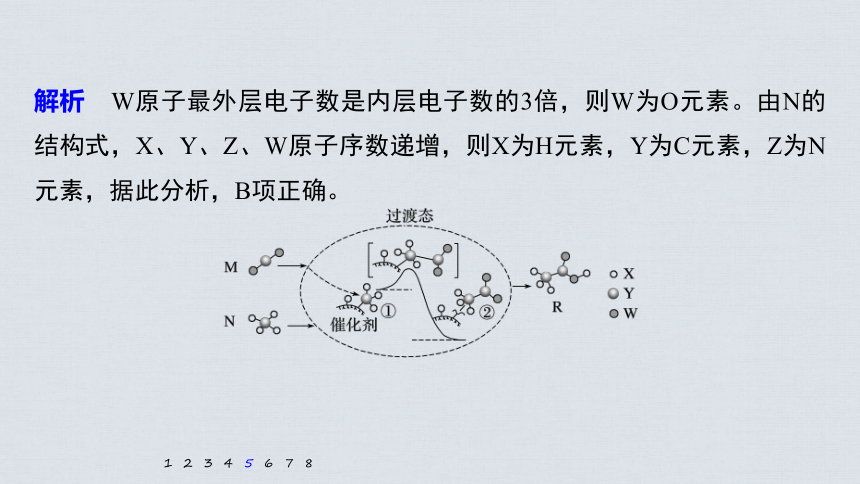
解析 W原子最外层电子数是内层电子数的3倍,则W为O元素。由N的结构式,X、Y、Z、W原子序数递增,则X为H元素,Y为C元素,Z为N元素,据此分析,B项正确。
1
2
3
4
5
6
7
8
6.埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法正确的是
1
2
3
4
5
6
A.该方法将电能转化成化学能
B.在此装置中钢管道作正极
C.该方法称为“外加电流的阴极保护法”
D.镁块上发生的电极反应为O2+2H2O+4e-===4OH-
√
解析 该保护装置利用了原电池原理,镁为负极,钢管为正极。
7
8
7
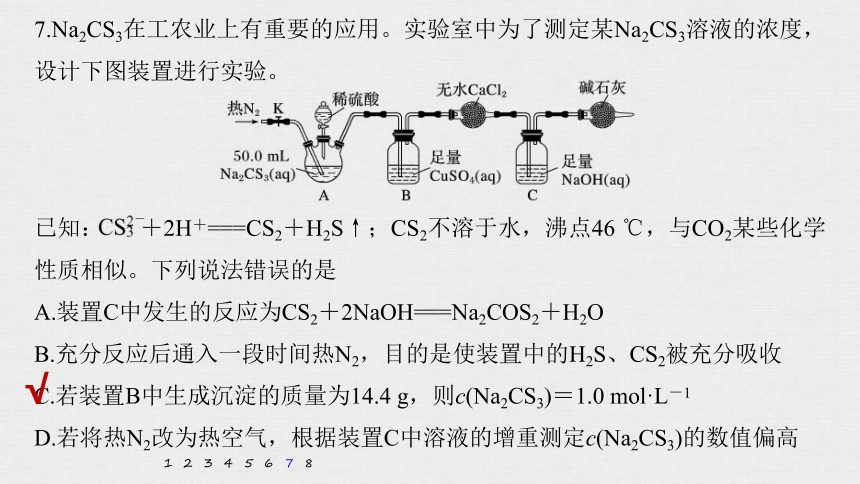
已知: +2H+===CS2+H2S↑;CS2不溶于水,沸点46 ℃,与CO2某些化学性质相似。下列说法错误的是
A.装置C中发生的反应为CS2+2NaOH===Na2COS2+H2O
B.充分反应后通入一段时间热N2,目的是使装置中的H2S、CS2被充分吸收
C.若装置B中生成沉淀的质量为14.4 g,则c(Na2CS3)=1.0 mol·L-1
D.若将热N2改为热空气,根据装置C中溶液的增重测定c(Na2CS3)的数值偏高
7.Na2CS3在工农业上有重要的应用。实验室中为了测定某Na2CS3溶液的浓度,设计下图装置进行实验。
1
2
3
4
5
6
√
8
7
1
2
3
4
5
6
8
8.四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
已知:①几种金属氢氧化物沉淀的pH如上表所示:
物质
Fe(OH)3
Al(OH)3
开始沉淀的pH
2.3
4.0
完全沉淀的pH
3.7
6.5
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
7
1
2
3
4
5
6
8
解析 加硫酸从矿石中浸出锂,如粉碎矿石、搅拌、加热等措施均可以提高反应速率。加入碳酸钙中和溶液中的酸,使铁、铝离子完全沉淀成氢氧化铁、氢氧化铝。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________________
__________(写两条);加入CaCO3的作用是__________________________
_____________。
粉碎矿石、加热、搅拌等
(任写两条)
调节pH使Fe3+、Al3+转化成
氢氧化物沉淀
7
1
2
3
4
5
6
8
(2)“a”最小值为_____。“电解”的阴极反应式为______________。
6.5
Li++e-===Li
物质
Fe(OH)3
Al(OH)3
开始沉淀的pH
2.3
4.0
完全沉淀的pH
3.7
6.5
解析 从表格信息看,调节pH最小值为6.5,确保铝离子完全沉淀。阴极上锂离子被还原成锂。
7
1
2
3
4
5
6
8
(3)设计简单方案由Li2CO3制备LiCl:_______________________________
_____。
用盐酸溶解,在氯化氢气体中蒸干
溶液
解析 在氯化氢气体中蒸干氯化锂溶液,类似从海水中提取氯化镁。
7
1
2
3
4
5
6
8
(4)写出LiH和AlCl3反应的化学方程式:_____________________________
_______(条件不作要求)。
3LiCl
解析 氯化铝与氢化锂反应生成四氢铝锂和氯化锂。
7
1
2
3
4
5
6
8
解析 依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,减少碳酸锂的损失。沉淀表面有硫酸钠,检验 可判断沉淀是否洗净。
(5)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是______________;检验碳酸锂是否洗净的实验方法是_________________________________
______________________________________________。
减少Li2CO3损失
取最后一次洗涤液于试管中,滴加氯
化钡溶液和稀硝酸,观察是否有沉淀产生(合理即可)
7
1
2
3
4
5
6
8
解析 还原能力指失电子数。1 mol LiAlH4能提供8 mol电子,相当于4 mol H2。LiAlH4的有效氢为 ≈0.21 g。
(6)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为______。(结果保留2位小数)
0.21 g
7
1
2
3
4
5
6
8
B组(25分钟)
1.(2020·潍坊三模)古代化学源远流长。下列说法错误的是
A.“熬胆矾铁釜,久之亦化为铜”,说明铁能置换出铜;这样铁釜能减
缓锈蚀
B.“欲试药金(铜锌合金),烧火有五色气起”,通过焰色反应可检验金
属元素
C.“龙泉水,可以淬刀剑”,高温的铁与水反应生成Fe3O4
D.“取朴硝(含有KNO3)以温汤溶解,次早结块”,该过程为重结晶
1
2
3
4
5
6
√
解析 铁置换出铜,构成原电池,会加速铁的腐蚀,故A项错误。
7
8
2.汞(熔点为39 ℃,沸点为356 ℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞,目前工业上制纯汞的一种流程图如下:
1
2
3
4
5
6
下列分析错误的是
A.洗涤粗汞可用5%的盐酸代替5%的硝酸
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.“灼烧辰砂法”发生的反应为HgS+O2 Hg+SO2
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
√
7
8
1
2
3
4
5
6
解析 铜与盐酸不反应,A项错误;
辰砂与氧化钙加热反应时,化合价升高的元素是S,所以CaSO4是氧化产物,B项正确;
“灼烧辰砂法”发生的反应为HgS+O2 Hg+SO2,C项正确;
该实验的目的是获得纯汞,最后一步根据汞沸点为356 ℃,可以通过减压蒸馏降低汞的沸点,提高分离效率,D项正确。
7
8
3.共用两个或两个以上碳原子的多环烃称为桥环烃,二环[1,1,0]丁烷( )
是一种简单的桥环烃。下列关于该有机物的说法错误的是
A.与环丁烯互为同分异构体
B.一氯代物有2种,二氯代物有4种
C.所有碳原子均处于同一平面内
D.开环加氢生成1 mol C4H10至少需要2 mol H2
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
解析 二环[1,1,0]丁烷与环丁烯[ ]的分子式均为C4H6,二者的分子结构不同,互为同分异构体,A项正确;
该烃分子中有2种不同化学环境的氢原子,则其一氯代物有2种;考虑两
个Cl原子在碳原子上的相对位置,有4种二氯代物,分别为 、
、 和 ,B项正确;
7
8
1
2
3
4
5
6
二环[1,1,0]丁烷分子中所有碳原子均形成4个单键,每个碳原子与周围 4个原子均形成四面体结构,故该烃分子中所有碳原子不处于同一平面内,C项错误;
该烃的分子式为C4H6,可与2 mol H2发生开环加氢反应生成分子式为C4H10的烃,D项正确。
7
8
下列说法正确的是
A.A、B、C分别盛有饱和Na2CO3溶液、浓硫酸和烧碱溶液
B.装置②中温水的作用是降低装置①中生成的CO2在液溴中的溶解度
C.实验开始时,先加热管式炉,再打开装置①中活塞
D.实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温
4.已知:溴化铁在200 ℃以上易分解,煮沸水溶液也会使其分解,生成溴化亚铁和溴单质。实验室里利用如图装置制取纯净的无水FeBr3。
1
2
3
4
5
6
√
7
8
解析 利用装置①制备的CO2中混有HCl、H2O(g),装置③中A、B依次除去HCl、H2O(g),利用装置④进行尾气处理,故A、B、C分别盛有饱和NaHCO3溶液、浓硫酸和烧碱溶液,A项错误;
装置②中温水的作用是促进液溴的挥发,得到溴蒸气,B项错误;
实验开始时,要先打开装置①中活塞,利用反应产生的CO2排出装置内空气,再加热管式炉,防止铁粉被O2氧化引入杂质,C项错误;
实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温,排出装置内溴蒸气,并被C中烧碱溶液吸收,防止污染环境,D项正确。
1
2
3
4
5
6
7
8
5.A、B、C、D、E、F为原子序数依次递增的六种短周期主族元素,工业上通过分离液态空气获得B的单质,C与A、F两元素原子序数之差的绝对值都是8,E的简单离子半径小于同周期其他元素的简单离子半径。下列说法正确的是
A.B元素一定位于第二周期ⅤA族
B.A元素与其他元素既能形成离子化合物,又能形成共价化合物
C.D单质的熔点高于E,则D的金属性强于E
D.F的氧化物的水化物酸性强于其他元素的氧化物的水化物酸性
1
2
3
4
5
6
√
7
8
解析 工业上通过分离液态空气可获得氧气和氮气;一般情况下,短周期同主族相邻周期元素原子序数之差为8,但H和Li例外;第三周期离子半径最小的简单离子是Al3+。据此推断出,A是氢、B是氮或氧、C是氟、D是钠或镁、E是铝、F是氯。B位于元素周期表中第二周期ⅥA族或第二周期ⅤA族,A项错误;
H与其他元素主要形成共价化合物如水、烃等,也可以形成离子化合物如NaH、MgH2等,B项正确;
Na或Mg的熔点低于Al,与两者金属性强弱无关,C项错误;
Cl的最高价氧化物的水化物高氯酸是酸性最强的含氧酸,该选项没有“最高价”限制,D项错误。
1
2
3
4
5
6
7
8
6.金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是
A.图示中与电子流向对应的氟离子移动方向是(B)
B.电池放电过程中,若转移1 mol电子,则M电极质量减少12 g
C.电池充电过程中阳极的电极反应式为:Bi+3F--3e-===BiF3
D.该电池需要在高温条件下工作,目的是将热能转化为电能
1
2
3
4
5
6
√
7
8
解析 依据电子流向以及金属的性质判断,放电时,M为正极,N为负极。F-应移向负极,A项错误;
1
2
3
4
5
6
外电路转移1 mol e-,M极应有1 mol F-进入固体电解质,电极质量减少19 g,B项错误;
高温的目的是使固体电解质电离形成自由移动的离子,放电时,是化学能转变为电能,D项错误。
7
8
7.向某Na2CO3、NaHCO3的混合溶液中加入少量
的BaCl2,测得溶液中lg 与-lg c(Ba2+)
的关系如图所示,下列说法不正确的是
A.该溶液中
B.B、D、E三点对应溶液pH的大小顺序为:B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)= +
c(OH-)+c(Cl-)
√
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
A、B、C三点对应的分散系中,A点属于过饱和溶液,会形成BaCO3沉淀,因此该分散系的稳定性最差,C项正确;
7
8
1
2
3
4
5
6
解析 滤渣A的主要成分是金、银,金不溶于硝酸。
8.碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上用精炼铜的阳极泥(主要含有TeO2,还含有少量Ag、Au)为原料制备单质碲的一种工艺流程如下:
已知TeO2微溶于水,易溶于较浓的强酸和强碱。
(1)从滤渣A中分离出Au的方法是__________________________________。
加稀硝酸充分反应,过滤、洗涤、干燥
7
8
1
2
3
4
5
6
(2)“沉碲”时控制溶液的pH为4.5~5.0,生成TeO2沉淀。防止溶液局部酸性过强的操作是_______________________________________________。
缓慢加入稀硫酸,同时搅拌,并随时检测溶液的pH
解析 为了避免溶液局部酸性过强,应缓慢加入稀硫酸,同时搅拌,并随时检测溶液的pH。
7
8
1
2
3
4
5
6
(3)写出“碱浸”时发生反应的离子方程式:__________________________。
滤液B经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到的副产品是________(填化学式)。
Na2SO4
解析 二氧化碲类似SO2,与氢氧化钠反应生成亚碲酸钠。“碱浸”时加入NaOH溶液,“沉碲”时加入稀硫酸,故滤液B中所得副产品是Na2SO4。
7
8
1
2
3
4
5
6
(4)为了提高“碱浸”的浸出率,宜采取的措施有____________________
_________________________________________(写两条即可)。“酸溶”时要控制温度,温度不宜过高,原因是_____________________________
_____________。
粉碎阳极泥、加热、
增大氢氧化钠溶液的浓度、搅拌等(合理即可)
温度过高,加快盐酸挥发,降低
原料的利用率
解析 从影响化学反应速率的因素角度考虑,即从增大接触面积、升温、增大浓度等角度分析。酸浸用到盐酸,温度高,盐酸挥发快。
7
8
1
2
3
4
5
6
(5)写出“还原”中发生反应的化学方程式:________________________
_______________。
TeCl4+2SO2+4H2O===Te↓
+2H2SO4+4HCl
解析 二氧化硫是还原剂,还原四氯化碲生成碲、硫酸和盐酸。
7
8
1
2
3
4
5
6
(6)经上述流程,从质量为m t的某阳极泥中提取出质量为n t的碲,已知该
阳极泥含TeO2的质量分数为w,则碲的提取率为_____________(用含w、
m、n的代数式表示,提取率= ×100%)。
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
C组(25分钟)
1.冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
据此分析,下列观点不正确的是
A.滤渣A的主要成分是CaSO4
B.上述流程中,所涉反应没有复
分解反应
C.“操作ⅰ”不可用硅酸盐质设
备进行分离
D.流程中可循环使用的物质除H2SO4、SiO2外,滤液B经浓缩后也能循环使用
√
7
8
1
2
3
4
5
6
解析 根据图示,反应①的反应物是CaF2、SiO2、H2SO4,生成物是H2SiF6和滤渣A,故滤渣A的主要成分是硫酸钙,A项正确;
H2SiF6与Na2SO4的反应属于复分解反应,B项错误;
操作ⅰ所得滤液中F-水解生成的HF腐蚀硅酸盐质设备,所以“操作ⅰ”不能用硅酸盐质设备进行分离,C项正确;
根据题意,反应③的离子方程式为
+4NH3·H2O,滤液B的主要成分是氨水,经浓缩后可以循环使用,D项正确。
7
8
1
2
3
4
5
6
2.对羟基苯甲酸乙酯用于食品防腐剂,工业上可用下列方法制备,以下说法错误的是
A.对羟基苯甲酸能发生缩聚反应、取代反应
B.可用浓溴水检验产物中是否有对羟基苯甲酸乙酯生成
C.1 mol对羟基苯甲酸乙酯最多与2 mol NaOH反应
D.乙醇脱水生成的乙烯不存在顺反异构
√
7
8
1
2
3
4
5
6
+C2H5OH
对羟基苯甲酸
对羟基苯甲酸乙酯
+H2O
解析 对羟基苯甲酸、对羟基苯甲酸乙酯二者都含有酚羟基,都能与浓溴水反应,无法用浓溴水检验产物的生成,故B项错误。
7
8
1
2
3
4
5
6
+C2H5OH
对羟基苯甲酸
对羟基苯甲酸乙酯
+H2O
3.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.电解精炼铜时,当外电路通过NA个电子时,阳极一定减轻32 g
B.反应3H2(g)+N2(g) 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ
时,转移电子数为0.6NA
C.0.1 mol·L-1的Na2CO3溶液中,若Na+的数目为NA,则
总数为0.5NA
D.标准状况下,NO和O2各11.2 L混合后充分反应,所得气体的分子总数
为0.75NA
√
7
8
1
2
3
4
5
6
解析 粗铜中含有Fe、Zn等杂质,电解精炼铜时,比Cu活泼的金属先放电,因此当外电路通过NA个电子时,阳极减少的质量不一定为32 g,A项错误;
当放出9.2 kJ热量时,消耗0.3 mol H2,转移电子数为0.6NA,B项正确;
由物料守恒知,Na+的数目若为NA,则 和H2CO3的总数为0.5 NA,C项错误;
标准状况下NO和O2各11.2 L(0.5 mol)充分混合发生反应,生成0.5 mol NO2,剩余0.25 mol O2,由于存在平衡2NO2(g) N2O4(g),因此所得气体的总物质的量小于0.75 mol,D项错误。
7
8
1
2
3
4
5
6
4.W、X、Y和Z均为短周期主族元素且原子序数依次增大,W、X、Y的最外层电子数之和与Z的最外层电子数相等,W的简单气态氢化物与Z单质在集气瓶中混合后,放置在光源下发生反应,气体颜色由黄绿色不断变浅且在瓶壁上有油状物生成。下列说法错误的是
A.Z分别与X、Y形成的二元化合物的水溶液均呈中性
B.X的简单离子的半径比Y的简单离子的半径大
C.Z的氧化物对应的水化物不一定是强酸
D.Z分别与W、Y形成的二元化合物所含化学键类型不同
√
7
8
1
2
3
4
5
6
解析 根据题意可推知W、X、Y和Z分别是C、Na、Mg和Cl。NaCl水溶液呈中性,MgCl2水溶液因Mg2+的水解而显酸性,A项错误;
Na+、Mg2+具有相同的电子层结构,Na+的核电荷数小,离子半径大,B项正确;
Cl的氧化物对应的水化物有多种,其中HClO4是强酸,HClO为弱酸,C项正确;
Z分别与W、Y形成的二元化合物为CCl4和MgCl2,前者所含有的化学键是共价键,而后者所含有的化学键是离子键,D项正确。
7
8
1
2
3
4
5
6
5.资料显示:在加热条件下,NO2被Cu还原生成N2。选择下列装置进行实验,其中错误的是
√
7
8
1
2
3
4
5
6
解析 铜和浓硝酸反应生成NO2,A项正确;
NO2与铜粉在加热条件下反应生成N2和CuO,B项正确;
NO2可用无水CaCl2干燥,C项正确;
收集N2之前要除去氮气中混有的NO2,可用氢氧化钠溶液吸收NO2,发生反应2NO2+2NaOH===NaNO3+NaNO2+H2O,若用饱和食盐水吸收NO2,会生成NO,水槽中集气瓶收集的气体中将含有NO,D项错误。
7
8
1
2
3
4
5
6
6.氮氧化物、硝酸盐废水都会给环境带来污染。图甲是监测NO含量的传感器的工作原理示意图,图乙是电化学降解酸性废水中 的工作原理示意图。下列有关叙述错误的是
A.图甲中,Pt电极上发生的是还原反应
B.图甲中,NiO电极上的电极反应式为NO+O2--2e-===NO2
C.图乙中,H+由电解池右侧移向左侧
D.图乙中,阴极反应式为2 +10e-+12H+===6H2O+N2↑
√
7
8
1
2
3
4
5
6
解析 图甲,NO在NiO电极上失去电子,发生氧化反应;氧气在铂电极上得到电子生成氧离子,发生还原反应,A项正确;
负极NiO上一氧化氮失去电子和氧离子结合生成二氧化氮,B项正确;
电解池中质子向阴极移动,所以电解过程中H+从左侧通过质子交换膜进入右侧,C项错误;
图乙,硝酸根离子得电子发生还原反应,则Ag-Pt电极作阴极,Pt电极作阳极,阳极上电极反应为2H2O-4e-===O2↑+4H+,阴极上电极反应为2 +12H++10e-===N2↑+6H2O,D项正确。
7
8
1
2
3
4
5
6
7.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是
A.Ksp(Ag2C2O4)数量级为10-11
B.n点表示Ag2C2O4的不饱和溶液
C.向c(Cl-)=c( )的混合溶液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+ (aq)的平衡常数为10-0.71
√
7
8
1
2
3
4
5
6
8.(2020·淄博一模)二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图1:
(1)(NH4)2MoO4中Mo的化合价为_____。
+6
解析 化合物中元素化合价代数和等于0,所以(NH4)2MoO4中Mo的化合价为+6。
7
8
1
2
3
4
5
6
(2)“焙烧”时MoS2转化为MoO3的化学方程式为______________
___________________。
2MoS2+7O2
解析 “焙烧”时MoS2和氧气反应生成MoO3和SO2,根据得失电子守恒
配平方程式为2MoS2+7O2 2MoO3+4SO2。
7
8
1
2
3
4
5
6
(3)由图2分析可知产生MoS3沉淀的流程中选择的最优温度和时间是______________,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____________________________________________
________________________________________________________________________________________________________________________________________。
40 ℃、30 min
温度太低,反应 MoS3↓+H2S↑产生的H2S气体不易逸出,不利于平衡正向移动生成MoS3;温度太高,反应物盐酸挥发,导致溶液中c(H+)下降,上述平衡逆向移动,也不利于生成MoS3
7
8
1
2
3
4
5
6
(4)利用低品相的原料制备高纯产品是工业生产中的普遍原则。如图3所示,反应[Ni(s)+4CO(g) Ni(CO)4(g) ΔH<0]在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡
移动原理,判断温度Tl_____T2(填“>”
“<”或“=”)。
>
解析 Ni(s)+4CO(g) Ni(CO)4(g) ΔH<0,正反应放热,升高温度平衡逆向移动,生成Ni单质,在温度为T1的一端得到了纯净的镍粉,所以Tl>T2。
7
8
1
2
3
4
5
6
(5)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去 (忽略溶液体积变化),则当 完全沉淀时,溶液中c( )<__________mol·L-1
(保留2位有效数字)。
3.6×10-3
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
题型二 无机综合——化工流程综合题的研究
A组(25分钟)
1.化学与生产、生活和科技密切相关。下列说法错误的是
A.N95型口罩的核心材料聚丙烯属于有机高分子材料
B.将“84消毒液”与75%的酒精混合使用,消毒效果更好
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.葡萄酒中通常含有微量SO2,既可以杀菌又可以防止营养成分被氧化
1
2
3
4
5
6
√
解析 84消毒液中的NaClO具有强氧化性,能与乙醇反应,生成有毒的Cl2,不仅降低消毒效果,还能引发中毒,故B项错误。
7
8
2.下列说法正确的是
A.铜锌原电池中,盐桥中的K+和 分别移向负极和正极
B.SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C.室温下,将Na2CO3和NaHCO3的混合溶液加水稀释, 减小
D.电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
1
2
3
4
5
6
√
7
8
D项,电解精炼铜时,阴极只发生Cu2++2e-===Cu,3.2 g Cu为0.05 mol,依据得失电子守恒,阳极失去电子的物质的量应为0.1 mol。
1
2
3
4
5
6
7
8
3.一种新型的合成氨的方法如图所示,下列说法错误的是
1
2
3
4
5
6
A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总结果为2N2+6H2O
===4NH3+3O2
√
7
8
解析 反应①是N2与Li反应生成Li3N,属于“氮的固定”,故A项正确;
反应②是Li3N与H2O反应生成NH3和LiOH,该反应中元素的化合价没有发生变化,属于非氧化还原反应,故B项正确;
1
2
3
4
5
6
电解LiOH水溶液时阴极上是H+得电子生成氢气而不是Li+得电子,故C项错误;
根据图中信息可知:上述三步循环的总结果为2N2+6H2O===4NH3+3O2,故D项正确。
7
8
4.乳酸乙酯( )是一种食用香料,常用于调制果香型、乳酸型食用
和酒用香精。乳酸乙酯的同分异构体M有如下性质:0.1 mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A.8种 B.9种 C.10种 D.12种
1
2
3
4
5
6
√
7
8
解析 乳酸乙酯的分子式为C5H10O3,由题意可判断,M中含有两个官能团,一个是羧基、一个是羟基,则M可视作两个官能团分别取代丁烷上
的氢原子后的产物, 、 。
若羧基在1号碳上,羟基可以在1号、2号、3号、4号碳四种情况;
若羧基在2号碳上,羟基可以在1号、2号、3号、4号碳四种情况;
若羧基在6号碳上,羟基可以在5号(同7号、8号)碳一种情况;
若羧基在5号碳上,羟基可以在5号、6号、7号(同8号)碳三种情况,因此共有12种。
1
2
3
4
5
6
7
8
5.X、Y、Z、W为原子序数依次增加的短周期元素,W原子的最外层电子数是内层电子数的3倍,M、N是由这些元素组成的二元化合物,M和N转化为R的反应历程如图所示。
1
2
3
4
5
6
下列叙述正确的是
A.氢化物稳定性:Z>W
B.①→②放出能量并有非极性
键形成
C.M、N、R三种分子中,所有原子均满足8电子稳定结构
D.X、Z、W三种元素组成的化合物一定是共价化合物
√
7
8
解析 W原子最外层电子数是内层电子数的3倍,则W为O元素。由N的结构式,X、Y、Z、W原子序数递增,则X为H元素,Y为C元素,Z为N元素,据此分析,B项正确。
1
2
3
4
5
6
7
8
6.埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法正确的是
1
2
3
4
5
6
A.该方法将电能转化成化学能
B.在此装置中钢管道作正极
C.该方法称为“外加电流的阴极保护法”
D.镁块上发生的电极反应为O2+2H2O+4e-===4OH-
√
解析 该保护装置利用了原电池原理,镁为负极,钢管为正极。
7
8
7
已知: +2H+===CS2+H2S↑;CS2不溶于水,沸点46 ℃,与CO2某些化学性质相似。下列说法错误的是
A.装置C中发生的反应为CS2+2NaOH===Na2COS2+H2O
B.充分反应后通入一段时间热N2,目的是使装置中的H2S、CS2被充分吸收
C.若装置B中生成沉淀的质量为14.4 g,则c(Na2CS3)=1.0 mol·L-1
D.若将热N2改为热空气,根据装置C中溶液的增重测定c(Na2CS3)的数值偏高
7.Na2CS3在工农业上有重要的应用。实验室中为了测定某Na2CS3溶液的浓度,设计下图装置进行实验。
1
2
3
4
5
6
√
8
7
1
2
3
4
5
6
8
8.四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
已知:①几种金属氢氧化物沉淀的pH如上表所示:
物质
Fe(OH)3
Al(OH)3
开始沉淀的pH
2.3
4.0
完全沉淀的pH
3.7
6.5
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
7
1
2
3
4
5
6
8
解析 加硫酸从矿石中浸出锂,如粉碎矿石、搅拌、加热等措施均可以提高反应速率。加入碳酸钙中和溶液中的酸,使铁、铝离子完全沉淀成氢氧化铁、氢氧化铝。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________________
__________(写两条);加入CaCO3的作用是__________________________
_____________。
粉碎矿石、加热、搅拌等
(任写两条)
调节pH使Fe3+、Al3+转化成
氢氧化物沉淀
7
1
2
3
4
5
6
8
(2)“a”最小值为_____。“电解”的阴极反应式为______________。
6.5
Li++e-===Li
物质
Fe(OH)3
Al(OH)3
开始沉淀的pH
2.3
4.0
完全沉淀的pH
3.7
6.5
解析 从表格信息看,调节pH最小值为6.5,确保铝离子完全沉淀。阴极上锂离子被还原成锂。
7
1
2
3
4
5
6
8
(3)设计简单方案由Li2CO3制备LiCl:_______________________________
_____。
用盐酸溶解,在氯化氢气体中蒸干
溶液
解析 在氯化氢气体中蒸干氯化锂溶液,类似从海水中提取氯化镁。
7
1
2
3
4
5
6
8
(4)写出LiH和AlCl3反应的化学方程式:_____________________________
_______(条件不作要求)。
3LiCl
解析 氯化铝与氢化锂反应生成四氢铝锂和氯化锂。
7
1
2
3
4
5
6
8
解析 依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,减少碳酸锂的损失。沉淀表面有硫酸钠,检验 可判断沉淀是否洗净。
(5)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是______________;检验碳酸锂是否洗净的实验方法是_________________________________
______________________________________________。
减少Li2CO3损失
取最后一次洗涤液于试管中,滴加氯
化钡溶液和稀硝酸,观察是否有沉淀产生(合理即可)
7
1
2
3
4
5
6
8
解析 还原能力指失电子数。1 mol LiAlH4能提供8 mol电子,相当于4 mol H2。LiAlH4的有效氢为 ≈0.21 g。
(6)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为______。(结果保留2位小数)
0.21 g
7
1
2
3
4
5
6
8
B组(25分钟)
1.(2020·潍坊三模)古代化学源远流长。下列说法错误的是
A.“熬胆矾铁釜,久之亦化为铜”,说明铁能置换出铜;这样铁釜能减
缓锈蚀
B.“欲试药金(铜锌合金),烧火有五色气起”,通过焰色反应可检验金
属元素
C.“龙泉水,可以淬刀剑”,高温的铁与水反应生成Fe3O4
D.“取朴硝(含有KNO3)以温汤溶解,次早结块”,该过程为重结晶
1
2
3
4
5
6
√
解析 铁置换出铜,构成原电池,会加速铁的腐蚀,故A项错误。
7
8
2.汞(熔点为39 ℃,沸点为356 ℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞,目前工业上制纯汞的一种流程图如下:
1
2
3
4
5
6
下列分析错误的是
A.洗涤粗汞可用5%的盐酸代替5%的硝酸
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.“灼烧辰砂法”发生的反应为HgS+O2 Hg+SO2
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
√
7
8
1
2
3
4
5
6
解析 铜与盐酸不反应,A项错误;
辰砂与氧化钙加热反应时,化合价升高的元素是S,所以CaSO4是氧化产物,B项正确;
“灼烧辰砂法”发生的反应为HgS+O2 Hg+SO2,C项正确;
该实验的目的是获得纯汞,最后一步根据汞沸点为356 ℃,可以通过减压蒸馏降低汞的沸点,提高分离效率,D项正确。
7
8
3.共用两个或两个以上碳原子的多环烃称为桥环烃,二环[1,1,0]丁烷( )
是一种简单的桥环烃。下列关于该有机物的说法错误的是
A.与环丁烯互为同分异构体
B.一氯代物有2种,二氯代物有4种
C.所有碳原子均处于同一平面内
D.开环加氢生成1 mol C4H10至少需要2 mol H2
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
解析 二环[1,1,0]丁烷与环丁烯[ ]的分子式均为C4H6,二者的分子结构不同,互为同分异构体,A项正确;
该烃分子中有2种不同化学环境的氢原子,则其一氯代物有2种;考虑两
个Cl原子在碳原子上的相对位置,有4种二氯代物,分别为 、
、 和 ,B项正确;
7
8
1
2
3
4
5
6
二环[1,1,0]丁烷分子中所有碳原子均形成4个单键,每个碳原子与周围 4个原子均形成四面体结构,故该烃分子中所有碳原子不处于同一平面内,C项错误;
该烃的分子式为C4H6,可与2 mol H2发生开环加氢反应生成分子式为C4H10的烃,D项正确。
7
8
下列说法正确的是
A.A、B、C分别盛有饱和Na2CO3溶液、浓硫酸和烧碱溶液
B.装置②中温水的作用是降低装置①中生成的CO2在液溴中的溶解度
C.实验开始时,先加热管式炉,再打开装置①中活塞
D.实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温
4.已知:溴化铁在200 ℃以上易分解,煮沸水溶液也会使其分解,生成溴化亚铁和溴单质。实验室里利用如图装置制取纯净的无水FeBr3。
1
2
3
4
5
6
√
7
8
解析 利用装置①制备的CO2中混有HCl、H2O(g),装置③中A、B依次除去HCl、H2O(g),利用装置④进行尾气处理,故A、B、C分别盛有饱和NaHCO3溶液、浓硫酸和烧碱溶液,A项错误;
装置②中温水的作用是促进液溴的挥发,得到溴蒸气,B项错误;
实验开始时,要先打开装置①中活塞,利用反应产生的CO2排出装置内空气,再加热管式炉,防止铁粉被O2氧化引入杂质,C项错误;
实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温,排出装置内溴蒸气,并被C中烧碱溶液吸收,防止污染环境,D项正确。
1
2
3
4
5
6
7
8
5.A、B、C、D、E、F为原子序数依次递增的六种短周期主族元素,工业上通过分离液态空气获得B的单质,C与A、F两元素原子序数之差的绝对值都是8,E的简单离子半径小于同周期其他元素的简单离子半径。下列说法正确的是
A.B元素一定位于第二周期ⅤA族
B.A元素与其他元素既能形成离子化合物,又能形成共价化合物
C.D单质的熔点高于E,则D的金属性强于E
D.F的氧化物的水化物酸性强于其他元素的氧化物的水化物酸性
1
2
3
4
5
6
√
7
8
解析 工业上通过分离液态空气可获得氧气和氮气;一般情况下,短周期同主族相邻周期元素原子序数之差为8,但H和Li例外;第三周期离子半径最小的简单离子是Al3+。据此推断出,A是氢、B是氮或氧、C是氟、D是钠或镁、E是铝、F是氯。B位于元素周期表中第二周期ⅥA族或第二周期ⅤA族,A项错误;
H与其他元素主要形成共价化合物如水、烃等,也可以形成离子化合物如NaH、MgH2等,B项正确;
Na或Mg的熔点低于Al,与两者金属性强弱无关,C项错误;
Cl的最高价氧化物的水化物高氯酸是酸性最强的含氧酸,该选项没有“最高价”限制,D项错误。
1
2
3
4
5
6
7
8
6.金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是
A.图示中与电子流向对应的氟离子移动方向是(B)
B.电池放电过程中,若转移1 mol电子,则M电极质量减少12 g
C.电池充电过程中阳极的电极反应式为:Bi+3F--3e-===BiF3
D.该电池需要在高温条件下工作,目的是将热能转化为电能
1
2
3
4
5
6
√
7
8
解析 依据电子流向以及金属的性质判断,放电时,M为正极,N为负极。F-应移向负极,A项错误;
1
2
3
4
5
6
外电路转移1 mol e-,M极应有1 mol F-进入固体电解质,电极质量减少19 g,B项错误;
高温的目的是使固体电解质电离形成自由移动的离子,放电时,是化学能转变为电能,D项错误。
7
8
7.向某Na2CO3、NaHCO3的混合溶液中加入少量
的BaCl2,测得溶液中lg 与-lg c(Ba2+)
的关系如图所示,下列说法不正确的是
A.该溶液中
B.B、D、E三点对应溶液pH的大小顺序为:B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)= +
c(OH-)+c(Cl-)
√
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
A、B、C三点对应的分散系中,A点属于过饱和溶液,会形成BaCO3沉淀,因此该分散系的稳定性最差,C项正确;
7
8
1
2
3
4
5
6
解析 滤渣A的主要成分是金、银,金不溶于硝酸。
8.碲(Te)常用于冶金工业,也是石油裂解的催化剂。工业上用精炼铜的阳极泥(主要含有TeO2,还含有少量Ag、Au)为原料制备单质碲的一种工艺流程如下:
已知TeO2微溶于水,易溶于较浓的强酸和强碱。
(1)从滤渣A中分离出Au的方法是__________________________________。
加稀硝酸充分反应,过滤、洗涤、干燥
7
8
1
2
3
4
5
6
(2)“沉碲”时控制溶液的pH为4.5~5.0,生成TeO2沉淀。防止溶液局部酸性过强的操作是_______________________________________________。
缓慢加入稀硫酸,同时搅拌,并随时检测溶液的pH
解析 为了避免溶液局部酸性过强,应缓慢加入稀硫酸,同时搅拌,并随时检测溶液的pH。
7
8
1
2
3
4
5
6
(3)写出“碱浸”时发生反应的离子方程式:__________________________。
滤液B经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到的副产品是________(填化学式)。
Na2SO4
解析 二氧化碲类似SO2,与氢氧化钠反应生成亚碲酸钠。“碱浸”时加入NaOH溶液,“沉碲”时加入稀硫酸,故滤液B中所得副产品是Na2SO4。
7
8
1
2
3
4
5
6
(4)为了提高“碱浸”的浸出率,宜采取的措施有____________________
_________________________________________(写两条即可)。“酸溶”时要控制温度,温度不宜过高,原因是_____________________________
_____________。
粉碎阳极泥、加热、
增大氢氧化钠溶液的浓度、搅拌等(合理即可)
温度过高,加快盐酸挥发,降低
原料的利用率
解析 从影响化学反应速率的因素角度考虑,即从增大接触面积、升温、增大浓度等角度分析。酸浸用到盐酸,温度高,盐酸挥发快。
7
8
1
2
3
4
5
6
(5)写出“还原”中发生反应的化学方程式:________________________
_______________。
TeCl4+2SO2+4H2O===Te↓
+2H2SO4+4HCl
解析 二氧化硫是还原剂,还原四氯化碲生成碲、硫酸和盐酸。
7
8
1
2
3
4
5
6
(6)经上述流程,从质量为m t的某阳极泥中提取出质量为n t的碲,已知该
阳极泥含TeO2的质量分数为w,则碲的提取率为_____________(用含w、
m、n的代数式表示,提取率= ×100%)。
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
C组(25分钟)
1.冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
据此分析,下列观点不正确的是
A.滤渣A的主要成分是CaSO4
B.上述流程中,所涉反应没有复
分解反应
C.“操作ⅰ”不可用硅酸盐质设
备进行分离
D.流程中可循环使用的物质除H2SO4、SiO2外,滤液B经浓缩后也能循环使用
√
7
8
1
2
3
4
5
6
解析 根据图示,反应①的反应物是CaF2、SiO2、H2SO4,生成物是H2SiF6和滤渣A,故滤渣A的主要成分是硫酸钙,A项正确;
H2SiF6与Na2SO4的反应属于复分解反应,B项错误;
操作ⅰ所得滤液中F-水解生成的HF腐蚀硅酸盐质设备,所以“操作ⅰ”不能用硅酸盐质设备进行分离,C项正确;
根据题意,反应③的离子方程式为
+4NH3·H2O,滤液B的主要成分是氨水,经浓缩后可以循环使用,D项正确。
7
8
1
2
3
4
5
6
2.对羟基苯甲酸乙酯用于食品防腐剂,工业上可用下列方法制备,以下说法错误的是
A.对羟基苯甲酸能发生缩聚反应、取代反应
B.可用浓溴水检验产物中是否有对羟基苯甲酸乙酯生成
C.1 mol对羟基苯甲酸乙酯最多与2 mol NaOH反应
D.乙醇脱水生成的乙烯不存在顺反异构
√
7
8
1
2
3
4
5
6
+C2H5OH
对羟基苯甲酸
对羟基苯甲酸乙酯
+H2O
解析 对羟基苯甲酸、对羟基苯甲酸乙酯二者都含有酚羟基,都能与浓溴水反应,无法用浓溴水检验产物的生成,故B项错误。
7
8
1
2
3
4
5
6
+C2H5OH
对羟基苯甲酸
对羟基苯甲酸乙酯
+H2O
3.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.电解精炼铜时,当外电路通过NA个电子时,阳极一定减轻32 g
B.反应3H2(g)+N2(g) 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ
时,转移电子数为0.6NA
C.0.1 mol·L-1的Na2CO3溶液中,若Na+的数目为NA,则
总数为0.5NA
D.标准状况下,NO和O2各11.2 L混合后充分反应,所得气体的分子总数
为0.75NA
√
7
8
1
2
3
4
5
6
解析 粗铜中含有Fe、Zn等杂质,电解精炼铜时,比Cu活泼的金属先放电,因此当外电路通过NA个电子时,阳极减少的质量不一定为32 g,A项错误;
当放出9.2 kJ热量时,消耗0.3 mol H2,转移电子数为0.6NA,B项正确;
由物料守恒知,Na+的数目若为NA,则 和H2CO3的总数为0.5 NA,C项错误;
标准状况下NO和O2各11.2 L(0.5 mol)充分混合发生反应,生成0.5 mol NO2,剩余0.25 mol O2,由于存在平衡2NO2(g) N2O4(g),因此所得气体的总物质的量小于0.75 mol,D项错误。
7
8
1
2
3
4
5
6
4.W、X、Y和Z均为短周期主族元素且原子序数依次增大,W、X、Y的最外层电子数之和与Z的最外层电子数相等,W的简单气态氢化物与Z单质在集气瓶中混合后,放置在光源下发生反应,气体颜色由黄绿色不断变浅且在瓶壁上有油状物生成。下列说法错误的是
A.Z分别与X、Y形成的二元化合物的水溶液均呈中性
B.X的简单离子的半径比Y的简单离子的半径大
C.Z的氧化物对应的水化物不一定是强酸
D.Z分别与W、Y形成的二元化合物所含化学键类型不同
√
7
8
1
2
3
4
5
6
解析 根据题意可推知W、X、Y和Z分别是C、Na、Mg和Cl。NaCl水溶液呈中性,MgCl2水溶液因Mg2+的水解而显酸性,A项错误;
Na+、Mg2+具有相同的电子层结构,Na+的核电荷数小,离子半径大,B项正确;
Cl的氧化物对应的水化物有多种,其中HClO4是强酸,HClO为弱酸,C项正确;
Z分别与W、Y形成的二元化合物为CCl4和MgCl2,前者所含有的化学键是共价键,而后者所含有的化学键是离子键,D项正确。
7
8
1
2
3
4
5
6
5.资料显示:在加热条件下,NO2被Cu还原生成N2。选择下列装置进行实验,其中错误的是
√
7
8
1
2
3
4
5
6
解析 铜和浓硝酸反应生成NO2,A项正确;
NO2与铜粉在加热条件下反应生成N2和CuO,B项正确;
NO2可用无水CaCl2干燥,C项正确;
收集N2之前要除去氮气中混有的NO2,可用氢氧化钠溶液吸收NO2,发生反应2NO2+2NaOH===NaNO3+NaNO2+H2O,若用饱和食盐水吸收NO2,会生成NO,水槽中集气瓶收集的气体中将含有NO,D项错误。
7
8
1
2
3
4
5
6
6.氮氧化物、硝酸盐废水都会给环境带来污染。图甲是监测NO含量的传感器的工作原理示意图,图乙是电化学降解酸性废水中 的工作原理示意图。下列有关叙述错误的是
A.图甲中,Pt电极上发生的是还原反应
B.图甲中,NiO电极上的电极反应式为NO+O2--2e-===NO2
C.图乙中,H+由电解池右侧移向左侧
D.图乙中,阴极反应式为2 +10e-+12H+===6H2O+N2↑
√
7
8
1
2
3
4
5
6
解析 图甲,NO在NiO电极上失去电子,发生氧化反应;氧气在铂电极上得到电子生成氧离子,发生还原反应,A项正确;
负极NiO上一氧化氮失去电子和氧离子结合生成二氧化氮,B项正确;
电解池中质子向阴极移动,所以电解过程中H+从左侧通过质子交换膜进入右侧,C项错误;
图乙,硝酸根离子得电子发生还原反应,则Ag-Pt电极作阴极,Pt电极作阳极,阳极上电极反应为2H2O-4e-===O2↑+4H+,阴极上电极反应为2 +12H++10e-===N2↑+6H2O,D项正确。
7
8
1
2
3
4
5
6
7.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑 的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是
A.Ksp(Ag2C2O4)数量级为10-11
B.n点表示Ag2C2O4的不饱和溶液
C.向c(Cl-)=c( )的混合溶液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+ (aq)的平衡常数为10-0.71
√
7
8
1
2
3
4
5
6
8.(2020·淄博一模)二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图1:
(1)(NH4)2MoO4中Mo的化合价为_____。
+6
解析 化合物中元素化合价代数和等于0,所以(NH4)2MoO4中Mo的化合价为+6。
7
8
1
2
3
4
5
6
(2)“焙烧”时MoS2转化为MoO3的化学方程式为______________
___________________。
2MoS2+7O2
解析 “焙烧”时MoS2和氧气反应生成MoO3和SO2,根据得失电子守恒
配平方程式为2MoS2+7O2 2MoO3+4SO2。
7
8
1
2
3
4
5
6
(3)由图2分析可知产生MoS3沉淀的流程中选择的最优温度和时间是______________,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因_____________________________________________
________________________________________________________________________________________________________________________________________。
40 ℃、30 min
温度太低,反应 MoS3↓+H2S↑产生的H2S气体不易逸出,不利于平衡正向移动生成MoS3;温度太高,反应物盐酸挥发,导致溶液中c(H+)下降,上述平衡逆向移动,也不利于生成MoS3
7
8
1
2
3
4
5
6
(4)利用低品相的原料制备高纯产品是工业生产中的普遍原则。如图3所示,反应[Ni(s)+4CO(g) Ni(CO)4(g) ΔH<0]在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡
移动原理,判断温度Tl_____T2(填“>”
“<”或“=”)。
>
解析 Ni(s)+4CO(g) Ni(CO)4(g) ΔH<0,正反应放热,升高温度平衡逆向移动,生成Ni单质,在温度为T1的一端得到了纯净的镍粉,所以Tl>T2。
7
8
1
2
3
4
5
6
(5)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去 (忽略溶液体积变化),则当 完全沉淀时,溶液中c( )<__________mol·L-1
(保留2位有效数字)。
3.6×10-3
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
同课章节目录
