2021届高中化学考前三个月专项复习课件题型三 真题调研 课件(33张ppt)
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件题型三 真题调研 课件(33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-01 11:11:54 | ||
图片预览








文档简介
真题调研
题型三 化学反应原理综合题的研究
1.(2020·全国卷Ⅰ,28)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:
ΔH=-98 kJ·mol-1。回答下列问题:
1
2
3
4
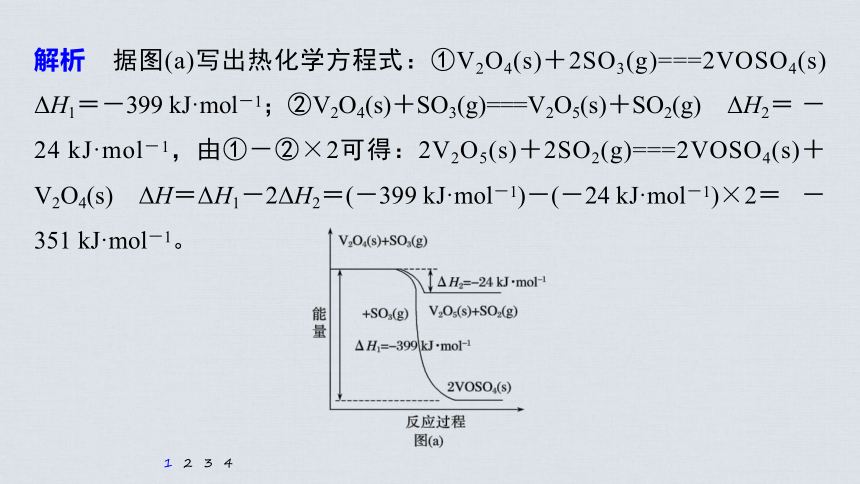
(1)钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:____________________________
_____________________________。
+V2O4(s) ΔH=-351 kJ·mol-1
解析 据图(a)写出热化学方程式:①V2O4(s)+2SO3(g)===2VOSO4(s) ΔH1=-399 kJ·mol-1;②V2O4(s)+SO3(g)===V2O5(s)+SO2(g) ΔH2= -24 kJ·mol-1,由①-②×2可得:2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2= -351 kJ·mol-1。
1
2
3
4
_______________________________________________________________。
影响α的因素有__________________________________________。
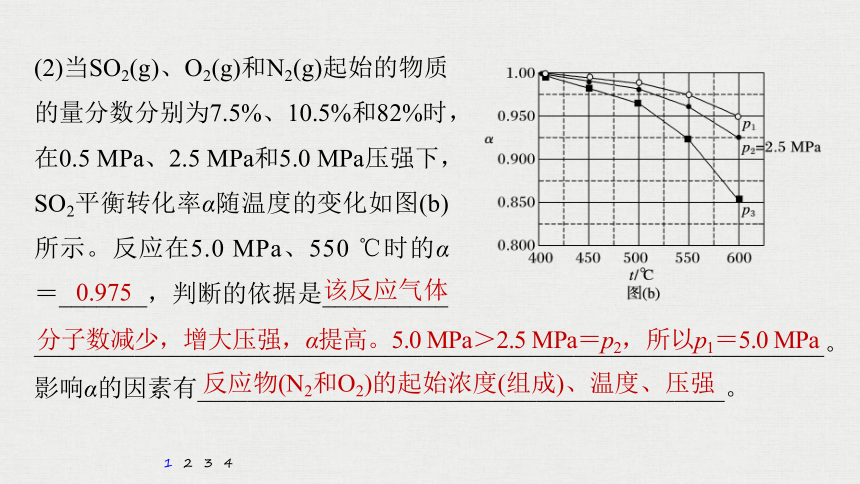
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图(b)所示。反应在5.0 MPa、550 ℃时的α=_______,判断的依据是__________
1
2
3
4
0.975
该反应气体
分子数减少,增大压强,α提高。5.0 MPa>2.5 MPa=p2,所以p1=5.0 MPa
反应物(N2和O2)的起始浓度(组成)、温度、压强
1
2
3
4
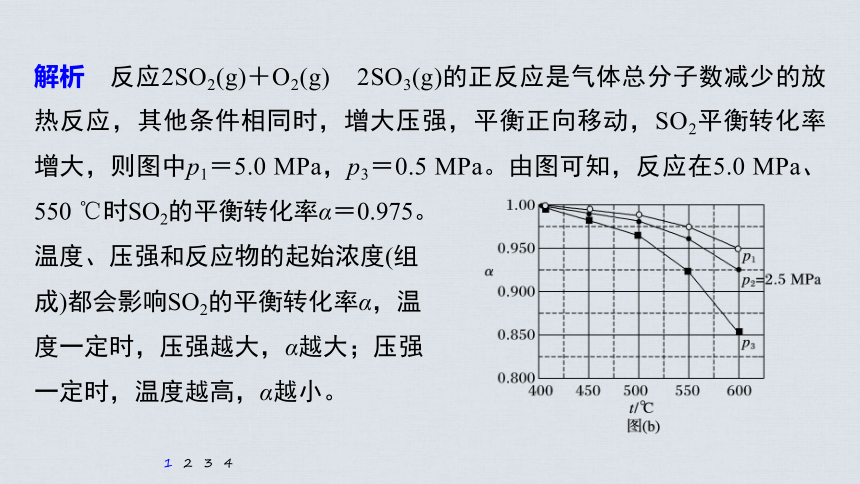
解析 反应2SO2(g)+O2(g) 2SO3(g)的正反应是气体总分子数减少的放热反应,其他条件相同时,增大压强,平衡正向移动,SO2平衡转化率增大,则图中p1=5.0 MPa,p3=0.5 MPa。由图可知,反应在5.0 MPa、550 ℃时SO2的平衡转化率α=0.975。
温度、压强和反应物的起始浓度(组
成)都会影响SO2的平衡转化率α,温
度一定时,压强越大,α越大;压强
一定时,温度越高,α越小。
(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,
则SO3压强为_________,平衡常数Kp=__________________(以分压表示,分压=总压×物质的量分数)。
1
2
3
4
解析 假设原气体的物质的量为100 mol,则SO2、O2和N2的物质的量分别为2m mol,m mol和q mol,2m+m+q=100,利用“三段式法”计算:
1
2
3
4
SO2(g) + O2(g) SO3(g)
起始量/mol 2m m 0
转化量/mol 2mα mα 2mα
平衡量/mol 2m×(1-α) m×(1-α) 2mα
平衡时混合气体的总物质的量为2m×(1-α)mol+m×(1-α)mol+2mα mol+q mol=(3m-mα+q ) mol,
1
2
3
4
_______________________________________________________________
_______。
k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
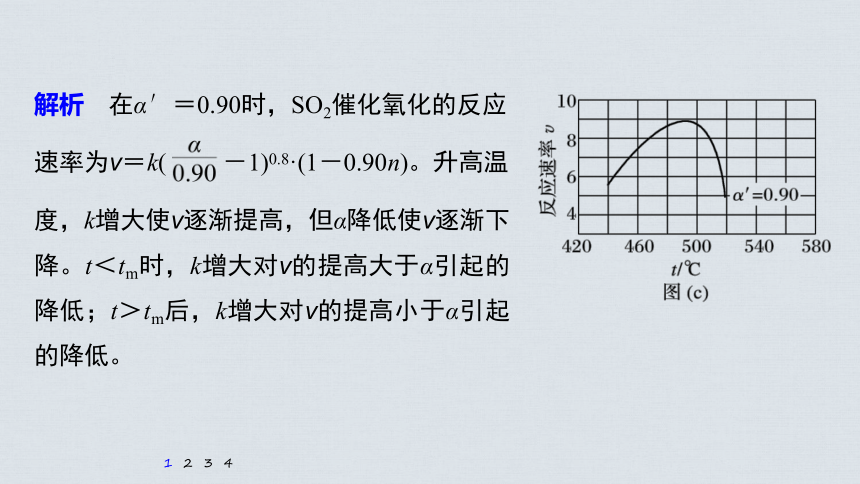
(4)研究表明,SO2催化氧化的反应速率方程为:v=k( -1)0.8(1-nα′)。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α′为某时刻SO2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。
1
2
3
4
曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm。ttm后,v逐渐下降。原因是______________________
_______________________________________
升高温度,k增大使v逐
渐提高,但α降低使v逐渐下降。当t<tm,
1
2
3
4
解析 在α′=0.90时,SO2催化氧化的反应
速率为v=k( -1)0.8·(1-0.90n)。升高温
度,k增大使v逐渐提高,但α降低使v逐渐下降。t<tm时,k增大对v的提高大于α引起的降低;t>tm后,k增大对v的提高小于α引起的降低。
2.(2020·全国卷Ⅱ,28)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
1
2
3
4
物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热ΔH/( kJ·mol-1)
-1 560
-1 411
-286
①ΔH1=______ kJ·mol-1。
+137
解析 先写出三种气体的燃烧热的热化学方程式,然后根据盖斯定律,ΔH1=-1 560 kJ·mol-1-(-1 411 kJ·mol-1)-(-286 kJ·mol-1)=+137 kJ·mol-1。
②提高该反应平衡转化率的方法有__________、__________________。
1
2
3
4
升高温度
减小压强(增大体积)
解析 C2H6(g)===C2H4(g)+H2(g) ΔH1=+137 kJ·mol-1是一个气体分子数增大的吸热反应,要提高反应物的转化率,可以采取升高温度、减小压强(增大体积)等措施。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙
烷的平衡转化率为α。反应的平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
1
2
3
4
解析 设容器中通入的乙烷和氢气均为1 mol,则:
C2H6(g)===C2H4(g)+H2(g) n(总)
初始量/mol 1 0 1
转化量/mol α α α
平衡量/mol 1-α α 1+α 2+α
1
2
3
4
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2。反应在初期阶段的速率方程为:r=k× ,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=______ r1。
1
2
3
4
(1-α)
解析 甲烷的转化率为α时, =(1-α) ,则 = =1-α,即r2=(1-α)r1。
②对于处于初期阶段的该反应,下列说法正确的是______。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
1
2
3
4
AD
解析 A对,由速率方程知,甲烷的浓度越大,反应越快;
B错,H2的浓度大小不影响反应速率;
C错,反应过程中 逐渐减小,故C2H6的生成速率逐渐减小;
D对,降低反应温度,反应速率减小,故k减小。
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
1
2
3
4
①阴极上的反应式为_____________________。
CO2+2e-===CO+O2-
解析 由图示可知,阴极上CO2―→CO,且固体电解质能传导O2-,则阴极反应式为CO2+2e-===CO+O2-。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为______。
1
2
3
4
6∶5
解析 假设生成的乙烯和乙烷的物质的量分别为2 mol和1 mol,由4CH4 ―→2C2H4+4H2、2CH4―→C2H6+H2知,生成2 mol乙烯和1 mol乙烷时,共脱去5 mol H2,转移10 mol e-,根据电子转移数目守恒可知,此时消耗的CO2为5 mol,消耗的CH4为6 mol,即消耗的CH4和CO2的体积比为6∶5。
3.(2020·全国卷Ⅲ,28)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶ n(H2O)=______。当反应达到平衡时,若增大压强,则n(C2H4)______(填“变大”“变小”或“不变”)。
1
2
3
4
1∶4
变大
解析 CO2催化加氢生成乙烯和水的化学方程式为2CO2(g)+6H2(g)
C2H4(g)+4H2O(g),产物的物质的量之比n(C2H4)∶n(H2O)=1∶4,该反应是气体体积减小的反应,增大压强平衡右移,则n(C2H4)变大。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
1
2
3
4
图中,表示C2H4、CO2变化的曲线分别是____、____。CO2催化加氢合成C2H4反应的ΔH_____0(填“大于”或“小于”)。
d
c
小于
解析 由平衡图像知,390 K时四种组分的物质的量分数之比满足1∶3的是c曲线和a曲线,物质的量分数之比满足1∶4的是d曲线和b曲线,结合反应方程式2CO2(g)+6H2(g) C2H4(g)+4H2O(g)和原始投料n(CO2)∶n(H2)=1∶3可得,曲线c
1
2
3
4
表示CO2,曲线a表示H2,曲线d表示C2H4,曲线b表示H2O;由图像的变化趋势可知,升高温度,曲线a、c增大,曲线b、d减小,说明平衡左移,所以正反应放热,ΔH<0。
(3)根据图中点A(440 K,0.39),计算该温
度时反应的平衡常数Kp=_____________
(MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
1
2
3
4
解析 起始投料比n(CO2)∶n(H2)=1∶3,平衡时总压为0.1 MPa,结合反应方程式可知p(CO2)∶p(H2)=1∶3,p(C2H4)∶p(H2O)=1∶4,由图像可知p(H2)=p(H2O)=0.1×0.39,
所以p(CO2)= ×0.39。
1
2
3
4
1
2
3
4
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当_________________。
1
2
3
4
选择合适催化剂等
解析 在一定温度和压强下,为了提高反应速率和乙烯的选择性,减少副反应的发生,应当选择合适催化剂等。
4.(2020·江苏,20)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为_____________
1
2
3
4
____________________;其他条件不变, 转化为HCOO-的转化率随温度的变化如图1所示。反应温度在40 ℃~80 ℃范围内, 催化加氢的转化率迅速上升,其主要原因是_________________________________
_________________。
温度升高反应速率增大,温度升高
催化剂的活性增强
1
2
3
4
解析 H2通入含有催化剂的KHCO3溶液生成HCOO-,根据原子个数守
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
1
2
3
4
①电池负极电极反应式为_________________
___________________;放电过程中需补充的物质A为________(填化学式)。
HCOO-+2OH-
H2SO4
1
2
3
4
解析 由图示可知,燃料电池负极区是HCOO-―→ ,因在碱性条件下,故电极反应式为HCOO-+2OH--2e-===
+H2O。电池正极区发生反应:Fe3++e-===Fe2+,Fe2+又被通入的O2氧化为Fe3+:4Fe2++O2+4H+===4Fe3++2H2O,同时还生成K2SO4,则需要补充的物质A为H2SO4。
②图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为____________
_____________________________________________________。
1
2
3
4
2HCOOH+
解析 根据电池反应的实质为HCOOH与O2反应生成 ,可写出电池反应的离子方程式为2HCOOH+2OH-+O2===2 +2H2O或2HCOO-+O2===2 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
1
2
3
4
①HCOOD催化释氢反应除生成CO2外,还生成_____(填化学式)。
HD
解析 根据反应机理,HCOOD在NH(CH3)2和Pd催化作用下的释氢反应除生成CO2外,还生成HD。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是_________________________。
1
2
3
4
提高释放氢气的速率及纯度
解析 HCOOK是强电解质,HCOOK溶液中HCOO-浓度更大,释放H2的速率更快;HCOOK溶液参与反应时,该过程主要反应的化学方程式为HCOOK+H2O===H2↑+KHCO3,减少了CO2的生成,因此能提高释放出氢气的纯度。
高考化学反应原理综合题的命题规律
以工业生产原理或元素化合物为情景,以速率、平衡为核心,结合图、表,综合考查平衡常数、转化率、平衡移动原理、化学反应速率、热化学方程式、反应热、溶液中的离子平衡、离子反应等相关知识;考查识图能力及运用化学基本理论解释实际问题的能力。
题型三 化学反应原理综合题的研究
1.(2020·全国卷Ⅰ,28)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:
ΔH=-98 kJ·mol-1。回答下列问题:
1
2
3
4
(1)钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:____________________________
_____________________________。
+V2O4(s) ΔH=-351 kJ·mol-1
解析 据图(a)写出热化学方程式:①V2O4(s)+2SO3(g)===2VOSO4(s) ΔH1=-399 kJ·mol-1;②V2O4(s)+SO3(g)===V2O5(s)+SO2(g) ΔH2= -24 kJ·mol-1,由①-②×2可得:2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2= -351 kJ·mol-1。
1
2
3
4
_______________________________________________________________。
影响α的因素有__________________________________________。
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图(b)所示。反应在5.0 MPa、550 ℃时的α=_______,判断的依据是__________
1
2
3
4
0.975
该反应气体
分子数减少,增大压强,α提高。5.0 MPa>2.5 MPa=p2,所以p1=5.0 MPa
反应物(N2和O2)的起始浓度(组成)、温度、压强
1
2
3
4
解析 反应2SO2(g)+O2(g) 2SO3(g)的正反应是气体总分子数减少的放热反应,其他条件相同时,增大压强,平衡正向移动,SO2平衡转化率增大,则图中p1=5.0 MPa,p3=0.5 MPa。由图可知,反应在5.0 MPa、550 ℃时SO2的平衡转化率α=0.975。
温度、压强和反应物的起始浓度(组
成)都会影响SO2的平衡转化率α,温
度一定时,压强越大,α越大;压强
一定时,温度越高,α越小。
(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,
则SO3压强为_________,平衡常数Kp=__________________(以分压表示,分压=总压×物质的量分数)。
1
2
3
4
解析 假设原气体的物质的量为100 mol,则SO2、O2和N2的物质的量分别为2m mol,m mol和q mol,2m+m+q=100,利用“三段式法”计算:
1
2
3
4
SO2(g) + O2(g) SO3(g)
起始量/mol 2m m 0
转化量/mol 2mα mα 2mα
平衡量/mol 2m×(1-α) m×(1-α) 2mα
平衡时混合气体的总物质的量为2m×(1-α)mol+m×(1-α)mol+2mα mol+q mol=(3m-mα+q ) mol,
1
2
3
4
_______________________________________________________________
_______。
k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
(4)研究表明,SO2催化氧化的反应速率方程为:v=k( -1)0.8(1-nα′)。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α′为某时刻SO2转化率,n为常数。在α′=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。
1
2
3
4
曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm。t
_______________________________________
升高温度,k增大使v逐
渐提高,但α降低使v逐渐下降。当t<tm,
1
2
3
4
解析 在α′=0.90时,SO2催化氧化的反应
速率为v=k( -1)0.8·(1-0.90n)。升高温
度,k增大使v逐渐提高,但α降低使v逐渐下降。t<tm时,k增大对v的提高大于α引起的降低;t>tm后,k增大对v的提高小于α引起的降低。
2.(2020·全国卷Ⅱ,28)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
1
2
3
4
物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热ΔH/( kJ·mol-1)
-1 560
-1 411
-286
①ΔH1=______ kJ·mol-1。
+137
解析 先写出三种气体的燃烧热的热化学方程式,然后根据盖斯定律,ΔH1=-1 560 kJ·mol-1-(-1 411 kJ·mol-1)-(-286 kJ·mol-1)=+137 kJ·mol-1。
②提高该反应平衡转化率的方法有__________、__________________。
1
2
3
4
升高温度
减小压强(增大体积)
解析 C2H6(g)===C2H4(g)+H2(g) ΔH1=+137 kJ·mol-1是一个气体分子数增大的吸热反应,要提高反应物的转化率,可以采取升高温度、减小压强(增大体积)等措施。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙
烷的平衡转化率为α。反应的平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
1
2
3
4
解析 设容器中通入的乙烷和氢气均为1 mol,则:
C2H6(g)===C2H4(g)+H2(g) n(总)
初始量/mol 1 0 1
转化量/mol α α α
平衡量/mol 1-α α 1+α 2+α
1
2
3
4
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2。反应在初期阶段的速率方程为:r=k× ,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=______ r1。
1
2
3
4
(1-α)
解析 甲烷的转化率为α时, =(1-α) ,则 = =1-α,即r2=(1-α)r1。
②对于处于初期阶段的该反应,下列说法正确的是______。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
1
2
3
4
AD
解析 A对,由速率方程知,甲烷的浓度越大,反应越快;
B错,H2的浓度大小不影响反应速率;
C错,反应过程中 逐渐减小,故C2H6的生成速率逐渐减小;
D对,降低反应温度,反应速率减小,故k减小。
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
1
2
3
4
①阴极上的反应式为_____________________。
CO2+2e-===CO+O2-
解析 由图示可知,阴极上CO2―→CO,且固体电解质能传导O2-,则阴极反应式为CO2+2e-===CO+O2-。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为______。
1
2
3
4
6∶5
解析 假设生成的乙烯和乙烷的物质的量分别为2 mol和1 mol,由4CH4 ―→2C2H4+4H2、2CH4―→C2H6+H2知,生成2 mol乙烯和1 mol乙烷时,共脱去5 mol H2,转移10 mol e-,根据电子转移数目守恒可知,此时消耗的CO2为5 mol,消耗的CH4为6 mol,即消耗的CH4和CO2的体积比为6∶5。
3.(2020·全国卷Ⅲ,28)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶ n(H2O)=______。当反应达到平衡时,若增大压强,则n(C2H4)______(填“变大”“变小”或“不变”)。
1
2
3
4
1∶4
变大
解析 CO2催化加氢生成乙烯和水的化学方程式为2CO2(g)+6H2(g)
C2H4(g)+4H2O(g),产物的物质的量之比n(C2H4)∶n(H2O)=1∶4,该反应是气体体积减小的反应,增大压强平衡右移,则n(C2H4)变大。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
1
2
3
4
图中,表示C2H4、CO2变化的曲线分别是____、____。CO2催化加氢合成C2H4反应的ΔH_____0(填“大于”或“小于”)。
d
c
小于
解析 由平衡图像知,390 K时四种组分的物质的量分数之比满足1∶3的是c曲线和a曲线,物质的量分数之比满足1∶4的是d曲线和b曲线,结合反应方程式2CO2(g)+6H2(g) C2H4(g)+4H2O(g)和原始投料n(CO2)∶n(H2)=1∶3可得,曲线c
1
2
3
4
表示CO2,曲线a表示H2,曲线d表示C2H4,曲线b表示H2O;由图像的变化趋势可知,升高温度,曲线a、c增大,曲线b、d减小,说明平衡左移,所以正反应放热,ΔH<0。
(3)根据图中点A(440 K,0.39),计算该温
度时反应的平衡常数Kp=_____________
(MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
1
2
3
4
解析 起始投料比n(CO2)∶n(H2)=1∶3,平衡时总压为0.1 MPa,结合反应方程式可知p(CO2)∶p(H2)=1∶3,p(C2H4)∶p(H2O)=1∶4,由图像可知p(H2)=p(H2O)=0.1×0.39,
所以p(CO2)= ×0.39。
1
2
3
4
1
2
3
4
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当_________________。
1
2
3
4
选择合适催化剂等
解析 在一定温度和压强下,为了提高反应速率和乙烯的选择性,减少副反应的发生,应当选择合适催化剂等。
4.(2020·江苏,20)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为_____________
1
2
3
4
____________________;其他条件不变, 转化为HCOO-的转化率随温度的变化如图1所示。反应温度在40 ℃~80 ℃范围内, 催化加氢的转化率迅速上升,其主要原因是_________________________________
_________________。
温度升高反应速率增大,温度升高
催化剂的活性增强
1
2
3
4
解析 H2通入含有催化剂的KHCO3溶液生成HCOO-,根据原子个数守
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
1
2
3
4
①电池负极电极反应式为_________________
___________________;放电过程中需补充的物质A为________(填化学式)。
HCOO-+2OH-
H2SO4
1
2
3
4
解析 由图示可知,燃料电池负极区是HCOO-―→ ,因在碱性条件下,故电极反应式为HCOO-+2OH--2e-===
+H2O。电池正极区发生反应:Fe3++e-===Fe2+,Fe2+又被通入的O2氧化为Fe3+:4Fe2++O2+4H+===4Fe3++2H2O,同时还生成K2SO4,则需要补充的物质A为H2SO4。
②图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为____________
_____________________________________________________。
1
2
3
4
2HCOOH+
解析 根据电池反应的实质为HCOOH与O2反应生成 ,可写出电池反应的离子方程式为2HCOOH+2OH-+O2===2 +2H2O或2HCOO-+O2===2 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
1
2
3
4
①HCOOD催化释氢反应除生成CO2外,还生成_____(填化学式)。
HD
解析 根据反应机理,HCOOD在NH(CH3)2和Pd催化作用下的释氢反应除生成CO2外,还生成HD。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是_________________________。
1
2
3
4
提高释放氢气的速率及纯度
解析 HCOOK是强电解质,HCOOK溶液中HCOO-浓度更大,释放H2的速率更快;HCOOK溶液参与反应时,该过程主要反应的化学方程式为HCOOK+H2O===H2↑+KHCO3,减少了CO2的生成,因此能提高释放出氢气的纯度。
高考化学反应原理综合题的命题规律
以工业生产原理或元素化合物为情景,以速率、平衡为核心,结合图、表,综合考查平衡常数、转化率、平衡移动原理、化学反应速率、热化学方程式、反应热、溶液中的离子平衡、离子反应等相关知识;考查识图能力及运用化学基本理论解释实际问题的能力。
同课章节目录
