2021届高中化学考前三个月专项复习课件题型三 “7+化学反应原理”特训 课件(71张ppt)
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件题型三 “7+化学反应原理”特训 课件(71张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-01 11:12:37 | ||
图片预览









文档简介
“7+化学反应原理”特训
题型三 化学反应原理综合题的研究
A组(25分钟)
1.(2020·邯郸模拟)新型冠状病毒来势汹汹,主要传播途径有飞沫传播、接触传播和气溶胶传播,但是它依然可防可控,采取有效的措施预防,戴口罩、勤洗手,给自己居住、生活的环境消毒,都是非常行之有效的方法。下列有关说法正确的是
A.云、烟、雾属于气溶胶,但它们不能发生丁达尔效应
B.使用酒精作为环境消毒剂时,酒精浓度越大,消毒效果越好
C.“84”消毒液与酒精混合使用可能会产生氯气中毒
D.生产“口罩”的无纺布材料是聚丙烯产品,属于天然高分子材料
1
2
3
4
5
6
√
7
8
解析 气溶胶也是胶体,胶体都能发生丁达尔效应,A选项错误;
医用酒精的体积分数为75%,酒精浓度过大和过小都起不到消毒作用,B选项错误;
“84”消毒液的有效成分是NaClO,有强氧化性,酒精(乙醇)有还原性,二者混合会因氧化还原反应生成氯气,C选项正确;
聚丙烯属于合成高分子材料,D选项错误。
1
2
3
4
5
6
7
8
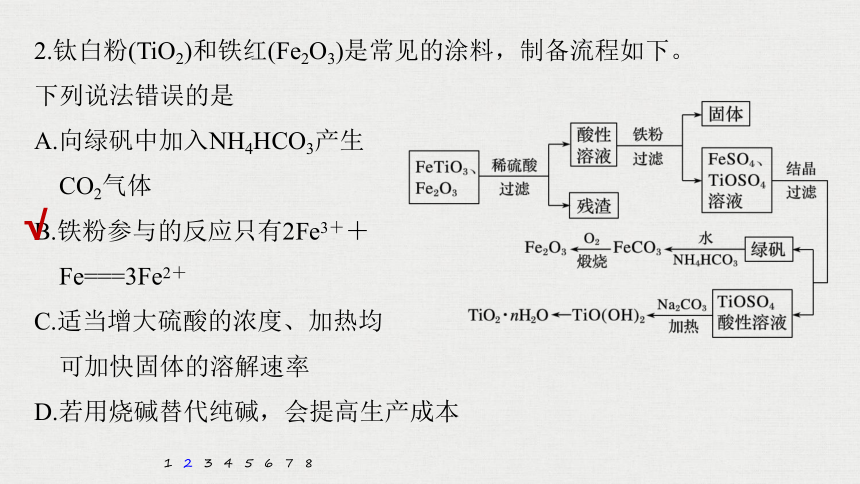
2.钛白粉(TiO2)和铁红(Fe2O3)是常见的涂料,制备流程如下。
1
2
3
4
5
6
7
8
下列说法错误的是
A.向绿矾中加入NH4HCO3产生
CO2气体
B.铁粉参与的反应只有2Fe3++
Fe===3Fe2+
C.适当增大硫酸的浓度、加热均
可加快固体的溶解速率
D.若用烧碱替代纯碱,会提高生产成本
√
1
2
3
4
5
6
7
8
解析 加入NH4HCO3,发生反应Fe2++ ===FeCO3↓+CO2↑+H2O,A项正确;
酸性溶液中含有Fe3+和H+,加入铁粉,发生反应2Fe3++Fe===3Fe2+、2H++Fe===Fe2++H2↑,B项错误;
升高温度、增大反应物的浓度均可加快反应速率,C项正确;
烧碱的价格高于纯碱的价格,若用烧碱替代纯碱,会提高生产成本,D项正确。
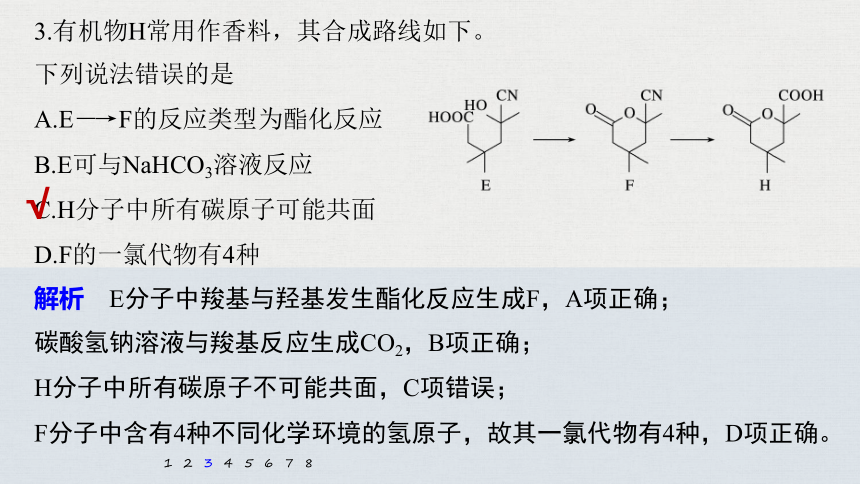
解析 E分子中羧基与羟基发生酯化反应生成F,A项正确;
碳酸氢钠溶液与羧基反应生成CO2,B项正确;
H分子中所有碳原子不可能共面,C项错误;
F分子中含有4种不同化学环境的氢原子,故其一氯代物有4种,D项正确。
3.有机物H常用作香料,其合成路线如下。
1
2
3
4
5
6
7
8
下列说法错误的是
A.E―→F的反应类型为酯化反应
B.E可与NaHCO3溶液反应
C.H分子中所有碳原子可能共面
D.F的一氯代物有4种
√
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),Z与W、W与Q的原子序数之差均为3,五种元素原子的最外层电子数之和为21,下列说法正确的是
A.X和Y的常见氧化物都是大气污染物
B.自然界中W的储量丰富,高纯度的W的氧化物是将太阳能转化为电能
的材料
C.一定条件下,Q单质可把Y从其氢化物中置换出来
D.最高价氧化物对应水化物的酸性顺序:Q>Y>W>X
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
7
8
解析 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。Z元素原子半径在短周期中最大,则Z为Na。Z与W、W与Q的原子序数之差均为3,则W为Si、Q为Cl。X与W处于同一主族,则X为C。五种元素原子的最外层电子数之和为21,则Y为N。X的常见氧化物二氧化碳,不是大气污染物,A项不正确;
自然界中Si的储量丰富,高纯度SiO2是制造光导纤维的材料,B项不正确;
Cl的非金属性比N强,所以在一定条件下,氯气可把氮元素从其氢化物中置换出来,C项正确;
最高价氧化物对应水化物的酸性:碳酸强于硅酸,D项不正确。
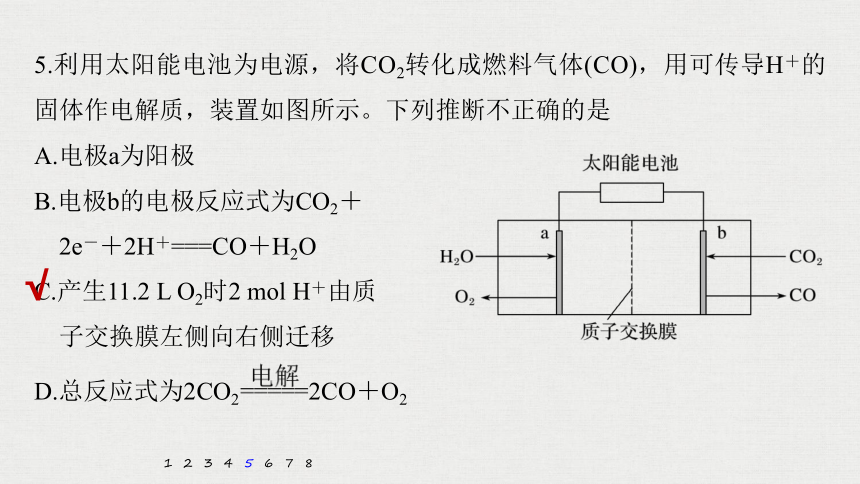
5.利用太阳能电池为电源,将CO2转化成燃料气体(CO),用可传导H+的固体作电解质,装置如图所示。下列推断不正确的是
1
2
3
4
5
6
7
8
A.电极a为阳极
B.电极b的电极反应式为CO2+
2e-+2H+===CO+H2O
C.产生11.2 L O2时2 mol H+由质
子交换膜左侧向右侧迁移
D.总反应式为2CO2 2CO+O2
√
B项,电极b为阴极,发生还原反应,电极反应式为CO2+2H++2e-===CO+H2O,正确;
C项,未指明温度和压强,故11.2 L O2的物质的量不一定为0.5 mol,错误;
D项,在得失电子守恒条件下,将阴、阳极的电极反应式相加得到总反应式,正确。
解析 观察题图装置,由电极上物质转化关系及元素化合价变化,可以判断电极反应类型。A项,水转化成氧气,发生氧化反应,则电极a为阳极,电极反应式为2H2O-4e-===4H++O2↑,正确;
1
2
3
4
5
6
7
8
6.下列实验及现象不能推出相应结论的是
1
2
3
4
5
6
7
8
选项
实验
现象
结论
A
向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:
Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一支试管中产生黄色沉淀,另一支试管中无明显现象
Ksp(AgI)<
Ksp(AgCl)
√
解析 发生的反应为2FeCl3+Fe===3FeCl2,Fe将Fe3+还原为Fe2+,所以还原性:Fe>Fe2+,A选项能推出相应结论;
发生的反应为4Na+CO2 C+2Na2O,CO2中C元素化合价降低,被还原,所以CO2具有氧化性,B选项能推出相应结论;
发生的反应为NH4HCO3 NH3↑+H2O+CO2↑,由于NH3与水反应生成NH3·H2O,NH3·H2O显碱性,所以石蕊试纸变蓝,C选项不能推出相应结论;
生成了AgI沉淀,没有生成AgCl沉淀,所以Ksp(AgI)1
2
3
4
5
6
7
8
7
7.25 ℃时,向20 mL 0.1 mol·L-1的一元酸HA溶液中逐滴加入等物质的量浓度的KOH溶液,所得溶液的pH与加入KOH溶液体积的变化关系如图所示。下列说法不正确的是
1
2
3
4
5
6
8
A.该温度下,A-的水解平衡常数的数量级为10-11
B.b点溶液中:c(H+)+c(HA)=c(A-)+c(OH-)
C.水的电离程度:c>b>d
D.当pH=7时,溶液中n(HA)与加入的n(KOH)的比值为10-3.2
√
7
1
2
3
4
5
6
8
b点溶液中,由物料守恒可得c(HA)+c(A-)=2c(K+),由电荷守恒可得c(H+)+c(K+)=c(A-)+c(OH-),故2c(H+)+c(HA)=c(A-)+2c(OH-),B项错误;
7
1
2
3
4
5
6
8
b点到c点过程中,HA与KOH反应,水的
电离程度增大,c点到d点过程中,KOH
溶液过量,抑制水的电离,水的电离程
度减小,故c点时水的电离程度最大,b点
时c水(H+)≈10-10 mol·L-1,d点时c水(H+)
≈10-12 mol·L-1,故水的电离程度:c>b>d,C项正确;
已知:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH1=-213 kJ·mol-1
反应Ⅱ:H2SO4(aq)===SO2(g)+H2O(l)+ O2(g) ΔH2=+327 kJ·mol-1
反应Ⅲ:2HI(aq)===H2(g)+I2(g) ΔH3=+172 kJ·mol-1
则反应2H2O(l)===2H2 (g)+O2(g) ΔH=_____________。
8.(2020·烟台一模)氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、
环保的制氢方法,其流程图如图:
7
1
2
3
4
5
6
8
+572 kJ·mol-1
解析 根据盖斯定律,反应(Ⅰ+Ⅱ+Ⅲ)×2可得到反应2H2O(l)===2H2(g)+O2(g),其ΔH=2(ΔH1+ΔH2+ΔH3)=2×(172+327-213)kJ·mol-1=
+572 kJ·mol-1。
7
1
2
3
4
5
6
8
(2)H2S可用于高效制取氢气,发生的反应为2H2S(g) S2(g)+2H2(g)。
Ⅰ.若起始时容器中只有H2S,平衡时三种物质的
物质的量与裂解温度的关系如图:
7
1
2
3
4
5
6
8
①图中曲线l表示的物质是_____(填化学式)。
S2
②A点时H2S的转化率为______。
7
1
2
3
4
5
6
8
50%
解析 根据图像,A点时,硫化氢和氢气的物质的量相等,根据2H2S(g)
S2(g)+2H2(g),说明反应的硫化氢与剩余的硫化氢相等,H2S的转化率为50%;
③C点时,设容器内的总压为p Pa,则平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
7
1
2
3
4
5
6
8
p
7
1
2
3
4
5
6
8
Ⅱ.若在两个等体积的恒容容器中分别加入2.0 mol H2S、1.0 mol H2S,测得不同温度下H2S的平衡转化率如图所示:
7
1
2
3
4
5
6
8
①M点和O点的逆反应速率v(M)_____
v(O)(填“>”“<”或“=”,下同);
<
解析 反应2H2S(g) S2(g)+2H2(g)中,H2S的物质的量增加,其平衡转化率反而减小,即M点和O点所在的曲线分别代表H2S的起始量为0.1 mol和0.2 mol,恒容容器中,M点的浓度小于O点,则逆反应速率v(M)②M、N两点容器内的压强2p(M)____p(N),平衡常数K(M)____K(N)。
7
1
2
3
4
5
6
8
<
<
解析 由图像可知,H2S的转化率均为45%,可列三段式有:
2H2S(g) S2(g)+2H2(g)
起始(mol) 2 0 0
转化(mol) 0.9 0.45 0.9
平衡(mol) 1.1 0.45 0.9
n(总)N=(1.1+0.45+0.9) mol=2.45 mol
7
1
2
3
4
5
6
8
2H2S(g) S2(g)+2H2(g)
起始(mol) 1 0 0
转化(mol) 0.45 0.225 0.45
平衡(mol) 0.55 0.225 0.45
n(总)M=(0.55+0.45+0.225) mol=1.225 mol
2n(总)M=n(总)N,由图像可知TM由图知,随温度升高,H2S的平衡转化率增大,平衡只与温度有关,T(M)7
1
2
3
4
5
6
8
B组(25分钟)
1.历史文物本身蕴含着许多化学知识,下列说法错误的是
A.战国·曾侯乙编钟属于青铜制品,青铜是一种合金
B.宋·王希孟《千里江山图》所用纸张为宣纸,其主要成分是碳纤维
C.秦朝·兵马俑用陶土烧制而成,属硅酸盐产品
D.对敦煌莫高窟壁画颜料分析,其绿色颜料铜绿的主要成分是碱式碳酸铜
1
2
3
4
5
6
√
7
8
2.NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.100 g质量分数为46%的乙醇溶液中,含H—O键的数目为7NA
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.0.1 mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D.1 L 0.1 mol·L-1的NH4Cl溶液中含有 数目为0.1NA
1
2
3
4
5
6
√
7
8
解析 A项中含水54 g,为3 mol,每个水分子中有两个O—H键,含乙醇46 g,为1 mol,一个乙醇分子中有一个O—H键,故正确;
C项中Fe在氧气中燃烧的产物为Fe3O4,转移电子数介于0.2NA到0.3NA之间,故错误。
3.金刚烷胺可用于流感病毒A型感染性疾病的治疗,其合成线路图如图所示。下列说法错误的是
1
2
3
4
5
6
7
8
A.金刚烷的分子式是C10H16
B.X的同分异构体不可能是芳香族化合物
C.上述反应都属于取代反应
D.金刚烷胺碳原子上的一溴代物有两种
√
1
2
3
4
5
6
解析 X的分子式是C10H15Br,其同分异构体不可能是芳香族化合物,B选项正确;
金刚烷变成X的过程中H原子被Br原子取代,X变成金刚烷胺的过程中Br原子被—NH2取代,C选项正确;
金刚烷胺碳原子上的一溴代物有3种,D选项错误。
7
8
4.某实验小组的同学拟通过下列方法制备硫酸亚铁溶液,流程如下。下列叙述错误的是
1
2
3
4
5
6
7
8
A.步骤①加入稀硫酸的目的是抑制Fe3+的水解
B.步骤②仅发生了反应Fe+2Fe3+===3Fe2+
C.步骤③静置后,若要检验清液中是否还含有Fe3+,可取少量清液加入
KSCN溶液
D.也可以通过铁屑与稀硫酸反应制备硫酸亚铁溶液
√
解析 步骤①加入稀硫酸的目的是抑制Fe3+的水解,A项正确;
步骤②发生的反应除了Fe+2Fe3+===3Fe2+,根据流程图信息还有Fe+2H+===Fe2++H2↑,B项错误;
步骤③静置后,若要检验清液中是否还含有Fe3+,可根据Fe3+的特征反应,取少量清液加入KSCN溶液进行检验,C项正确;
通过铁屑与稀硫酸反应也可以制备硫酸亚铁溶液,D项正确。
1
2
3
4
5
6
7
8
5.短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的简单氢化物是沼气的主要成分,X与Z的最外层电子数之和等于Y的最外层电子数,且X、Y、Z、W的最外层电子数均为偶数,向Y、Z、W组成的一种化合物中滴加稀硫酸,生成的气体能使品红溶液褪色。下列说法中错误的是
A.常温常压下,X、Z、W的单质均为固态
B.X、Y、W、M四种元素中,简单氢化物的稳定性最强的是Y
C.Z和M形成的化合物的水溶液呈酸性
D.M元素的含氧酸中,M的化合价越高,其氧化性越强
1
2
3
4
5
6
√
7
8
解析 短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的简单氢化物是沼气的主要成分,该氢化物是CH4,则X是C元素。X与Z的最外层电子数之和等于Y的最外层电子数,且X、Y、Z、W的最外层电子数均为偶数,向Y、Z、W组成的一种化合物中滴加稀硫酸,生成的气体能使品红溶液褪色,该气体为SO2,则Y是O元素,Z是Mg元素,W是S元素,M是Cl元素。常温常压下,C、Mg、S单质均为固态,A项正确;
元素的非金属性:O>Cl>S>C,则简单氢化物的稳定性:H2O>HCl>H2S>CH4,稳定性最强的是H2O,B项正确;
Mg和Cl元素形成的化合物为MgCl2,MgCl2溶液中由于Mg2+发生水解而使溶液呈酸性,C项正确;
Cl元素对应的含氧酸有HClO4、HClO3、HClO等,其中HClO的氧化性最强,D项错误。
1
2
3
4
5
6
7
8
6.(2020·邯郸市高三检测)锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,下列说法错误的是
1
2
3
4
5
6
7
8
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-===4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
√
1
2
3
4
5
6
7
8
解析 根据图示及电池反应,Cu2O为正极,Li为负极,放电时,阳离子向正极移动,则Li+透过固体电解质向Cu2O极移动,故A正确;
根据电池反应式知,正极反应式为Cu2O+H2O+2e-===2Cu+2OH-,故B错误;
放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故C正确;
整个反应过程中,铜相当于催化剂,氧化剂为O2,故D正确。
A.T ℃时,Ka2=10-4.2
B.pH=1.2溶液中:c(K+)+c(H+)=c(OH-)
+c(H2C2O4)
C.pH=2.7溶液中: =100
D.向pH=1.2的溶液中再加KOH溶液,将pH
增大至4.2的过程中水的电离度一直增大
√
7
8
1
2
3
4
5
6
解析 由图像可知,T ℃时,lgKa2=-4.2,A项正确;
pH=1.2时,H2C2O4、 的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c( ),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),B项正确;
7
8
1
2
3
4
5
6
向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,D项正确。
7
8
1
2
3
4
5
6
8.合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g) 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ΔH2<0
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH=___________(用含ΔH1和ΔH2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、
k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
7
8
1
2
3
4
5
6
ΔH1+ΔH2
7
8
1
2
3
4
5
6
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1____(填“>”“<”或“=”)E2。
7
8
1
2
3
4
5
6
<
解析 因为决定2NO(g)+O2(g) 2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2。
Ⅱ.(3)反应N2O4(g) 2NO2(g),在一定条件下
N2O4与NO2的消耗速率与自身压强有如下关系:
v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。
其中k1、k2是与温度有关的常数。一定温度下,
相应的速率与压强关系如图所示,在图中标出
的点中,能表示该反应达到平衡状态的两个点是____________,理由是____________________________________________________。
7
8
1
2
3
4
5
6
B、D
图中只有D点的NO2的消耗速率是B点N2O4的消耗速率的2倍
解析 满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的反应速率比为1∶2,所以B、D为平衡点。
(4)在25 ℃时,将a mol·L-1的氨水与0.02 mol·L-1HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示25 ℃
时NH3·H2O的电离常数Kb=_________________。用质量分数为17%、密度为0.93 g·cm-3的氨水,配制200 mL a mol·L-1的氨水,所需原氨水的
体积V=______________ mL。
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
(5)如图电解装置可将雾霾中的NO、SO2分别转化为 。物质A的化学式为_______,阴极的电极反应式是_______________________
_____。
7
8
1
2
3
4
5
6
H2SO4
H2O
解析 NO得电子生成铵根离子,离子方程式为NO+5e-+6H+===
+H2O,为阴极反应,阳极上SO2失电子形成硫酸。
C组(25分钟)
1.化学与生活密切相关。下列说法中错误的是
A.用浸泡过KMnO4溶液的硅藻土保鲜水果是利用KMnO4的氧化性
B.天然植物油在碱性条件下可水解生成高级脂肪酸盐和丙三醇
C.利用高纯硅制造的太阳能电池板可将光能直接转化为电能
D.宣纸的主要成分为蛋白质,在一定条件下可水解得到氨基酸
√
7
8
1
2
3
4
5
6
解析 用浸泡过KMnO4溶液的硅藻土保鲜是KMnO4将乙烯氧化除去,利用了KMnO4的氧化性,A说法正确;
天然植物油的主要成分为高级脂肪酸甘油酯,其在碱性条件下水解可生成高级脂肪酸盐和丙三醇(甘油),B项说法正确;
太阳能电池板是利用高纯硅制造并可将光能直接转化为电能,C项说法正确;
宣纸的主要成分是纤维素,其水解的最终产物是葡萄糖,D说法错误。
7
8
1
2
3
4
5
6
2.已知反应: 。下列说法正确的是
A.上述反应属于取代反应
B.上述三种物质均能使酸性KMnO4溶液褪色
C.M、N和P中的碳原子均可能在同一平面上
D.P的同分异构体中属于芳香烃的有7种
√
7
8
1
2
3
4
5
6
解析 题中反应属于加成反应,A项错误;
苯不能使酸性KMnO4溶液褪色,B项错误;
P分子的所有碳原子不可能在同一平面上,C项错误;
P的同分异构体中属于芳香烃的有 、 、
、 、 、 、 ,
共7种,D项正确。
7
8
1
2
3
4
5
6
3.短周期主族元素X、Y、Z、W的原子序数依次增大,Z的单质常温下能与水剧烈反应,常保存在由X、Y两元素组成的化合物中,W与Y同族。下列说法正确的是
A.Y的单质的熔点一定高于W的单质
B.X与Y形成的化合物均为弱电解质
C.W的最高价氧化物可溶于Z的最高价氧化物对应的水化物中
D.X与其他三种元素分别形成的化合物中均不存在离子键
√
7
8
1
2
3
4
5
6
解析 Z的单质常温下能与水剧烈反应,常保存在由X、Y两元素组成的化合物中,则Z为Na元素,Na保存在煤油中,煤油的主要成分是烃,且原子序数:Y>X,则X、Y分别是H、C元素,W与Y同族,则W为Si元素。C的单质有多种(如金刚石、石墨、C60等),其熔点不一定比Si高,A项错误;
H与C形成的化合物均为非电解质,B项错误;
SiO2因与NaOH溶液反应而溶解,C项正确;
X与Z形成的化合物NaH为离子化合物,含有离子键,D项错误。
7
8
1
2
3
4
5
6
4.工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
7
8
1
2
3
4
5
6
下列说法正确的是
A.酸溶时,MnO2作还原剂
B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用
D.在电解池的阴极处产生MnO2
√
解析 软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)在酸溶后生成了硫单质,说明二氧化锰作氧化剂,故A项错误;
盐酸代替硫酸进行酸溶,盐酸中氯离子被氧化生成氯气,故B项错误;
酸溶后在最后电解滤液时又生成H2SO4,可以循环利用,故C项正确;
二氧化锰在酸溶后被还原为锰离子,通电电解在阳极生成二氧化锰,阴极生成锌,故D项错误。
7
8
1
2
3
4
5
6
5.下列实验现象和结论均正确的是
7
8
1
2
3
4
5
6
选项
操作
实验现象
结论
A
向FeCl3和BaCl2混合溶液中通入足量SO2
溶液变为浅绿色,但不变浑浊
SO2能与FeCl3反应,但不与BaCl2反应
B
硝酸亚铁固体溶于稀硫酸后,滴加KSCN溶液
溶液变为红色
硝酸亚铁固体中含有Fe3+杂质
C
将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置
溶液分层,下层溶液变为紫色
Fe3+的氧化性比
I2强
D
向0.1 mol·L-1 AgNO3溶液中滴入NaCl溶液至不再有沉淀产生,再滴加0.1 mol·L-1 KI溶液
先有白色沉淀生成,后变为黄色沉淀
AgCl的溶度积比AgI的小
√
解析 Fe3+与SO2反应生成Fe2+和 , 与Ba2+反应生成BaSO4白色沉淀,A项现象错误且不能得出该结论;
硝酸亚铁与稀硫酸混合后,Fe2+会被酸性条件下的硝酸根离子氧化成Fe3+,Fe3+遇KSCN溶液变红,因此溶液变红不能说明硝酸亚铁固体中含有Fe3+杂质,B项结论错误;
KI与FeCl3发生氧化还原反应生成I2,因I2易溶于CCl4,且CCl4的密度比水大,故下层溶液变为紫色,反应的发生说明Fe3+的氧化性强于I2,C项正确;
由沉淀转化可知,反应总是向着生成更难溶沉淀的方向进行,所以AgCl的溶度积比AgI的大,D项结论错误。
7
8
1
2
3
4
5
6
6.(2020·石家庄月考)高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过,结构如图所示。
7
8
1
2
3
4
5
6
原理如下:(1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。下列说法不正确的是
A.放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D.充电时,Li+向左移动
√
7
8
1
2
3
4
5
6
解析 由总反应:(1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。放电时,作为原电池,LixCn为负极,化合价升高失去电子发生氧化反应,电子由负极到正极移动,FePO4为正极,化合价降低得到电子发生还原反应。充电时,作为电解池,LiFePO4参与阴极与阳极的反应,阳离子向阴极移动。
7.某温度下,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)和-lg c(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg 3≈0.5]。下列有关说法错误的是
7
8
1
2
3
4
5
6
A.对应溶液pH:a<b<e
B.a点对应的ZnCl2溶液中:c(Cl-)
<2[c(Zn2+)+c(H+)]
C.a~b~e为滴定CuCl2溶液的曲线
D.d点纵坐标小于34.9
√
解析 a点对应溶液中Zn2+和Cu2+水解,溶液显酸性,分别加入硫化钠溶液生成沉淀,b点对应溶液接近中性,e点时Na2S溶液过量,溶液显碱性,故对应溶液pH:a<b<e,选项A正确;
7
8
1
2
3
4
5
6
a点对应的ZnCl2溶液显酸性,且存在电荷守恒:c(Cl-)=2c(Zn2+)+c(H+)-c(OH-)<2[c(Zn2+)+c(H+)],选项B正确;
Ksp(ZnS)>Ksp(CuS),硫离子浓度相同时,c(Zn2+)>c(Cu2+),-lg c(Cu2+)
>-lg c(Zn2+),故a~b~e为滴定ZnCl2溶液的曲线,选项C错误;
由分析知a~c~d为滴定CuCl2溶液的曲线,c点时恰好完全反应,由图可知c点时-lg c(Cu2+)=17.7,则c(Cu2+)=10-17.7 mol·L-1,c(S2-)=10-17.7 mol·L-1,Ksp(CuS)=10-35.4,d点时c(S2-)= ×0.1 mol·L-1,则c(Cu2+)=
mol·L-1=3×10-34.4 mol·L-1,
-lg c(Cu2+)=33.9,故d点纵坐标小于34.9,选项D正确。
7
8
1
2
3
4
5
6
8.(2020·青岛一模)医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
Ⅰ.工业上主要采用乙烯直接水合法制乙醇(CH2==CH2+H2O―→CH3CH2OH)。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
7
8
1
2
3
4
5
6
随着反应进程,该过程能量变化如图所示。
下列有关说法正确的是____(填字母)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c. 是反应的中间产物
7
8
1
2
3
4
5
6
bc
解析 从能量图中分析可知,该反应过程的三步中,第i步吸热,第ii、iii步均释放能量,a错误;
活化能的定义:活化分子的平均能量与反应物分子的平均能量之差。活化能越大,活化分子所占的百分数就越小,反应越慢,第i步反应的活化能最大,决定总反应速率,b正确;
7
8
1
2
3
4
5
6
从题中三步反应可知, 是反应的中间产物,c正确。
(2)已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=
k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_____。
a.k正增大,k逆减小 b.k正减小,k逆增大
c.k正减小的倍数大于k逆 d.k正减小的倍数小于k逆
7
8
1
2
3
4
5
6
d
解析 若其他条件不变时,降低温度,正逆反应速率均减小,而浓度在那瞬间是不变的,所以k正、k逆均减小,再根据能量图,C2H4(g)+H2O(g)
C2H5OH(g)反应物总能量大于生成物,为放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k正减小的倍数小于k逆,d合理。
Ⅱ.工业用二氧化碳加氢可合成乙醇:
2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。保持压强为5 MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投
料比 的关系如图所示。
7
8
1
2
3
4
5
6
(1)投料比由大到小的顺序为____________。
m3>m2>m1
(2)若投料比m=1,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是____(填字母)。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c.CO2的体积分数不再变化
d.容器内 不再变化
e.断裂3NA个H—H键的同时生成1.5NA个水分子
7
8
1
2
3
4
5
6
ce
解析 若投料比m=1,一定温度下:密度等于气体质量与容器体积的比值,在2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g)中,物质均为气体,保持压强为5 MPa,随反应正向进行,容器体积减小,密度增大,密度不变,说明该反应达到平衡,a能;
7
8
1
2
3
4
5
6
平均相对分子质量等于气体总质量与气体总物质的量的比值,随反应正向进行,气体总质量不变,总物质的量减小,平均相对分子质量增大,当平均相对分子质量不再变化时,该反应达到平衡,b能;
CO2的体积分数即物质的量分数,反应前CO2的体积分数为50%,根据极值法可以求出当氢气完全消耗之后,二氧化碳的体积分数仍为50%,故反应中CO2的体积分数始终保持为50%,故CO2的体积分数不变不能据此判断该反应是否达到平衡标志,c不能;
7
8
1
2
3
4
5
6
(3)若m3=3,则A点温度下,该反应的平衡常数Kp的数值为___________(Kp是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时CO2的转化率____50%(填“>”“=”或“<”)。
7
8
1
2
3
4
5
6
4.8×10-3
<
解析 若m3=3,则A点温度下,CO2的平衡转化率
为50%,
2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)
起/mol 1 3 0 0
转/mol 1×50% 1.5 0.25 0.75
平/mol 0.5 1.5 0.25 0.75
平衡时气体的总物质的量为(0.5+1.5+0.25+0.75)mol=3 mol,
7
8
1
2
3
4
5
6
原题是同温同压下,正反应体积减小,现为刚性密闭容器,气体的物质的量减小,相当于减压,平衡向气体分子数增大的方向移动,即向逆反应方向移动,CO2的转化率小于50%。
7
8
1
2
3
4
5
6
题型三 化学反应原理综合题的研究
A组(25分钟)
1.(2020·邯郸模拟)新型冠状病毒来势汹汹,主要传播途径有飞沫传播、接触传播和气溶胶传播,但是它依然可防可控,采取有效的措施预防,戴口罩、勤洗手,给自己居住、生活的环境消毒,都是非常行之有效的方法。下列有关说法正确的是
A.云、烟、雾属于气溶胶,但它们不能发生丁达尔效应
B.使用酒精作为环境消毒剂时,酒精浓度越大,消毒效果越好
C.“84”消毒液与酒精混合使用可能会产生氯气中毒
D.生产“口罩”的无纺布材料是聚丙烯产品,属于天然高分子材料
1
2
3
4
5
6
√
7
8
解析 气溶胶也是胶体,胶体都能发生丁达尔效应,A选项错误;
医用酒精的体积分数为75%,酒精浓度过大和过小都起不到消毒作用,B选项错误;
“84”消毒液的有效成分是NaClO,有强氧化性,酒精(乙醇)有还原性,二者混合会因氧化还原反应生成氯气,C选项正确;
聚丙烯属于合成高分子材料,D选项错误。
1
2
3
4
5
6
7
8
2.钛白粉(TiO2)和铁红(Fe2O3)是常见的涂料,制备流程如下。
1
2
3
4
5
6
7
8
下列说法错误的是
A.向绿矾中加入NH4HCO3产生
CO2气体
B.铁粉参与的反应只有2Fe3++
Fe===3Fe2+
C.适当增大硫酸的浓度、加热均
可加快固体的溶解速率
D.若用烧碱替代纯碱,会提高生产成本
√
1
2
3
4
5
6
7
8
解析 加入NH4HCO3,发生反应Fe2++ ===FeCO3↓+CO2↑+H2O,A项正确;
酸性溶液中含有Fe3+和H+,加入铁粉,发生反应2Fe3++Fe===3Fe2+、2H++Fe===Fe2++H2↑,B项错误;
升高温度、增大反应物的浓度均可加快反应速率,C项正确;
烧碱的价格高于纯碱的价格,若用烧碱替代纯碱,会提高生产成本,D项正确。
解析 E分子中羧基与羟基发生酯化反应生成F,A项正确;
碳酸氢钠溶液与羧基反应生成CO2,B项正确;
H分子中所有碳原子不可能共面,C项错误;
F分子中含有4种不同化学环境的氢原子,故其一氯代物有4种,D项正确。
3.有机物H常用作香料,其合成路线如下。
1
2
3
4
5
6
7
8
下列说法错误的是
A.E―→F的反应类型为酯化反应
B.E可与NaHCO3溶液反应
C.H分子中所有碳原子可能共面
D.F的一氯代物有4种
√
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),Z与W、W与Q的原子序数之差均为3,五种元素原子的最外层电子数之和为21,下列说法正确的是
A.X和Y的常见氧化物都是大气污染物
B.自然界中W的储量丰富,高纯度的W的氧化物是将太阳能转化为电能
的材料
C.一定条件下,Q单质可把Y从其氢化物中置换出来
D.最高价氧化物对应水化物的酸性顺序:Q>Y>W>X
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
7
8
解析 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。Z元素原子半径在短周期中最大,则Z为Na。Z与W、W与Q的原子序数之差均为3,则W为Si、Q为Cl。X与W处于同一主族,则X为C。五种元素原子的最外层电子数之和为21,则Y为N。X的常见氧化物二氧化碳,不是大气污染物,A项不正确;
自然界中Si的储量丰富,高纯度SiO2是制造光导纤维的材料,B项不正确;
Cl的非金属性比N强,所以在一定条件下,氯气可把氮元素从其氢化物中置换出来,C项正确;
最高价氧化物对应水化物的酸性:碳酸强于硅酸,D项不正确。
5.利用太阳能电池为电源,将CO2转化成燃料气体(CO),用可传导H+的固体作电解质,装置如图所示。下列推断不正确的是
1
2
3
4
5
6
7
8
A.电极a为阳极
B.电极b的电极反应式为CO2+
2e-+2H+===CO+H2O
C.产生11.2 L O2时2 mol H+由质
子交换膜左侧向右侧迁移
D.总反应式为2CO2 2CO+O2
√
B项,电极b为阴极,发生还原反应,电极反应式为CO2+2H++2e-===CO+H2O,正确;
C项,未指明温度和压强,故11.2 L O2的物质的量不一定为0.5 mol,错误;
D项,在得失电子守恒条件下,将阴、阳极的电极反应式相加得到总反应式,正确。
解析 观察题图装置,由电极上物质转化关系及元素化合价变化,可以判断电极反应类型。A项,水转化成氧气,发生氧化反应,则电极a为阳极,电极反应式为2H2O-4e-===4H++O2↑,正确;
1
2
3
4
5
6
7
8
6.下列实验及现象不能推出相应结论的是
1
2
3
4
5
6
7
8
选项
实验
现象
结论
A
向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:
Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一支试管中产生黄色沉淀,另一支试管中无明显现象
Ksp(AgI)<
Ksp(AgCl)
√
解析 发生的反应为2FeCl3+Fe===3FeCl2,Fe将Fe3+还原为Fe2+,所以还原性:Fe>Fe2+,A选项能推出相应结论;
发生的反应为4Na+CO2 C+2Na2O,CO2中C元素化合价降低,被还原,所以CO2具有氧化性,B选项能推出相应结论;
发生的反应为NH4HCO3 NH3↑+H2O+CO2↑,由于NH3与水反应生成NH3·H2O,NH3·H2O显碱性,所以石蕊试纸变蓝,C选项不能推出相应结论;
生成了AgI沉淀,没有生成AgCl沉淀,所以Ksp(AgI)
2
3
4
5
6
7
8
7
7.25 ℃时,向20 mL 0.1 mol·L-1的一元酸HA溶液中逐滴加入等物质的量浓度的KOH溶液,所得溶液的pH与加入KOH溶液体积的变化关系如图所示。下列说法不正确的是
1
2
3
4
5
6
8
A.该温度下,A-的水解平衡常数的数量级为10-11
B.b点溶液中:c(H+)+c(HA)=c(A-)+c(OH-)
C.水的电离程度:c>b>d
D.当pH=7时,溶液中n(HA)与加入的n(KOH)的比值为10-3.2
√
7
1
2
3
4
5
6
8
b点溶液中,由物料守恒可得c(HA)+c(A-)=2c(K+),由电荷守恒可得c(H+)+c(K+)=c(A-)+c(OH-),故2c(H+)+c(HA)=c(A-)+2c(OH-),B项错误;
7
1
2
3
4
5
6
8
b点到c点过程中,HA与KOH反应,水的
电离程度增大,c点到d点过程中,KOH
溶液过量,抑制水的电离,水的电离程
度减小,故c点时水的电离程度最大,b点
时c水(H+)≈10-10 mol·L-1,d点时c水(H+)
≈10-12 mol·L-1,故水的电离程度:c>b>d,C项正确;
已知:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH1=-213 kJ·mol-1
反应Ⅱ:H2SO4(aq)===SO2(g)+H2O(l)+ O2(g) ΔH2=+327 kJ·mol-1
反应Ⅲ:2HI(aq)===H2(g)+I2(g) ΔH3=+172 kJ·mol-1
则反应2H2O(l)===2H2 (g)+O2(g) ΔH=_____________。
8.(2020·烟台一模)氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、
环保的制氢方法,其流程图如图:
7
1
2
3
4
5
6
8
+572 kJ·mol-1
解析 根据盖斯定律,反应(Ⅰ+Ⅱ+Ⅲ)×2可得到反应2H2O(l)===2H2(g)+O2(g),其ΔH=2(ΔH1+ΔH2+ΔH3)=2×(172+327-213)kJ·mol-1=
+572 kJ·mol-1。
7
1
2
3
4
5
6
8
(2)H2S可用于高效制取氢气,发生的反应为2H2S(g) S2(g)+2H2(g)。
Ⅰ.若起始时容器中只有H2S,平衡时三种物质的
物质的量与裂解温度的关系如图:
7
1
2
3
4
5
6
8
①图中曲线l表示的物质是_____(填化学式)。
S2
②A点时H2S的转化率为______。
7
1
2
3
4
5
6
8
50%
解析 根据图像,A点时,硫化氢和氢气的物质的量相等,根据2H2S(g)
S2(g)+2H2(g),说明反应的硫化氢与剩余的硫化氢相等,H2S的转化率为50%;
③C点时,设容器内的总压为p Pa,则平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
7
1
2
3
4
5
6
8
p
7
1
2
3
4
5
6
8
Ⅱ.若在两个等体积的恒容容器中分别加入2.0 mol H2S、1.0 mol H2S,测得不同温度下H2S的平衡转化率如图所示:
7
1
2
3
4
5
6
8
①M点和O点的逆反应速率v(M)_____
v(O)(填“>”“<”或“=”,下同);
<
解析 反应2H2S(g) S2(g)+2H2(g)中,H2S的物质的量增加,其平衡转化率反而减小,即M点和O点所在的曲线分别代表H2S的起始量为0.1 mol和0.2 mol,恒容容器中,M点的浓度小于O点,则逆反应速率v(M)
7
1
2
3
4
5
6
8
<
<
解析 由图像可知,H2S的转化率均为45%,可列三段式有:
2H2S(g) S2(g)+2H2(g)
起始(mol) 2 0 0
转化(mol) 0.9 0.45 0.9
平衡(mol) 1.1 0.45 0.9
n(总)N=(1.1+0.45+0.9) mol=2.45 mol
7
1
2
3
4
5
6
8
2H2S(g) S2(g)+2H2(g)
起始(mol) 1 0 0
转化(mol) 0.45 0.225 0.45
平衡(mol) 0.55 0.225 0.45
n(总)M=(0.55+0.45+0.225) mol=1.225 mol
2n(总)M=n(总)N,由图像可知TM
1
2
3
4
5
6
8
B组(25分钟)
1.历史文物本身蕴含着许多化学知识,下列说法错误的是
A.战国·曾侯乙编钟属于青铜制品,青铜是一种合金
B.宋·王希孟《千里江山图》所用纸张为宣纸,其主要成分是碳纤维
C.秦朝·兵马俑用陶土烧制而成,属硅酸盐产品
D.对敦煌莫高窟壁画颜料分析,其绿色颜料铜绿的主要成分是碱式碳酸铜
1
2
3
4
5
6
√
7
8
2.NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.100 g质量分数为46%的乙醇溶液中,含H—O键的数目为7NA
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.0.1 mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D.1 L 0.1 mol·L-1的NH4Cl溶液中含有 数目为0.1NA
1
2
3
4
5
6
√
7
8
解析 A项中含水54 g,为3 mol,每个水分子中有两个O—H键,含乙醇46 g,为1 mol,一个乙醇分子中有一个O—H键,故正确;
C项中Fe在氧气中燃烧的产物为Fe3O4,转移电子数介于0.2NA到0.3NA之间,故错误。
3.金刚烷胺可用于流感病毒A型感染性疾病的治疗,其合成线路图如图所示。下列说法错误的是
1
2
3
4
5
6
7
8
A.金刚烷的分子式是C10H16
B.X的同分异构体不可能是芳香族化合物
C.上述反应都属于取代反应
D.金刚烷胺碳原子上的一溴代物有两种
√
1
2
3
4
5
6
解析 X的分子式是C10H15Br,其同分异构体不可能是芳香族化合物,B选项正确;
金刚烷变成X的过程中H原子被Br原子取代,X变成金刚烷胺的过程中Br原子被—NH2取代,C选项正确;
金刚烷胺碳原子上的一溴代物有3种,D选项错误。
7
8
4.某实验小组的同学拟通过下列方法制备硫酸亚铁溶液,流程如下。下列叙述错误的是
1
2
3
4
5
6
7
8
A.步骤①加入稀硫酸的目的是抑制Fe3+的水解
B.步骤②仅发生了反应Fe+2Fe3+===3Fe2+
C.步骤③静置后,若要检验清液中是否还含有Fe3+,可取少量清液加入
KSCN溶液
D.也可以通过铁屑与稀硫酸反应制备硫酸亚铁溶液
√
解析 步骤①加入稀硫酸的目的是抑制Fe3+的水解,A项正确;
步骤②发生的反应除了Fe+2Fe3+===3Fe2+,根据流程图信息还有Fe+2H+===Fe2++H2↑,B项错误;
步骤③静置后,若要检验清液中是否还含有Fe3+,可根据Fe3+的特征反应,取少量清液加入KSCN溶液进行检验,C项正确;
通过铁屑与稀硫酸反应也可以制备硫酸亚铁溶液,D项正确。
1
2
3
4
5
6
7
8
5.短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的简单氢化物是沼气的主要成分,X与Z的最外层电子数之和等于Y的最外层电子数,且X、Y、Z、W的最外层电子数均为偶数,向Y、Z、W组成的一种化合物中滴加稀硫酸,生成的气体能使品红溶液褪色。下列说法中错误的是
A.常温常压下,X、Z、W的单质均为固态
B.X、Y、W、M四种元素中,简单氢化物的稳定性最强的是Y
C.Z和M形成的化合物的水溶液呈酸性
D.M元素的含氧酸中,M的化合价越高,其氧化性越强
1
2
3
4
5
6
√
7
8
解析 短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的简单氢化物是沼气的主要成分,该氢化物是CH4,则X是C元素。X与Z的最外层电子数之和等于Y的最外层电子数,且X、Y、Z、W的最外层电子数均为偶数,向Y、Z、W组成的一种化合物中滴加稀硫酸,生成的气体能使品红溶液褪色,该气体为SO2,则Y是O元素,Z是Mg元素,W是S元素,M是Cl元素。常温常压下,C、Mg、S单质均为固态,A项正确;
元素的非金属性:O>Cl>S>C,则简单氢化物的稳定性:H2O>HCl>H2S>CH4,稳定性最强的是H2O,B项正确;
Mg和Cl元素形成的化合物为MgCl2,MgCl2溶液中由于Mg2+发生水解而使溶液呈酸性,C项正确;
Cl元素对应的含氧酸有HClO4、HClO3、HClO等,其中HClO的氧化性最强,D项错误。
1
2
3
4
5
6
7
8
6.(2020·邯郸市高三检测)锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,下列说法错误的是
1
2
3
4
5
6
7
8
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-===4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
√
1
2
3
4
5
6
7
8
解析 根据图示及电池反应,Cu2O为正极,Li为负极,放电时,阳离子向正极移动,则Li+透过固体电解质向Cu2O极移动,故A正确;
根据电池反应式知,正极反应式为Cu2O+H2O+2e-===2Cu+2OH-,故B错误;
放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,可知通空气时,铜被腐蚀,表面产生Cu2O,故C正确;
整个反应过程中,铜相当于催化剂,氧化剂为O2,故D正确。
A.T ℃时,Ka2=10-4.2
B.pH=1.2溶液中:c(K+)+c(H+)=c(OH-)
+c(H2C2O4)
C.pH=2.7溶液中: =100
D.向pH=1.2的溶液中再加KOH溶液,将pH
增大至4.2的过程中水的电离度一直增大
√
7
8
1
2
3
4
5
6
解析 由图像可知,T ℃时,lgKa2=-4.2,A项正确;
pH=1.2时,H2C2O4、 的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c( ),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),B项正确;
7
8
1
2
3
4
5
6
向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,D项正确。
7
8
1
2
3
4
5
6
8.合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g) 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ΔH2<0
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的ΔH=___________(用含ΔH1和ΔH2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、
k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
7
8
1
2
3
4
5
6
ΔH1+ΔH2
7
8
1
2
3
4
5
6
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1____(填“>”“<”或“=”)E2。
7
8
1
2
3
4
5
6
<
解析 因为决定2NO(g)+O2(g) 2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2。
Ⅱ.(3)反应N2O4(g) 2NO2(g),在一定条件下
N2O4与NO2的消耗速率与自身压强有如下关系:
v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。
其中k1、k2是与温度有关的常数。一定温度下,
相应的速率与压强关系如图所示,在图中标出
的点中,能表示该反应达到平衡状态的两个点是____________,理由是____________________________________________________。
7
8
1
2
3
4
5
6
B、D
图中只有D点的NO2的消耗速率是B点N2O4的消耗速率的2倍
解析 满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的反应速率比为1∶2,所以B、D为平衡点。
(4)在25 ℃时,将a mol·L-1的氨水与0.02 mol·L-1HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示25 ℃
时NH3·H2O的电离常数Kb=_________________。用质量分数为17%、密度为0.93 g·cm-3的氨水,配制200 mL a mol·L-1的氨水,所需原氨水的
体积V=______________ mL。
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
(5)如图电解装置可将雾霾中的NO、SO2分别转化为 。物质A的化学式为_______,阴极的电极反应式是_______________________
_____。
7
8
1
2
3
4
5
6
H2SO4
H2O
解析 NO得电子生成铵根离子,离子方程式为NO+5e-+6H+===
+H2O,为阴极反应,阳极上SO2失电子形成硫酸。
C组(25分钟)
1.化学与生活密切相关。下列说法中错误的是
A.用浸泡过KMnO4溶液的硅藻土保鲜水果是利用KMnO4的氧化性
B.天然植物油在碱性条件下可水解生成高级脂肪酸盐和丙三醇
C.利用高纯硅制造的太阳能电池板可将光能直接转化为电能
D.宣纸的主要成分为蛋白质,在一定条件下可水解得到氨基酸
√
7
8
1
2
3
4
5
6
解析 用浸泡过KMnO4溶液的硅藻土保鲜是KMnO4将乙烯氧化除去,利用了KMnO4的氧化性,A说法正确;
天然植物油的主要成分为高级脂肪酸甘油酯,其在碱性条件下水解可生成高级脂肪酸盐和丙三醇(甘油),B项说法正确;
太阳能电池板是利用高纯硅制造并可将光能直接转化为电能,C项说法正确;
宣纸的主要成分是纤维素,其水解的最终产物是葡萄糖,D说法错误。
7
8
1
2
3
4
5
6
2.已知反应: 。下列说法正确的是
A.上述反应属于取代反应
B.上述三种物质均能使酸性KMnO4溶液褪色
C.M、N和P中的碳原子均可能在同一平面上
D.P的同分异构体中属于芳香烃的有7种
√
7
8
1
2
3
4
5
6
解析 题中反应属于加成反应,A项错误;
苯不能使酸性KMnO4溶液褪色,B项错误;
P分子的所有碳原子不可能在同一平面上,C项错误;
P的同分异构体中属于芳香烃的有 、 、
、 、 、 、 ,
共7种,D项正确。
7
8
1
2
3
4
5
6
3.短周期主族元素X、Y、Z、W的原子序数依次增大,Z的单质常温下能与水剧烈反应,常保存在由X、Y两元素组成的化合物中,W与Y同族。下列说法正确的是
A.Y的单质的熔点一定高于W的单质
B.X与Y形成的化合物均为弱电解质
C.W的最高价氧化物可溶于Z的最高价氧化物对应的水化物中
D.X与其他三种元素分别形成的化合物中均不存在离子键
√
7
8
1
2
3
4
5
6
解析 Z的单质常温下能与水剧烈反应,常保存在由X、Y两元素组成的化合物中,则Z为Na元素,Na保存在煤油中,煤油的主要成分是烃,且原子序数:Y>X,则X、Y分别是H、C元素,W与Y同族,则W为Si元素。C的单质有多种(如金刚石、石墨、C60等),其熔点不一定比Si高,A项错误;
H与C形成的化合物均为非电解质,B项错误;
SiO2因与NaOH溶液反应而溶解,C项正确;
X与Z形成的化合物NaH为离子化合物,含有离子键,D项错误。
7
8
1
2
3
4
5
6
4.工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
7
8
1
2
3
4
5
6
下列说法正确的是
A.酸溶时,MnO2作还原剂
B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用
D.在电解池的阴极处产生MnO2
√
解析 软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)在酸溶后生成了硫单质,说明二氧化锰作氧化剂,故A项错误;
盐酸代替硫酸进行酸溶,盐酸中氯离子被氧化生成氯气,故B项错误;
酸溶后在最后电解滤液时又生成H2SO4,可以循环利用,故C项正确;
二氧化锰在酸溶后被还原为锰离子,通电电解在阳极生成二氧化锰,阴极生成锌,故D项错误。
7
8
1
2
3
4
5
6
5.下列实验现象和结论均正确的是
7
8
1
2
3
4
5
6
选项
操作
实验现象
结论
A
向FeCl3和BaCl2混合溶液中通入足量SO2
溶液变为浅绿色,但不变浑浊
SO2能与FeCl3反应,但不与BaCl2反应
B
硝酸亚铁固体溶于稀硫酸后,滴加KSCN溶液
溶液变为红色
硝酸亚铁固体中含有Fe3+杂质
C
将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置
溶液分层,下层溶液变为紫色
Fe3+的氧化性比
I2强
D
向0.1 mol·L-1 AgNO3溶液中滴入NaCl溶液至不再有沉淀产生,再滴加0.1 mol·L-1 KI溶液
先有白色沉淀生成,后变为黄色沉淀
AgCl的溶度积比AgI的小
√
解析 Fe3+与SO2反应生成Fe2+和 , 与Ba2+反应生成BaSO4白色沉淀,A项现象错误且不能得出该结论;
硝酸亚铁与稀硫酸混合后,Fe2+会被酸性条件下的硝酸根离子氧化成Fe3+,Fe3+遇KSCN溶液变红,因此溶液变红不能说明硝酸亚铁固体中含有Fe3+杂质,B项结论错误;
KI与FeCl3发生氧化还原反应生成I2,因I2易溶于CCl4,且CCl4的密度比水大,故下层溶液变为紫色,反应的发生说明Fe3+的氧化性强于I2,C项正确;
由沉淀转化可知,反应总是向着生成更难溶沉淀的方向进行,所以AgCl的溶度积比AgI的大,D项结论错误。
7
8
1
2
3
4
5
6
6.(2020·石家庄月考)高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过,结构如图所示。
7
8
1
2
3
4
5
6
原理如下:(1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。下列说法不正确的是
A.放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D.充电时,Li+向左移动
√
7
8
1
2
3
4
5
6
解析 由总反应:(1-x)LiFePO4+xFePO4+LixCn LiFePO4+nC。放电时,作为原电池,LixCn为负极,化合价升高失去电子发生氧化反应,电子由负极到正极移动,FePO4为正极,化合价降低得到电子发生还原反应。充电时,作为电解池,LiFePO4参与阴极与阳极的反应,阳离子向阴极移动。
7.某温度下,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)和-lg c(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg 3≈0.5]。下列有关说法错误的是
7
8
1
2
3
4
5
6
A.对应溶液pH:a<b<e
B.a点对应的ZnCl2溶液中:c(Cl-)
<2[c(Zn2+)+c(H+)]
C.a~b~e为滴定CuCl2溶液的曲线
D.d点纵坐标小于34.9
√
解析 a点对应溶液中Zn2+和Cu2+水解,溶液显酸性,分别加入硫化钠溶液生成沉淀,b点对应溶液接近中性,e点时Na2S溶液过量,溶液显碱性,故对应溶液pH:a<b<e,选项A正确;
7
8
1
2
3
4
5
6
a点对应的ZnCl2溶液显酸性,且存在电荷守恒:c(Cl-)=2c(Zn2+)+c(H+)-c(OH-)<2[c(Zn2+)+c(H+)],选项B正确;
Ksp(ZnS)>Ksp(CuS),硫离子浓度相同时,c(Zn2+)>c(Cu2+),-lg c(Cu2+)
>-lg c(Zn2+),故a~b~e为滴定ZnCl2溶液的曲线,选项C错误;
由分析知a~c~d为滴定CuCl2溶液的曲线,c点时恰好完全反应,由图可知c点时-lg c(Cu2+)=17.7,则c(Cu2+)=10-17.7 mol·L-1,c(S2-)=10-17.7 mol·L-1,Ksp(CuS)=10-35.4,d点时c(S2-)= ×0.1 mol·L-1,则c(Cu2+)=
mol·L-1=3×10-34.4 mol·L-1,
-lg c(Cu2+)=33.9,故d点纵坐标小于34.9,选项D正确。
7
8
1
2
3
4
5
6
8.(2020·青岛一模)医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用,其主要成分是乙醇。回答下列问题:
Ⅰ.工业上主要采用乙烯直接水合法制乙醇(CH2==CH2+H2O―→CH3CH2OH)。
(1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下:
7
8
1
2
3
4
5
6
随着反应进程,该过程能量变化如图所示。
下列有关说法正确的是____(填字母)。
a.该反应过程中i~iii步均释放能量
b.第i步反应的活化能最大,决定总反应速率
c. 是反应的中间产物
7
8
1
2
3
4
5
6
bc
解析 从能量图中分析可知,该反应过程的三步中,第i步吸热,第ii、iii步均释放能量,a错误;
活化能的定义:活化分子的平均能量与反应物分子的平均能量之差。活化能越大,活化分子所占的百分数就越小,反应越慢,第i步反应的活化能最大,决定总反应速率,b正确;
7
8
1
2
3
4
5
6
从题中三步反应可知, 是反应的中间产物,c正确。
(2)已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=
k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中k正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是_____。
a.k正增大,k逆减小 b.k正减小,k逆增大
c.k正减小的倍数大于k逆 d.k正减小的倍数小于k逆
7
8
1
2
3
4
5
6
d
解析 若其他条件不变时,降低温度,正逆反应速率均减小,而浓度在那瞬间是不变的,所以k正、k逆均减小,再根据能量图,C2H4(g)+H2O(g)
C2H5OH(g)反应物总能量大于生成物,为放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k正减小的倍数小于k逆,d合理。
Ⅱ.工业用二氧化碳加氢可合成乙醇:
2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。保持压强为5 MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投
料比 的关系如图所示。
7
8
1
2
3
4
5
6
(1)投料比由大到小的顺序为____________。
m3>m2>m1
(2)若投料比m=1,一定温度下发生反应,下列说法不能作为反应是否达平衡判据的是____(填字母)。
a.容器内气体密度不再变化
b.容器内气体平均相对分子质量不再变化
c.CO2的体积分数不再变化
d.容器内 不再变化
e.断裂3NA个H—H键的同时生成1.5NA个水分子
7
8
1
2
3
4
5
6
ce
解析 若投料比m=1,一定温度下:密度等于气体质量与容器体积的比值,在2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g)中,物质均为气体,保持压强为5 MPa,随反应正向进行,容器体积减小,密度增大,密度不变,说明该反应达到平衡,a能;
7
8
1
2
3
4
5
6
平均相对分子质量等于气体总质量与气体总物质的量的比值,随反应正向进行,气体总质量不变,总物质的量减小,平均相对分子质量增大,当平均相对分子质量不再变化时,该反应达到平衡,b能;
CO2的体积分数即物质的量分数,反应前CO2的体积分数为50%,根据极值法可以求出当氢气完全消耗之后,二氧化碳的体积分数仍为50%,故反应中CO2的体积分数始终保持为50%,故CO2的体积分数不变不能据此判断该反应是否达到平衡标志,c不能;
7
8
1
2
3
4
5
6
(3)若m3=3,则A点温度下,该反应的平衡常数Kp的数值为___________(Kp是以分压表示的平衡常数);若其他条件不变,A点对应起始反应物置于某刚性密闭容器,则平衡时CO2的转化率____50%(填“>”“=”或“<”)。
7
8
1
2
3
4
5
6
4.8×10-3
<
解析 若m3=3,则A点温度下,CO2的平衡转化率
为50%,
2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)
起/mol 1 3 0 0
转/mol 1×50% 1.5 0.25 0.75
平/mol 0.5 1.5 0.25 0.75
平衡时气体的总物质的量为(0.5+1.5+0.25+0.75)mol=3 mol,
7
8
1
2
3
4
5
6
原题是同温同压下,正反应体积减小,现为刚性密闭容器,气体的物质的量减小,相当于减压,平衡向气体分子数增大的方向移动,即向逆反应方向移动,CO2的转化率小于50%。
7
8
1
2
3
4
5
6
同课章节目录
