2021届高中化学考前三个月专项复习课件题型一 “7+实验综合”特训 课件(61张ppt)
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件题型一 “7+实验综合”特训 课件(61张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-01 11:13:15 | ||
图片预览











文档简介
“7+实验综合”特训
题型一 化学实验综合题的研究
A组(20分钟)
1.化学在2020年抗击新型冠状病毒肺炎的战役中发挥了巨大作用。下列说法错误的是
A.防控新冠病毒所用的酒精浓度越大,消毒效果越好
B.防护服、口罩的生产均要用到有机高分子材料
C.过氧化氢、过氧乙酸、84消毒液、二氧化氯泡腾片都可用于环境消毒
D.冷链运输抗病毒疫苗的目的是避免蛋白质变性
1
2
3
4
5
6
√
7
8
解析 医用酒精浓度为75%,不是浓度越大越好。
解析 聚乙烯不含碳碳双键,则不能使溴水褪色,故A项错误;
纯棉面料主要成分为纤维素,主要含C、H、O三种元素,故B项正确;
植物油的主要成分为高级脂肪酸甘油酯,属于酯类,故C项正确;
聚碳酸亚乙酯的降解过程中发生水解反应,为取代反应,故D项正确。
2.下列说法错误的是
A.用于食品包装的聚乙烯塑料能使溴水褪色
B.纯棉面料主要含C、H、O三种元素
C.植物油的主要成分属于酯类物质
D.聚碳酸亚乙酯的降解过程中会发生取代反应
1
2
3
4
5
6
√
7
8
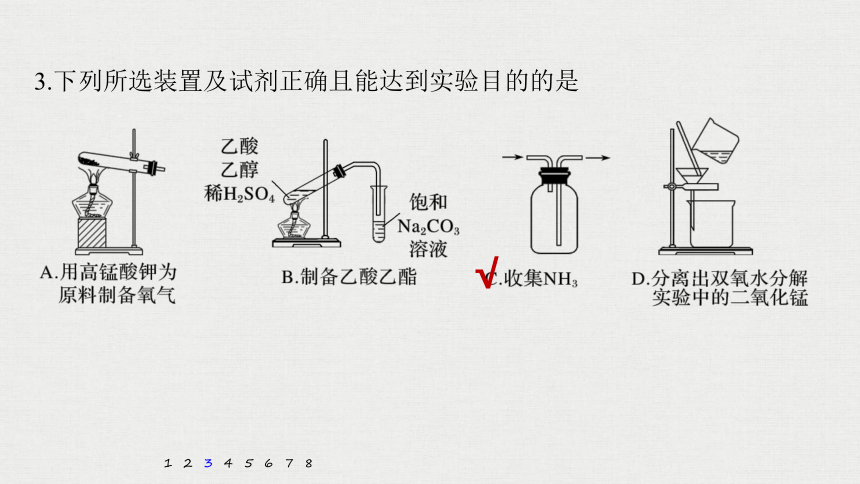
3.下列所选装置及试剂正确且能达到实验目的的是
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
解析 为了防止加热时高锰酸钾粉末堵塞导管,应在试管口处放置一团棉花,A项错误;
实验室制备乙酸乙酯所用试剂为乙酸、乙醇和浓硫酸,B项错误;
氨气的密度比空气的密度小,气体应从短导管进长导管出,C项正确;
过滤时,为防止滤液飞溅,漏斗下端尖嘴部分应紧贴烧杯内壁,D项错误。
7
8
4.NA是阿伏加德罗常数的值。下列说法正确的是
A.常温下1 L 0.1 mol·L-1 Na2CO3溶液中含0.1NA个
B.标准状况下,22.4 L SO3含NA个分子
C.常温下100 mL 0.1 mol·L-1醋酸溶液中含0.01NA个醋酸分子
D.0.1 mol Na2O2与足量水反应转移0.1NA个电子
1
2
3
4
5
6
√
7
8
解析 在溶液中会水解,故溶液中碳酸根的个数小于0.1NA个,故A
项错误;
标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故B项错误;
醋酸是弱电解质,在溶液中会部分电离,故溶液中的醋酸分子小于0.01NA个,故C项错误;
过氧化钠和水的反应为歧化反应,氧元素由-1价歧化为0价和-2价,故0.1 mol过氧化钠转移0.1NA个电子,故D项正确。
1
2
3
4
5
6
7
8
5.桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0]
丁烷( )是最简单的一种。下列关于该化合物的说法错误的是
A.与1,3-丁二烯互为同分异构体
B.二氯代物共有4种
C.碳碳键只有单键且彼此之间的夹角有45°和90°两种
D.每一个碳原子均处于与其直接相连的原子构成的四面体内部
1
2
3
4
5
6
√
7
8
解析 分子式均为C4H6,结构不同,互为同分异构体,故A项正确;
Cl原子可在相同的碳原子上,也可在不同的碳原子上,二氯代物为4种,故B项正确;
含有饱和碳原子,具有甲烷的结构特征,为立体结构,四个碳原子不在同一个平面上,键角大于45°,故C项错误;
每个碳原子均为饱和碳原子,每一个碳原子均处于与其直接相连的原子构成的四面体内部,故D项正确。
1
2
3
4
5
6
7
8
6.(2020·滨州二模)M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除M+外其他原子均满足8电子稳定结构。下列说法正确的是
A.M的单质通常保存在煤油中
B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>Y
D.上述五种元素中Z的非金属性最强
1
2
3
4
5
6
√
7
8
解析 X的最外层电子数是W次外层电子数的3倍,则W只能有2个电子层,次外层为2个电子,X为O元素,又M、W、X、Y、Z均在同一周期,故它们都是第二周期元素。由盐的结构简式知,Z可以形成4个共价键且能与氧形成双键,因此Z的最外层电子数为4,Z为C元素,Y能形成一个共价键,Y为F元素;W能形成4个共价键,W为B元素;M+带1个单位正电荷且不满足8电子稳定结构,则为Li元素。Li
的密度比煤油小,不可以保存于煤油中,A错误;
W的最高价氧化物的水化物为H3BO3,为一元弱酸,B正确;
F的非金属性大于O,则氢化物稳定性:HF>H2O,C错误;
上述五种元素中F的非金属性最强,D错误。
1
2
3
4
5
6
7
8
7.常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O的电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与粒子浓度比值的对数的
变化关系如图所示。下列叙述正确的是?
A.0.1 mol·L-1 HR溶液的pH为5
D.当c(R-)=c(HR)时,溶液必为中性
7
1
2
3
4
5
6
√
8
7
1
2
3
4
5
6
8
解析 pH=5时c(H+)=10-5 mol·L-1,由图可知此时 ,又因为一元酸HR溶液浓度为0.1 mol·L-1,所以c(R-)=c(HR)=0.05 mol·L-1,此时c(R-)≠c(H+),则0.1 mol·L-1 HR溶液的pH不是5,故A项错误;
7
1
2
3
4
5
6
8
由图可知,当c(R-)=c(HR)时,溶液pH=5呈酸性,故D项错误。
8.2018年8月受台风“温比亚”影响,山东多地连降暴雨,造成严重水灾。为确保水灾后无大疫,灾区使用了大量消毒剂——亚氯酸钠(NaClO2)。某化学小组同学查阅资料得知,工业上常利用反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2来制备亚氯酸钠;该小组同学设计下列装置,在实验室中完成亚氯酸钠的制备。
7
1
2
3
4
5
6
8
解析 装置A作安全瓶,起到防止倒吸的作用;仪器a的名称为干燥管。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出晶体是NaClO2,
高于60 ℃时NaClO2分解成NaClO3
和NaCl。
回答下列问题:
(1)装置A的作用是_________________,装置图C中a的名称为_______。
7
1
2
3
4
5
6
8
安全瓶,防止倒吸
干燥管
解析 在反应中NaClO3→ClO2,其中氯元素化合价降低作氧化剂,Na2SO3→Na2SO4,其中硫元素化合价升高作还原剂,根据化合价升降相等和原子守恒,可得反应方程式:2NaClO3+Na2SO3+H2SO4===2ClO2↑
+2Na2SO4+H2O。
(2)工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,其中Na2SO3被氧化为Na2SO4,写出
上述反应的化学方程式:________
______________________________
______________。
7
1
2
3
4
5
6
8
2NaClO3
+Na2SO3+H2SO4===2ClO2↑+
2Na2SO4+H2O
解析 用NaOH吸收多余的ClO2,在反应中ClO2发生歧化反应,对应离子方程式为:2ClO2+2OH-===
(3)装置C吸收ClO2,反应的离子方程式为___________________________
_______。
7
1
2
3
4
5
6
8
+H2O
解析 步骤b中趁热过滤的目的就是为了防止析出NaClO2·3H2O晶体,影响产品纯度;
(4)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:a.减压,55 ℃蒸发结晶;b.趁热过滤;c.温水洗涤;d.低于60 ℃干燥,得到成品。
①步骤b中趁热过滤的目的是______________________________________。
7
1
2
3
4
5
6
8
防止析出NaClO2·3H2O晶体,影响产品纯度
解析 洗涤沉淀时,应用38~60 ℃的温水浸没沉淀物,等液体自然流出后,重复操作2~3次。
②步骤c中洗涤固体的操作是______________________________________
_________________________________。
7
1
2
3
4
5
6
8
在过滤器中加38~60 ℃的温水浸没沉淀物,等液体自然流出后,重复操作2~3次
(5)目前已开发出电解法制取ClO2的新工艺,一定条件下电解饱和食盐水,在____极(填“阴”或“阳”)生成NaClO3,然后用HCl作还原剂生成ClO2,该反应的化学方程式为___________________________________________;将反应后的残液(含少量NaClO3和较多的NaCl)置于________中蒸发浓缩,放到电解槽中,将NaCl再电解成NaClO3,聚集成NaClO3的浓溶液进行循环使用,反应效率达到87.5%。
7
1
2
3
4
5
6
8
阳
2NaClO3+4HCl===2ClO2+Cl2+2NaCl+2H2O
蒸发皿
解析 由NaCl→NaClO3,发生氧化反应,故在阳极产生;在反应中NaClO3氧化HCl,根据化合价变化规则,可知NaClO3→ClO2,HCl→Cl2,根据得失电子相等和原子守恒,可得化学方程式:2NaClO3+4HCl===
2ClO2+Cl2+2NaCl+2H2O;实验室中蒸发浓缩溶液在蒸发皿中进行。
7
1
2
3
4
5
6
8
(6)下图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图:
7
1
2
3
4
5
6
8
电解一段时间,当阴极产生的气体体积为112 mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的物质的量为______ mol,用平衡移动原理解释阴极区pH增大的原因:________________________________
______________________________________。
0.01
阴极上水电离出的H+放电,导致H2O的电离平衡右移,OH-浓度增大,pH增大
解析 阴极产生标准状况下112 mL H2,转移电子0.01 mol,消耗的n(H+)=0.01 mol,为保持溶液呈电中性,故有相同物质的量的Na+通过阳离子交换膜移向阴极。阴极上H2O电离出的H+放电,导致H2O的电离平衡向右移动,OH-浓度增大,溶液pH增大。
7
1
2
3
4
5
6
8
B组(20分钟)
1.(2020·山东5月二模)山梨醇[CH2OH(CHOH)4CH2OH]可用作牙膏、食品的水分保持剂。其生产路线如下图所示。下列说法错误的是
A.活性炭脱色的过程为物理变化
B.加压氢化时葡萄糖中醛基转化为羟基
C.离子交换时可选用阴离子交换树脂
D.山梨醇可作水分保持剂是因为能与水形成氢键
1
2
3
4
5
6
√
7
8
解析 活性炭脱色利用了活性炭的吸附性,属于物理变化,故A正确;
加压氢化时葡萄糖中醛基转化为羟基,故B正确;
离子交换为了除去重金属离子,应选用阳离子交换膜,故C错误;
山梨醇可作水分保持剂是因为山梨醇中羟基能与水形成氢键,故D正确。
1
2
3
4
5
6
7
8
解析 由转化关系可知:X是能被氧化成羧酸的醇(C4H9—CH2OH),有4种;Y是醇X被酸性高锰酸钾溶液氧化得到的羧酸(C4H9—COOH),也有4种;由于羧酸Y与醇X的碳链结构必须相同,故对应的酯Z的分子结构最多也只有4种。
2.X、Y、Z三种有机物有如图所示的转化关系:
?
X的分子式为C5H12O,则Z的分子结构最多有(不含立体异构)
A.4种 B.8种 C.12种 D.16种
1
2
3
4
5
6
√
7
8
3.设计如下装置制备硝酸(夹持装置略),每个虚线框表示一个装置单元,其中完全正确的是
A.①② B.③④ C.①③ D.②④
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
解析 制备硝酸流程为NH3先进行催化氧化生成NO,NO再和氧气、水反应生成硝酸,图中装置①制取氨气和氧气,图②为NH3的催化氧化生成NO,③为除去氨气的装置,应使用浓硫酸除去气体中的NH3,④为防倒吸装置和吸收装置,进气应该是短口进,故①②正确,③④错误。
7
8
4.(2019·安庆市高三下学期第二次模拟)化工生产上有广泛用途的轻质碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]是以卤块(主要成分为MgCl2,含Fe2+、
Fe3+等杂质离子)为原料制
备。工艺流程如右:?
注:氢氧化亚铁沉淀为絮状,不易从溶液中除去
下列说法正确的是
A.沉淀的成分是Fe(OH)2和Fe(OH)3的混合物
B.“…”的操作步骤为:氧化和调节pH等分离和提纯过程
C.“热解”产生的CO2对生成轻质碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]有
重要的作用
D.“料液Ⅱ”呈酸性
1
2
3
4
5
6
√
7
8
解析 由题给信息可知,氢氧化亚铁为絮状沉淀,不易从溶液中除去,沉淀为Fe(OH)3,A项错误;
由以上分析可知,除去铁元素,应进行氧化、调节pH,生成Fe(OH)3沉淀,B项正确;
加入碳酸氢铵生成碱式碳酸镁,生成的二氧化碳不参与反应,C项错误;
“料液Ⅱ”呈碱性,D项错误。
1
2
3
4
5
6
7
8
5.如图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是
A.a、b极不能使用同种电极材料
B.工作时,a极的电势低于b极的电势
C.工作一段时间之后,a极区溶液的pH增大
D.b极的电极反应式为:
1
2
3
4
5
6
√
7
8
解析 图示分析可知:b电极CH3COO-失电子生成 ,说明b为原电池的负极,所以a为原电池的正极发生还
原反应。a、b可以是同种惰性材料,A、
B项错误;
b电极CH3COO-失电子生成 ,电极反应式为:CH3COO-+4H2O-8e-===2 +9H+,生成的氢离子通过质子交换膜进入a极区,导致a极区溶液的pH减小,故C项错误,D项正确。
1
2
3
4
5
6
7
8
6.W、X、Y、Z是四种短周期非金属元素,原子序数依次增大。X、Y原子核外L电子层的电子数之比为3∶4,X与Z为同主族元素,且X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质W2。下列说法正确的是
A.单质熔点:Z>Y
B.W与X形成的化合物中只含有极性键
C.最高价氧化物对应水化物的酸性:Z>Y
D.气态氢化物的热稳定性:Z>X
1
2
3
4
5
6
√
7
8
解析 根据X、Y原子核外L电子层的电子数之比为3∶4知,X的L层可以为3或6,即X为B或O,X与Z为同主族元素,若X为B,则Z为Al,为金属元素,不符合题意,故X为O,Z为S;根据X、Y、Z的最外层电子数之和为16,而X(O)、Z(S)的最外层电子数均为6,则Y的最外层电子数为4,故Y为Si。W-能与H2O反应生成单质W2,则W为H。S为分子晶体,Si为原子晶体,故单质熔点:S<Si,A项错误;
H与O形成的化合物有H2O、H2O2,H2O2中含有非极性键,B项错误;
非金属性:S>Si,故最高价氧化物对应水化物的酸性:H2SO4>H2SiO3,C项正确;
非金属性:S<O,故气态氢化物的热稳定性:H2S<H2O,D项错误。
1
2
3
4
5
6
7
8
7.常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 KHC2O4溶液,滴定时溶液中水电离的c水(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是
A.本实验可选用甲基橙或酚酞作指示剂
B.P点对应的溶液中:
C.Q点和S点对应的溶液中:pH=7
D.当溶液pH=4.9时 ,则H2C2O4的第二步电离常数Ka2
的数量级为10-5
7
8
1
2
3
4
5
6
√
解析 T点时水的电离程度最大,草酸盐水解,
此点溶液呈碱性,应选择酚酞作指示剂,A项
错误;
P点水电离程度小于纯水的电离程度,说明水
的电离受到抑制,即 的电离程度大于水解程度,溶液呈酸性,即c(H+)>c(OH-),B项错误;
在滴定过程中,溶液由酸性逐渐变为中性,再由中性变为碱性,T点之后,继续加入氢氧化钠溶液,碱性增强,故S点呈碱性,C项错误;
=a×10-5
(a>1),所以Ka2的数量级为10-5,D项正确。
7
8
1
2
3
4
5
6
编号
实验
现象
Ⅰ
向 1 mL pH=2的1 mol·L-1CuSO4溶液中加入0.5 mL 30% H2O2 溶液
出现少量气泡
Ⅱ
向1 mL pH=3 的1 mol·L-1CuSO4溶液中加入0.5 mL 30% H2O2 溶液
立即产生少量棕黄色沉淀,出现较明显气泡
Ⅲ
向 1 mL pH=5的 1 mol·L-1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液
立即产生大量棕褐色沉淀,产生大量气泡
8.(2020·北京模拟)研究不同pH时CuSO4溶液对H2O2分解的催化作用。资料:a.Cu2O为红色固体,难溶于水,能溶于硫酸,生成Cu和Cu2+。
b.CuO2为棕褐色固体,难溶于水,能溶于硫酸,生成Cu2+和H2O2。
c.H2O2有弱酸性:
7
8
1
2
3
4
5
6
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是_______________________。
解析 硫酸铜作催化剂,反应的化学方程式为2H2O2 O2↑+2H2O。
7
8
1
2
3
4
5
6
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为CuO2,其反应的离子方程式是________________
_____________。
解析 若Ⅲ中生成的沉淀为CuO2,说明双氧水与铜离子反应生成过氧化铜和水,反应的离子方程式为H2O2+Cu2+===CuO2↓+2H+;
7
8
1
2
3
4
5
6
H2O2+Cu2+===
CuO2↓+2H+
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是_____________________________________________
_________________________________________________。
解析 由题意可知,过氧化铜能与溶液中氢离子反应生成双氧水,双氧水具有强氧化性,在酸性条件下可能会氧化氧化亚铜或铜,无法观察到红色沉淀,说明假设ⅱ可能成立,乙同学的观点正确;
7
8
1
2
3
4
5
6
CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu
③为探究沉淀中是否存在Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加c mol·L-1EDTA 溶液
至滴定终点,消耗 EDTA 溶液 V mL。V=__________,可知沉淀中不含
Cu2O,假设ⅰ成立。[已知:Cu2++EDTA===EDTA-Cu2+,M(CuO2)=
96 g·mol-1,M(Cu2O)=144 g·mol-1]
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因:_______________________________________________________________
_________________________________________________。
7
8
1
2
3
4
5
6
解析 若过氧化铜能够催化过氧化氢分解,过氧化氢分解速率加快,催化剂过氧化铜的组成和质量不会发生变化,则实验操作和现象为将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L-1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:_______________________________________________________
______________________________________________________________________(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
7
8
1
2
3
4
5
6
将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变
解析 由以上实验可知,当溶液pH增大时,双氧水溶液中过氧根浓度增大,使得过氧化铜沉淀量增大,过氧化铜的催化能力强于铜离子,使双氧水的分解速率增大。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是_____________________________________________________________。
7
8
1
2
3
4
5
6
CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
C组(20分钟)
1.以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:
?
下列说法正确的是
A.“灼烧”可在石英坩埚中进行
B.母液中的溶质是K2CO3、KHCO3、KCl
C.“结晶”环节采用加热蒸发结晶的方法
D.“转化”反应中,生成的KMnO4和MnO2的物质的量之比为2∶1
√
7
8
1
2
3
4
5
6
2.我国古代文献中记载了大量的化学研究过程与成果。下列说法正确的是
A.《天工开物》记载:“水火既济而土合”。描述的是经过水和火的作
用后,黏土便凝固成玻璃器皿
B.《抱朴子》记载:“诈者谓以曾青涂铁,铁赤色如铜”。即湿法炼铜,
离子方程式为2Fe+3Cu2+===2Fe3++3Cu
C.《抱朴子》记载:“凡草木烧之即烬,而丹砂(HgS)烧之成水银,积变
又还成丹砂”。说明HgS Hg+S是可逆反应
D.《周礼》中记载:“煤饼烧蛎房(牡蛎壳)成灰”。该过程涉及分解反应
√
7
8
1
2
3
4
5
6
解析 黏土是生产陶瓷的主要原料,水火作用下变为陶瓷,制造玻璃的主要原料是石灰石、纯碱和石英砂,A项错误;
湿法炼铜的离子方程式是Fe+Cu2+===Fe2++Cu,B项错误;
HgS Hg+S与Hg+S===HgS的反应条件不同,不属于可逆反应,C项错误;
烧蛎房成灰涉及CaCO3高温分解为CaO和CO2的反应,D项正确。
7
8
1
2
3
4
5
6
解析 C4H10的二元取代物有12种,符合条件的留兰香油的同分异构体
理解为C4H10的 和—OH的二元取代物,故共有12种,C项错误。
3.留兰香油大量用于口腔卫生制品,分子结构如图所示。下列说法错误的是
A.留兰香油的分子式为C10H14O
B.留兰香油可使溴水和酸性KMnO4溶液褪色
C.留兰香油的同分异构体中能与金属钠反应的一取代芳香化合物共有4种
D.一定条件下,1 mol留兰香油最多能与3 mol H2加成
√
7
8
1
2
3
4
5
6
4.将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误
的是
A.阳极的电极反应式为2H2O-4e-
===4H++O2↑
B.在原料室与产品室间设计缓冲室
的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-
===2OH-+H2↑
D.膜①③④均为阳离子交换膜
√
7
8
1
2
3
4
5
6
解析 阳极室产生O2,生成的H+透过膜①进入产品室,原料室中的
透过AM和膜②进入产品室,故膜①为阳离子交换膜,膜②为阴离子交换膜;阴极室产生H2,生成的OH-透过膜④进入产品室,原料室中的Na+透过膜③和CM进入产品室,故膜③为阳离子交换膜,膜④为阴离子交换膜。A、B、C项正确,D项错误。
7
8
1
2
3
4
5
6
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。下列说法错误的是
A.装置A烧瓶内的试剂可以是KMnO4
B.装置B具有除杂和贮存气体的作用
C.实验结束后,振荡D会观察到液体
分层且下层呈紫红色
D.利用该装置能证明氯、溴、碘的非金属性逐渐减弱
√
7
8
1
2
3
4
5
6
解析 D装置中苯的密度比水小,应上层呈紫红色,故C项错误。
物质间存在反应:甲+乙→单质B+丙;丁+戊→单质D(淡黄色固体)+丙。下列说法正确的是
A.甲、乙、丙、丁、戊均只含极性键
B.原子半径:D>B>C;非金属性:B>C>D
C.可用酒精洗涤粘在容器内壁上的单质D
D.若2 mol甲与3 mol乙恰好反应生成2.5 mol单质B,则乙为双原子分子
6.A、B、C、D为原子序数依次增大的四种短周期元素,已知C、D元素的原子序数之和是A、B元素的原子序数之和的3倍,且C、D元素是同主族元素。甲、乙、丙、丁、戊五种二元化合物的组成如下表:
√
7
8
1
2
3
4
5
6
甲
乙
丙
丁
戊
A、B
B、C
A、C
A、D
C、D
解析 单质D为淡黄色固体,则D为S元素,又C、D同主族,则C为O元素,戊为SO2。C、D原子序数之和为A、B的3倍,则A、B原子序数之和为8,又戊(SO2)与丁生成单质硫,则丁为H2S,A为H元素,B为N元素,甲为NH3或N2H4。选项可据此分析。
7
8
1
2
3
4
5
6
7.柠檬酸(用H3R表示)是一种高效除垢剂。常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。下列说法正确的是
A.由a点判断H3R的第一步电离常数Ka1(H3R)的
数量级为10-3
B.若b点溶液中金属阳离子只有Na+,则有c(Na+)
=c(R3-)+c(H2R-)+c(HR2-)+c(H3R)
C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反应2H2R- H3R+HR2-在该温度下的平衡常数K=10y-x
√
7
8
1
2
3
4
5
6
解析 a点时c(H3R)=c(H2R-),则Ka1=c(H+)=10-x,3b点时,含Na+的溶质有NaH2R和Na2HR,故
B错误;
pH=6时,显酸性,c(H+)>c(OH-),由图知
c(HR2-)=c(R3-),故C正确;
D中反应K= ,Ka1=10-x,Ka2=10-y,则K=10x-y,故D错误。
7
8
1
2
3
4
5
6
8.(2020·济南二模)H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60 mL·min-1)和氨气(20 mL·min-1)气氛中于650 ℃热处理2 h可制得氮气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6 h除去灰分,用蒸馏水洗涤至中性。研磨的目的是___________________________。为了防止放置过程中再次吸水,烘干后的AC应置于________(填仪器名称)中备用。
7
8
1
2
3
4
5
6
增大接触面积,提高酸洗速率
干燥器
(2)制备ACN:
检查装置气密性并加入药品后,加热前应进行的操作是____________,其目的是_________________________________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为______________________。U形管b内试剂B的作用是______________________________。
7
8
1
2
3
4
5
6
通入氮气
将装置内的空气赶走,以免干扰实验
K1关闭,K2、K3打开
防止烧杯中的水蒸气进入管式炉
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN 0.5 g,加入0.05 mol·L-1的X溶液a mL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1 mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为b mL。则X为________(填“NaOH”“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为____________mol·kg-1(已知:ACN中,羧基的Ka=1.0×10-4、酚羟基的Ka=5.0×10-9;碳酸的Ka1=4.2×10-7、Ka2=5.6×10-11;用含a、b的代数式表示)。
7
8
1
2
3
4
5
6
NaHCO3
(0.1a-0.2b)
(4)某课题组以2 500 mg·L-1苯酚溶液为模型废水,研究AC和ACN表面的酸碱性对H2O2降解苯酚的影响,得到如右图像:
由图像可知,_______(填“AC”或“ACN”)更有利于H2O2降解苯酚,原因是________________
____________________________。
7
8
1
2
3
4
5
6
ACN
ACN表面呈碱性,有利于H2O2分解产生羟基自由基
题型一 化学实验综合题的研究
A组(20分钟)
1.化学在2020年抗击新型冠状病毒肺炎的战役中发挥了巨大作用。下列说法错误的是
A.防控新冠病毒所用的酒精浓度越大,消毒效果越好
B.防护服、口罩的生产均要用到有机高分子材料
C.过氧化氢、过氧乙酸、84消毒液、二氧化氯泡腾片都可用于环境消毒
D.冷链运输抗病毒疫苗的目的是避免蛋白质变性
1
2
3
4
5
6
√
7
8
解析 医用酒精浓度为75%,不是浓度越大越好。
解析 聚乙烯不含碳碳双键,则不能使溴水褪色,故A项错误;
纯棉面料主要成分为纤维素,主要含C、H、O三种元素,故B项正确;
植物油的主要成分为高级脂肪酸甘油酯,属于酯类,故C项正确;
聚碳酸亚乙酯的降解过程中发生水解反应,为取代反应,故D项正确。
2.下列说法错误的是
A.用于食品包装的聚乙烯塑料能使溴水褪色
B.纯棉面料主要含C、H、O三种元素
C.植物油的主要成分属于酯类物质
D.聚碳酸亚乙酯的降解过程中会发生取代反应
1
2
3
4
5
6
√
7
8
3.下列所选装置及试剂正确且能达到实验目的的是
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
解析 为了防止加热时高锰酸钾粉末堵塞导管,应在试管口处放置一团棉花,A项错误;
实验室制备乙酸乙酯所用试剂为乙酸、乙醇和浓硫酸,B项错误;
氨气的密度比空气的密度小,气体应从短导管进长导管出,C项正确;
过滤时,为防止滤液飞溅,漏斗下端尖嘴部分应紧贴烧杯内壁,D项错误。
7
8
4.NA是阿伏加德罗常数的值。下列说法正确的是
A.常温下1 L 0.1 mol·L-1 Na2CO3溶液中含0.1NA个
B.标准状况下,22.4 L SO3含NA个分子
C.常温下100 mL 0.1 mol·L-1醋酸溶液中含0.01NA个醋酸分子
D.0.1 mol Na2O2与足量水反应转移0.1NA个电子
1
2
3
4
5
6
√
7
8
解析 在溶液中会水解,故溶液中碳酸根的个数小于0.1NA个,故A
项错误;
标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故B项错误;
醋酸是弱电解质,在溶液中会部分电离,故溶液中的醋酸分子小于0.01NA个,故C项错误;
过氧化钠和水的反应为歧化反应,氧元素由-1价歧化为0价和-2价,故0.1 mol过氧化钠转移0.1NA个电子,故D项正确。
1
2
3
4
5
6
7
8
5.桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0]
丁烷( )是最简单的一种。下列关于该化合物的说法错误的是
A.与1,3-丁二烯互为同分异构体
B.二氯代物共有4种
C.碳碳键只有单键且彼此之间的夹角有45°和90°两种
D.每一个碳原子均处于与其直接相连的原子构成的四面体内部
1
2
3
4
5
6
√
7
8
解析 分子式均为C4H6,结构不同,互为同分异构体,故A项正确;
Cl原子可在相同的碳原子上,也可在不同的碳原子上,二氯代物为4种,故B项正确;
含有饱和碳原子,具有甲烷的结构特征,为立体结构,四个碳原子不在同一个平面上,键角大于45°,故C项错误;
每个碳原子均为饱和碳原子,每一个碳原子均处于与其直接相连的原子构成的四面体内部,故D项正确。
1
2
3
4
5
6
7
8
6.(2020·滨州二模)M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除M+外其他原子均满足8电子稳定结构。下列说法正确的是
A.M的单质通常保存在煤油中
B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>Y
D.上述五种元素中Z的非金属性最强
1
2
3
4
5
6
√
7
8
解析 X的最外层电子数是W次外层电子数的3倍,则W只能有2个电子层,次外层为2个电子,X为O元素,又M、W、X、Y、Z均在同一周期,故它们都是第二周期元素。由盐的结构简式知,Z可以形成4个共价键且能与氧形成双键,因此Z的最外层电子数为4,Z为C元素,Y能形成一个共价键,Y为F元素;W能形成4个共价键,W为B元素;M+带1个单位正电荷且不满足8电子稳定结构,则为Li元素。Li
的密度比煤油小,不可以保存于煤油中,A错误;
W的最高价氧化物的水化物为H3BO3,为一元弱酸,B正确;
F的非金属性大于O,则氢化物稳定性:HF>H2O,C错误;
上述五种元素中F的非金属性最强,D错误。
1
2
3
4
5
6
7
8
7.常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O的电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与粒子浓度比值的对数的
变化关系如图所示。下列叙述正确的是?
A.0.1 mol·L-1 HR溶液的pH为5
D.当c(R-)=c(HR)时,溶液必为中性
7
1
2
3
4
5
6
√
8
7
1
2
3
4
5
6
8
解析 pH=5时c(H+)=10-5 mol·L-1,由图可知此时 ,又因为一元酸HR溶液浓度为0.1 mol·L-1,所以c(R-)=c(HR)=0.05 mol·L-1,此时c(R-)≠c(H+),则0.1 mol·L-1 HR溶液的pH不是5,故A项错误;
7
1
2
3
4
5
6
8
由图可知,当c(R-)=c(HR)时,溶液pH=5呈酸性,故D项错误。
8.2018年8月受台风“温比亚”影响,山东多地连降暴雨,造成严重水灾。为确保水灾后无大疫,灾区使用了大量消毒剂——亚氯酸钠(NaClO2)。某化学小组同学查阅资料得知,工业上常利用反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2来制备亚氯酸钠;该小组同学设计下列装置,在实验室中完成亚氯酸钠的制备。
7
1
2
3
4
5
6
8
解析 装置A作安全瓶,起到防止倒吸的作用;仪器a的名称为干燥管。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出晶体是NaClO2,
高于60 ℃时NaClO2分解成NaClO3
和NaCl。
回答下列问题:
(1)装置A的作用是_________________,装置图C中a的名称为_______。
7
1
2
3
4
5
6
8
安全瓶,防止倒吸
干燥管
解析 在反应中NaClO3→ClO2,其中氯元素化合价降低作氧化剂,Na2SO3→Na2SO4,其中硫元素化合价升高作还原剂,根据化合价升降相等和原子守恒,可得反应方程式:2NaClO3+Na2SO3+H2SO4===2ClO2↑
+2Na2SO4+H2O。
(2)工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,其中Na2SO3被氧化为Na2SO4,写出
上述反应的化学方程式:________
______________________________
______________。
7
1
2
3
4
5
6
8
2NaClO3
+Na2SO3+H2SO4===2ClO2↑+
2Na2SO4+H2O
解析 用NaOH吸收多余的ClO2,在反应中ClO2发生歧化反应,对应离子方程式为:2ClO2+2OH-===
(3)装置C吸收ClO2,反应的离子方程式为___________________________
_______。
7
1
2
3
4
5
6
8
+H2O
解析 步骤b中趁热过滤的目的就是为了防止析出NaClO2·3H2O晶体,影响产品纯度;
(4)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:a.减压,55 ℃蒸发结晶;b.趁热过滤;c.温水洗涤;d.低于60 ℃干燥,得到成品。
①步骤b中趁热过滤的目的是______________________________________。
7
1
2
3
4
5
6
8
防止析出NaClO2·3H2O晶体,影响产品纯度
解析 洗涤沉淀时,应用38~60 ℃的温水浸没沉淀物,等液体自然流出后,重复操作2~3次。
②步骤c中洗涤固体的操作是______________________________________
_________________________________。
7
1
2
3
4
5
6
8
在过滤器中加38~60 ℃的温水浸没沉淀物,等液体自然流出后,重复操作2~3次
(5)目前已开发出电解法制取ClO2的新工艺,一定条件下电解饱和食盐水,在____极(填“阴”或“阳”)生成NaClO3,然后用HCl作还原剂生成ClO2,该反应的化学方程式为___________________________________________;将反应后的残液(含少量NaClO3和较多的NaCl)置于________中蒸发浓缩,放到电解槽中,将NaCl再电解成NaClO3,聚集成NaClO3的浓溶液进行循环使用,反应效率达到87.5%。
7
1
2
3
4
5
6
8
阳
2NaClO3+4HCl===2ClO2+Cl2+2NaCl+2H2O
蒸发皿
解析 由NaCl→NaClO3,发生氧化反应,故在阳极产生;在反应中NaClO3氧化HCl,根据化合价变化规则,可知NaClO3→ClO2,HCl→Cl2,根据得失电子相等和原子守恒,可得化学方程式:2NaClO3+4HCl===
2ClO2+Cl2+2NaCl+2H2O;实验室中蒸发浓缩溶液在蒸发皿中进行。
7
1
2
3
4
5
6
8
(6)下图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图:
7
1
2
3
4
5
6
8
电解一段时间,当阴极产生的气体体积为112 mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的物质的量为______ mol,用平衡移动原理解释阴极区pH增大的原因:________________________________
______________________________________。
0.01
阴极上水电离出的H+放电,导致H2O的电离平衡右移,OH-浓度增大,pH增大
解析 阴极产生标准状况下112 mL H2,转移电子0.01 mol,消耗的n(H+)=0.01 mol,为保持溶液呈电中性,故有相同物质的量的Na+通过阳离子交换膜移向阴极。阴极上H2O电离出的H+放电,导致H2O的电离平衡向右移动,OH-浓度增大,溶液pH增大。
7
1
2
3
4
5
6
8
B组(20分钟)
1.(2020·山东5月二模)山梨醇[CH2OH(CHOH)4CH2OH]可用作牙膏、食品的水分保持剂。其生产路线如下图所示。下列说法错误的是
A.活性炭脱色的过程为物理变化
B.加压氢化时葡萄糖中醛基转化为羟基
C.离子交换时可选用阴离子交换树脂
D.山梨醇可作水分保持剂是因为能与水形成氢键
1
2
3
4
5
6
√
7
8
解析 活性炭脱色利用了活性炭的吸附性,属于物理变化,故A正确;
加压氢化时葡萄糖中醛基转化为羟基,故B正确;
离子交换为了除去重金属离子,应选用阳离子交换膜,故C错误;
山梨醇可作水分保持剂是因为山梨醇中羟基能与水形成氢键,故D正确。
1
2
3
4
5
6
7
8
解析 由转化关系可知:X是能被氧化成羧酸的醇(C4H9—CH2OH),有4种;Y是醇X被酸性高锰酸钾溶液氧化得到的羧酸(C4H9—COOH),也有4种;由于羧酸Y与醇X的碳链结构必须相同,故对应的酯Z的分子结构最多也只有4种。
2.X、Y、Z三种有机物有如图所示的转化关系:
?
X的分子式为C5H12O,则Z的分子结构最多有(不含立体异构)
A.4种 B.8种 C.12种 D.16种
1
2
3
4
5
6
√
7
8
3.设计如下装置制备硝酸(夹持装置略),每个虚线框表示一个装置单元,其中完全正确的是
A.①② B.③④ C.①③ D.②④
1
2
3
4
5
6
√
7
8
1
2
3
4
5
6
解析 制备硝酸流程为NH3先进行催化氧化生成NO,NO再和氧气、水反应生成硝酸,图中装置①制取氨气和氧气,图②为NH3的催化氧化生成NO,③为除去氨气的装置,应使用浓硫酸除去气体中的NH3,④为防倒吸装置和吸收装置,进气应该是短口进,故①②正确,③④错误。
7
8
4.(2019·安庆市高三下学期第二次模拟)化工生产上有广泛用途的轻质碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]是以卤块(主要成分为MgCl2,含Fe2+、
Fe3+等杂质离子)为原料制
备。工艺流程如右:?
注:氢氧化亚铁沉淀为絮状,不易从溶液中除去
下列说法正确的是
A.沉淀的成分是Fe(OH)2和Fe(OH)3的混合物
B.“…”的操作步骤为:氧化和调节pH等分离和提纯过程
C.“热解”产生的CO2对生成轻质碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]有
重要的作用
D.“料液Ⅱ”呈酸性
1
2
3
4
5
6
√
7
8
解析 由题给信息可知,氢氧化亚铁为絮状沉淀,不易从溶液中除去,沉淀为Fe(OH)3,A项错误;
由以上分析可知,除去铁元素,应进行氧化、调节pH,生成Fe(OH)3沉淀,B项正确;
加入碳酸氢铵生成碱式碳酸镁,生成的二氧化碳不参与反应,C项错误;
“料液Ⅱ”呈碱性,D项错误。
1
2
3
4
5
6
7
8
5.如图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是
A.a、b极不能使用同种电极材料
B.工作时,a极的电势低于b极的电势
C.工作一段时间之后,a极区溶液的pH增大
D.b极的电极反应式为:
1
2
3
4
5
6
√
7
8
解析 图示分析可知:b电极CH3COO-失电子生成 ,说明b为原电池的负极,所以a为原电池的正极发生还
原反应。a、b可以是同种惰性材料,A、
B项错误;
b电极CH3COO-失电子生成 ,电极反应式为:CH3COO-+4H2O-8e-===2 +9H+,生成的氢离子通过质子交换膜进入a极区,导致a极区溶液的pH减小,故C项错误,D项正确。
1
2
3
4
5
6
7
8
6.W、X、Y、Z是四种短周期非金属元素,原子序数依次增大。X、Y原子核外L电子层的电子数之比为3∶4,X与Z为同主族元素,且X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质W2。下列说法正确的是
A.单质熔点:Z>Y
B.W与X形成的化合物中只含有极性键
C.最高价氧化物对应水化物的酸性:Z>Y
D.气态氢化物的热稳定性:Z>X
1
2
3
4
5
6
√
7
8
解析 根据X、Y原子核外L电子层的电子数之比为3∶4知,X的L层可以为3或6,即X为B或O,X与Z为同主族元素,若X为B,则Z为Al,为金属元素,不符合题意,故X为O,Z为S;根据X、Y、Z的最外层电子数之和为16,而X(O)、Z(S)的最外层电子数均为6,则Y的最外层电子数为4,故Y为Si。W-能与H2O反应生成单质W2,则W为H。S为分子晶体,Si为原子晶体,故单质熔点:S<Si,A项错误;
H与O形成的化合物有H2O、H2O2,H2O2中含有非极性键,B项错误;
非金属性:S>Si,故最高价氧化物对应水化物的酸性:H2SO4>H2SiO3,C项正确;
非金属性:S<O,故气态氢化物的热稳定性:H2S<H2O,D项错误。
1
2
3
4
5
6
7
8
7.常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 KHC2O4溶液,滴定时溶液中水电离的c水(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是
A.本实验可选用甲基橙或酚酞作指示剂
B.P点对应的溶液中:
C.Q点和S点对应的溶液中:pH=7
D.当溶液pH=4.9时 ,则H2C2O4的第二步电离常数Ka2
的数量级为10-5
7
8
1
2
3
4
5
6
√
解析 T点时水的电离程度最大,草酸盐水解,
此点溶液呈碱性,应选择酚酞作指示剂,A项
错误;
P点水电离程度小于纯水的电离程度,说明水
的电离受到抑制,即 的电离程度大于水解程度,溶液呈酸性,即c(H+)>c(OH-),B项错误;
在滴定过程中,溶液由酸性逐渐变为中性,再由中性变为碱性,T点之后,继续加入氢氧化钠溶液,碱性增强,故S点呈碱性,C项错误;
=a×10-5
(a>1),所以Ka2的数量级为10-5,D项正确。
7
8
1
2
3
4
5
6
编号
实验
现象
Ⅰ
向 1 mL pH=2的1 mol·L-1CuSO4溶液中加入0.5 mL 30% H2O2 溶液
出现少量气泡
Ⅱ
向1 mL pH=3 的1 mol·L-1CuSO4溶液中加入0.5 mL 30% H2O2 溶液
立即产生少量棕黄色沉淀,出现较明显气泡
Ⅲ
向 1 mL pH=5的 1 mol·L-1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液
立即产生大量棕褐色沉淀,产生大量气泡
8.(2020·北京模拟)研究不同pH时CuSO4溶液对H2O2分解的催化作用。资料:a.Cu2O为红色固体,难溶于水,能溶于硫酸,生成Cu和Cu2+。
b.CuO2为棕褐色固体,难溶于水,能溶于硫酸,生成Cu2+和H2O2。
c.H2O2有弱酸性:
7
8
1
2
3
4
5
6
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是_______________________。
解析 硫酸铜作催化剂,反应的化学方程式为2H2O2 O2↑+2H2O。
7
8
1
2
3
4
5
6
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为CuO2,其反应的离子方程式是________________
_____________。
解析 若Ⅲ中生成的沉淀为CuO2,说明双氧水与铜离子反应生成过氧化铜和水,反应的离子方程式为H2O2+Cu2+===CuO2↓+2H+;
7
8
1
2
3
4
5
6
H2O2+Cu2+===
CuO2↓+2H+
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是_____________________________________________
_________________________________________________。
解析 由题意可知,过氧化铜能与溶液中氢离子反应生成双氧水,双氧水具有强氧化性,在酸性条件下可能会氧化氧化亚铜或铜,无法观察到红色沉淀,说明假设ⅱ可能成立,乙同学的观点正确;
7
8
1
2
3
4
5
6
CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu
③为探究沉淀中是否存在Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加c mol·L-1EDTA 溶液
至滴定终点,消耗 EDTA 溶液 V mL。V=__________,可知沉淀中不含
Cu2O,假设ⅰ成立。[已知:Cu2++EDTA===EDTA-Cu2+,M(CuO2)=
96 g·mol-1,M(Cu2O)=144 g·mol-1]
7
8
1
2
3
4
5
6
7
8
1
2
3
4
5
6
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因:_______________________________________________________________
_________________________________________________。
7
8
1
2
3
4
5
6
解析 若过氧化铜能够催化过氧化氢分解,过氧化氢分解速率加快,催化剂过氧化铜的组成和质量不会发生变化,则实验操作和现象为将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L-1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:_______________________________________________________
______________________________________________________________________(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
7
8
1
2
3
4
5
6
将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变
解析 由以上实验可知,当溶液pH增大时,双氧水溶液中过氧根浓度增大,使得过氧化铜沉淀量增大,过氧化铜的催化能力强于铜离子,使双氧水的分解速率增大。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是_____________________________________________________________。
7
8
1
2
3
4
5
6
CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
C组(20分钟)
1.以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:
?
下列说法正确的是
A.“灼烧”可在石英坩埚中进行
B.母液中的溶质是K2CO3、KHCO3、KCl
C.“结晶”环节采用加热蒸发结晶的方法
D.“转化”反应中,生成的KMnO4和MnO2的物质的量之比为2∶1
√
7
8
1
2
3
4
5
6
2.我国古代文献中记载了大量的化学研究过程与成果。下列说法正确的是
A.《天工开物》记载:“水火既济而土合”。描述的是经过水和火的作
用后,黏土便凝固成玻璃器皿
B.《抱朴子》记载:“诈者谓以曾青涂铁,铁赤色如铜”。即湿法炼铜,
离子方程式为2Fe+3Cu2+===2Fe3++3Cu
C.《抱朴子》记载:“凡草木烧之即烬,而丹砂(HgS)烧之成水银,积变
又还成丹砂”。说明HgS Hg+S是可逆反应
D.《周礼》中记载:“煤饼烧蛎房(牡蛎壳)成灰”。该过程涉及分解反应
√
7
8
1
2
3
4
5
6
解析 黏土是生产陶瓷的主要原料,水火作用下变为陶瓷,制造玻璃的主要原料是石灰石、纯碱和石英砂,A项错误;
湿法炼铜的离子方程式是Fe+Cu2+===Fe2++Cu,B项错误;
HgS Hg+S与Hg+S===HgS的反应条件不同,不属于可逆反应,C项错误;
烧蛎房成灰涉及CaCO3高温分解为CaO和CO2的反应,D项正确。
7
8
1
2
3
4
5
6
解析 C4H10的二元取代物有12种,符合条件的留兰香油的同分异构体
理解为C4H10的 和—OH的二元取代物,故共有12种,C项错误。
3.留兰香油大量用于口腔卫生制品,分子结构如图所示。下列说法错误的是
A.留兰香油的分子式为C10H14O
B.留兰香油可使溴水和酸性KMnO4溶液褪色
C.留兰香油的同分异构体中能与金属钠反应的一取代芳香化合物共有4种
D.一定条件下,1 mol留兰香油最多能与3 mol H2加成
√
7
8
1
2
3
4
5
6
4.将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误
的是
A.阳极的电极反应式为2H2O-4e-
===4H++O2↑
B.在原料室与产品室间设计缓冲室
的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-
===2OH-+H2↑
D.膜①③④均为阳离子交换膜
√
7
8
1
2
3
4
5
6
解析 阳极室产生O2,生成的H+透过膜①进入产品室,原料室中的
透过AM和膜②进入产品室,故膜①为阳离子交换膜,膜②为阴离子交换膜;阴极室产生H2,生成的OH-透过膜④进入产品室,原料室中的Na+透过膜③和CM进入产品室,故膜③为阳离子交换膜,膜④为阴离子交换膜。A、B、C项正确,D项错误。
7
8
1
2
3
4
5
6
5.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。下列说法错误的是
A.装置A烧瓶内的试剂可以是KMnO4
B.装置B具有除杂和贮存气体的作用
C.实验结束后,振荡D会观察到液体
分层且下层呈紫红色
D.利用该装置能证明氯、溴、碘的非金属性逐渐减弱
√
7
8
1
2
3
4
5
6
解析 D装置中苯的密度比水小,应上层呈紫红色,故C项错误。
物质间存在反应:甲+乙→单质B+丙;丁+戊→单质D(淡黄色固体)+丙。下列说法正确的是
A.甲、乙、丙、丁、戊均只含极性键
B.原子半径:D>B>C;非金属性:B>C>D
C.可用酒精洗涤粘在容器内壁上的单质D
D.若2 mol甲与3 mol乙恰好反应生成2.5 mol单质B,则乙为双原子分子
6.A、B、C、D为原子序数依次增大的四种短周期元素,已知C、D元素的原子序数之和是A、B元素的原子序数之和的3倍,且C、D元素是同主族元素。甲、乙、丙、丁、戊五种二元化合物的组成如下表:
√
7
8
1
2
3
4
5
6
甲
乙
丙
丁
戊
A、B
B、C
A、C
A、D
C、D
解析 单质D为淡黄色固体,则D为S元素,又C、D同主族,则C为O元素,戊为SO2。C、D原子序数之和为A、B的3倍,则A、B原子序数之和为8,又戊(SO2)与丁生成单质硫,则丁为H2S,A为H元素,B为N元素,甲为NH3或N2H4。选项可据此分析。
7
8
1
2
3
4
5
6
7.柠檬酸(用H3R表示)是一种高效除垢剂。常温时,用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物质的量百分数随pH的变化如图所示。下列说法正确的是
A.由a点判断H3R的第一步电离常数Ka1(H3R)的
数量级为10-3
B.若b点溶液中金属阳离子只有Na+,则有c(Na+)
=c(R3-)+c(H2R-)+c(HR2-)+c(H3R)
C.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反应2H2R- H3R+HR2-在该温度下的平衡常数K=10y-x
√
7
8
1
2
3
4
5
6
解析 a点时c(H3R)=c(H2R-),则Ka1=c(H+)=10-x,3
B错误;
pH=6时,显酸性,c(H+)>c(OH-),由图知
c(HR2-)=c(R3-),故C正确;
D中反应K= ,Ka1=10-x,Ka2=10-y,则K=10x-y,故D错误。
7
8
1
2
3
4
5
6
8.(2020·济南二模)H2O2可降解废水中的有机物,活性炭(AC)能促进H2O2分解产生羟基自由基(·OH),提高对水中有机化合物的降解率。实验表明AC表面的酸碱性会影响H2O2的分解反应。实验室中,将纯化的AC在氮气(60 mL·min-1)和氨气(20 mL·min-1)气氛中于650 ℃热处理2 h可制得氮气改性活性炭(ACN)。回答下列问题:
(1)纯化AC:将AC研磨后置于10%盐酸中浸泡6 h除去灰分,用蒸馏水洗涤至中性。研磨的目的是___________________________。为了防止放置过程中再次吸水,烘干后的AC应置于________(填仪器名称)中备用。
7
8
1
2
3
4
5
6
增大接触面积,提高酸洗速率
干燥器
(2)制备ACN:
检查装置气密性并加入药品后,加热前应进行的操作是____________,其目的是_________________________________;一段时间后,打开电炉并加热反应管,此时活塞K1、K2、K3的状态为______________________。U形管b内试剂B的作用是______________________________。
7
8
1
2
3
4
5
6
通入氮气
将装置内的空气赶走,以免干扰实验
K1关闭,K2、K3打开
防止烧杯中的水蒸气进入管式炉
(3)通过氨气改性处理后,得到的ACN表面仍有少量羧基和酚羟基,其含量可采用滴定法测定。测定羧基含量的方法:在锥形瓶中加入ACN 0.5 g,加入0.05 mol·L-1的X溶液a mL。上恒温摇床,吸附平衡。以甲基橙作指示剂,用0.1 mol·L-1的标准盐酸反滴定剩余的X溶液,标准盐酸的平均用量为b mL。则X为________(填“NaOH”“Na2CO3”或“NaHCO3”),计算所得活性炭表面的羧基含量为____________mol·kg-1(已知:ACN中,羧基的Ka=1.0×10-4、酚羟基的Ka=5.0×10-9;碳酸的Ka1=4.2×10-7、Ka2=5.6×10-11;用含a、b的代数式表示)。
7
8
1
2
3
4
5
6
NaHCO3
(0.1a-0.2b)
(4)某课题组以2 500 mg·L-1苯酚溶液为模型废水,研究AC和ACN表面的酸碱性对H2O2降解苯酚的影响,得到如右图像:
由图像可知,_______(填“AC”或“ACN”)更有利于H2O2降解苯酚,原因是________________
____________________________。
7
8
1
2
3
4
5
6
ACN
ACN表面呈碱性,有利于H2O2分解产生羟基自由基
同课章节目录
