2021届高中化学考前三个月专项复习课件题型一 化学实验综合题的研究 真题调研 课件(35张ppt)
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件题型一 化学实验综合题的研究 真题调研 课件(35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-01 11:14:15 | ||
图片预览









文档简介
真题调研
题型一 化学实验综合题的研究
名称
相对分
子质量
熔点/℃
沸点
/℃
密度/(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100 ℃左
右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
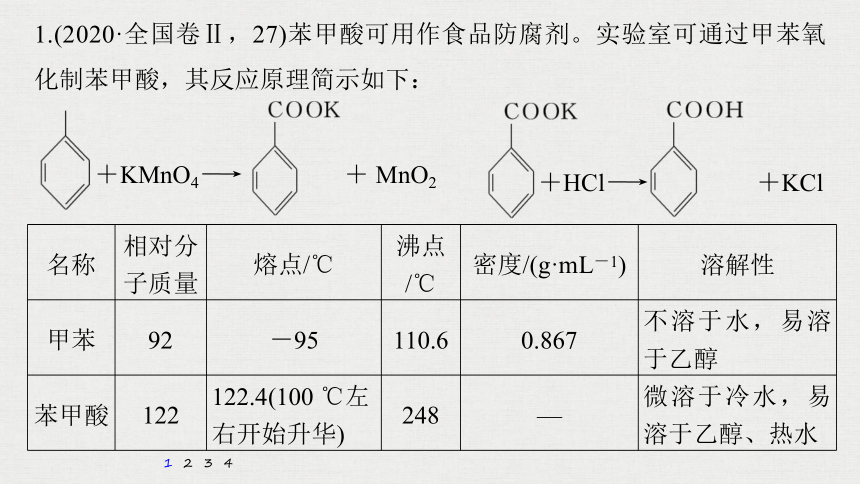
1.(2020·全国卷Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
1
2
3
4
+KMnO4―→ + MnO2
+HCl―→ +KCl
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
1
2
3
4
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.010 00 mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为_____(填标号)。
A.100 mL B.250 mL C.500 mL D.1 000 mL
1
2
3
4
B
解析 该反应需要向三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g高锰酸钾,所以三颈烧瓶的最适宜规格为250 mL。
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是_________________
_______________________。
1
2
3
4
球形
解析 反应中应选用球形冷凝管,球形冷凝管散热面积大,冷凝效果好;回流液中不再出现油珠,说明不溶于水的甲苯(油状液体)已经被KMnO4完全氧化。
无油珠说明不溶于
水的甲苯已经被完全氧化
解析 加入适量饱和亚硫酸氢钠溶液的目的:NaHSO3与KMnO4(H+)发生氧化还原反应除去过量的KMnO4(H+),防止用盐酸酸化时,KMnO4把盐酸中的Cl-氧化为Cl2;该过程也可用草酸在酸性条件下与KMnO4反应除去KMnO4,反应的离子方程式为 +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
(3)加入适量饱和亚硫酸氢钠溶液的目的是__________________________
_________________________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理___________________________________
_________________。
1
2
3
4
除去过量的高锰酸钾,避免
在用盐酸酸化时,产生氯气
+10CO2↑+8H2O
解析 用少量热水洗涤滤渣的目的是使生成的 尽可能溶于
水,故滤渣的主要成分是KMnO4在中性条件下的还原产物MnO2。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。
1
2
3
4
MnO2
解析 苯甲酸在100 ℃左右开始升华,干燥苯甲酸晶体时,若温度过高,苯甲酸易升华而损失。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是______________
_____。
1
2
3
4
苯甲酸升华而
损失
(6)本实验制备的苯甲酸的纯度为______;据此估算本实验中苯甲酸的产率最接近于______(填标号)。
A.70% B.60% C.50% D.40%
1
2
3
4
86.0%
C
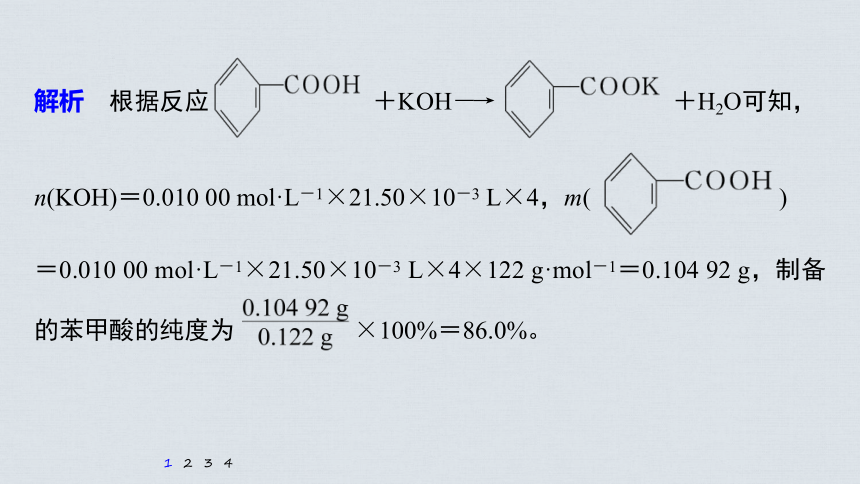
解析 根据反应 +KOH―→ +H2O可知,
n(KOH)=0.010 00 mol·L-1×21.50×10-3 L×4,m( )
=0.010 00 mol·L-1×21.50×10-3 L×4×122 g·mol-1=0.104 92 g,制备的苯甲酸的纯度为 ×100%=86.0%。
1
2
3
4
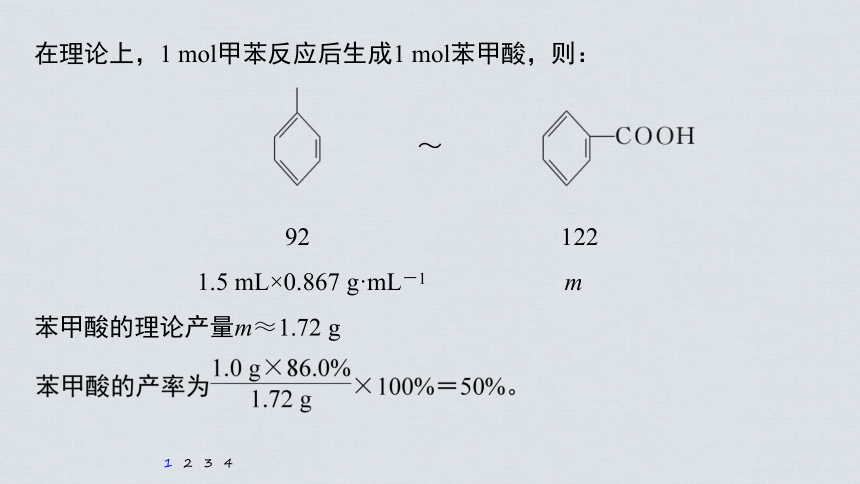
~
92 122
1.5 mL×0.867 g·mL-1 m
苯甲酸的理论产量m≈1.72 g
在理论上,1 mol甲苯反应后生成1 mol苯甲酸,则:
1
2
3
4
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
1
2
3
4
重结晶
解析 根据苯甲酸的水溶性可知,若要得到纯度更高的苯甲酸,需要利用重结晶的方法进行提纯。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是__________,a中的试剂为___________。
2.(2020·全国卷Ⅲ,26)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
1
2
3
4
圆底烧瓶
饱和食盐水
解析 由题干信息及装置图分析各装置的作用,a装置用于除杂,b装置用于制备氯酸钾,c装置用于制备次氯酸钠,d装置用于尾气处理。
盛放MnO2粉末的仪器是圆底烧瓶。产生的氯气中混有氯化氢杂质,除掉氯化氢需要将气体通过饱和食盐水。
1
2
3
4
解析 b装置的加热方式为水浴加热。c装置中氯气与氢氧化钠发生反应的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O。根据装置b、c水浴温度的不同推知,生成氯酸盐时需要酒精灯加热,生成次氯酸盐时需要冰水冷却,所以c中冰水浴的目的是避免氯酸钠的生成。
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是_____
__________________________,采用冰水浴冷却的目的是_______________。
1
2
3
4
水浴加热
2OH-===ClO-+Cl-+H2O
Cl2+
避免生成NaClO3
解析 d是尾气处理装置,吸收氯气可以用硫化钠溶液或氢氧化钙浊液。
(3)d的作用是________________,可选用试剂______(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
1
2
3
4
吸收尾气(Cl2)
AC
解析 从溶液中获得纯净氯酸钾的操作是冷却结晶,过滤,少量冷水洗涤,干燥,此处用少量冷水洗涤的目的是降低氯酸钾的损耗。
(4)反应结束后,取出b中试管,经冷却结晶,______,______________,干燥,得到KClO3晶体。
1
2
3
4
过滤
少量(冷)水洗涤
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力_______NaClO(填“大于”或“小于”)。
1
2
3
4
紫
小于
解析 碘在四氯化碳中呈紫色;碘在水中的颜色为棕色或褐色,主要由碘的浓度决定。2号试管中溶液变棕色说明生成I2,1号试管中没有颜色变化,说明没有生成I2,由此可以判断氯酸钾的氧化能力小于次氯酸钠的氧化能力。
1
2
3
4
解析 除去铁屑表面油污的方法是,用热纯碱溶液清洗铁屑,再用水洗。
3.(2019·全国卷Ⅰ,27)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
1
2
3
4
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是__________。
碱煮水洗
(2)步骤②需要加热的目的是__________,温度保持80~95 ℃,采用的合适加热方式是_______。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为____(填标号)。
1
2
3
4
加快反应
热水浴
C
解析 铁与稀硫酸反应时加热,可提高反应速率。温度低于水的沸点,可以用热水浴加热,受热均匀且便于控制。含少量硫化物的铁屑与稀硫酸反应有H2S生成。氢气不与碱溶液反应,而硫化氢能与碱溶液反应,且H2S在水中溶解度小,故氢气中混有的硫化氢用烧碱溶液除去,又因为硫化氢与碱反应较快,容易引起倒吸,C装置倒置漏斗能防倒吸。故宜选择C装置吸收硫化氢。
1
2
3
4
(3)步骤③中选用足量的H2O2,理由是_________________________________。分批加入H2O2,同时为了_____________,溶液要保持pH小于0.5。
1
2
3
4
将Fe2+全部氧化为Fe3+;不引入杂质
防止Fe3+水解
解析 铁与稀硫酸反应生成硫酸亚铁和氢气,加入足量双氧水的目的是将Fe2+全部氧化为Fe3+,发生反应为2Fe2++H2O2+2H+===2Fe3++2H2O,从生成物看,又不引入杂质。铁离子对双氧水分解起催化作用,分批加入双氧水,避免反应过快、放出热量较多,减少双氧水分解,以免造成氧化剂损失;铁离子易水解,保持溶液呈强酸性,避免铁离子发生水解反应生成氢氧化铁。
1
2
3
4
(4)步骤⑤的具体实验操作有______________________________,经干燥得到硫酸铁铵晶体样品。
1
2
3
4
加热浓缩、冷却结晶、过滤(洗涤)
解析 步骤⑤是要从溶液中得到硫酸铁铵晶体,故实验操作有加热浓缩、冷却结晶、过滤(洗涤)。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为
___________________。
1
2
3
4
解析 失重5.6%是质量分数,设结晶水合物的化学式为NH4Fe(SO4)2·xH2O,
NH4Fe(SO4)2·12H2O
4.(2019·全国卷Ⅱ,28)咖啡因是一种生物碱(易溶于
水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),
有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约
1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约
3%~10%,还含有色素、纤维素等。实验室从茶叶
中提取咖啡因的流程如图所示。
1
2
3
4
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是_________________________________。圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒_____。
1
2
3
4
增加固液接触面积,使萃取更充分
沸石
解析 实验时将茶叶研细,能增加茶叶与溶剂的接触面积,使萃取更加充分。乙醇为溶剂,为防止加热时暴沸,需在加热前向乙醇中加入几粒沸石。
1
2
3
4
解析 由于溶剂乙醇具有挥发性和易燃性,因此在提取过程中不可用明火直接加热。本实验中采用索氏提取器的优点是溶剂乙醇可循环使用,能减少溶剂用量,且萃取效率高。
(2)提取过程不可选用明火直接加热,原因是_____
______________。与常规的萃取相比,采用索氏提取器的优点是________________________________
_______。
1
2
3
4
乙醇
易挥发,易燃
使用溶剂量少,可连续萃取(萃取效
率高)
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是______________
_______。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有_____(填标号)。
A.直形冷凝管 B.球形冷凝管
C.接收瓶 D.烧杯
1
2
3
4
乙醇沸点低,
AC
易浓缩
解析 提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂具有沸点低和易浓缩的优点。“蒸馏浓缩”需选用的仪器除了所给仪器外,还有直形冷凝管和接收瓶(如锥形瓶)。
1
2
3
4
解析 向浓缩液中加入生石灰能中和单宁酸并吸收水分。
(4)浓缩液加生石灰的作用是中和_______和吸收___。
1
2
3
4
单宁酸
水
解析 结合分离提纯咖啡因的装置及将粉状物放入蒸发皿并小火加热,咖啡因凝结在扎有小孔的滤纸上,可知该分离提纯的方法为升华。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_____。
1
2
3
4
升华
高考实验综合题常见设问角度分析
以物质制备、性质、组成探究为载体考查:
(1)常见仪器识别、选择与连接。
(2)实验条件的控制。
(3)实验操作目的与解释。
(4)实验操作步骤、现象描述。
(5)实验方案的设计与评价。
(6)产品含量,物质组成定量分析。
(7)原理方程式的书写(放在工艺流程题中突破)。
题型一 化学实验综合题的研究
名称
相对分
子质量
熔点/℃
沸点
/℃
密度/(g·mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100 ℃左
右开始升华)
248
—
微溶于冷水,易溶于乙醇、热水
1.(2020·全国卷Ⅱ,27)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
1
2
3
4
+KMnO4―→ + MnO2
+HCl―→ +KCl
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
1
2
3
4
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25.00 mL溶液,用0.010 00 mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为_____(填标号)。
A.100 mL B.250 mL C.500 mL D.1 000 mL
1
2
3
4
B
解析 该反应需要向三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g高锰酸钾,所以三颈烧瓶的最适宜规格为250 mL。
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是_________________
_______________________。
1
2
3
4
球形
解析 反应中应选用球形冷凝管,球形冷凝管散热面积大,冷凝效果好;回流液中不再出现油珠,说明不溶于水的甲苯(油状液体)已经被KMnO4完全氧化。
无油珠说明不溶于
水的甲苯已经被完全氧化
解析 加入适量饱和亚硫酸氢钠溶液的目的:NaHSO3与KMnO4(H+)发生氧化还原反应除去过量的KMnO4(H+),防止用盐酸酸化时,KMnO4把盐酸中的Cl-氧化为Cl2;该过程也可用草酸在酸性条件下与KMnO4反应除去KMnO4,反应的离子方程式为 +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
(3)加入适量饱和亚硫酸氢钠溶液的目的是__________________________
_________________________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理___________________________________
_________________。
1
2
3
4
除去过量的高锰酸钾,避免
在用盐酸酸化时,产生氯气
+10CO2↑+8H2O
解析 用少量热水洗涤滤渣的目的是使生成的 尽可能溶于
水,故滤渣的主要成分是KMnO4在中性条件下的还原产物MnO2。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。
1
2
3
4
MnO2
解析 苯甲酸在100 ℃左右开始升华,干燥苯甲酸晶体时,若温度过高,苯甲酸易升华而损失。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是______________
_____。
1
2
3
4
苯甲酸升华而
损失
(6)本实验制备的苯甲酸的纯度为______;据此估算本实验中苯甲酸的产率最接近于______(填标号)。
A.70% B.60% C.50% D.40%
1
2
3
4
86.0%
C
解析 根据反应 +KOH―→ +H2O可知,
n(KOH)=0.010 00 mol·L-1×21.50×10-3 L×4,m( )
=0.010 00 mol·L-1×21.50×10-3 L×4×122 g·mol-1=0.104 92 g,制备的苯甲酸的纯度为 ×100%=86.0%。
1
2
3
4
~
92 122
1.5 mL×0.867 g·mL-1 m
苯甲酸的理论产量m≈1.72 g
在理论上,1 mol甲苯反应后生成1 mol苯甲酸,则:
1
2
3
4
(7)若要得到纯度更高的苯甲酸,可通过在水中________的方法提纯。
1
2
3
4
重结晶
解析 根据苯甲酸的水溶性可知,若要得到纯度更高的苯甲酸,需要利用重结晶的方法进行提纯。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是__________,a中的试剂为___________。
2.(2020·全国卷Ⅲ,26)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
1
2
3
4
圆底烧瓶
饱和食盐水
解析 由题干信息及装置图分析各装置的作用,a装置用于除杂,b装置用于制备氯酸钾,c装置用于制备次氯酸钠,d装置用于尾气处理。
盛放MnO2粉末的仪器是圆底烧瓶。产生的氯气中混有氯化氢杂质,除掉氯化氢需要将气体通过饱和食盐水。
1
2
3
4
解析 b装置的加热方式为水浴加热。c装置中氯气与氢氧化钠发生反应的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O。根据装置b、c水浴温度的不同推知,生成氯酸盐时需要酒精灯加热,生成次氯酸盐时需要冰水冷却,所以c中冰水浴的目的是避免氯酸钠的生成。
(2)b中采用的加热方式是_________,c中化学反应的离子方程式是_____
__________________________,采用冰水浴冷却的目的是_______________。
1
2
3
4
水浴加热
2OH-===ClO-+Cl-+H2O
Cl2+
避免生成NaClO3
解析 d是尾气处理装置,吸收氯气可以用硫化钠溶液或氢氧化钙浊液。
(3)d的作用是________________,可选用试剂______(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
1
2
3
4
吸收尾气(Cl2)
AC
解析 从溶液中获得纯净氯酸钾的操作是冷却结晶,过滤,少量冷水洗涤,干燥,此处用少量冷水洗涤的目的是降低氯酸钾的损耗。
(4)反应结束后,取出b中试管,经冷却结晶,______,______________,干燥,得到KClO3晶体。
1
2
3
4
过滤
少量(冷)水洗涤
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力_______NaClO(填“大于”或“小于”)。
1
2
3
4
紫
小于
解析 碘在四氯化碳中呈紫色;碘在水中的颜色为棕色或褐色,主要由碘的浓度决定。2号试管中溶液变棕色说明生成I2,1号试管中没有颜色变化,说明没有生成I2,由此可以判断氯酸钾的氧化能力小于次氯酸钠的氧化能力。
1
2
3
4
解析 除去铁屑表面油污的方法是,用热纯碱溶液清洗铁屑,再用水洗。
3.(2019·全国卷Ⅰ,27)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
1
2
3
4
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是__________。
碱煮水洗
(2)步骤②需要加热的目的是__________,温度保持80~95 ℃,采用的合适加热方式是_______。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为____(填标号)。
1
2
3
4
加快反应
热水浴
C
解析 铁与稀硫酸反应时加热,可提高反应速率。温度低于水的沸点,可以用热水浴加热,受热均匀且便于控制。含少量硫化物的铁屑与稀硫酸反应有H2S生成。氢气不与碱溶液反应,而硫化氢能与碱溶液反应,且H2S在水中溶解度小,故氢气中混有的硫化氢用烧碱溶液除去,又因为硫化氢与碱反应较快,容易引起倒吸,C装置倒置漏斗能防倒吸。故宜选择C装置吸收硫化氢。
1
2
3
4
(3)步骤③中选用足量的H2O2,理由是_________________________________。分批加入H2O2,同时为了_____________,溶液要保持pH小于0.5。
1
2
3
4
将Fe2+全部氧化为Fe3+;不引入杂质
防止Fe3+水解
解析 铁与稀硫酸反应生成硫酸亚铁和氢气,加入足量双氧水的目的是将Fe2+全部氧化为Fe3+,发生反应为2Fe2++H2O2+2H+===2Fe3++2H2O,从生成物看,又不引入杂质。铁离子对双氧水分解起催化作用,分批加入双氧水,避免反应过快、放出热量较多,减少双氧水分解,以免造成氧化剂损失;铁离子易水解,保持溶液呈强酸性,避免铁离子发生水解反应生成氢氧化铁。
1
2
3
4
(4)步骤⑤的具体实验操作有______________________________,经干燥得到硫酸铁铵晶体样品。
1
2
3
4
加热浓缩、冷却结晶、过滤(洗涤)
解析 步骤⑤是要从溶液中得到硫酸铁铵晶体,故实验操作有加热浓缩、冷却结晶、过滤(洗涤)。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为
___________________。
1
2
3
4
解析 失重5.6%是质量分数,设结晶水合物的化学式为NH4Fe(SO4)2·xH2O,
NH4Fe(SO4)2·12H2O
4.(2019·全国卷Ⅱ,28)咖啡因是一种生物碱(易溶于
水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),
有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约
1%~5%、单宁酸(Ka约为10-6,易溶于水及乙醇)约
3%~10%,还含有色素、纤维素等。实验室从茶叶
中提取咖啡因的流程如图所示。
1
2
3
4
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是_________________________________。圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒_____。
1
2
3
4
增加固液接触面积,使萃取更充分
沸石
解析 实验时将茶叶研细,能增加茶叶与溶剂的接触面积,使萃取更加充分。乙醇为溶剂,为防止加热时暴沸,需在加热前向乙醇中加入几粒沸石。
1
2
3
4
解析 由于溶剂乙醇具有挥发性和易燃性,因此在提取过程中不可用明火直接加热。本实验中采用索氏提取器的优点是溶剂乙醇可循环使用,能减少溶剂用量,且萃取效率高。
(2)提取过程不可选用明火直接加热,原因是_____
______________。与常规的萃取相比,采用索氏提取器的优点是________________________________
_______。
1
2
3
4
乙醇
易挥发,易燃
使用溶剂量少,可连续萃取(萃取效
率高)
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是______________
_______。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有_____(填标号)。
A.直形冷凝管 B.球形冷凝管
C.接收瓶 D.烧杯
1
2
3
4
乙醇沸点低,
AC
易浓缩
解析 提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂具有沸点低和易浓缩的优点。“蒸馏浓缩”需选用的仪器除了所给仪器外,还有直形冷凝管和接收瓶(如锥形瓶)。
1
2
3
4
解析 向浓缩液中加入生石灰能中和单宁酸并吸收水分。
(4)浓缩液加生石灰的作用是中和_______和吸收___。
1
2
3
4
单宁酸
水
解析 结合分离提纯咖啡因的装置及将粉状物放入蒸发皿并小火加热,咖啡因凝结在扎有小孔的滤纸上,可知该分离提纯的方法为升华。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_____。
1
2
3
4
升华
高考实验综合题常见设问角度分析
以物质制备、性质、组成探究为载体考查:
(1)常见仪器识别、选择与连接。
(2)实验条件的控制。
(3)实验操作目的与解释。
(4)实验操作步骤、现象描述。
(5)实验方案的设计与评价。
(6)产品含量,物质组成定量分析。
(7)原理方程式的书写(放在工艺流程题中突破)。
同课章节目录
