第2节 原子结构与元素周期表
图片预览




文档简介
第2节 原子结构与元素周期表
【课标要求】
知道原子核外电子的能级,能用电子排布式表示常见的(1—36号)原子核外电子的排布。
分布从原子外围电子排布认识原子结构的周期性变化 ;
【教学内容展现】
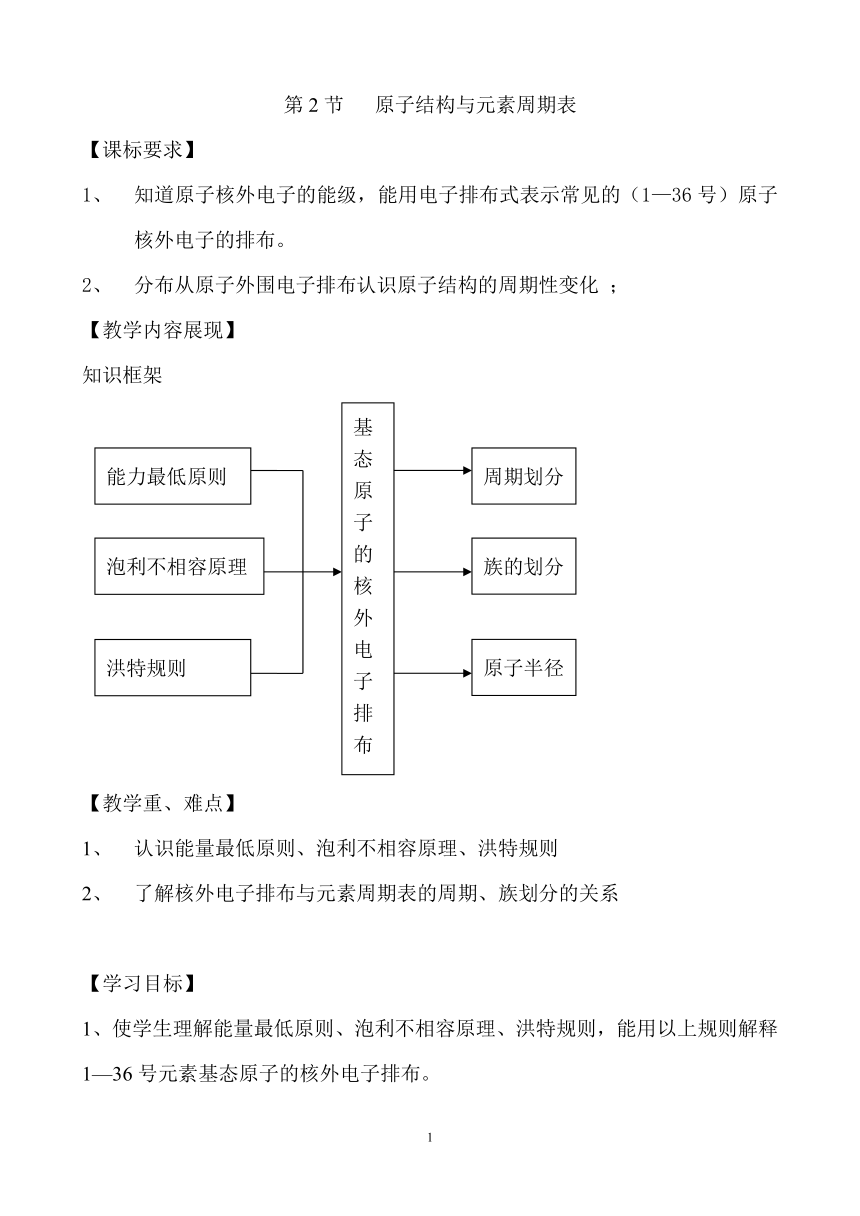
知识框架
【教学重、难点】
认识能量最低原则、泡利不相容原理、洪特规则
了解核外电子排布与元素周期表的周期、族划分的关系
【学习目标】
1、使学生理解能量最低原则、泡利不相容原理、洪特规则,能用以上规则解释1—36号元素基态原子的核外电子排布。
2、使学生能根据基态原子的核外电子排布规则和基态原子的核外电子排布顺序图完成1—36号元素基态原子的核外电子排布和价电子排布。
3、使学生知道元素周期表中元素按周期划分的原因,族的划分与原子中价电子数目和价电子排布的密切关系。
4、使学生了解原子半径的周期性变化,能用原子结构的知识解释主族元素原子半径周期性变化的原因。
5、通过学习,使学生明确原子结构的量子力学模型的建立使元素周期表的建立有了理论依据。
第1章 第2节 原子结构与元素周期表
第一课时
【学习过程】
【温故知新】核外电子排布规律:
1、核外电子是 排布的
2、不同电子层上的电子能量不同,离核越近,能量越 。
3、电子优先排布在能量最 的电子层里。
4、每个电子层所能容纳的电子数最多为 (n为电子层数)。
5、最外层电子数不超过 个(K为最外层时不超过2个),次外层不超过 个,倒数第三层不超过 个。
【课前预习区】
1、核外电子的运动状态是由哪几个方面决定的?
2、写出氖的原子结构示意图,并述此原子结构示意图所代表的意义。
3、氖的原子结构示意图能否完整描述核外电子的运动状态?
4、为什么第一层最多只能容纳2个电子?第二层最多只能容纳8个电子而不能容纳更多的电子?第n层最多容纳2n2个电子?原子核外电子的排布与原子轨道有什么关系?
【课堂互动区】
一、基态原子的核外电子排布
1、原子轨道能量高低的规律
①相同电子层上原子轨道能量的高低:ns np nd nf。
②形状相同的原子轨道能量的高低: 1s 2s 3s 4s…… ;
2p 3p 4p 5p……
③电子层和形状相同的原子轨道的能量相等,如2px = 2py =2pz 。
【学以致用】请将1S、2S、3S、4S、2P、3P、3d、4p原子轨道的能量由低到高顺序排列。
④阅读下图:原子轨道能量顺序图,填写下空
1s﹤2s﹤2p﹤3s﹤3p﹤___________________________…。
[说明]自左而右、自上而下,轨道能量依次递增。
2、基态原子的核外电子排布原则
①能量最低原理:
②泡利不相容原理:
③洪特规则:
3、电子排布式——书写电子排布式的格式
(1)元素符号;
(2)轨道符号(带电子层数);
(3)电子个数(右上角)。
例如:氖 Ne 1s22s22p6
[练习1]:写出氢、氦、锂的电子排布式。
4、轨道表示式——书写轨道表示式的格式
(1)元素符号;
(2)轨道框(一个轨道一个框,能量相同的轨道可连在一起);
(3)电子及其自旋状态;
(4)轨道符号(在轨道框下面)。
例如:氖
Ne
1s 2s 2p
[练习2]:写出He、Na、Mg的电子排布式及轨道表示式。
[练习3]:写出N原子的电子排布式及轨道表示式。
[练习4]写出下列原子或离子的电子排布式和轨道表示式
1、Al
2、Ca
3、Fe Fe2+ Fe3+
4、Cr Cu
【小结】洪特规则特例
【思考】观察下列电子排布式,找出相互间的区别与联系
氖 Ne 1s2 2s2 2p6
钠 Na 1s2 2s2 2p6 3s1
Na [Ne] 3s1
4、电子排布的简化表示——原子实表示法
原子实:
价电子:
(原子的外围电子排布式:教材所附元素周期表中所列的外围电子排布为准。)
[注意]在化学反应中原子的外围电子发生变化而原子实不受影响。
[练习5]
1以原子实表示法写出N、Cl、Mn、Br的核外电子排布,并写出对应的价电子排布式。
2、观察以上电子式,回答电子排布式是否等于原子实+价电子(外围电子排布式)?
【小结】
1、价电子排布式规律:主族元素 最外层的ns或nsnp轨道上
稀有气体 ns2np6 (He 1s2)
过渡元素 (n-1)d1-10ns1-2
2、电子排布式≠原子实+外围电子排布式,
如:Br [Ar]3d104s24p5 溴的外围电子排布式是4s24p5。
【课堂巩固区】
1、下列电子排布式是否正确?若不正确,请改正。
(1)O 1S2 2S1 2P5
(2)Ca 1S2 2S2 2P6 3S2 3P6 3d2
(3)Ti 1S2 2S2 2P6 3S2 3P6 4S2 3d2
(4)Fe2+ 1S2 2S2 2P6 3S2 3P6 3d4 4S2
2、写出下列微粒的电子排布式:
(1)Cl (2)Mg (3)Mn (4)Cu
(5)S2- (6)Al3+ (7)Fe3+ (8)Zn2+
3、下列微粒中,最外层未成对电子数 最多的是( )
A. O B. P C. Mn D.Fe3+
【课后巩固区】
1、写出下列原子或离子的电子排布式和轨道表示式
(1)O、S、Se、P、As
(2)Li+、K +; F-、Cl-、Br –
(3)He、Ne、Ar、Kr
(4)钪、钛、钒、锰
(5)铁、钴、镍、锌
(6)铬、铜
2、下列说法中正确的是
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
3、X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是
A.X:3s23P1 Y:3s23P5 B.X:2s22P3 Y:2s22P4
C.X:3s23P1 Y:3s23P4 D.X:3s2 Y:2s22P3
4、气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A. 1s22s22p63s23p2→1s22s22p63s23p1
B. 1s22s22p63s23p3→1s22s22p63s23p2
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
5、某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学式是 。
6、某元素的原子序数为33,写出该元素原子的核外电子排布式,此元素的原子的电子中被电子占据的轨道有几个?有多少个能量不同的轨道?
第三课时
【学习过程】
【温故知新】
(一)元素周期表的组成和结构:在下面表格中画出元素周期表的外框,表示出族、周期名称,镧系、锕系的位置,
(二)写出各主族及零族的价电子电子排布式。
【课前预习区】
1、周期与 相关。元素所在的周期数等于 。
2、主族元素的族序数等于 。
3、根据核外电子排布的特点,将元素周期表分为 区。
4、同一周期主族元素自左而右原子半径逐渐 ,同一主族主族元素自上而下原子半径逐渐 。
【课堂互动区】
一、核外电子排布与元素周期表
1、核外电子排布与族的划分
【问题组一】
族 ⅠA
价电子排布
(1)观察第一主族元素原子的价电子排布有什么特点?其他主族及零族的价电子有什么排布特征?
(2)写出各主族的价电子排布,找出其与最外层电子数、族序数的关系是 。
(3)观察同一纵列的过渡金属价电子排布有什么特点?
【小结】
(1)主族和零族元素价电子全都排布在 或 轨道上,过渡金属原子价电子排布为 。
(2)同主族元素的 不同, 相同,并等于 。
(3)过渡金属的 等于在元素周期表中的纵行数。
2、核外电子排布与周期的划分
【问题组二】
(1)观察第三周期元素原子价电子排布自左而右有什么特点?
(2)阅读课本14页鲍林近似能级图,根据各个能级所能容纳的电子数分析与元素周期表中划分周期的依据。
【小结】
(1)元素原子最外层电子所在轨道的主量子数为n时,该原子位于 。
(2)原子核外电子排布与元素周期表中周期划分的本质联系: 。
二、核外电子排布与原子半径
【问题组三】
(1)同主族元素原子半径有何递变规律?同周期元素原子半径有何递变规律?
(2)元素原子半径的周期性变化与核外电子排布有何联系?
(3)同一周期过渡金属自左而右原子半径如何变化?其变化的根本原因是什么?
【小结】
⒈ 同周期元素的原子半径随核电荷数的增多而_______,到稀有气体半径突然____。因_________相同,____________的增多成了影响半径大小的主要因素。
⒉ 同主族元素的原子半径随核电荷数的增多而______。因__________增多成了影响半径大小的主要因素。
⒊ 原子半径最小的元素是____,最大的是_____。(若谈能在自然界稳定存在的元素,半径最大者应是_____)。
【课堂巩固区】
1、甲元素是第3周期p区元素,其最低化合价为-1价;乙元素是第4周期d区元素,其最高化合价为+4价,填写下表:
元素 价电子排布 周期 族 金属或非金属
甲
乙
2、某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3, l=2, m=2, ms=+1/2。试回答:
(1)写出该元素原子核外电子排布式。
(2)指出该元素的原子序数,在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正化合价。
【课后巩固区】
1.下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第二周期元素
B.位于周期表中第三周期ⅢA族的元素
C.原子最外电子层排布为2s22p6的元素
D.原子最外电子层排布为3s23P5的元素
2.以下元素的原子半径递变规律是( )
A. Be<B<Na<Mg
B. B<Be<Mg<Na
C. Be<B<Mg<Na
D. B<Be<Na<Mg
3.在多电子原子中,轨道能量是由谁决定( )。
A. n B. n和m
C. n和l D. n、l、m
4.指出下列元素是主族元素还是副族元素?位于周期表中第几周期?第几族?
⑴ 1s22s22p63s23p4
(2) [Kr] 4d105s25p2
(3) [Ar] 3d34s2
(4) [Ar] 3d104s1
5.在周期表中可分为 、 、 、 、 五个区,各区的价电子排布为 、 、 、 、 。
6.具有下列价电子排布的元素位于周期表中哪个区?是金属元素还是非金属元素?
⑴ ns2(n≠1) ;
⑵ ns2np4 ;
⑶ (n-1)d5ns2 ;
⑷ (n-1)d8ns2 。
7.满足下列条件之一的是哪一族或哪一种元素?
⑴ 最外层具有6个p电子: 。
⑵ 价电子数是n=4、l=0的轨道上有2个电子和n=3、l=2的轨道上有5个电子: 。
⑶ 次外层d轨道全满,最外层有一个s电子: 。
⑷ 某元素+3价离子和氩原子的电子排布相同: 。
⑸ 某元素+3价离子的3d轨道半充满: 。
8.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径
最大的主族元素。试回答下列问题:
(1)A的元素符号 ;D的原子结构示意图 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 。
能力最低原则
泡利不相容原理
洪特规则
基态原子的核外电子排布
周期划分
族的划分
原子半径
PAGE
12
【课标要求】
知道原子核外电子的能级,能用电子排布式表示常见的(1—36号)原子核外电子的排布。
分布从原子外围电子排布认识原子结构的周期性变化 ;
【教学内容展现】
知识框架
【教学重、难点】
认识能量最低原则、泡利不相容原理、洪特规则
了解核外电子排布与元素周期表的周期、族划分的关系
【学习目标】
1、使学生理解能量最低原则、泡利不相容原理、洪特规则,能用以上规则解释1—36号元素基态原子的核外电子排布。
2、使学生能根据基态原子的核外电子排布规则和基态原子的核外电子排布顺序图完成1—36号元素基态原子的核外电子排布和价电子排布。
3、使学生知道元素周期表中元素按周期划分的原因,族的划分与原子中价电子数目和价电子排布的密切关系。
4、使学生了解原子半径的周期性变化,能用原子结构的知识解释主族元素原子半径周期性变化的原因。
5、通过学习,使学生明确原子结构的量子力学模型的建立使元素周期表的建立有了理论依据。
第1章 第2节 原子结构与元素周期表
第一课时
【学习过程】
【温故知新】核外电子排布规律:
1、核外电子是 排布的
2、不同电子层上的电子能量不同,离核越近,能量越 。
3、电子优先排布在能量最 的电子层里。
4、每个电子层所能容纳的电子数最多为 (n为电子层数)。
5、最外层电子数不超过 个(K为最外层时不超过2个),次外层不超过 个,倒数第三层不超过 个。
【课前预习区】
1、核外电子的运动状态是由哪几个方面决定的?
2、写出氖的原子结构示意图,并述此原子结构示意图所代表的意义。
3、氖的原子结构示意图能否完整描述核外电子的运动状态?
4、为什么第一层最多只能容纳2个电子?第二层最多只能容纳8个电子而不能容纳更多的电子?第n层最多容纳2n2个电子?原子核外电子的排布与原子轨道有什么关系?
【课堂互动区】
一、基态原子的核外电子排布
1、原子轨道能量高低的规律
①相同电子层上原子轨道能量的高低:ns np nd nf。
②形状相同的原子轨道能量的高低: 1s 2s 3s 4s…… ;
2p 3p 4p 5p……
③电子层和形状相同的原子轨道的能量相等,如2px = 2py =2pz 。
【学以致用】请将1S、2S、3S、4S、2P、3P、3d、4p原子轨道的能量由低到高顺序排列。
④阅读下图:原子轨道能量顺序图,填写下空
1s﹤2s﹤2p﹤3s﹤3p﹤___________________________…。
[说明]自左而右、自上而下,轨道能量依次递增。
2、基态原子的核外电子排布原则
①能量最低原理:
②泡利不相容原理:
③洪特规则:
3、电子排布式——书写电子排布式的格式
(1)元素符号;
(2)轨道符号(带电子层数);
(3)电子个数(右上角)。
例如:氖 Ne 1s22s22p6
[练习1]:写出氢、氦、锂的电子排布式。
4、轨道表示式——书写轨道表示式的格式
(1)元素符号;
(2)轨道框(一个轨道一个框,能量相同的轨道可连在一起);
(3)电子及其自旋状态;
(4)轨道符号(在轨道框下面)。
例如:氖
Ne
1s 2s 2p
[练习2]:写出He、Na、Mg的电子排布式及轨道表示式。
[练习3]:写出N原子的电子排布式及轨道表示式。
[练习4]写出下列原子或离子的电子排布式和轨道表示式
1、Al
2、Ca
3、Fe Fe2+ Fe3+
4、Cr Cu
【小结】洪特规则特例
【思考】观察下列电子排布式,找出相互间的区别与联系
氖 Ne 1s2 2s2 2p6
钠 Na 1s2 2s2 2p6 3s1
Na [Ne] 3s1
4、电子排布的简化表示——原子实表示法
原子实:
价电子:
(原子的外围电子排布式:教材所附元素周期表中所列的外围电子排布为准。)
[注意]在化学反应中原子的外围电子发生变化而原子实不受影响。
[练习5]
1以原子实表示法写出N、Cl、Mn、Br的核外电子排布,并写出对应的价电子排布式。
2、观察以上电子式,回答电子排布式是否等于原子实+价电子(外围电子排布式)?
【小结】
1、价电子排布式规律:主族元素 最外层的ns或nsnp轨道上
稀有气体 ns2np6 (He 1s2)
过渡元素 (n-1)d1-10ns1-2
2、电子排布式≠原子实+外围电子排布式,
如:Br [Ar]3d104s24p5 溴的外围电子排布式是4s24p5。
【课堂巩固区】
1、下列电子排布式是否正确?若不正确,请改正。
(1)O 1S2 2S1 2P5
(2)Ca 1S2 2S2 2P6 3S2 3P6 3d2
(3)Ti 1S2 2S2 2P6 3S2 3P6 4S2 3d2
(4)Fe2+ 1S2 2S2 2P6 3S2 3P6 3d4 4S2
2、写出下列微粒的电子排布式:
(1)Cl (2)Mg (3)Mn (4)Cu
(5)S2- (6)Al3+ (7)Fe3+ (8)Zn2+
3、下列微粒中,最外层未成对电子数 最多的是( )
A. O B. P C. Mn D.Fe3+
【课后巩固区】
1、写出下列原子或离子的电子排布式和轨道表示式
(1)O、S、Se、P、As
(2)Li+、K +; F-、Cl-、Br –
(3)He、Ne、Ar、Kr
(4)钪、钛、钒、锰
(5)铁、钴、镍、锌
(6)铬、铜
2、下列说法中正确的是
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
3、X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是
A.X:3s23P1 Y:3s23P5 B.X:2s22P3 Y:2s22P4
C.X:3s23P1 Y:3s23P4 D.X:3s2 Y:2s22P3
4、气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A. 1s22s22p63s23p2→1s22s22p63s23p1
B. 1s22s22p63s23p3→1s22s22p63s23p2
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
5、某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学式是 。
6、某元素的原子序数为33,写出该元素原子的核外电子排布式,此元素的原子的电子中被电子占据的轨道有几个?有多少个能量不同的轨道?
第三课时
【学习过程】
【温故知新】
(一)元素周期表的组成和结构:在下面表格中画出元素周期表的外框,表示出族、周期名称,镧系、锕系的位置,
(二)写出各主族及零族的价电子电子排布式。
【课前预习区】
1、周期与 相关。元素所在的周期数等于 。
2、主族元素的族序数等于 。
3、根据核外电子排布的特点,将元素周期表分为 区。
4、同一周期主族元素自左而右原子半径逐渐 ,同一主族主族元素自上而下原子半径逐渐 。
【课堂互动区】
一、核外电子排布与元素周期表
1、核外电子排布与族的划分
【问题组一】
族 ⅠA
价电子排布
(1)观察第一主族元素原子的价电子排布有什么特点?其他主族及零族的价电子有什么排布特征?
(2)写出各主族的价电子排布,找出其与最外层电子数、族序数的关系是 。
(3)观察同一纵列的过渡金属价电子排布有什么特点?
【小结】
(1)主族和零族元素价电子全都排布在 或 轨道上,过渡金属原子价电子排布为 。
(2)同主族元素的 不同, 相同,并等于 。
(3)过渡金属的 等于在元素周期表中的纵行数。
2、核外电子排布与周期的划分
【问题组二】
(1)观察第三周期元素原子价电子排布自左而右有什么特点?
(2)阅读课本14页鲍林近似能级图,根据各个能级所能容纳的电子数分析与元素周期表中划分周期的依据。
【小结】
(1)元素原子最外层电子所在轨道的主量子数为n时,该原子位于 。
(2)原子核外电子排布与元素周期表中周期划分的本质联系: 。
二、核外电子排布与原子半径
【问题组三】
(1)同主族元素原子半径有何递变规律?同周期元素原子半径有何递变规律?
(2)元素原子半径的周期性变化与核外电子排布有何联系?
(3)同一周期过渡金属自左而右原子半径如何变化?其变化的根本原因是什么?
【小结】
⒈ 同周期元素的原子半径随核电荷数的增多而_______,到稀有气体半径突然____。因_________相同,____________的增多成了影响半径大小的主要因素。
⒉ 同主族元素的原子半径随核电荷数的增多而______。因__________增多成了影响半径大小的主要因素。
⒊ 原子半径最小的元素是____,最大的是_____。(若谈能在自然界稳定存在的元素,半径最大者应是_____)。
【课堂巩固区】
1、甲元素是第3周期p区元素,其最低化合价为-1价;乙元素是第4周期d区元素,其最高化合价为+4价,填写下表:
元素 价电子排布 周期 族 金属或非金属
甲
乙
2、某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3, l=2, m=2, ms=+1/2。试回答:
(1)写出该元素原子核外电子排布式。
(2)指出该元素的原子序数,在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正化合价。
【课后巩固区】
1.下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第二周期元素
B.位于周期表中第三周期ⅢA族的元素
C.原子最外电子层排布为2s22p6的元素
D.原子最外电子层排布为3s23P5的元素
2.以下元素的原子半径递变规律是( )
A. Be<B<Na<Mg
B. B<Be<Mg<Na
C. Be<B<Mg<Na
D. B<Be<Na<Mg
3.在多电子原子中,轨道能量是由谁决定( )。
A. n B. n和m
C. n和l D. n、l、m
4.指出下列元素是主族元素还是副族元素?位于周期表中第几周期?第几族?
⑴ 1s22s22p63s23p4
(2) [Kr] 4d105s25p2
(3) [Ar] 3d34s2
(4) [Ar] 3d104s1
5.在周期表中可分为 、 、 、 、 五个区,各区的价电子排布为 、 、 、 、 。
6.具有下列价电子排布的元素位于周期表中哪个区?是金属元素还是非金属元素?
⑴ ns2(n≠1) ;
⑵ ns2np4 ;
⑶ (n-1)d5ns2 ;
⑷ (n-1)d8ns2 。
7.满足下列条件之一的是哪一族或哪一种元素?
⑴ 最外层具有6个p电子: 。
⑵ 价电子数是n=4、l=0的轨道上有2个电子和n=3、l=2的轨道上有5个电子: 。
⑶ 次外层d轨道全满,最外层有一个s电子: 。
⑷ 某元素+3价离子和氩原子的电子排布相同: 。
⑸ 某元素+3价离子的3d轨道半充满: 。
8.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径
最大的主族元素。试回答下列问题:
(1)A的元素符号 ;D的原子结构示意图 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 。
能力最低原则
泡利不相容原理
洪特规则
基态原子的核外电子排布
周期划分
族的划分
原子半径
PAGE
12
