2021届高考化学考前三个月专项复习 命题区间十 角度二 无机流程微型化 课件(42张ppt)
文档属性
| 名称 | 2021届高考化学考前三个月专项复习 命题区间十 角度二 无机流程微型化 课件(42张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览


文档简介
无机流程微型化
角度二
一、金属及其重要化合物的转化关系
一般从“单质、氧化物、对应的碱和盐”串连构建体系。
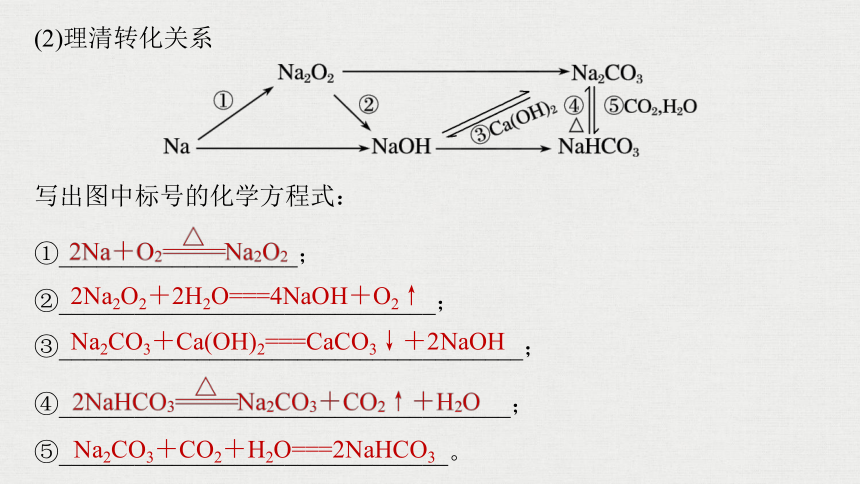
1.钠及其化合物(极活泼金属的代表)
(1)抓住知识主线
高考必备知识
(2)理清转化关系
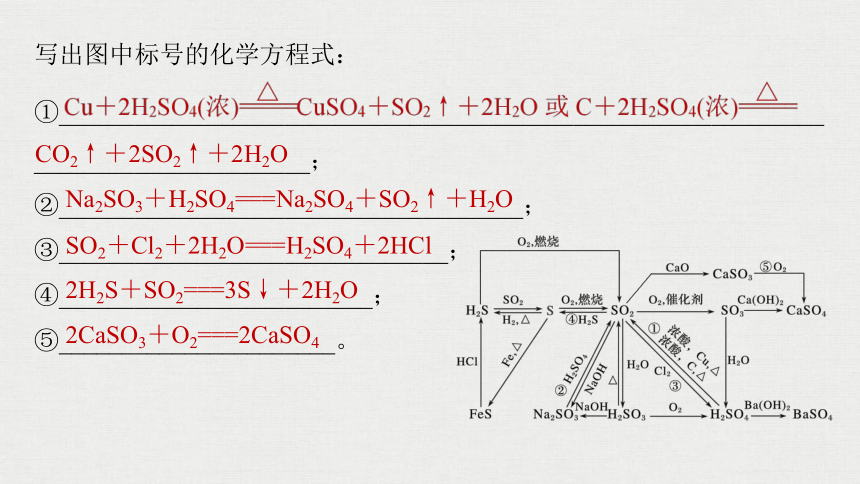
写出图中标号的化学方程式:
①___________________;
②______________________________;
③_____________________________________;
④____________________________________;
⑤_______________________________。
2Na2O2+2H2O===4NaOH+O2↑
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
Na2CO3+CO2+H2O===2NaHCO3
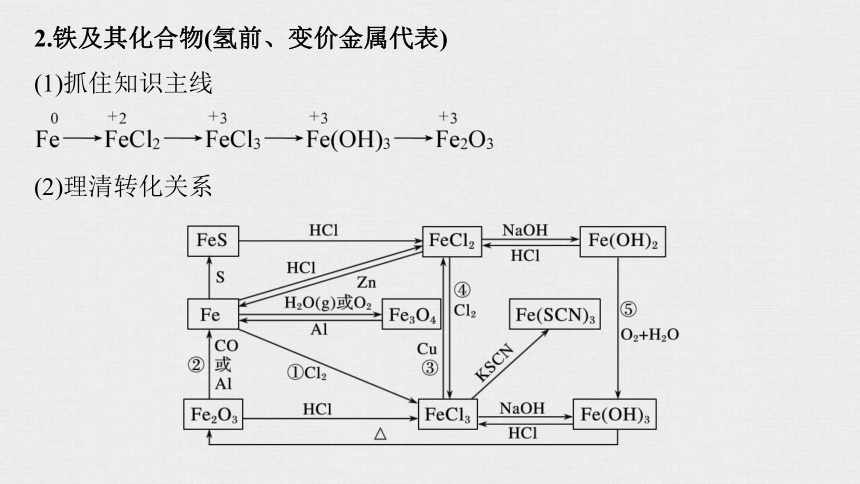
2.铁及其化合物(氢前、变价金属代表)
(1)抓住知识主线
(2)理清转化关系
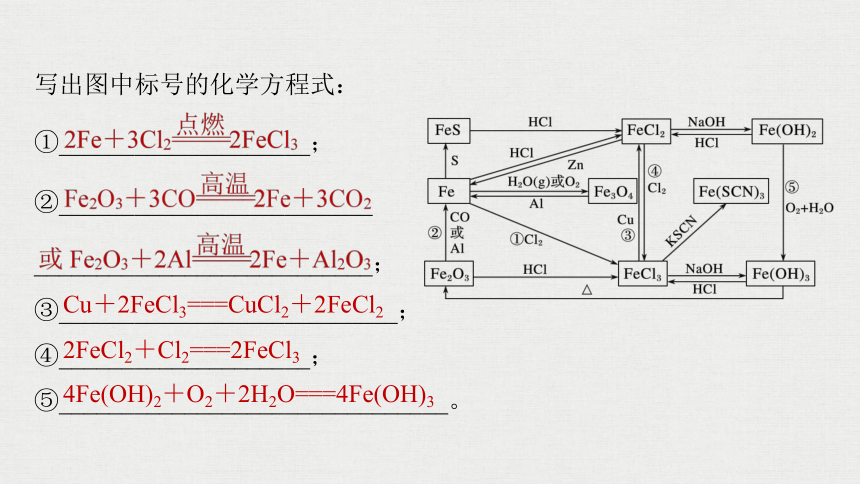
写出图中标号的化学方程式:
①____________________;
②_________________________
___________________________;
③___________________________;
④____________________;
⑤_______________________________。
Cu+2FeCl3===CuCl2+2FeCl2
2FeCl2+Cl2===2FeCl3
4Fe(OH)2+O2+2H2O===4Fe(OH)3
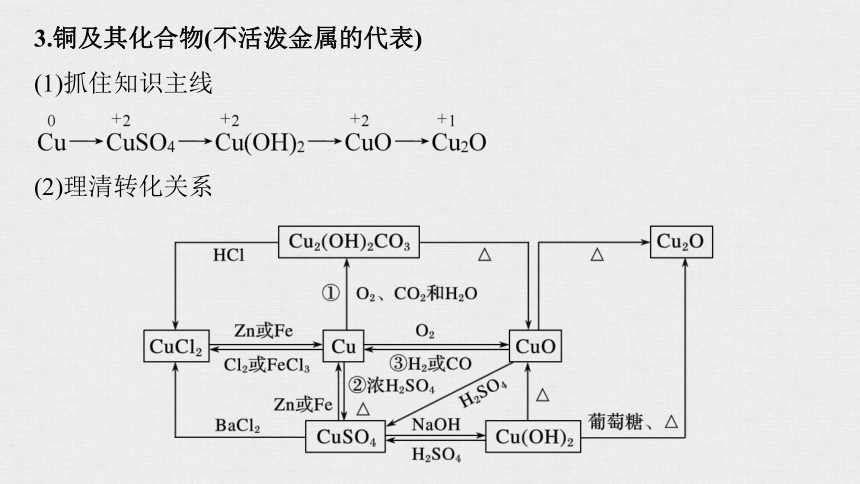
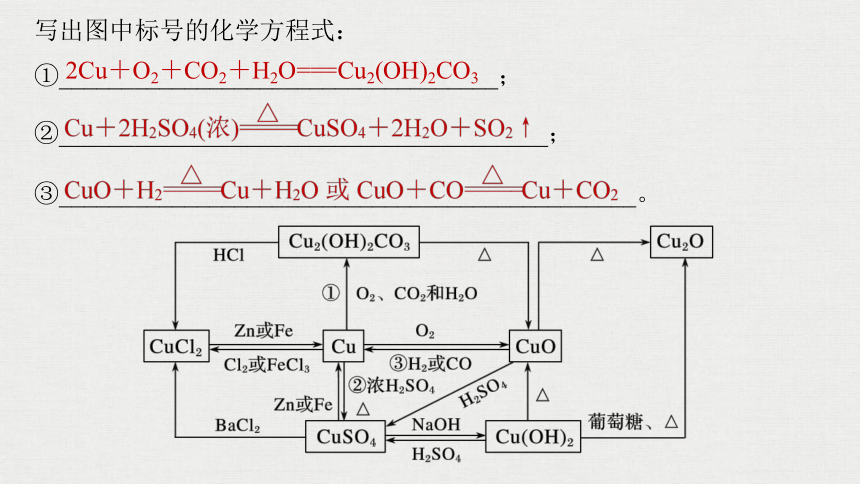
3.铜及其化合物(不活泼金属的代表)
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①___________________________________;
②_______________________________________;
③______________________________________________。
2Cu+O2+CO2+H2O===Cu2(OH)2CO3
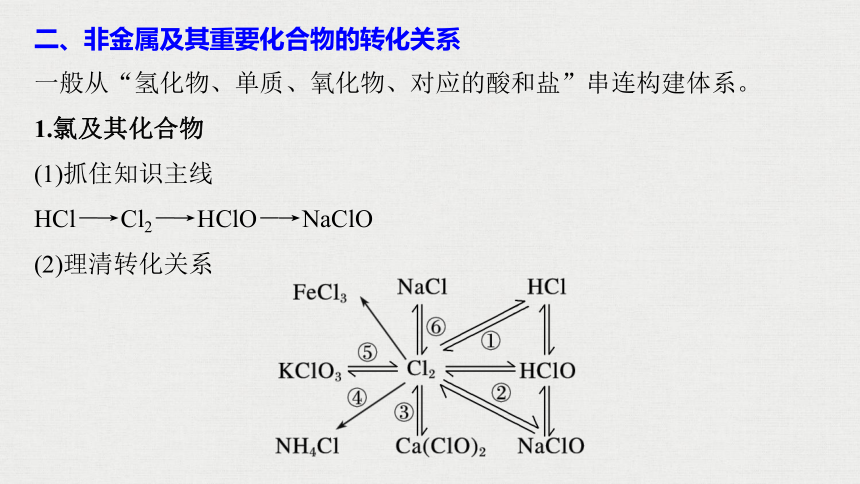
二、非金属及其重要化合物的转化关系
一般从“氢化物、单质、氧化物、对应的酸和盐”串连构建体系。
1.氯及其化合物
(1)抓住知识主线
HCl―→Cl2―→HClO―→NaClO
(2)理清转化关系
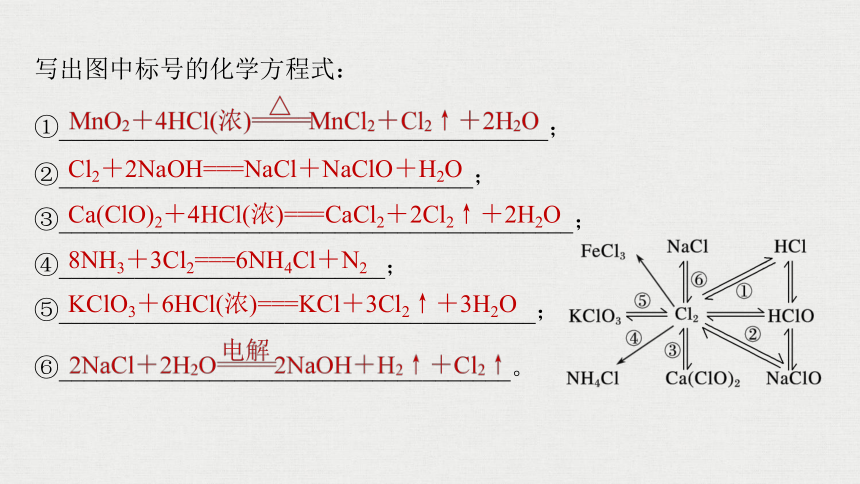
写出图中标号的化学方程式:
①_______________________________________;
②_________________________________;
③_________________________________________;
④__________________________;
⑤______________________________________;
⑥____________________________________。
Cl2+2NaOH===NaCl+NaClO+H2O
Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
8NH3+3Cl2===6NH4Cl+N2
KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
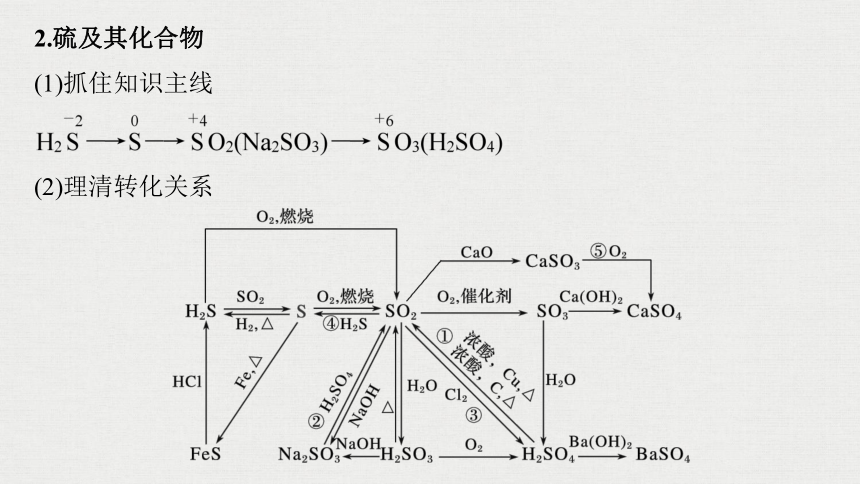
2.硫及其化合物
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①_____________________________________________________________
______________________;
②_____________________________________;
③_______________________________;
④_________________________;
⑤______________________。
CO2↑+2SO2↑+2H2O
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
2H2S+SO2===3S↓+2H2O
2CaSO3+O2===2CaSO4
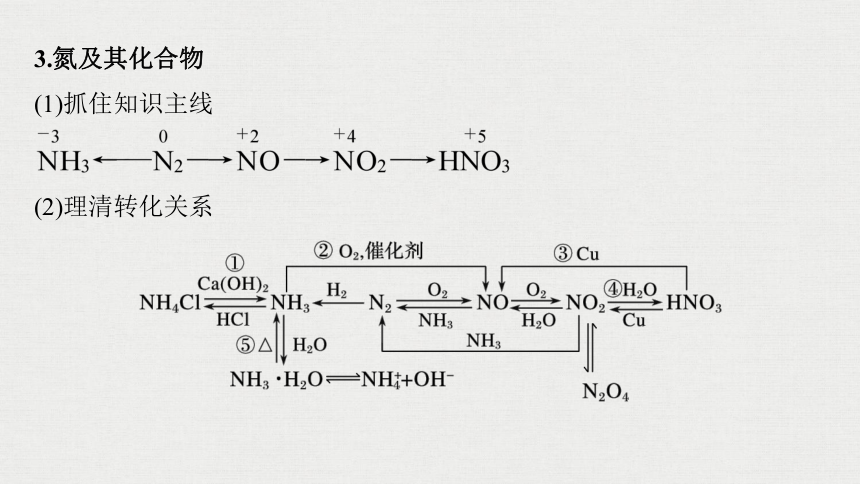
3.氮及其化合物
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①_________________________________________;
②____________________________;
③___________________________________________;
④__________________________;
⑤_________________________。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3NO2+H2O===2HNO3+NO
1.[2020·新高考全国卷Ⅰ(山东),8]实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
1
2
3
4
5
6
√
重练高考真题
7
解析 萃取振荡时,分液漏斗下口应倾斜向上,A项错误;
分液时先将下层液体从下口放出,B项正确;
水相为无色说明黄色配离子基本被萃取出来,C项正确;
直形冷凝管有利于液体流出,D项正确。
1
2
3
4
5
6
7
2.[2020·新高考全国卷Ⅰ(山东),9]以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
?
已知浸出时产生的废渣中有SiO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
1
2
3
4
5
6
√
7
解析 氯化铵溶液显酸性,与MgO反应,相当于MgO促进了氯化铵的水解,生成氨气,A项正确;
氨水易分解,故沉镁时温度
不可太高,B项错误;
由流程图可知氨气可循环使用,沉镁过程中产生氯化铵,故氯化铵也可循环使用,C项正确;
浸出过程中产生Fe(OH)3和Al(OH)3,沉镁过程中加氨水调节pH产生Mg(OH)2,利用三种离子氢氧化物Ksp的不同,使其先后沉淀而分离,D项正确。
1
2
3
4
5
6
7
3.(2019·全国卷Ⅲ,10)离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-===H2O
1
2
3
4
5
6
√
7
解析 结合上述分析及电荷守恒可知,经过阳离子交换树脂后,水中阳离子总数增多,A错误;
水中的 被阴离子树脂吸附除去,
B正确;
经过净化处理后,水中的离子浓度降低,水的导
电性减弱,C正确;
阳离子交换树脂吸附交换时产生的H+,通过阴离
子交换树脂时与OH-反应生成H2O,离子方程式为:H++OH-===H2O,D正确。
1
2
3
4
5
6
7
4.(2018·全国卷Ⅰ,7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
√
1
2
3
4
5
6
7
解析 Li2SO4易溶于水,用硫酸钠代替碳酸钠,不能形成含Li沉淀,D项错误;
合理处理废旧电池有利于保护环境和资源再利用,A项正确;
LiFePO4中含有Li和Fe元素,正极片碱溶所得滤液中含有Al元素,B项正确;
Fe2+能被HNO3氧化为Fe3+,Fe3+遇到碱液后沉淀,而另一种金属离子
——锂离子遇到碳酸钠后沉淀,C项正确。
1
2
3
4
5
6
7
5.(2018·浙江4月选考,24)某同学通过如下流程制备氧化亚铜:
已知:CuCl难溶于水和稀硫酸;Cu2O+2H+===Cu2++Cu+H2O。
下列说法不正确的是
A.步骤②中的SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C.步骤④发生反应的离子方程式为2CuCl+2OH- Cu2O+2Cl-+H2O
D.如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反
应,根据反应前、后固体质量可计算试样纯度
1
2
3
4
5
6
√
7
1
2
3
4
5
6
解析 A项,步骤②中SO2的主要目的是将CuCl2还原为CuCl,Na2SO3同样具有还原性;
B项,SO2水溶液具有还原性,可以防止CuCl被氧化;
D项,如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与试样充分反应得到的固体中有CuCl和Cu,无法计算试样纯度。
7
6.(2019·江苏,9)在给定条件下,下列选项所示的物质间转化均能实现的是
1
2
3
4
5
6
√
7
解析 A项,Cl2与Fe发生反应生成FeCl3,错误;
B项,MgCl2与Ca(OH)2发生反应生成Mg(OH)2沉淀,煅烧Mg(OH)2生成MgO固体,正确;
C项,S在O2中燃烧只能生成SO2,错误;
D项,NH3、CO2和NaCl溶液反应生成NaHCO3,反应的化学方程式为NH3+CO2+NaCl+H2O===NaHCO3↓+NH4Cl,错误。
1
2
3
4
5
6
7
7.(2015·全国卷Ⅱ,12)海水开发利用的部分过程如图所示。下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程
提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
1
2
3
4
5
6
√
7
解析 A项,向苦卤中通入Cl2 时发生反应Cl2+2Br-===2Cl-+Br2,故其目的是为了提取溴,正确;
C项,工业生产常选用廉价的Ca(OH)2作为沉淀剂,错误;
D项,由于通入Cl2后所得溶液中Br2的浓度很小,因此利用Br2的挥发性,可先用热空气和水蒸气吹出Br2,再用SO2将其还原为HBr进行富集,正确。
1
2
3
4
5
6
B项,可将粗盐溶解、过滤除去难溶性杂质,然后向滤液中加入沉淀剂,过滤后调节滤液pH以除去可溶性杂质,最后重结晶可得精盐,正确;
7
题组一 模拟工业生产流程类
1.(2020·北京模拟)高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消
毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应Ⅰ中尾气后可再利用
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO41
2
3
4
5
6
7
√
精练预测押题
解析 K2FeO4具有强氧化性,可用于杀菌消毒,生成的铁离子可水解生成具有吸附性的氢氧化铁胶体,可用于净水,故A正确;
尾气含有氯气,可与氯化亚铁反应生成氯化铁,可再利用,故B正确;
反应中Cl元素化合价由+1价降低为-1价,Fe元素化合价由+3价升高到+6价,则氧化剂与还原剂的物质的量之比为3∶2,故C正确;
结晶过程中加入饱和KOH溶液,增大了K+的浓度,该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,有利于K2FeO4晶体的析出,故D错误。
1
2
3
4
5
6
7
2.(2020·遂宁零诊)用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备超顺磁性(平均直径25 nm)纳米Fe3O4的流程示意图如下:
下列叙述不正确的是
A.常用热的Na2CO3溶液
除去钢铁表面的油污
B.步骤②中,主要反应
的离子方程式是2Fe3++Fe===3Fe2+
C.步骤④中,反应完成后剩余的H2O2无需除去
D.步骤⑤中,为了验证得到的固体是超顺磁性的Fe3O4粒子,可将其均匀
分散在水中,做丁达尔效应实验
1
2
3
4
5
6
7
√
解析 钢铁表面的油污在碱性条件下可以发生水解反应,Na2CO3是强碱弱酸盐溶液,显碱性,热的Na2CO3溶液可以让油脂水解,故A正确;
滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子和反应过量的盐酸:2Fe3++Fe===3Fe2+,故B正确;
1
2
3
4
5
6
7
步骤④中,为防止过量H2O2在步骤⑤中继续氧化+2价的铁元素,反应完成后需再加热一段时间除去剩余的H2O2,故C错误;
超顺磁性的Fe3O4粒子的平均直径为25 nm,将其均匀分散在水中形成胶体,可以做丁达尔效应实验,故D正确。
1
2
3
4
5
6
7
3.绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如右流程:
下列说法正确的是
A.固体1中主要含有CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含 废水时,发生的反应为:
1
2
3
4
5
6
7
√
1
2
3
4
5
6
7
解析 固体还包括过量的Ca(OH)2,A错;
通入空气不能过量,不然会生成 ,B错;
通过分析,气体2为一氧化碳和氮气的混合气体,氮气无污染,所以捕获的气体为一氧化碳,C项正确;
铵根离子和亚硝酸根离子发生氧化还原反应生成氮气,方程式为
题组二 实验流程中物质的转化
4.实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8 ℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说
法不正确的是
A.A装置烧瓶中发生的反应可以表
示为:
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
1
2
3
4
5
6
7
√
解析 利用D装置加热固体制取氧气,用氯酸钾制备氧气时,需要用二氧化锰作催化剂,B项错误;
对于定量测定实验,除了要排除
空气、水蒸气等的干扰,还要将
产物SO3以及未反应的SO2全部驱
赶至后续装置以进行准确测量或称量,故反应停止后还要继续通入一段时间的氧气,C项正确;
装置C中发生的反应是:3SO2+3Ba2++ +2H2O===3BaSO4↓+2NO↑+4H+,沉淀为BaSO4,D项正确。
1
2
3
4
5
6
7
5.四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3 ℃,沸点为233.5 ℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2 TiBr4+CO2制备TiBr4的装置如图所示。下列说法错误的是
A.检查装置气密性并加入药品
后,加热前应先打开K1,关
闭K2、K3
B.试剂A为浓H2SO4,干燥CO2防止产品水解
C.装置单元X为干燥装置,盛放浓硫酸,防止空气中的水蒸气进入收集瓶
D.反应过程中需用热源间歇性微热连接管,其目的是防止TiBr4在连接管
处冷凝,堵塞导管
1
2
3
4
5
6
7
√
解析 打开K1,关闭K2、K3,通入CO2排除装置内的空气,防止C粉被氧化,A正确;
浓H2SO4干燥CO2,防止产品遇水蒸气潮解和水解,B正确;
装置单元X目的是吸收挥发出的溴蒸气,且防止空气中的水蒸气进入,浓硫酸不能吸收溴蒸气,C错误;
TiBr4熔点较低,间歇性微热连接管的目的是防止其在连接管处冷凝,堵塞导管,D正确。
1
2
3
4
5
6
7
6.高温下CaSO4和焦炭可发生反应:CaSO4+C CaS+CaO+气体产物。某化学兴趣小组设计了如图所示实验装置探究气体产物的成分。已知B、C、D、E、F装置中的试剂均
为足量。?
下列叙述错误的是
A.通入氮气可排尽空气,防止氧气
的干扰,a管的作用是平衡气压
B.若实验后酸性KMnO4溶液的颜色变浅、pH增大,则气体产物中含有SO2
C.若实验后Ba(OH)2溶液中产生白色沉淀,则气体产物中含有CO2
D.若实验后E装置中黑色固体变红、F装置中溶液变浑浊,则气体产物中
含有CO
√
1
2
3
4
5
6
7
解析 如果不排尽装置中的空气,氧气与碳在高温下反应,会干扰气体产物的检验,a管可以起到平衡气压的作用,A项正确;
酸性高锰酸钾溶液既要检验二氧化硫,又要除去二氧化硫,所以酸性高锰酸钾溶液颜色变浅,反应的化学方程式为
+2Mn2++4H+,所以反应后溶液中c(H+)增大,pH减小,B项错误;
1
2
3
4
5
6
7
C装置中产生的白色沉淀应为碳酸钡,据此可判断气体产物中含有CO2,C项正确;
黑色氧化铜变为红色的铜,同时澄清石灰水变浑浊,说明气体产物中含有CO,D项正确。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
题组三 物质的检验与推断
7.(2019·浙江4月选考,25)白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验:
下列推断不正确的是
A.无色溶液B的pH≥7
B.白色固体F的主要成分是H2SiO3
C.混合物A中有Na2SiO3、CuSO4和CaCO3
D.在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀
生成,说明混合物A中有KCl
√
角度二
一、金属及其重要化合物的转化关系
一般从“单质、氧化物、对应的碱和盐”串连构建体系。
1.钠及其化合物(极活泼金属的代表)
(1)抓住知识主线
高考必备知识
(2)理清转化关系
写出图中标号的化学方程式:
①___________________;
②______________________________;
③_____________________________________;
④____________________________________;
⑤_______________________________。
2Na2O2+2H2O===4NaOH+O2↑
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
Na2CO3+CO2+H2O===2NaHCO3
2.铁及其化合物(氢前、变价金属代表)
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①____________________;
②_________________________
___________________________;
③___________________________;
④____________________;
⑤_______________________________。
Cu+2FeCl3===CuCl2+2FeCl2
2FeCl2+Cl2===2FeCl3
4Fe(OH)2+O2+2H2O===4Fe(OH)3
3.铜及其化合物(不活泼金属的代表)
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①___________________________________;
②_______________________________________;
③______________________________________________。
2Cu+O2+CO2+H2O===Cu2(OH)2CO3
二、非金属及其重要化合物的转化关系
一般从“氢化物、单质、氧化物、对应的酸和盐”串连构建体系。
1.氯及其化合物
(1)抓住知识主线
HCl―→Cl2―→HClO―→NaClO
(2)理清转化关系
写出图中标号的化学方程式:
①_______________________________________;
②_________________________________;
③_________________________________________;
④__________________________;
⑤______________________________________;
⑥____________________________________。
Cl2+2NaOH===NaCl+NaClO+H2O
Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
8NH3+3Cl2===6NH4Cl+N2
KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
2.硫及其化合物
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①_____________________________________________________________
______________________;
②_____________________________________;
③_______________________________;
④_________________________;
⑤______________________。
CO2↑+2SO2↑+2H2O
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
2H2S+SO2===3S↓+2H2O
2CaSO3+O2===2CaSO4
3.氮及其化合物
(1)抓住知识主线
(2)理清转化关系
写出图中标号的化学方程式:
①_________________________________________;
②____________________________;
③___________________________________________;
④__________________________;
⑤_________________________。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3NO2+H2O===2HNO3+NO
1.[2020·新高考全国卷Ⅰ(山东),8]实验室分离Fe3+和Al3+的流程如下:
已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
1
2
3
4
5
6
√
重练高考真题
7
解析 萃取振荡时,分液漏斗下口应倾斜向上,A项错误;
分液时先将下层液体从下口放出,B项正确;
水相为无色说明黄色配离子基本被萃取出来,C项正确;
直形冷凝管有利于液体流出,D项正确。
1
2
3
4
5
6
7
2.[2020·新高考全国卷Ⅰ(山东),9]以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
?
已知浸出时产生的废渣中有SiO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
1
2
3
4
5
6
√
7
解析 氯化铵溶液显酸性,与MgO反应,相当于MgO促进了氯化铵的水解,生成氨气,A项正确;
氨水易分解,故沉镁时温度
不可太高,B项错误;
由流程图可知氨气可循环使用,沉镁过程中产生氯化铵,故氯化铵也可循环使用,C项正确;
浸出过程中产生Fe(OH)3和Al(OH)3,沉镁过程中加氨水调节pH产生Mg(OH)2,利用三种离子氢氧化物Ksp的不同,使其先后沉淀而分离,D项正确。
1
2
3
4
5
6
7
3.(2019·全国卷Ⅲ,10)离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-===H2O
1
2
3
4
5
6
√
7
解析 结合上述分析及电荷守恒可知,经过阳离子交换树脂后,水中阳离子总数增多,A错误;
水中的 被阴离子树脂吸附除去,
B正确;
经过净化处理后,水中的离子浓度降低,水的导
电性减弱,C正确;
阳离子交换树脂吸附交换时产生的H+,通过阴离
子交换树脂时与OH-反应生成H2O,离子方程式为:H++OH-===H2O,D正确。
1
2
3
4
5
6
7
4.(2018·全国卷Ⅰ,7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
√
1
2
3
4
5
6
7
解析 Li2SO4易溶于水,用硫酸钠代替碳酸钠,不能形成含Li沉淀,D项错误;
合理处理废旧电池有利于保护环境和资源再利用,A项正确;
LiFePO4中含有Li和Fe元素,正极片碱溶所得滤液中含有Al元素,B项正确;
Fe2+能被HNO3氧化为Fe3+,Fe3+遇到碱液后沉淀,而另一种金属离子
——锂离子遇到碳酸钠后沉淀,C项正确。
1
2
3
4
5
6
7
5.(2018·浙江4月选考,24)某同学通过如下流程制备氧化亚铜:
已知:CuCl难溶于水和稀硫酸;Cu2O+2H+===Cu2++Cu+H2O。
下列说法不正确的是
A.步骤②中的SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C.步骤④发生反应的离子方程式为2CuCl+2OH- Cu2O+2Cl-+H2O
D.如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反
应,根据反应前、后固体质量可计算试样纯度
1
2
3
4
5
6
√
7
1
2
3
4
5
6
解析 A项,步骤②中SO2的主要目的是将CuCl2还原为CuCl,Na2SO3同样具有还原性;
B项,SO2水溶液具有还原性,可以防止CuCl被氧化;
D项,如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与试样充分反应得到的固体中有CuCl和Cu,无法计算试样纯度。
7
6.(2019·江苏,9)在给定条件下,下列选项所示的物质间转化均能实现的是
1
2
3
4
5
6
√
7
解析 A项,Cl2与Fe发生反应生成FeCl3,错误;
B项,MgCl2与Ca(OH)2发生反应生成Mg(OH)2沉淀,煅烧Mg(OH)2生成MgO固体,正确;
C项,S在O2中燃烧只能生成SO2,错误;
D项,NH3、CO2和NaCl溶液反应生成NaHCO3,反应的化学方程式为NH3+CO2+NaCl+H2O===NaHCO3↓+NH4Cl,错误。
1
2
3
4
5
6
7
7.(2015·全国卷Ⅱ,12)海水开发利用的部分过程如图所示。下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程
提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
1
2
3
4
5
6
√
7
解析 A项,向苦卤中通入Cl2 时发生反应Cl2+2Br-===2Cl-+Br2,故其目的是为了提取溴,正确;
C项,工业生产常选用廉价的Ca(OH)2作为沉淀剂,错误;
D项,由于通入Cl2后所得溶液中Br2的浓度很小,因此利用Br2的挥发性,可先用热空气和水蒸气吹出Br2,再用SO2将其还原为HBr进行富集,正确。
1
2
3
4
5
6
B项,可将粗盐溶解、过滤除去难溶性杂质,然后向滤液中加入沉淀剂,过滤后调节滤液pH以除去可溶性杂质,最后重结晶可得精盐,正确;
7
题组一 模拟工业生产流程类
1.(2020·北京模拟)高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消
毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应Ⅰ中尾气后可再利用
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4
2
3
4
5
6
7
√
精练预测押题
解析 K2FeO4具有强氧化性,可用于杀菌消毒,生成的铁离子可水解生成具有吸附性的氢氧化铁胶体,可用于净水,故A正确;
尾气含有氯气,可与氯化亚铁反应生成氯化铁,可再利用,故B正确;
反应中Cl元素化合价由+1价降低为-1价,Fe元素化合价由+3价升高到+6价,则氧化剂与还原剂的物质的量之比为3∶2,故C正确;
结晶过程中加入饱和KOH溶液,增大了K+的浓度,该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,有利于K2FeO4晶体的析出,故D错误。
1
2
3
4
5
6
7
2.(2020·遂宁零诊)用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备超顺磁性(平均直径25 nm)纳米Fe3O4的流程示意图如下:
下列叙述不正确的是
A.常用热的Na2CO3溶液
除去钢铁表面的油污
B.步骤②中,主要反应
的离子方程式是2Fe3++Fe===3Fe2+
C.步骤④中,反应完成后剩余的H2O2无需除去
D.步骤⑤中,为了验证得到的固体是超顺磁性的Fe3O4粒子,可将其均匀
分散在水中,做丁达尔效应实验
1
2
3
4
5
6
7
√
解析 钢铁表面的油污在碱性条件下可以发生水解反应,Na2CO3是强碱弱酸盐溶液,显碱性,热的Na2CO3溶液可以让油脂水解,故A正确;
滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子和反应过量的盐酸:2Fe3++Fe===3Fe2+,故B正确;
1
2
3
4
5
6
7
步骤④中,为防止过量H2O2在步骤⑤中继续氧化+2价的铁元素,反应完成后需再加热一段时间除去剩余的H2O2,故C错误;
超顺磁性的Fe3O4粒子的平均直径为25 nm,将其均匀分散在水中形成胶体,可以做丁达尔效应实验,故D正确。
1
2
3
4
5
6
7
3.绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如右流程:
下列说法正确的是
A.固体1中主要含有CaCO3、CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含 废水时,发生的反应为:
1
2
3
4
5
6
7
√
1
2
3
4
5
6
7
解析 固体还包括过量的Ca(OH)2,A错;
通入空气不能过量,不然会生成 ,B错;
通过分析,气体2为一氧化碳和氮气的混合气体,氮气无污染,所以捕获的气体为一氧化碳,C项正确;
铵根离子和亚硝酸根离子发生氧化还原反应生成氮气,方程式为
题组二 实验流程中物质的转化
4.实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8 ℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说
法不正确的是
A.A装置烧瓶中发生的反应可以表
示为:
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
1
2
3
4
5
6
7
√
解析 利用D装置加热固体制取氧气,用氯酸钾制备氧气时,需要用二氧化锰作催化剂,B项错误;
对于定量测定实验,除了要排除
空气、水蒸气等的干扰,还要将
产物SO3以及未反应的SO2全部驱
赶至后续装置以进行准确测量或称量,故反应停止后还要继续通入一段时间的氧气,C项正确;
装置C中发生的反应是:3SO2+3Ba2++ +2H2O===3BaSO4↓+2NO↑+4H+,沉淀为BaSO4,D项正确。
1
2
3
4
5
6
7
5.四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3 ℃,沸点为233.5 ℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2 TiBr4+CO2制备TiBr4的装置如图所示。下列说法错误的是
A.检查装置气密性并加入药品
后,加热前应先打开K1,关
闭K2、K3
B.试剂A为浓H2SO4,干燥CO2防止产品水解
C.装置单元X为干燥装置,盛放浓硫酸,防止空气中的水蒸气进入收集瓶
D.反应过程中需用热源间歇性微热连接管,其目的是防止TiBr4在连接管
处冷凝,堵塞导管
1
2
3
4
5
6
7
√
解析 打开K1,关闭K2、K3,通入CO2排除装置内的空气,防止C粉被氧化,A正确;
浓H2SO4干燥CO2,防止产品遇水蒸气潮解和水解,B正确;
装置单元X目的是吸收挥发出的溴蒸气,且防止空气中的水蒸气进入,浓硫酸不能吸收溴蒸气,C错误;
TiBr4熔点较低,间歇性微热连接管的目的是防止其在连接管处冷凝,堵塞导管,D正确。
1
2
3
4
5
6
7
6.高温下CaSO4和焦炭可发生反应:CaSO4+C CaS+CaO+气体产物。某化学兴趣小组设计了如图所示实验装置探究气体产物的成分。已知B、C、D、E、F装置中的试剂均
为足量。?
下列叙述错误的是
A.通入氮气可排尽空气,防止氧气
的干扰,a管的作用是平衡气压
B.若实验后酸性KMnO4溶液的颜色变浅、pH增大,则气体产物中含有SO2
C.若实验后Ba(OH)2溶液中产生白色沉淀,则气体产物中含有CO2
D.若实验后E装置中黑色固体变红、F装置中溶液变浑浊,则气体产物中
含有CO
√
1
2
3
4
5
6
7
解析 如果不排尽装置中的空气,氧气与碳在高温下反应,会干扰气体产物的检验,a管可以起到平衡气压的作用,A项正确;
酸性高锰酸钾溶液既要检验二氧化硫,又要除去二氧化硫,所以酸性高锰酸钾溶液颜色变浅,反应的化学方程式为
+2Mn2++4H+,所以反应后溶液中c(H+)增大,pH减小,B项错误;
1
2
3
4
5
6
7
C装置中产生的白色沉淀应为碳酸钡,据此可判断气体产物中含有CO2,C项正确;
黑色氧化铜变为红色的铜,同时澄清石灰水变浑浊,说明气体产物中含有CO,D项正确。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
题组三 物质的检验与推断
7.(2019·浙江4月选考,25)白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验:
下列推断不正确的是
A.无色溶液B的pH≥7
B.白色固体F的主要成分是H2SiO3
C.混合物A中有Na2SiO3、CuSO4和CaCO3
D.在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀
生成,说明混合物A中有KCl
√
同课章节目录
