2021届高考化学考前三个月专项复习课件(33张ppt) 题型四 物质结构与性质逐空特训
文档属性
| 名称 | 2021届高考化学考前三个月专项复习课件(33张ppt) 题型四 物质结构与性质逐空特训 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 07:11:20 | ||
图片预览











文档简介
物质结构与性质逐空特训
题型四 物质结构与性质综合题的研究(选考)
1.(2019·海南,19,改编)Ⅰ.下列各组物质性质的比较,结论正确的是_____。
A.分子的极性:BCl3<NCl3
B.物质的硬度:NaIC.物质的沸点:HF<HCl
D.在CS2中的溶解度:CCl4<H2O
1
2
3
4
5
6
AB
解析 BCl3中B原子达到最高化合价+3价,是非极性分子;而NCl3的N原子上有一对孤电子对,是极性分子,所以分子极性:BCl3<NCl3,A项正确;
NaF、NaI都是离子晶体,阴、阳离子通过离子键结合,由于离子半径:F-<I-,离子半径越小,离子键越强,物质的硬度就越大,所以物质硬度:NaF>NaI,B项正确;
HCl分子之间只存在分子间作用力,而HF分子之间除存在分子间作用力外,还存在氢键,因此HF的沸点比HCl的高,C项错误;
CCl4 、CS2都是由非极性分子构成的物质,H2O是由极性分子构成的物质,根据相似相溶原理可知,由非极性分子构成的溶质CCl4容易溶解在由非极性分子构成的溶剂CS2中,由极性分子H2O构成的溶质不容易溶解在由非极性分子构成的溶剂CS2中,所以溶解度:CCl4>H2O,D项错误。
1
2
3
4
5
6
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:
(1)Mn位于元素周期表中第四周期_____族,基态Mn原子核外未成对电子有____个。
1
2
3
4
5
6
ⅦB
5
解析 Mn是25号元素,在元素周期表中位于第四周期ⅦB族,根据构造原理可得基态Mn原子核外电子排布式1s22s22p63s23p63d54s2,根据电子排布式可知,该原子核外的未成对电子有5个。
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为______键。NH3分子的空间构型为_________,其中N原子的杂化轨道类型为____。
1
2
3
4
5
6
配位
三角锥形
sp3
解析 MnCl2中的Mn2+上有空轨道,而NH3的N原子上有孤电子对,因此二者反应可形成络合物[Mn(NH3)6]Cl2,则新生成的化学键为配位键。
NH3中N原子的价层电子对数为 ,且N原子上有一对孤电
子对,孤电子对对成键电子对的排斥作用大于成键电子对的排斥作用,所以NH3分子的立体构型为三角锥形,其中N原子的杂化轨道类型为sp3杂化。
(3)金属锰有多种晶型,其中δ-Mn的结构为体心立方堆积,晶胞参数为a pm,
δ-Mn中锰的原子半径为_____ pm。已知阿伏加德罗常数的值为NA,δ-Mn
的理论密度ρ=_____________ g·cm-3。(列出计算式)
1
2
3
4
5
6
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为_____,其配位数为____。
1
2
3
4
5
6
+2
6
解析 在晶胞中含有的Mn原子数目为: ,含有的O原子数目
为: ,n(Mn)∶n(O)=4∶4=1∶1,所以该氧化物的化学
式为MnO,根据化合物中元素化合价代数和等于0可知,由于O的化合价为-2价,所以Mn的化合价为+2价;根据晶胞结构可知:在Mn原子上、下、前、后、左、右6个方向各有一个O原子,所以Mn原子的配位数是6。
2.(2019·江苏,21-A)Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu2+基态核外电子排布式为_________________________。
1
2
3
4
5
6
[Ar]3d9(或1s22s22p63s23p63d9)
解析 Cu为29号元素,根据构造原理可知,Cu的核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1,失去2个电子后变为Cu2+,则Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。
(2) 的空间构型为____________(用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为_____(填元素符号)。
1
2
3
4
5
6
正四面体形
O
解析 中S没有孤电子对,价电子对数为0+4=4,故S为sp3杂化,
的空间构型为正四面体形。该配离子中Cu提供空轨道,O提供孤电子对,故配位原子为O。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:_________(填“难溶于水”或“易溶于水”)。
1
2
3
4
5
6
sp3、sp2
易溶于水
解析 该分子中形成单键的碳原子为sp3杂化,形成双键的碳原子为sp2杂化。1个抗坏血酸分子中含有4个羟基,其可以与H2O形成分子间氢键,所以抗坏血酸易溶于水。
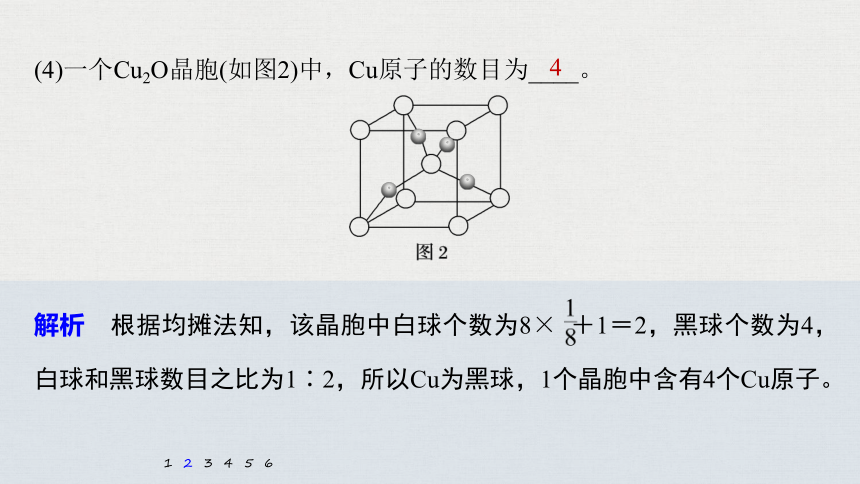
(4)一个Cu2O晶胞(如图2)中,Cu原子的数目为____。
1
2
3
4
5
6
4
解析 根据均摊法知,该晶胞中白球个数为8× +1=2,黑球个数为4,
白球和黑球数目之比为1∶2,所以Cu为黑球,1个晶胞中含有4个Cu原子。
3.(2020·遂宁零诊)向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____________________
_______。
1
2
3
4
5
6
ds
1s22s22p63s23p63d8或
[Ar]3d8
解析 根据元素周期表,Cu位于周期表中第四周期ⅠB族,位于ds区;铜的核外电子排布式1s22s22p63s23p63d104s1,基态Cu3+失去最外层的三个电子,基态Cu3+的核外电子排布式1s22s22p63s23p63d8。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是________(用元素符号表示)。
1
2
3
4
5
6
N>O>S
解析 N、O位于同一周期,同周期从左到右,第一电离能呈现增大的趋势,但N的最外层电子处于半充满状态,故第一电离能N>O,O、S位于同一主族,同主族从上到下,第一电离能呈减小的趋势,故第一电离能O>S,故第一电离能由大到小的顺序为N>O>S。
(3)上述深蓝色晶体中含有的元素电负性最小的是_____(用元素符号表示)。
1
2
3
4
5
6
Cu
解析 深蓝色晶体为[Cu(NH3)4]SO4·H2O,含有Cu、N、H、S、O元素,非金属性越弱,电负性越小,则电负性最小的为Cu。
(4)H2O的中心原子轨道杂化类型为______杂化; 离子的立体构型是
__________,写出与 互为等电子体的一种离子______________。
1
2
3
4
5
6
sp3
正四面体形
解析 H2O的中心原子是O,根据VSEPR理论,价电子对数=成键电子
对数+孤电子对数=2+ ×(6-1×2)=4,根据杂化轨道理论,中心原
子O的杂化方式为sp3;深蓝色晶体的阴离子为 ,根据VSEPR理论,
价电子对数=成键电子对数+孤电子对数=4+ ×(6+2-4×2)=4,根
据杂化轨道理论,中心S的杂化方式为sp3,其空间构型为正四面体。
_____________________________________________________________________________________________________________。
(5)NH3分子独立存在时H—N—H键角为107°。如图为[Zn(NH3)6]2+离子的部分结构以及H—N—H键角的测量值。解释配合物中H—N—H键角变为109°28′的原因:___________________________
1
2
3
4
5
6
氨分子与Zn2+形成配合物后,
孤对电子与Zn2+成键,原孤对电子与成键电子对间的排斥作用变为成键电子对间的排斥,排斥减弱,故H—N—H键角变大
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30 ℃才凝固的低温冰,180 ℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为
_________________________g·cm-3(只列式,不计算)。
1
2
3
4
5
6
4.(1)①C60和金刚石都是碳的同素异形体,二者相比较熔点高的是______。
1
2
3
4
5
6
金刚石
解析 C60是分子晶体、金刚石是原子晶体,所以金刚石的熔点远远高于C60的熔点。
②超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与____个氮原子相连,与同一个N原子相连的Al原子构成的立体构型为____________,氮化铝晶体属于_____晶体。
4
正四面体形
原子
解析 由金刚石结构每个C原子均以sp3杂化与其他四个C原子相连形成四个共价键构成正四面体结构可推测。
③金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,呈正四面体构型。试推测Ni(CO)4的晶体类型是_________,Ni(CO)4易溶于下列______(填字母,下同)。
A.水 B.四氯化碳
C.苯 D.硫酸镍溶液
1
2
3
4
5
6
分子晶体
BC
解析 由挥发性液体可知Ni(CO)4是分子晶体,由正四面体构型可知Ni(CO)4是非极性分子。
④氯化铝在177.8 ℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_____。
A.氯化铝为共价化合物 B.氯化铝为离子化合物
C.氯化铝难溶于有机溶剂 D.Al2Cl6中存在配位键
1
2
3
4
5
6
BC
解析 由氯化铝易升华可知氯化铝是分子晶体,Al—Cl键不属于离子键应为共价键,Al原子最外层三个电子全部成键,形成三个Al—Cl σ键,无孤电子对,是非极性分子,易溶于有机溶剂,Al有空轨道,与氯原子的孤电子对能形成配位键,A、D正确。
(2)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____;若该晶胞密度为ρ g·cm-3,硒化锌的摩尔质量为M g·mol-1。NA代表阿伏加德罗常数的值,则
晶胞参数a为____________pm。
1
2
3
4
5
6
4
1
2
3
4
5
6
5.第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价层电子排布图为________________。
(2)氮元素的单质除了N2外,还有N4,则N4中N的轨道杂化方式为____。
(3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是_____(填“前者”或“后者”),原因是____________________________________________
_______________。
1
2
3
4
5
6
sp3
前者
前者形成分子间氢键,而后者形成分子内氢键,
因而前者沸点高
(4)汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中阴离子的立体构型为________。
1
2
3
4
5
6
直线形
解析 在NaN3固体中,阴离子为 ,离子中有16个价电子,所以与CO2互为等电子体,根据等电子体结构相似判断,确定NaN3中阴离子的立体构型。
(5)王水溶解黄金的反应如下:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O,产物中的H[AuCl4]是配合物,它的配位体是_____。
Cl-
解析 在配合物中,中心原子或离子含有空轨道,配位体含有孤电子对。
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图,晶胞参数a=565 pm。
1
2
3
4
5
6
①砷化镓的化学式为______,镓原子的配位数为___。
②砷化镓的晶胞密度=_____________________________________g·cm-3
(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间
的距离为________pm(列式表示)。
GaAs
4
1
2
3
4
5
6
6.(2020·深圳二检)2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2和LiMnO2等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态Co原子价层电子排布式为______。
(2)已知第三电离能数据:I3(Mn)=3 246 kJ·mol-1,I3(Fe)=2 957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是_________________
_________________________________________________________________________________________________________________________________________。
1
2
3
4
5
6
3d74s2
式为3d5,达到稳定结构,不易失电子形成Mn3+,Fe2+价层电子排布式为3d6,要失去1个电子才达到稳定结构,较易形成Fe3+,故锰的第三电离能大于铁
Mn2+价层电子排布
(3)据报道,在MnO2的催化下,甲醛可被氧化成CO2,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角______CO2中键角(填“大于” “小于”或“等于”)。
1
2
3
4
5
6
小于
解析 HCHO分子呈平面结构,键角接近120°,而CO2的键角是180°。
(4)Co3+、Co2+能与NH3、H2O、SCN-等配体组成配合物。
①1 mol [Co(NH3)6]3+含_____mol σ键。
1
2
3
4
5
6
24
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式为[S==C==N]-,SCN-与金属离子形成的配离子中配位原子是____(填元素符号)。
解析 1个NH3含3个共价键,还能形成1个配位键,配位键也是σ键。
解析 SCN-中C没有孤电子对,N的电负性大于S,故S提供孤电子对。
S
③配离子在水中颜色与分裂能有关,某些水合离子的分裂能如表所示:
1
2
3
4
5
6
配离子
[Fe(H2O)6]3+
[Fe(H2O)6]2+
[Co(H2O)6]2+
[Co(H2O)6]3+
分裂能/kJ·mol-1
164
124
a
b
由此推知,a_____b(填“>”“<”或“=”),主要原因是____________
_________________。
<
[Co(H2O)6]3+
所带正电荷数较多
解析 依题意,配体相同、配位数相等的配离子,分裂能与中心离子的电荷数有关,正电荷数越多,吸引电子能力越强,分裂能越大。
(5)工业上,采用电解熔融氯化锂制备锂,钠还原TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为605 ℃、-24 ℃,它们的熔点相差很大,其主要原因是_______________________________________________________。
1
2
3
4
5
6
LiCl是离子晶体,TiCl4是分子晶体,离子键比分子间作用力强
(6)钛的化合物有2种不同结构的晶体,其晶胞如图所示。
1
2
3
4
5
6
二氧化钛晶胞(如图1)中钛原子配位数为____。氮化钛的晶胞如图2所示,图3是氮化钛的晶胞截面图。已知:NA是阿伏加德罗常数的值,氮化钛晶体
密度为d g·cm-3。氮化钛晶胞中N原子半径为_________________________pm。
6
解析 图1中,由均摊法可知
1个晶胞含2个黑球,4个白球
(2个白球在体内,4个白球在
面心),所以,黑球为钛,白
球为氧。1个钛与6个氧相连,钛的配位数为6。由图2知,1个晶胞含4个TiN(类似氯化钠晶胞),图3棱上三个粒子相切。
1
2
3
4
5
6
题型四 物质结构与性质综合题的研究(选考)
1.(2019·海南,19,改编)Ⅰ.下列各组物质性质的比较,结论正确的是_____。
A.分子的极性:BCl3<NCl3
B.物质的硬度:NaI
D.在CS2中的溶解度:CCl4<H2O
1
2
3
4
5
6
AB
解析 BCl3中B原子达到最高化合价+3价,是非极性分子;而NCl3的N原子上有一对孤电子对,是极性分子,所以分子极性:BCl3<NCl3,A项正确;
NaF、NaI都是离子晶体,阴、阳离子通过离子键结合,由于离子半径:F-<I-,离子半径越小,离子键越强,物质的硬度就越大,所以物质硬度:NaF>NaI,B项正确;
HCl分子之间只存在分子间作用力,而HF分子之间除存在分子间作用力外,还存在氢键,因此HF的沸点比HCl的高,C项错误;
CCl4 、CS2都是由非极性分子构成的物质,H2O是由极性分子构成的物质,根据相似相溶原理可知,由非极性分子构成的溶质CCl4容易溶解在由非极性分子构成的溶剂CS2中,由极性分子H2O构成的溶质不容易溶解在由非极性分子构成的溶剂CS2中,所以溶解度:CCl4>H2O,D项错误。
1
2
3
4
5
6
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:
(1)Mn位于元素周期表中第四周期_____族,基态Mn原子核外未成对电子有____个。
1
2
3
4
5
6
ⅦB
5
解析 Mn是25号元素,在元素周期表中位于第四周期ⅦB族,根据构造原理可得基态Mn原子核外电子排布式1s22s22p63s23p63d54s2,根据电子排布式可知,该原子核外的未成对电子有5个。
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为______键。NH3分子的空间构型为_________,其中N原子的杂化轨道类型为____。
1
2
3
4
5
6
配位
三角锥形
sp3
解析 MnCl2中的Mn2+上有空轨道,而NH3的N原子上有孤电子对,因此二者反应可形成络合物[Mn(NH3)6]Cl2,则新生成的化学键为配位键。
NH3中N原子的价层电子对数为 ,且N原子上有一对孤电
子对,孤电子对对成键电子对的排斥作用大于成键电子对的排斥作用,所以NH3分子的立体构型为三角锥形,其中N原子的杂化轨道类型为sp3杂化。
(3)金属锰有多种晶型,其中δ-Mn的结构为体心立方堆积,晶胞参数为a pm,
δ-Mn中锰的原子半径为_____ pm。已知阿伏加德罗常数的值为NA,δ-Mn
的理论密度ρ=_____________ g·cm-3。(列出计算式)
1
2
3
4
5
6
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为_____,其配位数为____。
1
2
3
4
5
6
+2
6
解析 在晶胞中含有的Mn原子数目为: ,含有的O原子数目
为: ,n(Mn)∶n(O)=4∶4=1∶1,所以该氧化物的化学
式为MnO,根据化合物中元素化合价代数和等于0可知,由于O的化合价为-2价,所以Mn的化合价为+2价;根据晶胞结构可知:在Mn原子上、下、前、后、左、右6个方向各有一个O原子,所以Mn原子的配位数是6。
2.(2019·江苏,21-A)Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu2+基态核外电子排布式为_________________________。
1
2
3
4
5
6
[Ar]3d9(或1s22s22p63s23p63d9)
解析 Cu为29号元素,根据构造原理可知,Cu的核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1,失去2个电子后变为Cu2+,则Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9。
(2) 的空间构型为____________(用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为_____(填元素符号)。
1
2
3
4
5
6
正四面体形
O
解析 中S没有孤电子对,价电子对数为0+4=4,故S为sp3杂化,
的空间构型为正四面体形。该配离子中Cu提供空轨道,O提供孤电子对,故配位原子为O。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:_________(填“难溶于水”或“易溶于水”)。
1
2
3
4
5
6
sp3、sp2
易溶于水
解析 该分子中形成单键的碳原子为sp3杂化,形成双键的碳原子为sp2杂化。1个抗坏血酸分子中含有4个羟基,其可以与H2O形成分子间氢键,所以抗坏血酸易溶于水。
(4)一个Cu2O晶胞(如图2)中,Cu原子的数目为____。
1
2
3
4
5
6
4
解析 根据均摊法知,该晶胞中白球个数为8× +1=2,黑球个数为4,
白球和黑球数目之比为1∶2,所以Cu为黑球,1个晶胞中含有4个Cu原子。
3.(2020·遂宁零诊)向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____________________
_______。
1
2
3
4
5
6
ds
1s22s22p63s23p63d8或
[Ar]3d8
解析 根据元素周期表,Cu位于周期表中第四周期ⅠB族,位于ds区;铜的核外电子排布式1s22s22p63s23p63d104s1,基态Cu3+失去最外层的三个电子,基态Cu3+的核外电子排布式1s22s22p63s23p63d8。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是________(用元素符号表示)。
1
2
3
4
5
6
N>O>S
解析 N、O位于同一周期,同周期从左到右,第一电离能呈现增大的趋势,但N的最外层电子处于半充满状态,故第一电离能N>O,O、S位于同一主族,同主族从上到下,第一电离能呈减小的趋势,故第一电离能O>S,故第一电离能由大到小的顺序为N>O>S。
(3)上述深蓝色晶体中含有的元素电负性最小的是_____(用元素符号表示)。
1
2
3
4
5
6
Cu
解析 深蓝色晶体为[Cu(NH3)4]SO4·H2O,含有Cu、N、H、S、O元素,非金属性越弱,电负性越小,则电负性最小的为Cu。
(4)H2O的中心原子轨道杂化类型为______杂化; 离子的立体构型是
__________,写出与 互为等电子体的一种离子______________。
1
2
3
4
5
6
sp3
正四面体形
解析 H2O的中心原子是O,根据VSEPR理论,价电子对数=成键电子
对数+孤电子对数=2+ ×(6-1×2)=4,根据杂化轨道理论,中心原
子O的杂化方式为sp3;深蓝色晶体的阴离子为 ,根据VSEPR理论,
价电子对数=成键电子对数+孤电子对数=4+ ×(6+2-4×2)=4,根
据杂化轨道理论,中心S的杂化方式为sp3,其空间构型为正四面体。
_____________________________________________________________________________________________________________。
(5)NH3分子独立存在时H—N—H键角为107°。如图为[Zn(NH3)6]2+离子的部分结构以及H—N—H键角的测量值。解释配合物中H—N—H键角变为109°28′的原因:___________________________
1
2
3
4
5
6
氨分子与Zn2+形成配合物后,
孤对电子与Zn2+成键,原孤对电子与成键电子对间的排斥作用变为成键电子对间的排斥,排斥减弱,故H—N—H键角变大
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30 ℃才凝固的低温冰,180 ℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为
_________________________g·cm-3(只列式,不计算)。
1
2
3
4
5
6
4.(1)①C60和金刚石都是碳的同素异形体,二者相比较熔点高的是______。
1
2
3
4
5
6
金刚石
解析 C60是分子晶体、金刚石是原子晶体,所以金刚石的熔点远远高于C60的熔点。
②超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与____个氮原子相连,与同一个N原子相连的Al原子构成的立体构型为____________,氮化铝晶体属于_____晶体。
4
正四面体形
原子
解析 由金刚石结构每个C原子均以sp3杂化与其他四个C原子相连形成四个共价键构成正四面体结构可推测。
③金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,呈正四面体构型。试推测Ni(CO)4的晶体类型是_________,Ni(CO)4易溶于下列______(填字母,下同)。
A.水 B.四氯化碳
C.苯 D.硫酸镍溶液
1
2
3
4
5
6
分子晶体
BC
解析 由挥发性液体可知Ni(CO)4是分子晶体,由正四面体构型可知Ni(CO)4是非极性分子。
④氯化铝在177.8 ℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_____。
A.氯化铝为共价化合物 B.氯化铝为离子化合物
C.氯化铝难溶于有机溶剂 D.Al2Cl6中存在配位键
1
2
3
4
5
6
BC
解析 由氯化铝易升华可知氯化铝是分子晶体,Al—Cl键不属于离子键应为共价键,Al原子最外层三个电子全部成键,形成三个Al—Cl σ键,无孤电子对,是非极性分子,易溶于有机溶剂,Al有空轨道,与氯原子的孤电子对能形成配位键,A、D正确。
(2)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____;若该晶胞密度为ρ g·cm-3,硒化锌的摩尔质量为M g·mol-1。NA代表阿伏加德罗常数的值,则
晶胞参数a为____________pm。
1
2
3
4
5
6
4
1
2
3
4
5
6
5.第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价层电子排布图为________________。
(2)氮元素的单质除了N2外,还有N4,则N4中N的轨道杂化方式为____。
(3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是_____(填“前者”或“后者”),原因是____________________________________________
_______________。
1
2
3
4
5
6
sp3
前者
前者形成分子间氢键,而后者形成分子内氢键,
因而前者沸点高
(4)汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中阴离子的立体构型为________。
1
2
3
4
5
6
直线形
解析 在NaN3固体中,阴离子为 ,离子中有16个价电子,所以与CO2互为等电子体,根据等电子体结构相似判断,确定NaN3中阴离子的立体构型。
(5)王水溶解黄金的反应如下:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O,产物中的H[AuCl4]是配合物,它的配位体是_____。
Cl-
解析 在配合物中,中心原子或离子含有空轨道,配位体含有孤电子对。
(6)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图,晶胞参数a=565 pm。
1
2
3
4
5
6
①砷化镓的化学式为______,镓原子的配位数为___。
②砷化镓的晶胞密度=_____________________________________g·cm-3
(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间
的距离为________pm(列式表示)。
GaAs
4
1
2
3
4
5
6
6.(2020·深圳二检)2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2和LiMnO2等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态Co原子价层电子排布式为______。
(2)已知第三电离能数据:I3(Mn)=3 246 kJ·mol-1,I3(Fe)=2 957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是_________________
_________________________________________________________________________________________________________________________________________。
1
2
3
4
5
6
3d74s2
式为3d5,达到稳定结构,不易失电子形成Mn3+,Fe2+价层电子排布式为3d6,要失去1个电子才达到稳定结构,较易形成Fe3+,故锰的第三电离能大于铁
Mn2+价层电子排布
(3)据报道,在MnO2的催化下,甲醛可被氧化成CO2,在处理含HCHO的废水或空气方面有广泛应用。HCHO中键角______CO2中键角(填“大于” “小于”或“等于”)。
1
2
3
4
5
6
小于
解析 HCHO分子呈平面结构,键角接近120°,而CO2的键角是180°。
(4)Co3+、Co2+能与NH3、H2O、SCN-等配体组成配合物。
①1 mol [Co(NH3)6]3+含_____mol σ键。
1
2
3
4
5
6
24
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式为[S==C==N]-,SCN-与金属离子形成的配离子中配位原子是____(填元素符号)。
解析 1个NH3含3个共价键,还能形成1个配位键,配位键也是σ键。
解析 SCN-中C没有孤电子对,N的电负性大于S,故S提供孤电子对。
S
③配离子在水中颜色与分裂能有关,某些水合离子的分裂能如表所示:
1
2
3
4
5
6
配离子
[Fe(H2O)6]3+
[Fe(H2O)6]2+
[Co(H2O)6]2+
[Co(H2O)6]3+
分裂能/kJ·mol-1
164
124
a
b
由此推知,a_____b(填“>”“<”或“=”),主要原因是____________
_________________。
<
[Co(H2O)6]3+
所带正电荷数较多
解析 依题意,配体相同、配位数相等的配离子,分裂能与中心离子的电荷数有关,正电荷数越多,吸引电子能力越强,分裂能越大。
(5)工业上,采用电解熔融氯化锂制备锂,钠还原TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为605 ℃、-24 ℃,它们的熔点相差很大,其主要原因是_______________________________________________________。
1
2
3
4
5
6
LiCl是离子晶体,TiCl4是分子晶体,离子键比分子间作用力强
(6)钛的化合物有2种不同结构的晶体,其晶胞如图所示。
1
2
3
4
5
6
二氧化钛晶胞(如图1)中钛原子配位数为____。氮化钛的晶胞如图2所示,图3是氮化钛的晶胞截面图。已知:NA是阿伏加德罗常数的值,氮化钛晶体
密度为d g·cm-3。氮化钛晶胞中N原子半径为_________________________pm。
6
解析 图1中,由均摊法可知
1个晶胞含2个黑球,4个白球
(2个白球在体内,4个白球在
面心),所以,黑球为钛,白
球为氧。1个钛与6个氧相连,钛的配位数为6。由图2知,1个晶胞含4个TiN(类似氯化钠晶胞),图3棱上三个粒子相切。
1
2
3
4
5
6
同课章节目录
