2021届高考化学考前三个月专项复习课件(26张ppt) 命题区间十 角度一 物质转化微观过程探析
文档属性
| 名称 | 2021届高考化学考前三个月专项复习课件(26张ppt) 命题区间十 角度一 物质转化微观过程探析 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览





文档简介
物质转化微观过程探析
角度一
1.大多数的化学反应不能一步完成,在微观上是分几步完成的,这每一步反应都叫一个基元反应。
如反应:H2O2+2Br-+2H+===Br2+2H2O,通过大量实验提出它们微观过程如下:
(3)HOBr+H++Br-===H2O+Br2
高考必备知识
2.基元反应过渡状态理论
基元反应过渡状态理论认为,基元反应在从反应物到产物的变化过程中要经历一个中间状态,这个状态称为过渡态。
AB+C―→[A…B…C]―→A+BC
反应物 过渡态 产物
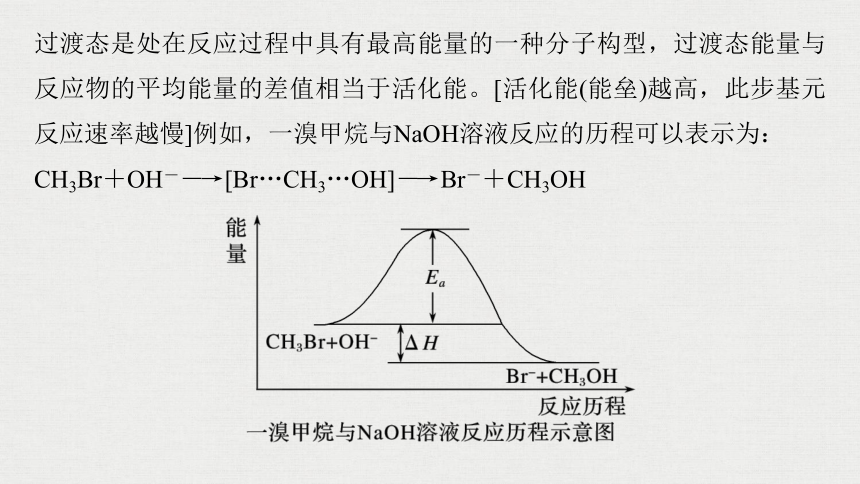
过渡态是处在反应过程中具有最高能量的一种分子构型,过渡态能量与反应物的平均能量的差值相当于活化能。[活化能(能垒)越高,此步基元反应速率越慢]例如,一溴甲烷与NaOH溶液反应的历程可以表示为:
CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
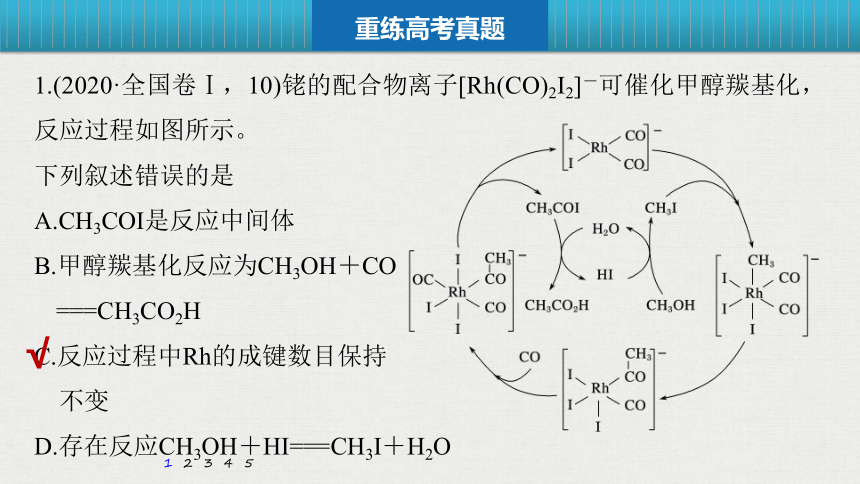
1.(2020·全国卷Ⅰ,10)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO
===CH3CO2H
C.反应过程中Rh的成键数目保持
不变
D.存在反应CH3OH+HI===CH3I+H2O
1
2
3
4
5
√
重练高考真题
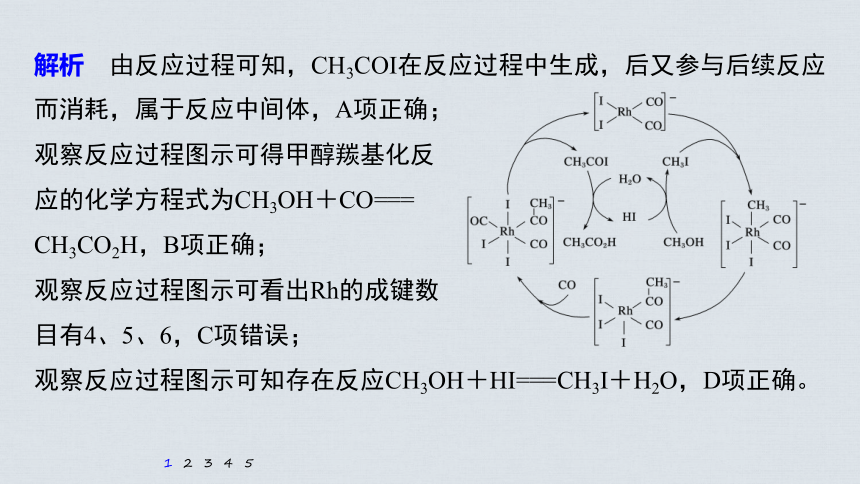
解析 由反应过程可知,CH3COI在反应过程中生成,后又参与后续反应而消耗,属于反应中间体,A项正确;
观察反应过程图示可得甲醇羰基化反
应的化学方程式为CH3OH+CO===
CH3CO2H,B项正确;
观察反应过程图示可看出Rh的成键数
目有4、5、6,C项错误;
观察反应过程图示可知存在反应CH3OH+HI===CH3I+H2O,D项正确。
1
2
3
4
5
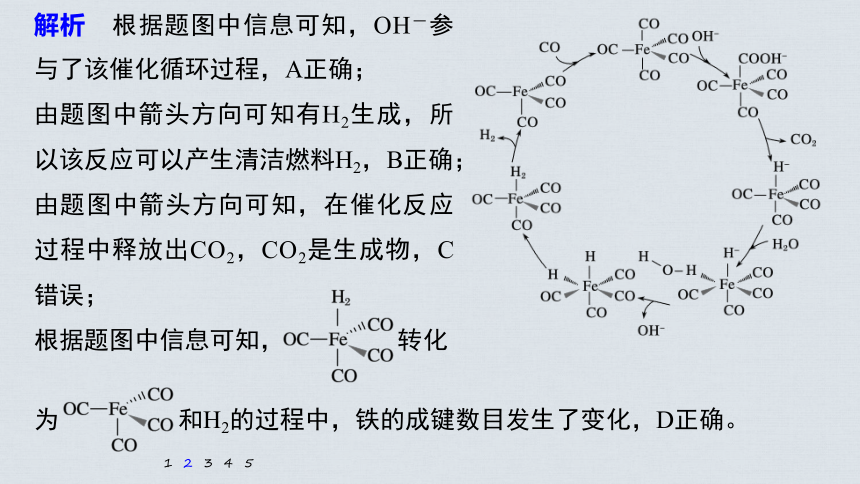
2.(2020·全国卷Ⅱ,11)据文献报道:
Fe(CO)5催化某反应的一种反应机理
如右图所示。下列叙述错误的是
A.OH-参与了该催化循环
B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2
D.该催化循环中Fe的成键数目发
生变化
1
2
3
4
5
√
为 和H2的过程中,铁的成键数目发生了变化,D正确。
解析 根据题图中信息可知,OH-参与了该催化循环过程,A正确;
由题图中箭头方向可知有H2生成,所以该反应可以产生清洁燃料H2,B正确;
由题图中箭头方向可知,在催化反应过程中释放出CO2,CO2是生成物,C错误;
根据题图中信息可知, 转化
1
2
3
4
5
3.[2020·新高考全国卷Ⅰ(山东),14改编]1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子( );第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如图所示。已知在0 ℃和40 ℃时,1,2-加成产物与1,4-加成产物的比例分别为70∶30和15∶85。下列说法正确的是
A.1,2-加成产物比1,4-加成产物稳定
B.与0 ℃相比,40 ℃时1,3-丁二烯的转化率
增大
C.从0 ℃升至40 ℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0 ℃升至40 ℃,1,2-加成正反应速率的增大程度小于其逆反应速率的
增大程度
1
2
3
4
5
√
解析 A项,由图可知1,4-加成产物的能
量比1,2-加成产物的能量低,前者更稳定,
错误;
B项,由图可知,第一步为吸热反应,第
二步为放热反应,升高温度第二步平衡逆向移动,1,3-丁二烯的转化率减小,错误;
C项,升高温度,反应速率均增大,错误;
D项,1,2-加成反应为放热反应,升高温度平衡逆向移动,所以从0 ℃升至40 ℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度,正确。
1
2
3
4
5
4.(2018·北京,7)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是
A.生成CH3COOH总反应的
原子利用率为100%
B.CH4→CH3COOH过程中,
有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
√
1
2
3
4
5
解析 催化剂不能使平衡发生移动,故不能提高反应物的平衡转化率,D错;
CH4+CO2―→CH3COOH,反应的原子利用率为100%,A对;
1
2
3
4
5
由题图可知,CH4→CH3COOH有C—H键发生断裂,B对;
反应物总能量高于生成物总能量,反应放出能量,①→②形成了C—C键,C对。
1
2
3
4
5
5.(2018·海南,12改编)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是
A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低
0.42 eV
C.氧分子的活化是O—O键的断裂与C—O
键的生成过程
D.炭黑颗粒不是大气中二氧化硫转化为三氧化硫的催化剂
√
1
2
3
4
5
解析 根据能量变化图分析,最终结果为活化氧,体系能量降低,则每活化一个氧分子放出0.29 eV能量,故A项错误;
根据能量图分析,没有水加入的反应的活
化能为E=0.75 eV,有水加入的反应的活
化能为E=0.57 eV,所以水可使氧分子活
化反应的活化能降低0.75 eV-0.57 eV=
0.18 eV,故B项错误;
根据图像分析,氧分子活化过程中O—O键断裂,生成C—O键,所以氧分子的活化是O—O键的断裂与C—O键的生成过程,故C项正确;
1
2
3
4
5
活化氧可以快速氧化SO2,而炭黑颗粒可以活化氧分子产生活化氧,所以炭黑颗粒是大气中SO2转化为SO3的催化剂,故D项错误。
1.氮及其化合物的转化过程如图所示。下列分析合理的是
A.催化剂a表面发生了极性
共价键的断裂和形成
B.N2与H2反应生成NH3的原
子利用率为100%
C.在催化剂b表面形成氮氧
键时不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
1
2
3
4
√
精练预测押题
1
2
3
4
解析 催化剂a表面是氢气和氮气反应生成氨气,催化剂a表面发生了非极性共价键的断裂和极性共价键的形成,故A项错误;
N2与H2反应生成NH3,反应物参加反
应过程中原子利用率为100%,故B项
正确;
催化剂b表面是氨气催化氧化生成NO
的反应,发生的是氧化还原反应,故C项错误;
催化剂a、b改变反应速率,不改变化学平衡,不能提高反应的平衡转化率,故D项错误。
2.(2020·淮北一模)高能固氮反应条件苛刻,计算机模拟该历程如图所示:在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的是
1
2
3
4
A.图1中,中间体1到产物1的方程式为O—O==N―→O+N==O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72 kJ·mol-1
D.由N原子和O2制NO的过程比由O原子和N2制NO的过程速率慢
1
2
3
4
√
解析 由图1可知,中间体1为O—O==N,产物1为O+N==O,所以中间体1到产物1的方程式为O—O==N―→O+N==O,故A正确;
反应的能垒越高,反应速率越慢,总反应的快慢主要由机理反应慢的一步决定,由图2可知,中间体2到过渡态4的能垒较大,为223.26 kJ·mol-1,决定了NO的生成速率很慢,故B正确;
1
2
3
4
由图2可知,反应物2到过渡态4的能垒为315.72 kJ·mol-1,过渡态4到反应物2放出能量,为逆反应的活化能,所以由O和N2制NO的能垒或活化能为315.72 kJ·mol-1,故C正确;
1
2
3
4
由图1可知,N和O2制NO的过程中各步机理反应的能垒不大,反应速率较快;由图2可知,O原子和N2制NO的过程中多步机理反应的能垒较高,中间体2到过渡态4的能垒为223.26 kJ·mol-1,导致O原子和N2制NO的反应速率较慢,所以由N原子和O2制NO的过程比由O原子和N2制NO的过程速率快,故D错误。
1
2
3
4
3.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
A.HAP能提高HCHO与
O2的反应速率
B.HCHO在反应过程中,
有C—H键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.该反应可表示为:HCHO+O2 CO2+H2O
1
2
3
4
√
1
2
3
4
解析 根据图知,HAP在第一步反应中作反应物、第二步反应中作生成物,所以为催化剂,催化剂能改变化学反应速率,故A项正确;
HCHO在反应中有C—H键的断裂和C==O键的形成,所以甲醛被氧化生成二氧化碳和水,故B项正确;
根据图知,CO2分子中的氧原子一部分来自于甲醛,故C项错误;
该反应中反应物是甲醛和氧气,生成物是二氧化碳和水,HAP为催化剂,反应方程式为HCHO+O2 CO2+H2O,故D项正确。
4.(2020·北京模拟)研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是
A.整个过程中O3作催化剂
B.反应Ⅲ的方程式为O2+O===O3
C.光化学烟雾中含甲醛、乙醛等
刺激性物质
D.反应Ⅰ、反应Ⅱ均属于氧化还原反应
1
2
3
4
√
解析 反应前后催化剂的质量和性质不发生改变,根据过程图,O3只参与反应,没有O3的生成,因此O3不是催化剂,故A说法错误;
根据过程,反应Ⅲ:O和O2参与
反应,生成O3,即反应方程式为
O2+O===O3,故B说法正确;
根据反应过程,反应Ⅱ生成甲醛
和乙醛,因此光化学烟雾中含有甲醛和乙醛等刺激性物质,故C说法正确;
反应Ⅰ:O3+3NO===3NO2,存在化合价的变化,属于氧化还原反应,反应Ⅱ丙烯与O3发生反应生成甲醛和乙醛,发生氧化还原反应,故D说法正确。
1
2
3
4
角度一
1.大多数的化学反应不能一步完成,在微观上是分几步完成的,这每一步反应都叫一个基元反应。
如反应:H2O2+2Br-+2H+===Br2+2H2O,通过大量实验提出它们微观过程如下:
(3)HOBr+H++Br-===H2O+Br2
高考必备知识
2.基元反应过渡状态理论
基元反应过渡状态理论认为,基元反应在从反应物到产物的变化过程中要经历一个中间状态,这个状态称为过渡态。
AB+C―→[A…B…C]―→A+BC
反应物 过渡态 产物
过渡态是处在反应过程中具有最高能量的一种分子构型,过渡态能量与反应物的平均能量的差值相当于活化能。[活化能(能垒)越高,此步基元反应速率越慢]例如,一溴甲烷与NaOH溶液反应的历程可以表示为:
CH3Br+OH-―→[Br…CH3…OH]―→Br-+CH3OH
1.(2020·全国卷Ⅰ,10)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO
===CH3CO2H
C.反应过程中Rh的成键数目保持
不变
D.存在反应CH3OH+HI===CH3I+H2O
1
2
3
4
5
√
重练高考真题
解析 由反应过程可知,CH3COI在反应过程中生成,后又参与后续反应而消耗,属于反应中间体,A项正确;
观察反应过程图示可得甲醇羰基化反
应的化学方程式为CH3OH+CO===
CH3CO2H,B项正确;
观察反应过程图示可看出Rh的成键数
目有4、5、6,C项错误;
观察反应过程图示可知存在反应CH3OH+HI===CH3I+H2O,D项正确。
1
2
3
4
5
2.(2020·全国卷Ⅱ,11)据文献报道:
Fe(CO)5催化某反应的一种反应机理
如右图所示。下列叙述错误的是
A.OH-参与了该催化循环
B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2
D.该催化循环中Fe的成键数目发
生变化
1
2
3
4
5
√
为 和H2的过程中,铁的成键数目发生了变化,D正确。
解析 根据题图中信息可知,OH-参与了该催化循环过程,A正确;
由题图中箭头方向可知有H2生成,所以该反应可以产生清洁燃料H2,B正确;
由题图中箭头方向可知,在催化反应过程中释放出CO2,CO2是生成物,C错误;
根据题图中信息可知, 转化
1
2
3
4
5
3.[2020·新高考全国卷Ⅰ(山东),14改编]1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子( );第二步Br-进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如图所示。已知在0 ℃和40 ℃时,1,2-加成产物与1,4-加成产物的比例分别为70∶30和15∶85。下列说法正确的是
A.1,2-加成产物比1,4-加成产物稳定
B.与0 ℃相比,40 ℃时1,3-丁二烯的转化率
增大
C.从0 ℃升至40 ℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0 ℃升至40 ℃,1,2-加成正反应速率的增大程度小于其逆反应速率的
增大程度
1
2
3
4
5
√
解析 A项,由图可知1,4-加成产物的能
量比1,2-加成产物的能量低,前者更稳定,
错误;
B项,由图可知,第一步为吸热反应,第
二步为放热反应,升高温度第二步平衡逆向移动,1,3-丁二烯的转化率减小,错误;
C项,升高温度,反应速率均增大,错误;
D项,1,2-加成反应为放热反应,升高温度平衡逆向移动,所以从0 ℃升至40 ℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度,正确。
1
2
3
4
5
4.(2018·北京,7)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是
A.生成CH3COOH总反应的
原子利用率为100%
B.CH4→CH3COOH过程中,
有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
√
1
2
3
4
5
解析 催化剂不能使平衡发生移动,故不能提高反应物的平衡转化率,D错;
CH4+CO2―→CH3COOH,反应的原子利用率为100%,A对;
1
2
3
4
5
由题图可知,CH4→CH3COOH有C—H键发生断裂,B对;
反应物总能量高于生成物总能量,反应放出能量,①→②形成了C—C键,C对。
1
2
3
4
5
5.(2018·海南,12改编)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是
A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低
0.42 eV
C.氧分子的活化是O—O键的断裂与C—O
键的生成过程
D.炭黑颗粒不是大气中二氧化硫转化为三氧化硫的催化剂
√
1
2
3
4
5
解析 根据能量变化图分析,最终结果为活化氧,体系能量降低,则每活化一个氧分子放出0.29 eV能量,故A项错误;
根据能量图分析,没有水加入的反应的活
化能为E=0.75 eV,有水加入的反应的活
化能为E=0.57 eV,所以水可使氧分子活
化反应的活化能降低0.75 eV-0.57 eV=
0.18 eV,故B项错误;
根据图像分析,氧分子活化过程中O—O键断裂,生成C—O键,所以氧分子的活化是O—O键的断裂与C—O键的生成过程,故C项正确;
1
2
3
4
5
活化氧可以快速氧化SO2,而炭黑颗粒可以活化氧分子产生活化氧,所以炭黑颗粒是大气中SO2转化为SO3的催化剂,故D项错误。
1.氮及其化合物的转化过程如图所示。下列分析合理的是
A.催化剂a表面发生了极性
共价键的断裂和形成
B.N2与H2反应生成NH3的原
子利用率为100%
C.在催化剂b表面形成氮氧
键时不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
1
2
3
4
√
精练预测押题
1
2
3
4
解析 催化剂a表面是氢气和氮气反应生成氨气,催化剂a表面发生了非极性共价键的断裂和极性共价键的形成,故A项错误;
N2与H2反应生成NH3,反应物参加反
应过程中原子利用率为100%,故B项
正确;
催化剂b表面是氨气催化氧化生成NO
的反应,发生的是氧化还原反应,故C项错误;
催化剂a、b改变反应速率,不改变化学平衡,不能提高反应的平衡转化率,故D项错误。
2.(2020·淮北一模)高能固氮反应条件苛刻,计算机模拟该历程如图所示:在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的是
1
2
3
4
A.图1中,中间体1到产物1的方程式为O—O==N―→O+N==O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72 kJ·mol-1
D.由N原子和O2制NO的过程比由O原子和N2制NO的过程速率慢
1
2
3
4
√
解析 由图1可知,中间体1为O—O==N,产物1为O+N==O,所以中间体1到产物1的方程式为O—O==N―→O+N==O,故A正确;
反应的能垒越高,反应速率越慢,总反应的快慢主要由机理反应慢的一步决定,由图2可知,中间体2到过渡态4的能垒较大,为223.26 kJ·mol-1,决定了NO的生成速率很慢,故B正确;
1
2
3
4
由图2可知,反应物2到过渡态4的能垒为315.72 kJ·mol-1,过渡态4到反应物2放出能量,为逆反应的活化能,所以由O和N2制NO的能垒或活化能为315.72 kJ·mol-1,故C正确;
1
2
3
4
由图1可知,N和O2制NO的过程中各步机理反应的能垒不大,反应速率较快;由图2可知,O原子和N2制NO的过程中多步机理反应的能垒较高,中间体2到过渡态4的能垒为223.26 kJ·mol-1,导致O原子和N2制NO的反应速率较慢,所以由N原子和O2制NO的过程比由O原子和N2制NO的过程速率快,故D错误。
1
2
3
4
3.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
A.HAP能提高HCHO与
O2的反应速率
B.HCHO在反应过程中,
有C—H键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.该反应可表示为:HCHO+O2 CO2+H2O
1
2
3
4
√
1
2
3
4
解析 根据图知,HAP在第一步反应中作反应物、第二步反应中作生成物,所以为催化剂,催化剂能改变化学反应速率,故A项正确;
HCHO在反应中有C—H键的断裂和C==O键的形成,所以甲醛被氧化生成二氧化碳和水,故B项正确;
根据图知,CO2分子中的氧原子一部分来自于甲醛,故C项错误;
该反应中反应物是甲醛和氧气,生成物是二氧化碳和水,HAP为催化剂,反应方程式为HCHO+O2 CO2+H2O,故D项正确。
4.(2020·北京模拟)研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是
A.整个过程中O3作催化剂
B.反应Ⅲ的方程式为O2+O===O3
C.光化学烟雾中含甲醛、乙醛等
刺激性物质
D.反应Ⅰ、反应Ⅱ均属于氧化还原反应
1
2
3
4
√
解析 反应前后催化剂的质量和性质不发生改变,根据过程图,O3只参与反应,没有O3的生成,因此O3不是催化剂,故A说法错误;
根据过程,反应Ⅲ:O和O2参与
反应,生成O3,即反应方程式为
O2+O===O3,故B说法正确;
根据反应过程,反应Ⅱ生成甲醛
和乙醛,因此光化学烟雾中含有甲醛和乙醛等刺激性物质,故C说法正确;
反应Ⅰ:O3+3NO===3NO2,存在化合价的变化,属于氧化还原反应,反应Ⅱ丙烯与O3发生反应生成甲醛和乙醛,发生氧化还原反应,故D说法正确。
1
2
3
4
同课章节目录
