2021届高考化学考前三个月专项复习课件(70张ppt) 题型五 “3+有机化学基础”特训
文档属性
| 名称 | 2021届高考化学考前三个月专项复习课件(70张ppt) 题型五 “3+有机化学基础”特训 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 07:12:28 | ||
图片预览





文档简介
“3+有机化学基础”特训
题型五 有机化学基础综合题研究(选考)
A组(30分钟)
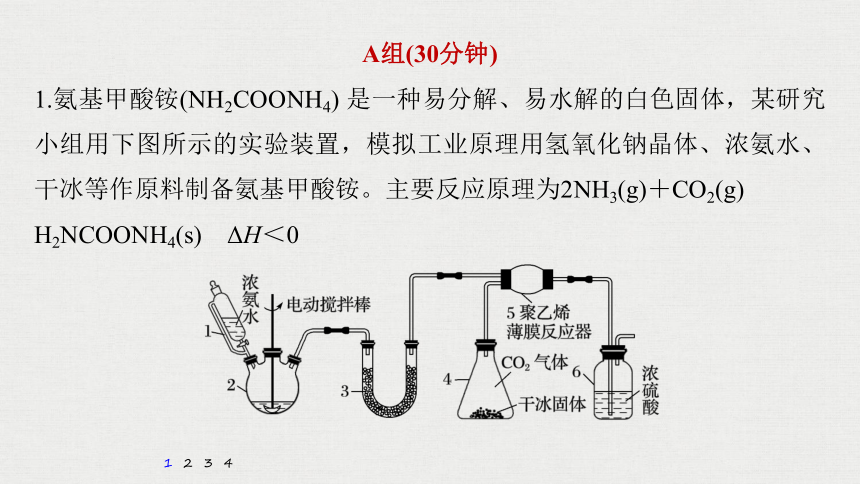
1.氨基甲酸铵(NH2COONH4) 是一种易分解、易水解的白色固体,某研究小组用下图所示的实验装置,模拟工业原理用氢氧化钠晶体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理为2NH3(g)+CO2(g)
H2NCOONH4(s) ΔH<0
1
2
3
4
解析 浓硫酸中有气泡产生,说明CO2过量,因而应加快氨气的产生速率。
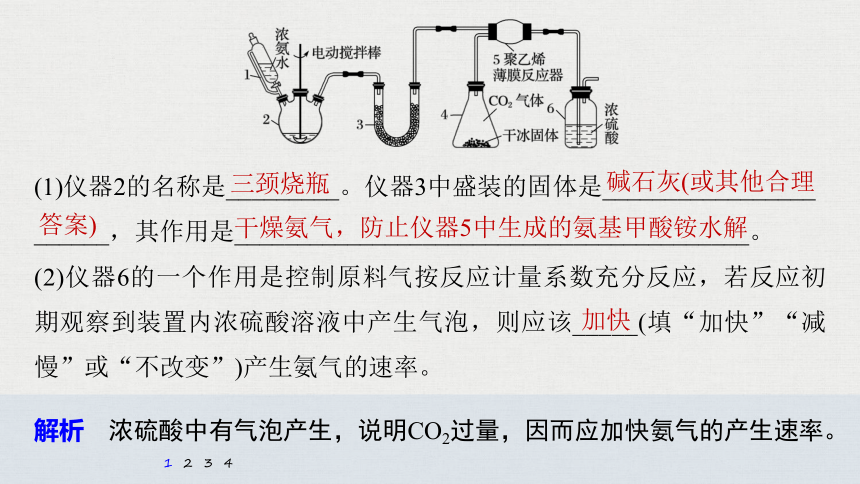
(1)仪器2的名称是_________。仪器3中盛装的固体是_________________
______,其作用是_________________________________________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸溶液中产生气泡,则应该_____(填“加快”“减慢”或“不改变”)产生氨气的速率。
1
2
3
4
三颈烧瓶
碱石灰(或其他合理
答案)
干燥氨气,防止仪器5中生成的氨基甲酸铵水解
加快
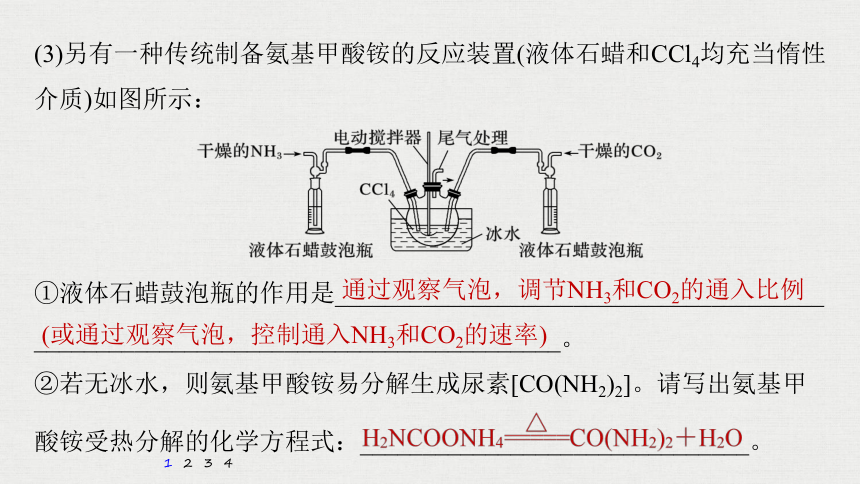
(3)另有一种传统制备氨基甲酸铵的反应装置(液体石蜡和CCl4均充当惰性介质)如图所示:
1
2
3
4
①液体石蜡鼓泡瓶的作用是_______________________________________
__________________________________________。
②若无冰水,则氨基甲酸铵易分解生成尿素[CO(NH2)2]。请写出氨基甲
酸铵受热分解的化学方程式:_______________________________。
通过观察气泡,调节NH3和CO2的通入比例
(或通过观察气泡,控制通入NH3和CO2的速率)
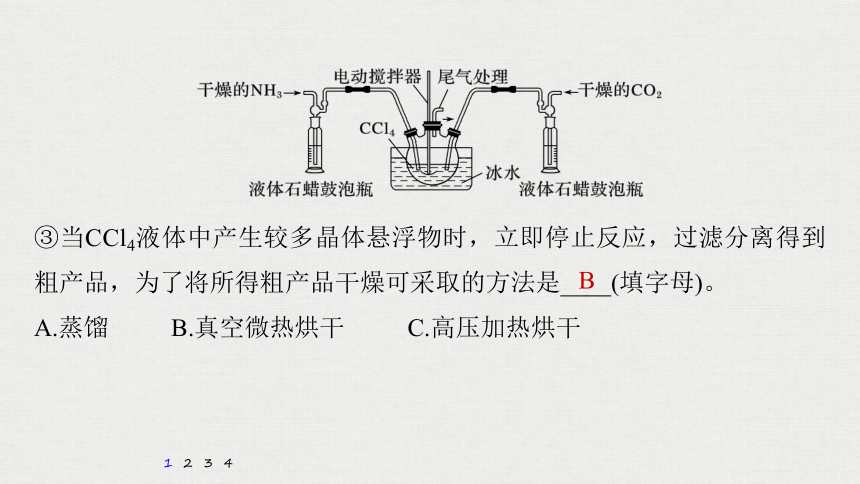
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥可采取的方法是____(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
1
2
3
4
B
2.1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2==CHCH2Cl),反应原理为
ⅰ.CH2==CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) ΔH1=-134 kJ·mol-1
ⅱ.CH2==CHCH3(g)+Cl2(g) CH2==CHCH2Cl(g)+HCl(g)
ΔH2=-102 kJ·mol-1
1
2
3
4
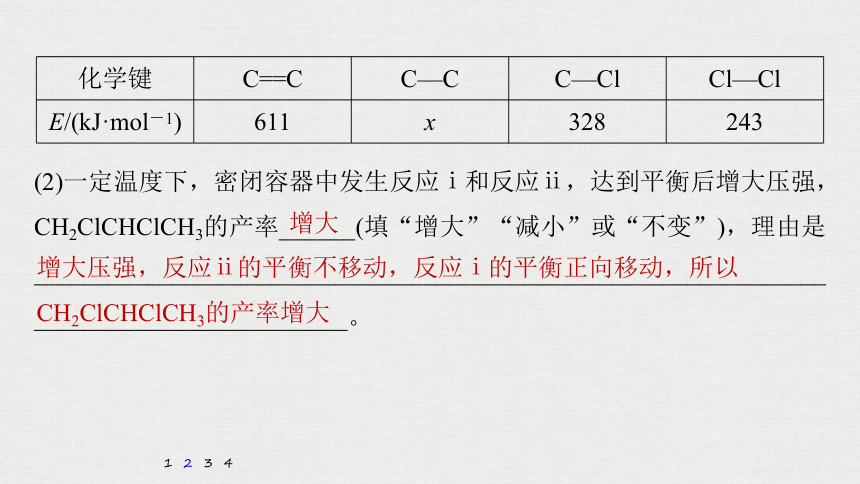
已知:相关化学键的键能数据如下表所示:
化学键
C==C
C—C
C—Cl
Cl—Cl
E/(kJ·mol-1)
611
x
328
243
请回答下列问题:
(1)由反应ⅰ计算出表中x=_____。
1
2
3
4
化学键
C==C
C—C
C—Cl
Cl—Cl
E/(kJ·mol-1)
611
x
328
243
332
解析 根据ΔH=反应物键能之和-生成物键能之和计算。
(2)一定温度下,密闭容器中发生反应ⅰ和反应ⅱ,达到平衡后增大压强,CH2ClCHClCH3的产率______(填“增大”“减小”或“不变”),理由是________________________________________________________________________________________。
1
2
3
4
增大
增大压强,反应ⅱ的平衡不移动,反应ⅰ的平衡正向移动,所以CH2ClCHClCH3的产率增大
化学键
C==C
C—C
C—Cl
Cl—Cl
E/(kJ·mol-1)
611
x
328
243
(3)T1 K时,向10 L恒容的密闭容器中充入1 mol CH2==CHCH2Cl和2 mol HCl,只发生反应CH2==CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g) ΔH3。5 min反应达到平衡,测得0~5 min内,用CH2ClCHClCH3表示的反应速率v(CH2ClCHClCH3)=0.016 mol·L-1·min-1。
①平衡时,HCl的体积分数为_______(保留三位有效数字)。
1
2
3
4
54.5%
解析 生成n(CH2ClCHClCH3)=0.016 mol·L-1·min-1×5 min×10 L=0.8 mol,
②保持其他条件不变,6 min时再向该容器中充入0.6 mol CH2==CHCH2Cl、0.2 mol HCl和0.1 mol CH2ClCHClCH3,则起始反应速率v正(HCl)_____(填“>”“<”或“=”)v逆(HCl)。
1
2
3
4
>
解析 依据上述数据计算T1 K下的平衡常数,再根据新加入各组分的量计算此时Q,通过比较Q与K的相对大小,判断反应进行的方向。
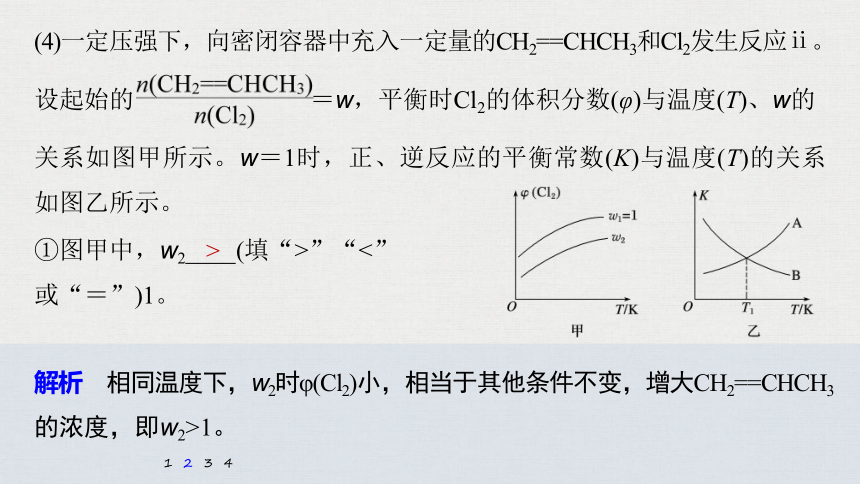
(4)一定压强下,向密闭容器中充入一定量的CH2==CHCH3和Cl2发生反应ⅱ。
设起始的 =w,平衡时Cl2的体积分数(φ)与温度(T)、w的
关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
1
2
3
4
①图甲中,w2____(填“>”“<”
或“=”)1。
>
解析 相同温度下,w2时φ(Cl2)小,相当于其他条件不变,增大CH2==CHCH3的浓度,即w2>1。
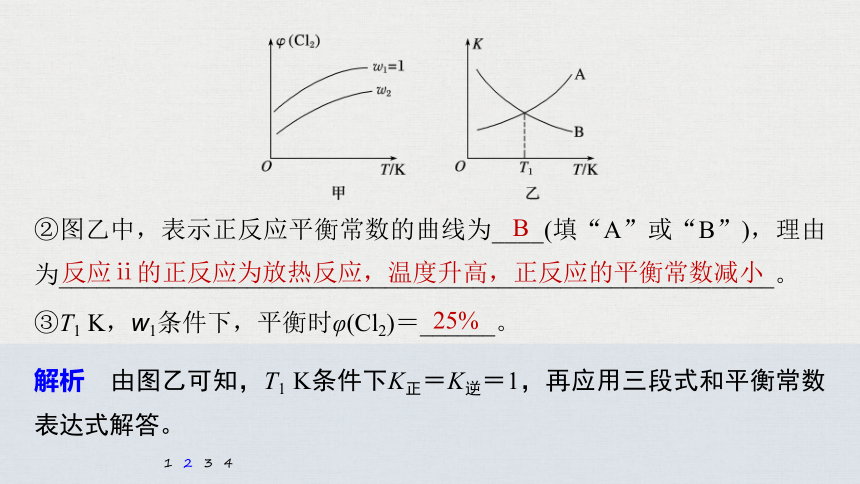
②图乙中,表示正反应平衡常数的曲线为____(填“A”或“B”),理由为_________________________________________________________。
1
2
3
4
B
反应ⅱ的正反应为放热反应,温度升高,正反应的平衡常数减小
③T1 K,w1条件下,平衡时φ(Cl2)=______。
25%
解析 由图乙可知,T1 K条件下K正=K逆=1,再应用三段式和平衡常数表达式解答。
(5)起始时向某恒容绝热容器中充入1 molCH2==CHCH3和1 mol Cl2发生反应ⅱ,达到平衡时,容器内气体压强________(填“增大”“减小”或“不变”)。
1
2
3
4
增大
解析 该反应正向放热,随反应进行,温度升高,压强增大。
3.钴是周期表第四周期Ⅷ族元素,其化合物用途广泛,利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O的工艺流程如下:
1
2
3
4
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
1
2
3
4
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
完全沉淀的pH
3.7
9.6
9.2
5.2
9.8
(1)浸出过程中加入NaClO3的目的是________________________________
_____。
将Fe2+氧化为Fe3+,利于从混合液中
除去
解析 使Fe2+完全沉淀的pH=9.6,使Co2+完全沉淀的pH=9.2,如果直接除掉Fe2+,溶液中的Co2+也会沉淀。Fe3+完全沉淀的pH=3.7,所以加NaClO3将浸出液中Fe2+氧化为Fe3+,利于从混合液中除去。
1
2
3
4
(2)请用平衡移动原理说明加Na2CO3调pH到5.2生成沉淀的原因:_____________________________________________________________________________________________________________________________________________________。
1
2
3
4
1
2
3
4
解析 加Na2CO3调pH=5.2能使Fe3+、Al3+转化成氢氧化物沉淀,原因是Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++3H2O M(OH)3+3H+, ,两者相互促进,最终生成沉淀和CO2气体。
(3)滤液Ⅱ中加入萃取剂的作用是__________。
1
2
3
4
除去Mn2+
解析 由工艺流程可知溶液中的锰离子还未除去,最终得到草酸钴,说明滤液中加入萃取剂的作用是除去锰离子。
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过
量NaF后,所得滤液中 =______。
1
2
3
4
0.7
1
2
3
4
(5)已知水钴矿中Co2O3的质量分数为83%,若取1 kg该矿石按照上述流程,理论上最多能制得CoC2O4的质量为______ g。
1
2
3
4
1 470
4.(2020·日照一模)新型冠状病毒具有较强的传染性,中科院发现大约有三十种药物可能对新型冠状病毒有效,其中山豆根等中药材中含有的黄酮类化合物可能对新型冠状肺炎有治疗作用。某黄酮类化合物G的合成路线如下图所示,分子中Ar表示芳香基。
1
2
3
4
已知:
RCOCH3+R′COCl RCOCH2COR′+HCl
回答下列问题:
(1)有机物A的名称为_______________________,A转化为B的目的是_____________________________。C中含有的官能团的名称为__________。
1
2
3
4
对苯二酚(或1,4-苯二酚)
保护酚羟基,防止与乙酰氯反应
酯基、羰基
1
2
3
4
解析 有机物A的结构简式为 ,叫做1,4-苯二酚(或对苯二酚),为了
保护酚羟基,防止与乙酰氯反应,可先将A与(CH3CO)2O发生取代反应得
到B,C的结构简式为 ,含有的官能团有酯基和羰基。
(2)D转化为E的化学方程式为_____________________________________。
E到F的转化率大约为78.6%,原因是易生成副产物X(分子中含有一个七
元环),则X的结构简式为___________,则此过程中涉及的反应的类型为___________________。
1
2
3
4
加成反应、消去反应
解析 由上述分析可知,D与试剂H发生已知信息的反应得到E,则试剂
H为ArCOCl,反应方程式为 ,E经
过加成反应和消去反应得到F,此过程易产生分子中含有一个七元环的副
产物 。
1
2
3
4
(3)某芳香族化合物K与D互为同分异构体,写出一种符合下列条件的K的
结构简式__________________________。
(已知 结构具有较强的氧化性,与还原性原子团不能共存)
①与FeCl3不发生显色反应;
②可发生水解反应和银镜反应。
1
2
3
4
(合理即可)
1
2
3
4
(4)请以丙酮(CH3COCH3)和 为原料,参照题中所给信息(其他试
剂任选),设计合成 的路线_________________________。
答案
1
2
3
4
1
2
3
4
解析 根据题干已知反应,可先向丙酮(CH3COCH3)和 中加入
K2CO3发生已知信息的反应得到 , 再发生E→F
的反应得到 ,再与溴水发生加成反应得到 ,其合
成路线见答案。
B组(30分钟)
1.(2019·天津,9)环己烯是重要的化工原料。其实验室制备流程如下:
1
2
3
4
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为______________,现象为___________。
FeCl3溶液
溶液显紫色
解析 利用苯酚遇FeCl3溶液显紫色,检验环己醇中含有的苯酚。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
1
2
3
4
①烧瓶A中进行的可逆反应化学方程式为___________________________,浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为_____(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
+H2O
ab
a项,浓硫酸易使原料炭化并产生SO2,会降低
原料利用率,正确;
b项,使用FeCl3·6H2O不产生有毒气体,污染小,
可以循环使用,符合绿色化学理念,正确;
c项,同等条件下,浓硫酸能吸收反应生成的水,
促进反应向右进行,故用浓硫酸比用FeCl3·6H2O的平衡转化率高,错误。
解析 烧瓶A中进行的可逆反应为 +H2O。
1
2
3
4
②仪器B的作用为________________。
1
2
3
4
减少环己醇蒸出
解析 仪器B的作用为冷凝回流,减少环己醇蒸出。
(3)操作2用到的玻璃仪器是_______________。
1
2
3
4
分液漏斗、烧杯
解析 操作2得到有机相和水相,为分液操作,用到的玻璃仪器有分液漏斗、烧杯。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,_______________,弃去前馏分,收集83 ℃的馏分。
解析 蒸馏实验开始时,先通冷凝水,后加热。
通冷凝水,加热
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液v mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①
②Br2+2KI===I2+2KBr
③I2+2Na2S2O3===2NaI+Na2S4O6
1
2
3
4
(5)滴定所用指示剂为_____________。样品中环己烯的质量分数为
_____________________(用字母表示)。
1
2
3
4
淀粉溶液
1
2
3
4
(6)下列情况会导致测定结果偏低的是_____(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
1
2
3
4
bc
解析 a项,样品中含有苯酚杂质,苯酚能与溴反应,会导致样品消耗的Br2偏多,剩余的Br2偏少,最终消耗的Na2S2O3溶液偏少,测定结果偏高,错误;
b项,在测定过程中部分环己烯挥发,会导致样品消耗的Br2偏少,剩余的Br2偏多,最终消耗的Na2S2O3溶液偏多,导致测定结果偏低,正确;
c项,Na2S2O3标准溶液部分被氧化,最终消耗的Na2S2O3溶液偏多,导致测定结果偏低,正确。
1
2
3
4
2.2019年1月3日,嫦娥四号成功登陆月球背面,全人类首次实现月球背面软着陆。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图所示。
1
2
3
4
1
2
3
4
已知:MgF2和CaF2难溶于水。
回答下列问题:
(1)提高浸出速率的方法有
_________________________
_________________________
______________(任写两项);
已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:________________________。
粉碎废渣、增大HF溶液的浓度、适当升高温度、充分搅拌(写两项即可)
Be+4HF===H2BeF4+H2↑
解析 加快浸出速率的方法有粉碎废渣、增大HF溶液的浓度、适当升高温度等。Be和HF溶液发生氧化还原反应生成H2BeF4和H2,据此可写出反应的化学方程式:Be+4HF===H2BeF4+H2↑。
1
2
3
4
(2)向滤液Ⅰ中加入适量CaCO3的目的是________________;
过滤所得滤渣Ⅱ的主要成分为_____(填化学式)。
1
2
3
4
除去过量的HF
CaF2
解析 向滤液Ⅰ中加入适量CaCO3的作用是除去滤液Ⅰ中过量的HF,反应会有CaF2沉淀生成,所以滤渣Ⅱ的主要成分为CaF2。
(3)在实验室进行过滤操作时用到的玻璃仪器有_____________
_______;NH4F与滤液Ⅱ发生反应的化学方程式为_________
_________________________;
已知(NH4)2BeF4易溶于水,
1
2
3
4
漏斗、烧杯、
玻璃棒
H2BeF4+
2NH4F===(NH4)2BeF4+2HF
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指_____________________________________。
解析 过滤时用到的玻璃仪器为漏斗、烧杯、玻璃棒。H2BeF4与NH4F反应生成(NH4)2BeF4和HF,对应的化学方程式为H2BeF4+2NH4F=== (NH4)2BeF4+2HF。(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,宜采用冷却结晶的方法从溶液中分离出(NH4)2BeF4晶体,具体操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
1
2
3
4
(4)“分解”过程中产生的BeF2在熔融状态下不能导电,
其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________
_________。
1
2
3
4
镁的还原
性比铍强
解析 BeF2在熔融状态下不能导电,说明其为共价化合物,电子式为
。同主族元素从上到下,金属性逐渐增强,单质还原性也逐渐增强,Mg和Be位于同一主族,还原性:Mg>Be,故可以用镁制备金属铍。
3.(2020·淄博一模)Ⅰ.CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
iii.CO(g)+2H2(g) CH3OH(g) ΔH3
回答下列问题:
(1)ΔH3=________kJ·mol-1。
1
2
3
4
-90.6
解析 i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
根据盖斯定律 i-ii得CO(g)+2H2(g) CH3OH(g) ΔH3=-49.4 kJ·mol-1 -41.2 kJ·mol-1=-90.6 kJ·mol-1。
1
2
3
4
(2)已知反应i的速率方程为v正=k正·x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·
x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。其物
质的量分数平衡常数Kx=____(以k正、k逆表示)。
1
2
3
4
即k正·x(CO2)·x3(H2) =k逆·x(CH3OH)·x(H2O),
(3)5 MPa时,往某密闭容器中按投料比n(H2)∶
n(CO2)=3∶1充入H2和CO2。反应达平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。
1
2
3
4
①图中Y代表________(填化学式)。
CH3OH
解析 升高温度,反应i逆向移动、反应iii逆向移动,所以甲醇的含量明显减小;反应ii正向移动,CO含量增大,水的含量变化小于甲醇,故图中Y代表CH3OH、X代表CO、Z代表H2O;
②250 ℃时反应ii的Kx_____1(填“>”“<”或“=”)。
1
2
3
4
③下列措施中,一定无法提高甲醇产率的
是______(填字母)。
A.加入适量CO B.使用催化剂
C.循环利用原料气 D.升高温度
1
2
3
4
BD
解析 加入适量CO ,反应iii正向移动,能提高甲醇的产率,故不选A;
使用催化剂,平衡不移动,一定不能提高甲醇的产率,故选B;
循环利用原料气,提高原料利用率,能提高甲醇的产率,故不选C;
升高温度,反应i、iii均逆向移动,一定不能提高甲醇的产率,故选D。
(4)在10 MPa下将H2、CO按一定比例投料,平衡状态时各组分的物质的量与温度的关系如图2所示。曲线b代表的物质为_____(填化学式)。温度
为700 K时,该反应的平衡常数Kp=___(MPa)-2
(结果用分数表示)。
1
2
3
4
H2
解析 升高温度,反应iii逆向移动,H2、CO按2∶1的比例增大,CH3OH的物质的量减小,故图中a代表CH3OH、c代表CO、b代表H2;
1
2
3
4
温度为700 K时,该反应的平衡常数Kp=
Ⅱ.在恒容容器中,使用某种催化剂对反应NO2(g)+SO2(g) SO3(g)+NO(g) ΔH<0进行相关实验探究。改变投料比[n(SO2)∶n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]实验结果如图3所示。
已知:KR=16,KZ=1。
(5)如果要将图3中R点的平衡状态改变
为X点的平衡状态。应采取的措施是
_________。
1
2
3
4
升高温度
解析 图中R点的平衡状态改变为X点的平衡状态,α(SO2)减小,平衡逆向移动,所以改变的条件可以是升高温度。
1
2
3
4
(6)通过计算确定图中R、X、Y、Z四点中温度相等的点是_______。
1
2
3
4
X和Z
解析 X点:
NO2(g)+SO2(g) SO3(g)+NO(g)
开始 a a 0 0
转化 0.5a 0.5a 0.5a 0.5a
平衡 0.5a 0.5a 0.5a 0.5a
1
2
3
4
Y点:
NO2(g)+SO2(g) SO3(g)+NO(g)
开始 a 2a 0 0
转化 0.5a 0.5a 0.5a 0.5a
平衡 0.5a 1.5a 0.5a 0.5a
1
2
3
4
KR=16,KZ=1;
所以图中R、X、Y、Z四点中温度相等的点是X、Z。
4.(2020·烟台一模)2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:
已知:醛基在一定条件下可以还原成甲基。
1
2
3
4
回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为____________,A与新制氢氧化铜悬浊液反应的化
学方程式为__________________
____________________________________。
1
2
3
4
醛基、醚键
+3H2O
1
2
3
4
解析 化合物A的结构简式为
,其含氧官能团有醚键和醛基,A中的醛基可以与新制氢氧化铜悬浊液反应生成Cu2O红色沉淀,方程式为
+3H2O。
(2)C的结构简式为________,D与E之间的关系为___________。
1
2
3
4
同分异构体
解析 由分析可知,C的结构简式
为 ,D与E的分子式相同,结构不同,互为同分异构体。
(3)反应⑦的反应类型为_________;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为___________________。
1
2
3
4
加成反应
CH3COCH2CH==CH2
解析 反应⑦为G发生加成反应生成H,反应⑤为E在浓硫酸、加热的条件下反应生成F[CH3CO(CH2)3Br],若温度过高会发生消去反应生成CH3COCH2CH==CH2。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有____种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为___________。
1
2
3
4
13
2-甲基丁酸
解析 有机物E的同分异构体中,属于羧酸和酯的有CH3CH2CH2CH2COOH、
、 、 、 、 、
、 、 、 、 、
、 ,共13种,其中是羧酸且含有手性碳原子为
,其名称为2-甲基丁酸。
1
2
3
4
(5)请设计合成路线以2-丙醇和必要的试剂合成2-丙胺[CH3CH(NH2)CH3]:
_______________________________
_______________________________
_______________________________
(用箭头表示转化关系,箭头上注明试剂)。
1
2
3
4
CH3CH(OH)CH3
CH3COCH3
CH3CH(NH2)CH3
1
2
3
4
解析 结合题干合成信息,可将2-丙醇催化氧化制得CH3COCH3,再与NH3、无水乙醇反应得到
,再加入无水乙醇发
生消去反应生成 ,
最后与H2发生加成反应得到2-丙胺[CH3CH(NH2)CH3]。
题型五 有机化学基础综合题研究(选考)
A组(30分钟)
1.氨基甲酸铵(NH2COONH4) 是一种易分解、易水解的白色固体,某研究小组用下图所示的实验装置,模拟工业原理用氢氧化钠晶体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理为2NH3(g)+CO2(g)
H2NCOONH4(s) ΔH<0
1
2
3
4
解析 浓硫酸中有气泡产生,说明CO2过量,因而应加快氨气的产生速率。
(1)仪器2的名称是_________。仪器3中盛装的固体是_________________
______,其作用是_________________________________________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸溶液中产生气泡,则应该_____(填“加快”“减慢”或“不改变”)产生氨气的速率。
1
2
3
4
三颈烧瓶
碱石灰(或其他合理
答案)
干燥氨气,防止仪器5中生成的氨基甲酸铵水解
加快
(3)另有一种传统制备氨基甲酸铵的反应装置(液体石蜡和CCl4均充当惰性介质)如图所示:
1
2
3
4
①液体石蜡鼓泡瓶的作用是_______________________________________
__________________________________________。
②若无冰水,则氨基甲酸铵易分解生成尿素[CO(NH2)2]。请写出氨基甲
酸铵受热分解的化学方程式:_______________________________。
通过观察气泡,调节NH3和CO2的通入比例
(或通过观察气泡,控制通入NH3和CO2的速率)
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥可采取的方法是____(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
1
2
3
4
B
2.1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2==CHCH2Cl),反应原理为
ⅰ.CH2==CHCH3(g)+Cl2(g) CH2ClCHClCH3(g) ΔH1=-134 kJ·mol-1
ⅱ.CH2==CHCH3(g)+Cl2(g) CH2==CHCH2Cl(g)+HCl(g)
ΔH2=-102 kJ·mol-1
1
2
3
4
已知:相关化学键的键能数据如下表所示:
化学键
C==C
C—C
C—Cl
Cl—Cl
E/(kJ·mol-1)
611
x
328
243
请回答下列问题:
(1)由反应ⅰ计算出表中x=_____。
1
2
3
4
化学键
C==C
C—C
C—Cl
Cl—Cl
E/(kJ·mol-1)
611
x
328
243
332
解析 根据ΔH=反应物键能之和-生成物键能之和计算。
(2)一定温度下,密闭容器中发生反应ⅰ和反应ⅱ,达到平衡后增大压强,CH2ClCHClCH3的产率______(填“增大”“减小”或“不变”),理由是________________________________________________________________________________________。
1
2
3
4
增大
增大压强,反应ⅱ的平衡不移动,反应ⅰ的平衡正向移动,所以CH2ClCHClCH3的产率增大
化学键
C==C
C—C
C—Cl
Cl—Cl
E/(kJ·mol-1)
611
x
328
243
(3)T1 K时,向10 L恒容的密闭容器中充入1 mol CH2==CHCH2Cl和2 mol HCl,只发生反应CH2==CHCH2Cl(g)+HCl(g) CH2ClCHClCH3(g) ΔH3。5 min反应达到平衡,测得0~5 min内,用CH2ClCHClCH3表示的反应速率v(CH2ClCHClCH3)=0.016 mol·L-1·min-1。
①平衡时,HCl的体积分数为_______(保留三位有效数字)。
1
2
3
4
54.5%
解析 生成n(CH2ClCHClCH3)=0.016 mol·L-1·min-1×5 min×10 L=0.8 mol,
②保持其他条件不变,6 min时再向该容器中充入0.6 mol CH2==CHCH2Cl、0.2 mol HCl和0.1 mol CH2ClCHClCH3,则起始反应速率v正(HCl)_____(填“>”“<”或“=”)v逆(HCl)。
1
2
3
4
>
解析 依据上述数据计算T1 K下的平衡常数,再根据新加入各组分的量计算此时Q,通过比较Q与K的相对大小,判断反应进行的方向。
(4)一定压强下,向密闭容器中充入一定量的CH2==CHCH3和Cl2发生反应ⅱ。
设起始的 =w,平衡时Cl2的体积分数(φ)与温度(T)、w的
关系如图甲所示。w=1时,正、逆反应的平衡常数(K)与温度(T)的关系如图乙所示。
1
2
3
4
①图甲中,w2____(填“>”“<”
或“=”)1。
>
解析 相同温度下,w2时φ(Cl2)小,相当于其他条件不变,增大CH2==CHCH3的浓度,即w2>1。
②图乙中,表示正反应平衡常数的曲线为____(填“A”或“B”),理由为_________________________________________________________。
1
2
3
4
B
反应ⅱ的正反应为放热反应,温度升高,正反应的平衡常数减小
③T1 K,w1条件下,平衡时φ(Cl2)=______。
25%
解析 由图乙可知,T1 K条件下K正=K逆=1,再应用三段式和平衡常数表达式解答。
(5)起始时向某恒容绝热容器中充入1 molCH2==CHCH3和1 mol Cl2发生反应ⅱ,达到平衡时,容器内气体压强________(填“增大”“减小”或“不变”)。
1
2
3
4
增大
解析 该反应正向放热,随反应进行,温度升高,压强增大。
3.钴是周期表第四周期Ⅷ族元素,其化合物用途广泛,利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O的工艺流程如下:
1
2
3
4
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
1
2
3
4
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
完全沉淀的pH
3.7
9.6
9.2
5.2
9.8
(1)浸出过程中加入NaClO3的目的是________________________________
_____。
将Fe2+氧化为Fe3+,利于从混合液中
除去
解析 使Fe2+完全沉淀的pH=9.6,使Co2+完全沉淀的pH=9.2,如果直接除掉Fe2+,溶液中的Co2+也会沉淀。Fe3+完全沉淀的pH=3.7,所以加NaClO3将浸出液中Fe2+氧化为Fe3+,利于从混合液中除去。
1
2
3
4
(2)请用平衡移动原理说明加Na2CO3调pH到5.2生成沉淀的原因:_____________________________________________________________________________________________________________________________________________________。
1
2
3
4
1
2
3
4
解析 加Na2CO3调pH=5.2能使Fe3+、Al3+转化成氢氧化物沉淀,原因是Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++3H2O M(OH)3+3H+, ,两者相互促进,最终生成沉淀和CO2气体。
(3)滤液Ⅱ中加入萃取剂的作用是__________。
1
2
3
4
除去Mn2+
解析 由工艺流程可知溶液中的锰离子还未除去,最终得到草酸钴,说明滤液中加入萃取剂的作用是除去锰离子。
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过
量NaF后,所得滤液中 =______。
1
2
3
4
0.7
1
2
3
4
(5)已知水钴矿中Co2O3的质量分数为83%,若取1 kg该矿石按照上述流程,理论上最多能制得CoC2O4的质量为______ g。
1
2
3
4
1 470
4.(2020·日照一模)新型冠状病毒具有较强的传染性,中科院发现大约有三十种药物可能对新型冠状病毒有效,其中山豆根等中药材中含有的黄酮类化合物可能对新型冠状肺炎有治疗作用。某黄酮类化合物G的合成路线如下图所示,分子中Ar表示芳香基。
1
2
3
4
已知:
RCOCH3+R′COCl RCOCH2COR′+HCl
回答下列问题:
(1)有机物A的名称为_______________________,A转化为B的目的是_____________________________。C中含有的官能团的名称为__________。
1
2
3
4
对苯二酚(或1,4-苯二酚)
保护酚羟基,防止与乙酰氯反应
酯基、羰基
1
2
3
4
解析 有机物A的结构简式为 ,叫做1,4-苯二酚(或对苯二酚),为了
保护酚羟基,防止与乙酰氯反应,可先将A与(CH3CO)2O发生取代反应得
到B,C的结构简式为 ,含有的官能团有酯基和羰基。
(2)D转化为E的化学方程式为_____________________________________。
E到F的转化率大约为78.6%,原因是易生成副产物X(分子中含有一个七
元环),则X的结构简式为___________,则此过程中涉及的反应的类型为___________________。
1
2
3
4
加成反应、消去反应
解析 由上述分析可知,D与试剂H发生已知信息的反应得到E,则试剂
H为ArCOCl,反应方程式为 ,E经
过加成反应和消去反应得到F,此过程易产生分子中含有一个七元环的副
产物 。
1
2
3
4
(3)某芳香族化合物K与D互为同分异构体,写出一种符合下列条件的K的
结构简式__________________________。
(已知 结构具有较强的氧化性,与还原性原子团不能共存)
①与FeCl3不发生显色反应;
②可发生水解反应和银镜反应。
1
2
3
4
(合理即可)
1
2
3
4
(4)请以丙酮(CH3COCH3)和 为原料,参照题中所给信息(其他试
剂任选),设计合成 的路线_________________________。
答案
1
2
3
4
1
2
3
4
解析 根据题干已知反应,可先向丙酮(CH3COCH3)和 中加入
K2CO3发生已知信息的反应得到 , 再发生E→F
的反应得到 ,再与溴水发生加成反应得到 ,其合
成路线见答案。
B组(30分钟)
1.(2019·天津,9)环己烯是重要的化工原料。其实验室制备流程如下:
1
2
3
4
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为______________,现象为___________。
FeCl3溶液
溶液显紫色
解析 利用苯酚遇FeCl3溶液显紫色,检验环己醇中含有的苯酚。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
1
2
3
4
①烧瓶A中进行的可逆反应化学方程式为___________________________,浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为_____(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
+H2O
ab
a项,浓硫酸易使原料炭化并产生SO2,会降低
原料利用率,正确;
b项,使用FeCl3·6H2O不产生有毒气体,污染小,
可以循环使用,符合绿色化学理念,正确;
c项,同等条件下,浓硫酸能吸收反应生成的水,
促进反应向右进行,故用浓硫酸比用FeCl3·6H2O的平衡转化率高,错误。
解析 烧瓶A中进行的可逆反应为 +H2O。
1
2
3
4
②仪器B的作用为________________。
1
2
3
4
减少环己醇蒸出
解析 仪器B的作用为冷凝回流,减少环己醇蒸出。
(3)操作2用到的玻璃仪器是_______________。
1
2
3
4
分液漏斗、烧杯
解析 操作2得到有机相和水相,为分液操作,用到的玻璃仪器有分液漏斗、烧杯。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,_______________,弃去前馏分,收集83 ℃的馏分。
解析 蒸馏实验开始时,先通冷凝水,后加热。
通冷凝水,加热
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液v mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①
②Br2+2KI===I2+2KBr
③I2+2Na2S2O3===2NaI+Na2S4O6
1
2
3
4
(5)滴定所用指示剂为_____________。样品中环己烯的质量分数为
_____________________(用字母表示)。
1
2
3
4
淀粉溶液
1
2
3
4
(6)下列情况会导致测定结果偏低的是_____(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
1
2
3
4
bc
解析 a项,样品中含有苯酚杂质,苯酚能与溴反应,会导致样品消耗的Br2偏多,剩余的Br2偏少,最终消耗的Na2S2O3溶液偏少,测定结果偏高,错误;
b项,在测定过程中部分环己烯挥发,会导致样品消耗的Br2偏少,剩余的Br2偏多,最终消耗的Na2S2O3溶液偏多,导致测定结果偏低,正确;
c项,Na2S2O3标准溶液部分被氧化,最终消耗的Na2S2O3溶液偏多,导致测定结果偏低,正确。
1
2
3
4
2.2019年1月3日,嫦娥四号成功登陆月球背面,全人类首次实现月球背面软着陆。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图所示。
1
2
3
4
1
2
3
4
已知:MgF2和CaF2难溶于水。
回答下列问题:
(1)提高浸出速率的方法有
_________________________
_________________________
______________(任写两项);
已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:________________________。
粉碎废渣、增大HF溶液的浓度、适当升高温度、充分搅拌(写两项即可)
Be+4HF===H2BeF4+H2↑
解析 加快浸出速率的方法有粉碎废渣、增大HF溶液的浓度、适当升高温度等。Be和HF溶液发生氧化还原反应生成H2BeF4和H2,据此可写出反应的化学方程式:Be+4HF===H2BeF4+H2↑。
1
2
3
4
(2)向滤液Ⅰ中加入适量CaCO3的目的是________________;
过滤所得滤渣Ⅱ的主要成分为_____(填化学式)。
1
2
3
4
除去过量的HF
CaF2
解析 向滤液Ⅰ中加入适量CaCO3的作用是除去滤液Ⅰ中过量的HF,反应会有CaF2沉淀生成,所以滤渣Ⅱ的主要成分为CaF2。
(3)在实验室进行过滤操作时用到的玻璃仪器有_____________
_______;NH4F与滤液Ⅱ发生反应的化学方程式为_________
_________________________;
已知(NH4)2BeF4易溶于水,
1
2
3
4
漏斗、烧杯、
玻璃棒
H2BeF4+
2NH4F===(NH4)2BeF4+2HF
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指_____________________________________。
解析 过滤时用到的玻璃仪器为漏斗、烧杯、玻璃棒。H2BeF4与NH4F反应生成(NH4)2BeF4和HF,对应的化学方程式为H2BeF4+2NH4F=== (NH4)2BeF4+2HF。(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,宜采用冷却结晶的方法从溶液中分离出(NH4)2BeF4晶体,具体操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
1
2
3
4
(4)“分解”过程中产生的BeF2在熔融状态下不能导电,
其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________
_________。
1
2
3
4
镁的还原
性比铍强
解析 BeF2在熔融状态下不能导电,说明其为共价化合物,电子式为
。同主族元素从上到下,金属性逐渐增强,单质还原性也逐渐增强,Mg和Be位于同一主族,还原性:Mg>Be,故可以用镁制备金属铍。
3.(2020·淄博一模)Ⅰ.CO2催化加氢制甲醇是极具前景的资源化研究领域,主要反应有:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
iii.CO(g)+2H2(g) CH3OH(g) ΔH3
回答下列问题:
(1)ΔH3=________kJ·mol-1。
1
2
3
4
-90.6
解析 i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.4 kJ·mol-1
ii.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
根据盖斯定律 i-ii得CO(g)+2H2(g) CH3OH(g) ΔH3=-49.4 kJ·mol-1 -41.2 kJ·mol-1=-90.6 kJ·mol-1。
1
2
3
4
(2)已知反应i的速率方程为v正=k正·x(CO2)·x3(H2),v逆=k逆·x(CH3OH)·
x(H2O),k正、k逆均为速率常数且只与温度有关,x为物质的量分数。其物
质的量分数平衡常数Kx=____(以k正、k逆表示)。
1
2
3
4
即k正·x(CO2)·x3(H2) =k逆·x(CH3OH)·x(H2O),
(3)5 MPa时,往某密闭容器中按投料比n(H2)∶
n(CO2)=3∶1充入H2和CO2。反应达平衡时,测得各组分的物质的量分数随温度变化的曲线如图1所示。
1
2
3
4
①图中Y代表________(填化学式)。
CH3OH
解析 升高温度,反应i逆向移动、反应iii逆向移动,所以甲醇的含量明显减小;反应ii正向移动,CO含量增大,水的含量变化小于甲醇,故图中Y代表CH3OH、X代表CO、Z代表H2O;
②250 ℃时反应ii的Kx_____1(填“>”“<”或“=”)。
1
2
3
4
③下列措施中,一定无法提高甲醇产率的
是______(填字母)。
A.加入适量CO B.使用催化剂
C.循环利用原料气 D.升高温度
1
2
3
4
BD
解析 加入适量CO ,反应iii正向移动,能提高甲醇的产率,故不选A;
使用催化剂,平衡不移动,一定不能提高甲醇的产率,故选B;
循环利用原料气,提高原料利用率,能提高甲醇的产率,故不选C;
升高温度,反应i、iii均逆向移动,一定不能提高甲醇的产率,故选D。
(4)在10 MPa下将H2、CO按一定比例投料,平衡状态时各组分的物质的量与温度的关系如图2所示。曲线b代表的物质为_____(填化学式)。温度
为700 K时,该反应的平衡常数Kp=___(MPa)-2
(结果用分数表示)。
1
2
3
4
H2
解析 升高温度,反应iii逆向移动,H2、CO按2∶1的比例增大,CH3OH的物质的量减小,故图中a代表CH3OH、c代表CO、b代表H2;
1
2
3
4
温度为700 K时,该反应的平衡常数Kp=
Ⅱ.在恒容容器中,使用某种催化剂对反应NO2(g)+SO2(g) SO3(g)+NO(g) ΔH<0进行相关实验探究。改变投料比[n(SO2)∶n(NO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定SO2的平衡转化率[α(SO2)]实验结果如图3所示。
已知:KR=16,KZ=1。
(5)如果要将图3中R点的平衡状态改变
为X点的平衡状态。应采取的措施是
_________。
1
2
3
4
升高温度
解析 图中R点的平衡状态改变为X点的平衡状态,α(SO2)减小,平衡逆向移动,所以改变的条件可以是升高温度。
1
2
3
4
(6)通过计算确定图中R、X、Y、Z四点中温度相等的点是_______。
1
2
3
4
X和Z
解析 X点:
NO2(g)+SO2(g) SO3(g)+NO(g)
开始 a a 0 0
转化 0.5a 0.5a 0.5a 0.5a
平衡 0.5a 0.5a 0.5a 0.5a
1
2
3
4
Y点:
NO2(g)+SO2(g) SO3(g)+NO(g)
开始 a 2a 0 0
转化 0.5a 0.5a 0.5a 0.5a
平衡 0.5a 1.5a 0.5a 0.5a
1
2
3
4
KR=16,KZ=1;
所以图中R、X、Y、Z四点中温度相等的点是X、Z。
4.(2020·烟台一模)2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:
已知:醛基在一定条件下可以还原成甲基。
1
2
3
4
回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为____________,A与新制氢氧化铜悬浊液反应的化
学方程式为__________________
____________________________________。
1
2
3
4
醛基、醚键
+3H2O
1
2
3
4
解析 化合物A的结构简式为
,其含氧官能团有醚键和醛基,A中的醛基可以与新制氢氧化铜悬浊液反应生成Cu2O红色沉淀,方程式为
+3H2O。
(2)C的结构简式为________,D与E之间的关系为___________。
1
2
3
4
同分异构体
解析 由分析可知,C的结构简式
为 ,D与E的分子式相同,结构不同,互为同分异构体。
(3)反应⑦的反应类型为_________;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为___________________。
1
2
3
4
加成反应
CH3COCH2CH==CH2
解析 反应⑦为G发生加成反应生成H,反应⑤为E在浓硫酸、加热的条件下反应生成F[CH3CO(CH2)3Br],若温度过高会发生消去反应生成CH3COCH2CH==CH2。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有____种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为___________。
1
2
3
4
13
2-甲基丁酸
解析 有机物E的同分异构体中,属于羧酸和酯的有CH3CH2CH2CH2COOH、
、 、 、 、 、
、 、 、 、 、
、 ,共13种,其中是羧酸且含有手性碳原子为
,其名称为2-甲基丁酸。
1
2
3
4
(5)请设计合成路线以2-丙醇和必要的试剂合成2-丙胺[CH3CH(NH2)CH3]:
_______________________________
_______________________________
_______________________________
(用箭头表示转化关系,箭头上注明试剂)。
1
2
3
4
CH3CH(OH)CH3
CH3COCH3
CH3CH(NH2)CH3
1
2
3
4
解析 结合题干合成信息,可将2-丙醇催化氧化制得CH3COCH3,再与NH3、无水乙醇反应得到
,再加入无水乙醇发
生消去反应生成 ,
最后与H2发生加成反应得到2-丙胺[CH3CH(NH2)CH3]。
同课章节目录
