2021届高考化学考前三个月专项复习课件(44张ppt)命题区间四 角度二 元素周期律和周期表的综合应用
文档属性
| 名称 | 2021届高考化学考前三个月专项复习课件(44张ppt)命题区间四 角度二 元素周期律和周期表的综合应用 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览









文档简介
元素周期律和周期表的综合应用
角度二
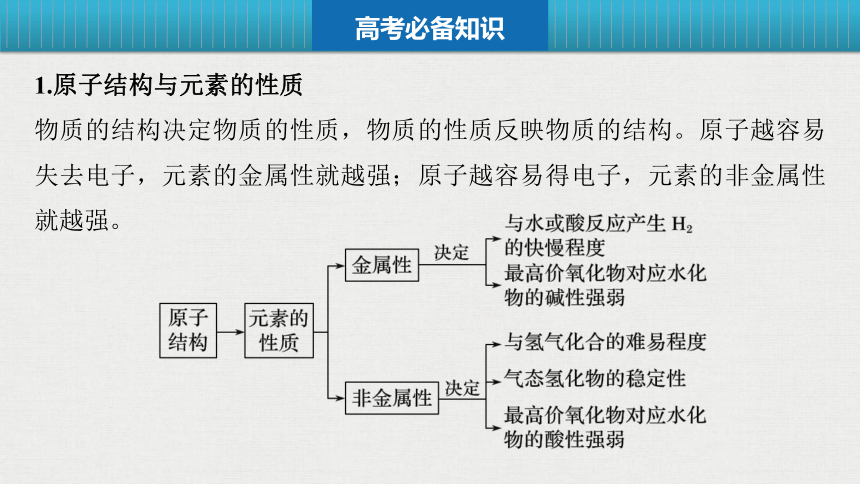
1.原子结构与元素的性质
物质的结构决定物质的性质,物质的性质反映物质的结构。原子越容易失去电子,元素的金属性就越强;原子越容易得电子,元素的非金属性就越强。
高考必备知识
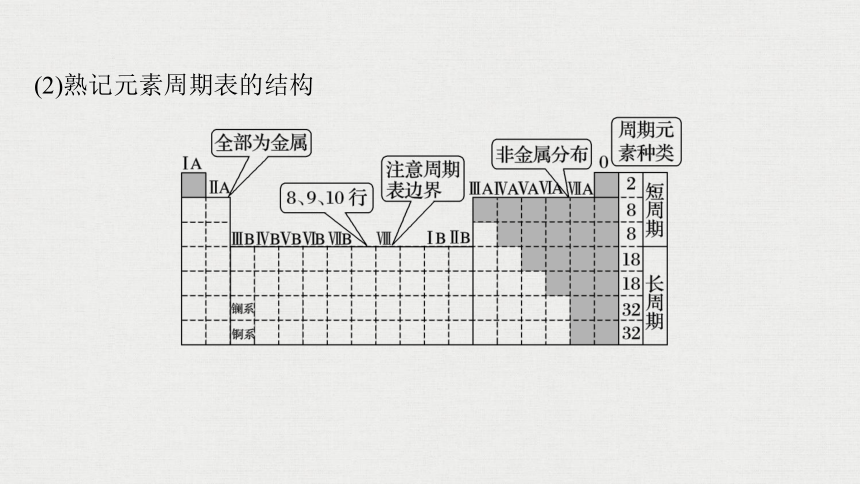
2.元素周期表
(1)必记三个重要关系
①电子层数=周期序数
②最外层电子数=主族序数=元素的最高正化合价(O、F除外)
③最高正化合价+|最低负化合价|=8(H、O、F除外)
(2)熟记元素周期表的结构
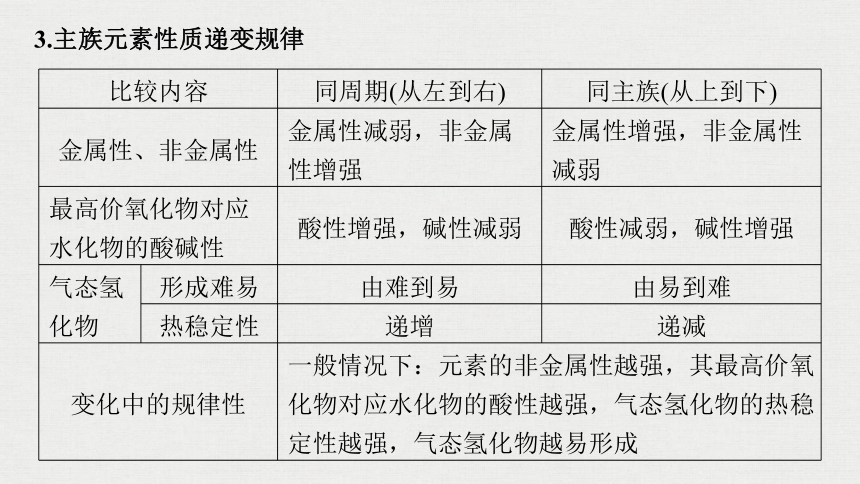
3.主族元素性质递变规律
比较内容
同周期(从左到右)
同主族(从上到下)
金属性、非金属性
金属性减弱,非金属性增强
金属性增强,非金属性减弱
最高价氧化物对应水化物的酸碱性
酸性增强,碱性减弱
酸性减弱,碱性增强
气态氢化物
形成难易
由难到易
由易到难
热稳定性
递增
递减
变化中的规律性
一般情况下:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,气态氢化物的热稳定性越强,气态氢化物越易形成
4.微粒半径大小比较的规律
“三看法”比较微粒半径大小:
“一看”电子层数:当电子层数不同时,电子层数越多,半径越大。
“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
1.(2020·全国卷Ⅱ,13)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
1
2
3
4
5
√
重练高考真题
解析 根据图中信息可得,Z为Na,W为H,结合题给信息“W、X、Y、Z的原子序数依次增大、且总和为24”可推知,X为B,Y为N。H、B、N三种非金属元素之间形成的化学键均为共价键,A正确;
Na既可以与水反应,也可以和甲醇反应,B正确;
N的最高价氧化物对应的水化物为硝酸,C正确;
三氟化硼中硼原子最外层有3个电子,与氟原子之
间形成3个共价键,即最外层共6个电子,不满足8电子稳定结构,D错误。
1
2
3
4
5
2.(2020·全国卷Ⅲ,13)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
1
2
3
4
5
√
解析 化合物XW3与WZ相遇会产生白烟,推断为NH3与HCl反应,则W为H,X为N,Z为Cl,四种元素的核外电子总数满足X+Y=W+Z,推断出Y为Na。非金属性:Z>X>W>Y,A错误;
原子半径:Y>Z>X>W,B错误;
元素X的最高价氧化物对应的含氧酸(HNO3)是强酸,而HNO2不是强酸,C错误;
Y的氧化物对应的水化物是NaOH,属于强碱,D正确。
1
2
3
4
5
3.(2019·全国卷Ⅱ,9)今年是门捷列夫发现元素周期律150周年。如图是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:WB.常温常压下,Y单质为固态
C.气态氢化物热稳定性:ZD.X的最高价氧化物的水化物是强碱
1
2
3
4
5
√
解析 原子半径:N常温常压下,单质硅呈固态,B项正确;
由非金属性:PAl的最高价氧化物对应的水化物Al(OH)3是典型的两性氢氧化物,并非强碱,D项错误。
1
2
3
4
5
4.(2019·全国卷Ⅰ,13)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
√
1
2
3
4
5
解析 由题推知,W、X、Y、Z分别为
Na、Si、P、Cl。氯化钠是强酸强碱盐,
其水溶液呈中性,A项错误;
元素非金属性顺序为Z(Cl)>Y(P)>X(Si),B项错误;
磷的最高价氧化物是P2O5,其对应的水化物为HPO3、H3PO4,它们均是中强酸,C项正确;
2个硅原子和1个P原子形成2个共价键,阴离子得到1个电子,所以该化合物中磷原子最外层达到8电子稳定结构,D项错误。
1
2
3
4
5
1
2
3
4
5
5.(2016·全国卷Ⅰ,13)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径的大小WB.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
√
1
2
3
4
5
解析 由n是元素Z的单质,通常为黄绿色气体,可知Z元素为Cl,n为Cl2,再根据q的水溶液具有漂白性,可知q为HClO,由0.01 mol·L-1 r溶液的pH为2,可判断r为一元强酸,则r为HCl,然后根据n和p的反应条件,以及s通常是难溶于水的混合物,可知p为烷烃,s为烷烃的氯代物;根据题意,W、X、Y、Z是短周期原子序数依次增加的四种元素,可进一步推知W、X、Y分别为H、C、O。
A项,根据原子半径的变化规律,可知原子半径:HB项,根据同周期元素非金属性的变化规律,可知非金属性:O>C,再由CCl4、ClO2中化合价的正、负,可知非金属性:O>Cl>C,错误;
1
2
3
4
5
C项,氧元素的氢化物可能为H2O或H2O2,常温常压下二者均为液态,正确;
D项,碳的最高价氧化物的水化物H2CO3为弱酸,错误。
1
2
3
4
5
6
7
8
9
10
题组一 结合原子结构推断
1.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦原子相同,b和c的次外层均有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性强弱为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
√
精练预测押题
1
2
3
4
5
6
7
8
9
10
解析 根据题意可推知,a为H,b为S,c为Cl,d为K。非金属性:Cl>S>H,A正确;
H和K形成离子化合物KH,B错误;
K和H、S、Cl能分别形成离子化合物:KH、K2S、KCl,C正确;
H、S、Cl各自的最高化合价分别为+1、+6、+7,最低化合价分别为-1、-2、-1,故元素a、b、c各自最高和最低化合价的代数和分别为0、4、6,D正确。
2.Q、W、X、Y、Z是原子序数依次增大的短周期主族元素,X的原子半径在短周期主族元素中最大,Q元素原子的最外层电子数是其内层电子数的2倍,W、Z元素原子的最外层电子数相同,Z的核电荷数是W的2倍,含元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是
A.简单离子半径:X>Y>Z>W
B.元素Q和Z形成的化合物QZ2属于离子化合物
C.X、Y、Z的最高价氧化物对应的水化物两两间能发生反应
D.Z元素简单氢化物的沸点高于W元素简单氢化物的沸点
1
2
3
4
5
6
7
8
9
10
√
解析 Q、W、X、Y、Z是原子序数依次增大的短周期主族元素,X的原子半径在短周期主族元素中最大,X为钠元素,Q元素原子的最外层电子数是其内层电子数的2倍,Q为碳元素,W、Z元素原子的最外层电子数相同,Z的核电荷数是W的2倍,W为氧元素,Z为硫元素,含元素Y的合金是日常生活中使用量最广泛的金属材料之一,Y为铝元素。
A项,电子层结构相同的离子,核电荷数越大离子半径越小;电子层越多离子半径越大,故离子半径:S2->O2->Na+>Al3+,错误;
B项,CS2属于共价化合物,错误;
1
2
3
4
5
6
7
8
9
10
C项,X、Y、Z最高价氧化物对应的水化物分别是NaOH、Al(OH)3、H2SO4,Al(OH)3是两性氢氧化物,故两两间能发生反应,正确;
D项,忽略水分子之间存在氢键而判断错误,水的沸点高于硫化氢的沸点,错误。
1
2
3
4
5
6
7
8
9
10
3.(2019·潍坊一模)X、Y、Z、W、R为五种短周期主族元素,Y、Z、W是原子序数递增的同周期相邻元素,且最外层电子数之和为15;X比Y核外少一个电子层;R的质子数是X、Y、Z、W四种元素原子的质子数之和的 。下列说法正确的是
A.简单离子半径:R>W>Z
B.X与Y形成的二元化合物常温下一定为气态
C.W和R形成的化合物是离子化合物
D.Y与W、Z与W形成的二元化合物都是大气污染物
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 同周期相邻元素X、Y、W最外层电子数之和为15的分别为6C、7N、8O;X比Y核外少一个电子层,则X为H,最后根据R与X、Y、Z、W质子数的关系确定R为Na。
A项,Na+与O2-的电子层结构相同,Na的核电荷数大,因而Na+半径小于O2-,错误;
B项,碳原子数大于4的烃,常温下为非气态,错误;
C项,Na2O和Na2O2均为离子化合物,正确;
D项,CO2不是大气污染物,错误。
4.(2020·威海一模)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为7;W、X原子序数之和是Y的一半;W与Z同族;Y的单质是我国古代四大发明之一黑火药的一种成分。下列说法错误的是
A.简单离子半径:Y>Z
B.W、X、Y三种元素非金属性由强到弱的顺序为:Y>X>W
C.W与Z形成的化合物的水溶液显碱性
D.X、Z二者最高价氧化物对应水化物与Y的简单氢化物三者间两两相互
反应
1
2
3
4
5
6
7
8
9
10
√
解析 W与Z同族,且W、X、Z最外层电子数之和为7,则三者最外层电子数可能是1,5,1、2,3,2、3,1,3;黑火药中的单质有S和C,若Y为C,则W、X的原子序数之和为3,则必有一种元素为0族元素,不符合题意,所以Y为S,W、X的原子序数之和为8,再结合W、X最外层电子可能的情况可知W为H,X为N,则Z为K。半径:S2->K+,故A正确;
非金属性:N>S,故B错误;
W与Z形成的化合物为KH,溶于水生成KOH,溶液显碱性,故C正确;
X、Z二者最高价氧化物对应的水化物为HNO3和KOH,Y的简单氢化物为H2S,三者间两两相互反应,故D正确。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
方法技巧
依据结构推断元素的常考突破口总结
(1)利用特殊的结构推断(短周期主族元素)
特殊电子层结构
在周期表中的位置
元素
电子层数等于最外层电子数
第一周期ⅠA族、第二周期ⅡA族、第三周期ⅢA族
H、Be、Al
最外层电子数是电子层数的2倍
第二周期ⅣA族、第三周期ⅥA族
C、S
最外层电子数是电子层数的3倍
第二周期ⅥA族
O
电子层数是最外层电子数的3倍
第三周期ⅠA族
Na
1
2
3
4
5
6
7
8
9
10
(2)定位法:“阴上阳下”规律,即具有相同电子层结构的离子,阴离子和阳离子分别位于相邻周期的右上角和左下角。如aX(n+1)+、bYn+、cZ(n+1)-、
dMn-的电子层结构相同,在周期表中位置关系为
?
?
…
cZ
dM
0族
bY
aX
…
?
?
?
题组二 依据周期表的位置推断
5.短周期元素A、B、C在元素周期表中所处的位置如图所示,A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为其次外层电子数的2倍,则下列说法正确的是
A.B的气态氢化物比C的气态氢化物稳定
B.元素D形成的气态氢化物一定是正四面体形分子
C.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物
发生反应,且反应类型相同
D.四种元素的原子半径:B>D>A>C
1
2
3
4
5
6
7
8
9
10
√
解析 根据A、B、C三种元素在周期表中的相对位置可知,如果设A的原子序数是x,则B是x+9,C是x+2,则x+x+9+x+2=32,解得x=7,即A是N,B是S,C是F。D元素原子的最外层电子数为次外层电子数的
2倍,因此D是碳元素。非金属性越强,氢化物的稳定性越强,F是最活泼的非金属,HF的稳定性最高,选项A不正确;
碳元素的氢化物乙烯是平面形结构,选项B不正确;
氨气和硝酸反应是化合反应,且不是氧化还原反应。H2S和浓硫酸反应是氧化还原反应,反应类型不同,选项C不正确;
同周期元素原子从左到右原子半径依次减小,同主族元素原子从上到下原子半径依次增大,故四种元素的原子半径:B>D>A>C,选项D正确。
1
2
3
4
5
6
7
8
9
10
6.R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。X原子最外层电子数等于其电子层数的3倍,下列推断正确的是
A.气态氢化物的热稳定性由强到弱的顺序为Z>R>X>Y
B.原子半径由小到大的顺序为ZC.最高价氧化物对应的水化物酸性由弱到强的顺序为ZD.RY3、A2X、ZA5分子中每个原子最外层都达到8电子结构
√
1
2
3
4
5
6
7
8
9
10
解析 由元素在周期表中的位置关系知,X位于第二周期,只有氧原子的最外层电子数等于其电子层数的3倍,则X为氧元素,由此推知R为氮元素,Y为氟元素,Z为磷元素,A为氯元素。
A项,热稳定性:PH3B项,原子半径:r(P)>r(Cl)>r(O)>r(F),错误;
C项,最高价氧化物对应的水化物酸性:H3PO4D项,PCl5分子中磷原子最外层有10个电子,错误。
1
2
3
4
5
6
7
8
9
10
7.短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示,Y原子的核外电子数是R的2倍,下列说法正确的是
A.可用YO2+Z2+2H2O===H2YO4+2HZ,证明
非金属性:Z>Y
B.含有Z元素的钠盐溶液都呈中性
C.由非金属性Z>Y可知,最高价氧化物对应的水化物的氧化性:Z>Y
D.最简单气态氢化物的热稳定性:R>X
1
2
3
4
5
6
7
8
9
10
√
?
R
?
X
Y
Z
解析 根据题意可知:R为O元素,X为P元素,Y为S元素,Z为Cl元素。A项,判断非金属性强弱应用置换反应,但SO2+Cl2+2H2O===H2SO4+2HCl不属于置换反应,错误;
B项,NaClO溶液呈碱性,错误;
C项,由非金属性强弱可推知最高价氧化物对应水化物的酸性强弱而不是氧化性强弱,错误;
D项,非金属性越强,最简单气态氢化物越稳定,非金属性:R>Y,Y>X,则R>X,正确。
1
2
3
4
5
6
7
8
9
10
?
R
?
X
Y
Z
1
2
3
4
5
6
7
8
9
10
练后反思
1.在短周期中,同周期相邻元素的原子序数相差1;同主族相邻元素的原子序数除H、Li相差“2”外,其余均相差“8”;同主族相邻元素的原子序数为2倍关系的是硫和氧。
2.在短周期中,原子半径最大的是钠,最小的是氢。
题组三 依据物质的特性推断
8.短周期元素X、Y、Z、W、Q的原子序数依次增大,X和Y各自组成的单质是空气的主要成分,常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.离子半径的大小顺序为W>Q>Z>X>Y
B.元素X与Y最多可形成5种化合物
C.元素X的气态氢化物与Q的单质可发生置换反应
D.元素Q的氧化物对应水化物酸性比W的强
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 短周期元素X、Y、Z、W、Q的原子序数依次增大,X和Y各自组成的单质是空气的主要成分,则X和Y分别是N和O;常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液,则Z为Al,W为S,Q为Cl。X、Y、Z、W、Q对应的离子分别为N3-、O2-、Al3+、S2-、Cl-,电子层数越多的离子,其半径越大,电子层数相同的离子,核电荷数越小半径越大,所以离子半径的大小顺序为W>Q>X>Y>Z,
A项不正确;
元素N与O至少可以形成6种化合物,如N2O、NO、N2O3、NO2、N2O4、N2O5,B项不正确;
1
2
3
4
5
6
7
8
9
10
Cl的非金属性强于N,故元素N的气态氢化物与Cl的单质可以发生置换反应,C项正确;
元素Q的氧化物对应的水化物可以是HClO,HClO的酸性比H2SO4的酸性弱,D项不正确。
9.W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数之比为1∶1的具有漂白性的物质,工业上常用电解饱和YZ溶液来获得Z的单质及其他产品,下列说法正确的是
A.W和X、Y、Z均能形成18电子的分子
B.上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W)
C.X、Y之间形成的化合物可能同时含有离子键和非极性共价键
D.W、X、Z三种元素形成的化合物一定是弱酸
1
2
3
4
5
6
7
8
9
10
√
解析 由已知条件分析可知W为H元素,X为O元素,Y为Na元素,Z为Cl元素。W和X、Z均能形成18电子的分子,如H2O2、HCl,但W和Y只能形成化合物NaH,NaH不是18电子的分子,A项错误;
四种元素的原子半径大小顺序为r(Na)>r(Cl)>r(O)>r(H),即r(Y)>r(Z)>r(X)
>r(W),B项错误;
X、Y之间形成的化合物可能为氧化钠或过氧化钠,过氧化钠中同时含有离子键和非极性共价键,C项正确;
W、X、Z三种元素形成的化合物可能是HClO4,HClO4为强酸,D项错误。
1
2
3
4
5
6
7
8
9
10
10.(2020·烟台一模)短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是
A.Y、Z、W三种元素非金属性:
W>Z>Y
B.Y、Z、W三种元素的原子半
径:Y>Z>W
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中可能只含有共价键
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 K是红棕色气体,丙的浓溶液具有强氧化性,可知K为NO2,丙为HNO3,NO2和H2O、O2反应最终生成HNO3,则乙为O2,L为H2O,甲是常见的固体,与浓硝酸反应生成NO2、H2O和CO2,即M为CO2,则X为H元素,Y为C元素,Z为N元素,W为O元素,据此分析解答。X、Y组成的化合物可以是有机高分子化合物,其沸点大于H2O,C选项错误;
由X、Y、Z、W构成的化合物可以是氨基酸,氨基酸分子中只含有共价键,D选项正确。
1
2
3
4
5
6
7
8
9
10
方法指导
熟记高考常考典型物质的特性,锁定突破口
(1)根据含量推断:空气中含量最多的物质是氮气,地壳中含量最多的元素是氧,地壳中含量最多的金属元素是铝。
(2)根据元素的性质推断:短周期中金属性最强的是钠,非金属性最强的是氟,其单质为半导体的是硅。
1
2
3
4
5
6
7
8
9
10
(3)依据物质的特殊性质推断(短周期元素)
①既能与强酸反应又能与强碱反应的常见物质有Al、Al2O3、Al(OH)3、NaHCO3。
②气态氢化物溶于水显碱性,气态氢化物和最高价氧化物对应水化物能反应生成离子化合物的元素是N。
③气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素是S。
④同主族并且能够形成离子化合物的两种元素是H和Na。
⑤密度最小的气体为H2,硬度最大的单质为金刚石,有色的气态物质为Cl2和NO2。
角度二
1.原子结构与元素的性质
物质的结构决定物质的性质,物质的性质反映物质的结构。原子越容易失去电子,元素的金属性就越强;原子越容易得电子,元素的非金属性就越强。
高考必备知识
2.元素周期表
(1)必记三个重要关系
①电子层数=周期序数
②最外层电子数=主族序数=元素的最高正化合价(O、F除外)
③最高正化合价+|最低负化合价|=8(H、O、F除外)
(2)熟记元素周期表的结构
3.主族元素性质递变规律
比较内容
同周期(从左到右)
同主族(从上到下)
金属性、非金属性
金属性减弱,非金属性增强
金属性增强,非金属性减弱
最高价氧化物对应水化物的酸碱性
酸性增强,碱性减弱
酸性减弱,碱性增强
气态氢化物
形成难易
由难到易
由易到难
热稳定性
递增
递减
变化中的规律性
一般情况下:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,气态氢化物的热稳定性越强,气态氢化物越易形成
4.微粒半径大小比较的规律
“三看法”比较微粒半径大小:
“一看”电子层数:当电子层数不同时,电子层数越多,半径越大。
“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
1.(2020·全国卷Ⅱ,13)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
1
2
3
4
5
√
重练高考真题
解析 根据图中信息可得,Z为Na,W为H,结合题给信息“W、X、Y、Z的原子序数依次增大、且总和为24”可推知,X为B,Y为N。H、B、N三种非金属元素之间形成的化学键均为共价键,A正确;
Na既可以与水反应,也可以和甲醇反应,B正确;
N的最高价氧化物对应的水化物为硝酸,C正确;
三氟化硼中硼原子最外层有3个电子,与氟原子之
间形成3个共价键,即最外层共6个电子,不满足8电子稳定结构,D错误。
1
2
3
4
5
2.(2020·全国卷Ⅲ,13)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
1
2
3
4
5
√
解析 化合物XW3与WZ相遇会产生白烟,推断为NH3与HCl反应,则W为H,X为N,Z为Cl,四种元素的核外电子总数满足X+Y=W+Z,推断出Y为Na。非金属性:Z>X>W>Y,A错误;
原子半径:Y>Z>X>W,B错误;
元素X的最高价氧化物对应的含氧酸(HNO3)是强酸,而HNO2不是强酸,C错误;
Y的氧化物对应的水化物是NaOH,属于强碱,D正确。
1
2
3
4
5
3.(2019·全国卷Ⅱ,9)今年是门捷列夫发现元素周期律150周年。如图是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:W
C.气态氢化物热稳定性:Z
1
2
3
4
5
√
解析 原子半径:N
由非金属性:P
1
2
3
4
5
4.(2019·全国卷Ⅰ,13)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
√
1
2
3
4
5
解析 由题推知,W、X、Y、Z分别为
Na、Si、P、Cl。氯化钠是强酸强碱盐,
其水溶液呈中性,A项错误;
元素非金属性顺序为Z(Cl)>Y(P)>X(Si),B项错误;
磷的最高价氧化物是P2O5,其对应的水化物为HPO3、H3PO4,它们均是中强酸,C项正确;
2个硅原子和1个P原子形成2个共价键,阴离子得到1个电子,所以该化合物中磷原子最外层达到8电子稳定结构,D项错误。
1
2
3
4
5
1
2
3
4
5
5.(2016·全国卷Ⅰ,13)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
A.原子半径的大小W
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
√
1
2
3
4
5
解析 由n是元素Z的单质,通常为黄绿色气体,可知Z元素为Cl,n为Cl2,再根据q的水溶液具有漂白性,可知q为HClO,由0.01 mol·L-1 r溶液的pH为2,可判断r为一元强酸,则r为HCl,然后根据n和p的反应条件,以及s通常是难溶于水的混合物,可知p为烷烃,s为烷烃的氯代物;根据题意,W、X、Y、Z是短周期原子序数依次增加的四种元素,可进一步推知W、X、Y分别为H、C、O。
A项,根据原子半径的变化规律,可知原子半径:H
1
2
3
4
5
C项,氧元素的氢化物可能为H2O或H2O2,常温常压下二者均为液态,正确;
D项,碳的最高价氧化物的水化物H2CO3为弱酸,错误。
1
2
3
4
5
6
7
8
9
10
题组一 结合原子结构推断
1.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦原子相同,b和c的次外层均有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性强弱为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
√
精练预测押题
1
2
3
4
5
6
7
8
9
10
解析 根据题意可推知,a为H,b为S,c为Cl,d为K。非金属性:Cl>S>H,A正确;
H和K形成离子化合物KH,B错误;
K和H、S、Cl能分别形成离子化合物:KH、K2S、KCl,C正确;
H、S、Cl各自的最高化合价分别为+1、+6、+7,最低化合价分别为-1、-2、-1,故元素a、b、c各自最高和最低化合价的代数和分别为0、4、6,D正确。
2.Q、W、X、Y、Z是原子序数依次增大的短周期主族元素,X的原子半径在短周期主族元素中最大,Q元素原子的最外层电子数是其内层电子数的2倍,W、Z元素原子的最外层电子数相同,Z的核电荷数是W的2倍,含元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是
A.简单离子半径:X>Y>Z>W
B.元素Q和Z形成的化合物QZ2属于离子化合物
C.X、Y、Z的最高价氧化物对应的水化物两两间能发生反应
D.Z元素简单氢化物的沸点高于W元素简单氢化物的沸点
1
2
3
4
5
6
7
8
9
10
√
解析 Q、W、X、Y、Z是原子序数依次增大的短周期主族元素,X的原子半径在短周期主族元素中最大,X为钠元素,Q元素原子的最外层电子数是其内层电子数的2倍,Q为碳元素,W、Z元素原子的最外层电子数相同,Z的核电荷数是W的2倍,W为氧元素,Z为硫元素,含元素Y的合金是日常生活中使用量最广泛的金属材料之一,Y为铝元素。
A项,电子层结构相同的离子,核电荷数越大离子半径越小;电子层越多离子半径越大,故离子半径:S2->O2->Na+>Al3+,错误;
B项,CS2属于共价化合物,错误;
1
2
3
4
5
6
7
8
9
10
C项,X、Y、Z最高价氧化物对应的水化物分别是NaOH、Al(OH)3、H2SO4,Al(OH)3是两性氢氧化物,故两两间能发生反应,正确;
D项,忽略水分子之间存在氢键而判断错误,水的沸点高于硫化氢的沸点,错误。
1
2
3
4
5
6
7
8
9
10
3.(2019·潍坊一模)X、Y、Z、W、R为五种短周期主族元素,Y、Z、W是原子序数递增的同周期相邻元素,且最外层电子数之和为15;X比Y核外少一个电子层;R的质子数是X、Y、Z、W四种元素原子的质子数之和的 。下列说法正确的是
A.简单离子半径:R>W>Z
B.X与Y形成的二元化合物常温下一定为气态
C.W和R形成的化合物是离子化合物
D.Y与W、Z与W形成的二元化合物都是大气污染物
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 同周期相邻元素X、Y、W最外层电子数之和为15的分别为6C、7N、8O;X比Y核外少一个电子层,则X为H,最后根据R与X、Y、Z、W质子数的关系确定R为Na。
A项,Na+与O2-的电子层结构相同,Na的核电荷数大,因而Na+半径小于O2-,错误;
B项,碳原子数大于4的烃,常温下为非气态,错误;
C项,Na2O和Na2O2均为离子化合物,正确;
D项,CO2不是大气污染物,错误。
4.(2020·威海一模)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为7;W、X原子序数之和是Y的一半;W与Z同族;Y的单质是我国古代四大发明之一黑火药的一种成分。下列说法错误的是
A.简单离子半径:Y>Z
B.W、X、Y三种元素非金属性由强到弱的顺序为:Y>X>W
C.W与Z形成的化合物的水溶液显碱性
D.X、Z二者最高价氧化物对应水化物与Y的简单氢化物三者间两两相互
反应
1
2
3
4
5
6
7
8
9
10
√
解析 W与Z同族,且W、X、Z最外层电子数之和为7,则三者最外层电子数可能是1,5,1、2,3,2、3,1,3;黑火药中的单质有S和C,若Y为C,则W、X的原子序数之和为3,则必有一种元素为0族元素,不符合题意,所以Y为S,W、X的原子序数之和为8,再结合W、X最外层电子可能的情况可知W为H,X为N,则Z为K。半径:S2->K+,故A正确;
非金属性:N>S,故B错误;
W与Z形成的化合物为KH,溶于水生成KOH,溶液显碱性,故C正确;
X、Z二者最高价氧化物对应的水化物为HNO3和KOH,Y的简单氢化物为H2S,三者间两两相互反应,故D正确。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
方法技巧
依据结构推断元素的常考突破口总结
(1)利用特殊的结构推断(短周期主族元素)
特殊电子层结构
在周期表中的位置
元素
电子层数等于最外层电子数
第一周期ⅠA族、第二周期ⅡA族、第三周期ⅢA族
H、Be、Al
最外层电子数是电子层数的2倍
第二周期ⅣA族、第三周期ⅥA族
C、S
最外层电子数是电子层数的3倍
第二周期ⅥA族
O
电子层数是最外层电子数的3倍
第三周期ⅠA族
Na
1
2
3
4
5
6
7
8
9
10
(2)定位法:“阴上阳下”规律,即具有相同电子层结构的离子,阴离子和阳离子分别位于相邻周期的右上角和左下角。如aX(n+1)+、bYn+、cZ(n+1)-、
dMn-的电子层结构相同,在周期表中位置关系为
?
?
…
cZ
dM
0族
bY
aX
…
?
?
?
题组二 依据周期表的位置推断
5.短周期元素A、B、C在元素周期表中所处的位置如图所示,A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为其次外层电子数的2倍,则下列说法正确的是
A.B的气态氢化物比C的气态氢化物稳定
B.元素D形成的气态氢化物一定是正四面体形分子
C.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物
发生反应,且反应类型相同
D.四种元素的原子半径:B>D>A>C
1
2
3
4
5
6
7
8
9
10
√
解析 根据A、B、C三种元素在周期表中的相对位置可知,如果设A的原子序数是x,则B是x+9,C是x+2,则x+x+9+x+2=32,解得x=7,即A是N,B是S,C是F。D元素原子的最外层电子数为次外层电子数的
2倍,因此D是碳元素。非金属性越强,氢化物的稳定性越强,F是最活泼的非金属,HF的稳定性最高,选项A不正确;
碳元素的氢化物乙烯是平面形结构,选项B不正确;
氨气和硝酸反应是化合反应,且不是氧化还原反应。H2S和浓硫酸反应是氧化还原反应,反应类型不同,选项C不正确;
同周期元素原子从左到右原子半径依次减小,同主族元素原子从上到下原子半径依次增大,故四种元素的原子半径:B>D>A>C,选项D正确。
1
2
3
4
5
6
7
8
9
10
6.R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。X原子最外层电子数等于其电子层数的3倍,下列推断正确的是
A.气态氢化物的热稳定性由强到弱的顺序为Z>R>X>Y
B.原子半径由小到大的顺序为Z
√
1
2
3
4
5
6
7
8
9
10
解析 由元素在周期表中的位置关系知,X位于第二周期,只有氧原子的最外层电子数等于其电子层数的3倍,则X为氧元素,由此推知R为氮元素,Y为氟元素,Z为磷元素,A为氯元素。
A项,热稳定性:PH3
C项,最高价氧化物对应的水化物酸性:H3PO4
1
2
3
4
5
6
7
8
9
10
7.短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示,Y原子的核外电子数是R的2倍,下列说法正确的是
A.可用YO2+Z2+2H2O===H2YO4+2HZ,证明
非金属性:Z>Y
B.含有Z元素的钠盐溶液都呈中性
C.由非金属性Z>Y可知,最高价氧化物对应的水化物的氧化性:Z>Y
D.最简单气态氢化物的热稳定性:R>X
1
2
3
4
5
6
7
8
9
10
√
?
R
?
X
Y
Z
解析 根据题意可知:R为O元素,X为P元素,Y为S元素,Z为Cl元素。A项,判断非金属性强弱应用置换反应,但SO2+Cl2+2H2O===H2SO4+2HCl不属于置换反应,错误;
B项,NaClO溶液呈碱性,错误;
C项,由非金属性强弱可推知最高价氧化物对应水化物的酸性强弱而不是氧化性强弱,错误;
D项,非金属性越强,最简单气态氢化物越稳定,非金属性:R>Y,Y>X,则R>X,正确。
1
2
3
4
5
6
7
8
9
10
?
R
?
X
Y
Z
1
2
3
4
5
6
7
8
9
10
练后反思
1.在短周期中,同周期相邻元素的原子序数相差1;同主族相邻元素的原子序数除H、Li相差“2”外,其余均相差“8”;同主族相邻元素的原子序数为2倍关系的是硫和氧。
2.在短周期中,原子半径最大的是钠,最小的是氢。
题组三 依据物质的特性推断
8.短周期元素X、Y、Z、W、Q的原子序数依次增大,X和Y各自组成的单质是空气的主要成分,常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.离子半径的大小顺序为W>Q>Z>X>Y
B.元素X与Y最多可形成5种化合物
C.元素X的气态氢化物与Q的单质可发生置换反应
D.元素Q的氧化物对应水化物酸性比W的强
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 短周期元素X、Y、Z、W、Q的原子序数依次增大,X和Y各自组成的单质是空气的主要成分,则X和Y分别是N和O;常温下,Z的单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液,则Z为Al,W为S,Q为Cl。X、Y、Z、W、Q对应的离子分别为N3-、O2-、Al3+、S2-、Cl-,电子层数越多的离子,其半径越大,电子层数相同的离子,核电荷数越小半径越大,所以离子半径的大小顺序为W>Q>X>Y>Z,
A项不正确;
元素N与O至少可以形成6种化合物,如N2O、NO、N2O3、NO2、N2O4、N2O5,B项不正确;
1
2
3
4
5
6
7
8
9
10
Cl的非金属性强于N,故元素N的气态氢化物与Cl的单质可以发生置换反应,C项正确;
元素Q的氧化物对应的水化物可以是HClO,HClO的酸性比H2SO4的酸性弱,D项不正确。
9.W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数之比为1∶1的具有漂白性的物质,工业上常用电解饱和YZ溶液来获得Z的单质及其他产品,下列说法正确的是
A.W和X、Y、Z均能形成18电子的分子
B.上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W)
C.X、Y之间形成的化合物可能同时含有离子键和非极性共价键
D.W、X、Z三种元素形成的化合物一定是弱酸
1
2
3
4
5
6
7
8
9
10
√
解析 由已知条件分析可知W为H元素,X为O元素,Y为Na元素,Z为Cl元素。W和X、Z均能形成18电子的分子,如H2O2、HCl,但W和Y只能形成化合物NaH,NaH不是18电子的分子,A项错误;
四种元素的原子半径大小顺序为r(Na)>r(Cl)>r(O)>r(H),即r(Y)>r(Z)>r(X)
>r(W),B项错误;
X、Y之间形成的化合物可能为氧化钠或过氧化钠,过氧化钠中同时含有离子键和非极性共价键,C项正确;
W、X、Z三种元素形成的化合物可能是HClO4,HClO4为强酸,D项错误。
1
2
3
4
5
6
7
8
9
10
10.(2020·烟台一模)短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是
A.Y、Z、W三种元素非金属性:
W>Z>Y
B.Y、Z、W三种元素的原子半
径:Y>Z>W
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中可能只含有共价键
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 K是红棕色气体,丙的浓溶液具有强氧化性,可知K为NO2,丙为HNO3,NO2和H2O、O2反应最终生成HNO3,则乙为O2,L为H2O,甲是常见的固体,与浓硝酸反应生成NO2、H2O和CO2,即M为CO2,则X为H元素,Y为C元素,Z为N元素,W为O元素,据此分析解答。X、Y组成的化合物可以是有机高分子化合物,其沸点大于H2O,C选项错误;
由X、Y、Z、W构成的化合物可以是氨基酸,氨基酸分子中只含有共价键,D选项正确。
1
2
3
4
5
6
7
8
9
10
方法指导
熟记高考常考典型物质的特性,锁定突破口
(1)根据含量推断:空气中含量最多的物质是氮气,地壳中含量最多的元素是氧,地壳中含量最多的金属元素是铝。
(2)根据元素的性质推断:短周期中金属性最强的是钠,非金属性最强的是氟,其单质为半导体的是硅。
1
2
3
4
5
6
7
8
9
10
(3)依据物质的特殊性质推断(短周期元素)
①既能与强酸反应又能与强碱反应的常见物质有Al、Al2O3、Al(OH)3、NaHCO3。
②气态氢化物溶于水显碱性,气态氢化物和最高价氧化物对应水化物能反应生成离子化合物的元素是N。
③气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素是S。
④同主族并且能够形成离子化合物的两种元素是H和Na。
⑤密度最小的气体为H2,硬度最大的单质为金刚石,有色的气态物质为Cl2和NO2。
同课章节目录
