2021届高考化学考前三个月专项复习课件(59张ppt)题型四 “3+物质结构与性质”特训
文档属性
| 名称 | 2021届高考化学考前三个月专项复习课件(59张ppt)题型四 “3+物质结构与性质”特训 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 07:13:29 | ||
图片预览






文档简介
“3+物质结构与性质”特训
题型四 物质结构与性质综合题的研究(选考)
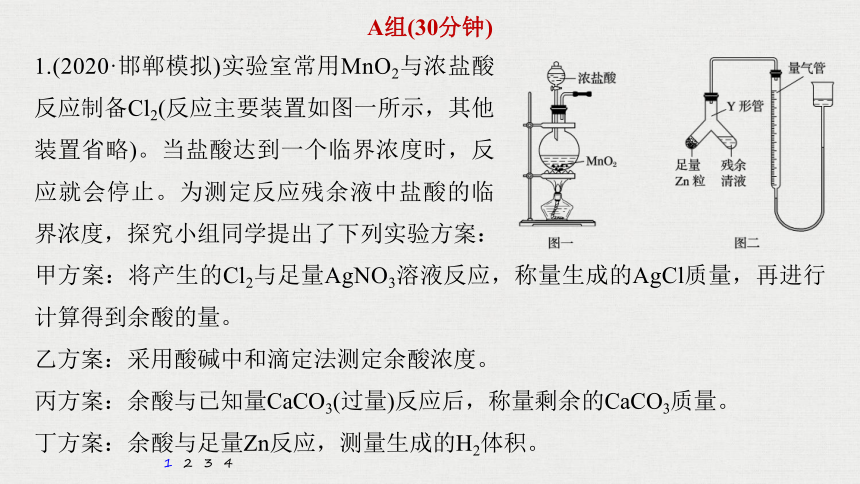
甲方案:将产生的Cl2与足量AgNO3溶液反应,称量生成的AgCl质量,再进行计算得到余酸的量。
乙方案:采用酸碱中和滴定法测定余酸浓度。
丙方案:余酸与已知量CaCO3(过量)反应后,称量剩余的CaCO3质量。
丁方案:余酸与足量Zn反应,测量生成的H2体积。
A组(30分钟)
1
2
3
4
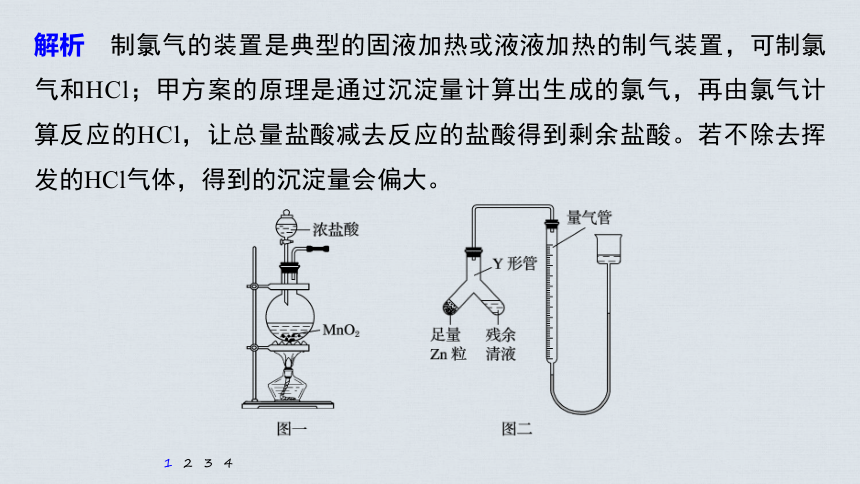
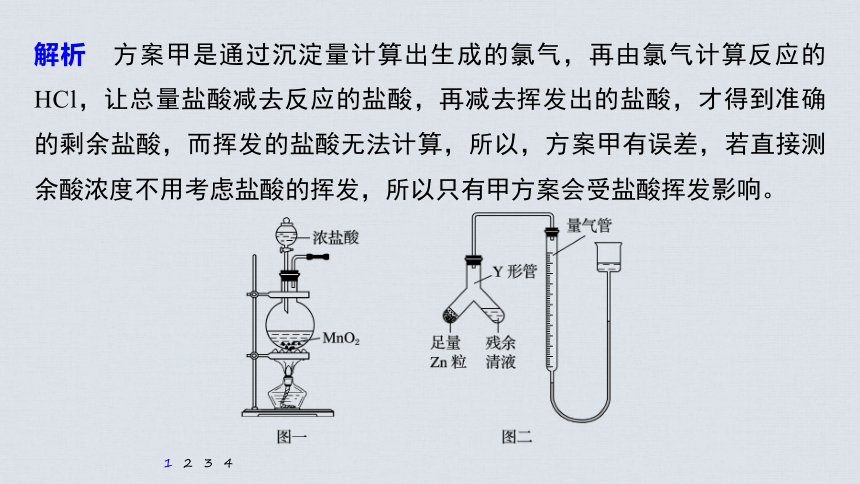
1.(2020·邯郸模拟)实验室常用MnO2与浓盐酸反应制备Cl2(反应主要装置如图一所示,其他装置省略)。当盐酸达到一个临界浓度时,反应就会停止。为测定反应残余液中盐酸的临界浓度,探究小组同学提出了下列实验方案:
具体操作:装配好仪器并检查装置气密性,接下来的操作依次是:
①往烧瓶中加入足量MnO2粉末
②往烧瓶中加入20 mL 12 mol·L-1浓盐酸
③加热使之充分反应。
(1)在实验室中,该发生装置除了可以用于制备Cl2,还可以制备
的气体是______。
A.O2 B.H2 C.CH2==CH2 D.HCl
若使用甲方案,产生的Cl2必须先通过盛有____________(填试剂名称)的洗气瓶, 再通入足量AgNO3溶液中,这样做的目的是__________________;已知AgClO易溶于水,写出Cl2与AgNO3溶液反应的化学方程式:_____________________
______________________。
1
2
3
4
D
饱和食盐水
除去挥发的HCl气体
Cl2+H2O+AgNO3===
AgCl↓+HClO+HNO3
解析 制氯气的装置是典型的固液加热或液液加热的制气装置,可制氯气和HCl;甲方案的原理是通过沉淀量计算出生成的氯气,再由氯气计算反应的HCl,让总量盐酸减去反应的盐酸得到剩余盐酸。若不除去挥发的HCl气体,得到的沉淀量会偏大。
1
2
3
4
(2)进行乙方案实验:准确量取残余清液,稀释5倍后作为试样。准确量取试样25.00 mL,用1.500 mol·L-1NaOH标准溶液滴定,选用合适的指示剂,消耗NaOH标准溶液23.00 mL,则由此计算得到盐酸的临界浓度为___mol·L-1 (保留两位有效数字);选用的合适指示剂是____。
A.石蕊 B.酚酞 C.甲基橙
1
2
3
4
6.9
C
解析 滴定指示剂一般不选石蕊,本题滴定虽属于强酸强碱的中和滴定,但盐酸中含有强酸弱碱盐MnCl2,若用酚酞,滴定终点偏碱性,此时Mn2+也会结合NaOH,导致用碱量偏大,所以只能选用甲基橙。
1
2
3
4
解析 根据题意碳酸锰的Ksp比碳酸钙小,其中有部分碳酸钙与锰离子反应转化成碳酸锰沉淀,碳酸锰的相对分子质量大于碳酸钙,相当于剩余固体质量变大,参加反应的碳酸钙减少,参加反应的盐酸也减少,由此计算得出剩余盐酸的浓度就偏小了。
(3)判断丙方案的实验结果,测得余酸的临界浓度_____(填“偏大”“偏小”或“无影响”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
1
2
3
4
偏小
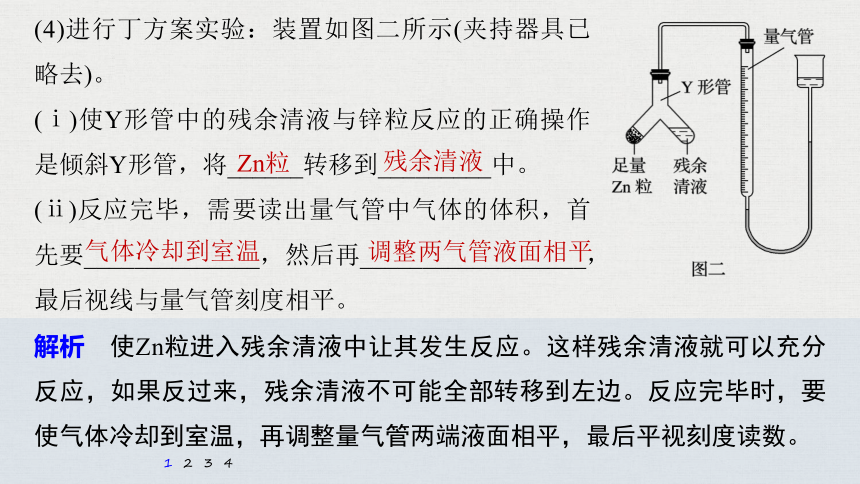
解析 使Zn粒进入残余清液中让其发生反应。这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边。反应完毕时,要使气体冷却到室温,再调整量气管两端液面相平,最后平视刻度读数。
(4)进行丁方案实验:装置如图二所示(夹持器具已略去)。
(ⅰ)使Y形管中的残余清液与锌粒反应的正确操作是倾斜Y形管,将______转移到_________中。
(ⅱ)反应完毕,需要读出量气管中气体的体积,首先要______________,然后再__________________,最后视线与量气管刻度相平。
1
2
3
4
Zn粒
残余清液
气体冷却到室温
调整两气管液面相平
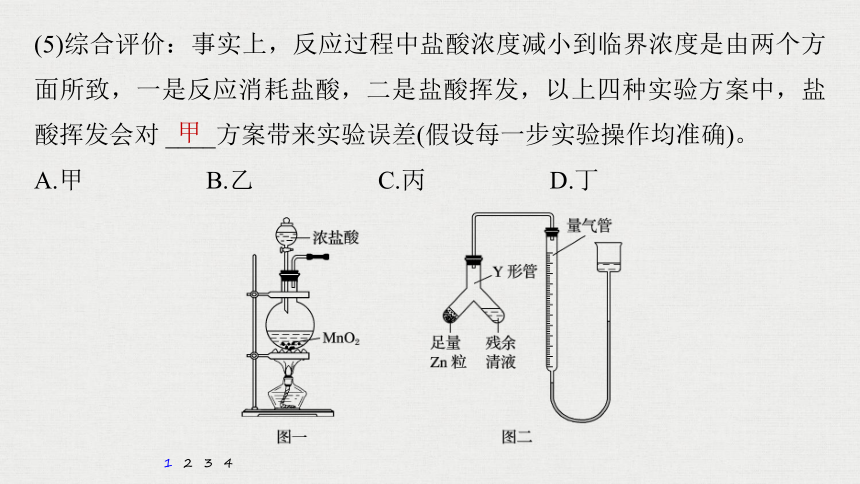
(5)综合评价:事实上,反应过程中盐酸浓度减小到临界浓度是由两个方面所致,一是反应消耗盐酸,二是盐酸挥发,以上四种实验方案中,盐酸挥发会对 ____方案带来实验误差(假设每一步实验操作均准确)。
A.甲 B.乙 C.丙 D.丁
1
2
3
4
甲
解析 方案甲是通过沉淀量计算出生成的氯气,再由氯气计算反应的HCl,让总量盐酸减去反应的盐酸,再减去挥发出的盐酸,才得到准确的剩余盐酸,而挥发的盐酸无法计算,所以,方案甲有误差,若直接测余酸浓度不用考虑盐酸的挥发,所以只有甲方案会受盐酸挥发影响。
1
2
3
4
2.(2020·泰安一模)苯乙烯是重要的基础有机化工原料。工业中以乙苯催化脱氢来制取苯乙烯:
ΔH=+117.6 kJ·mol-1
已知:上述反应的速率方程为v正=k正 p乙苯,v逆=k逆 p苯乙烯 p氢气,其中k正、k逆分别为正、逆反应速率常数,p为各组分分压。
(1)同时增大乙苯的反应速率和平衡转化率所采取的措施是_____。
1
2
3
4
升温
解析 乙苯催化脱氢反应正向是体积增大的吸热反应,同时增大乙苯的反应速率和平衡转化率所采取的措施有升温。
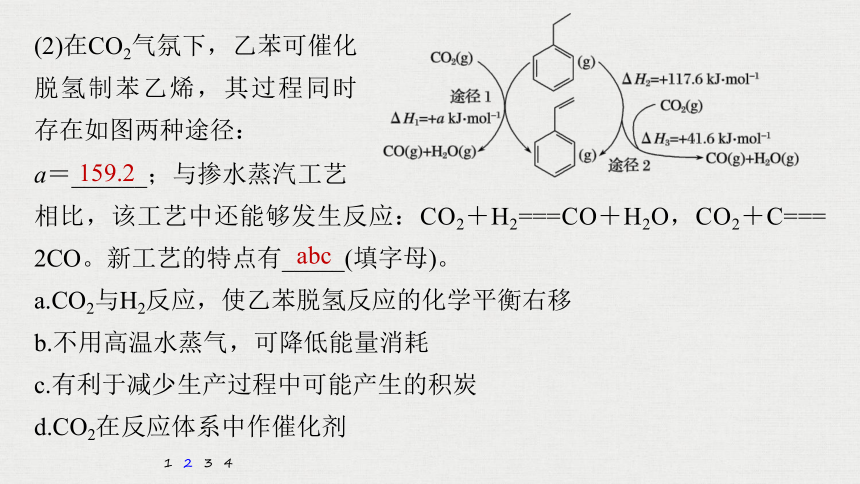
(2)在CO2气氛下,乙苯可催化脱氢制苯乙烯,其过程同时存在如图两种途径:
1
2
3
4
a=______;与掺水蒸汽工艺
相比,该工艺中还能够发生反应:CO2+H2===CO+H2O,CO2+C=== 2CO。新工艺的特点有_____(填字母)。
a.CO2与H2反应,使乙苯脱氢反应的化学平衡右移
b.不用高温水蒸气,可降低能量消耗
c.有利于减少生产过程中可能产生的积炭
d.CO2在反应体系中作催化剂
159.2
abc
加入的二氧化碳会发生反应CO2+C===2CO,有利于减少积炭,故c正确;
根据图示,二氧化碳反应生成了CO,不是催化剂,故d错误。
解析 由图片可知ΔH1=ΔH2+ΔH3=+117.6 kJ·mol-1+(+41.6 kJ·mol-1)=+159.2 kJ·mol-1,即a=159.2;CO2与H2反应,导致氢气浓度减小,有利于乙苯脱氢反应的化学平衡右移,故a正确;
1
2
3
4
由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少,故b正确;
(3)在实际生产中,往反应釜中同时通入乙苯和水蒸气,加入水蒸气稀释剂能提高乙苯转化率的原因是_____________________________________
_________________________________________。
1
2
3
4
体系总压不变时,加入水蒸气,相当于反
应体系减压,平衡正向移动,乙苯转化率增大
解析 体系总压不变时,加入水蒸气,相当于反应体系减压,平衡正向移动,乙苯转化率增大,因此在实际生产中,往反应釜中同时通入乙苯和水蒸气,能提高乙苯转化率。
(4)测得容器总压(p总)和乙苯转化率α随时间变化结果如图所示。平衡时,p(H2O)=_____kPa,平衡常数Kp=____kPa(用平衡分压代替平衡浓度计
算);a处的 =_____。
1
2
3
4
80
45
2.5
解析 设起始时n(乙苯)=a mol,n(H2O)=b mol,
1
2
3
4
起始量/mol a 0 0
变化量/mol 0.75a 0.75a 0.75a
平衡量/mol 0.25a 0.75a 0.75a
平衡时v正=v逆,即k正 p乙苯=k逆 p苯乙烯 p氢气,
1
2
3
4
a处:
起始量/mol a 0 0
变化量/mol 0.6a 0.6a 0.6a
平衡量/mol 0.4a 0.6a 0.6a
1
2
3
4
3.过氧化碳酰胺[CO(NH2)2·H2O2]是一种治疗尘肺病的药物。工业上合成过氧化碳酰胺的流程如图:
1
2
3
4
已知如下信息:
①合成原理:H2O2+CO(NH2)2 CO(NH2)2·H2O2。
②过氧化碳酰胺在极少量重金属离子存在下就会迅速分解。
请回答下列问题:
(1)合成时控制反应温度为30 ℃的原因可能是________________________
_____________________________________________________。
①温度过低,反应速率过
慢;②温度过高,双氧水分解速率加快,双氧水利用率降低
解析 从反应速率和双氧水分解两个角度分析:温度过低,反应速率过慢,温度过高,双氧水分解速率加快,双氧水的利用率降低。
1
2
3
4
(2)上述流程中,操作②④的名称分别为_________、______。
1
2
3
4
冷却结晶
洗涤
解析 题中所述流程中,操作①②③④⑤分别为减压蒸发、冷却结晶、过滤、洗涤、干燥。
(3)下列物质中,可以作稳定剂的是____(填字母)。
A.FeCl3 B.MnO2 C.NaH2PO4 D.K2S
1
2
3
4
C
解析 Fe3+是重金属离子,根据已知信息②,过氧化碳酰胺在Fe3+存在下会迅速分解;MnO2能催化双氧水分解;K2S具有还原性,能与双氧水反应,所以只有NaH2PO4可以作稳定剂。
解析 依题意,CrO5中铬为+6价,则可设CrO5中-1价的O原子有x个,则+6+(-1)×x+(-2)×(5-x)=0,解得x=4,故1个CrO5分子中有4个-1价氧原子和1个-2价氧原子,故存在2个过氧键。
(4)过氧化碳酰胺的鉴定反应:4H2O2+ +2H+===2CrO5(蓝色)+5H2O。已知该反应是非氧化还原反应,则1 mol CrO5中含____ mol过氧键(—O—O—键)。
1
2
3
4
2
①写出双氧水和KI在稀硫酸中反应的离子方程式:___________________
_________。
(5)测定成品中过氧化碳酰胺的含量:称取成品2.000 g溶于水,配成250 mL溶液;准确量取25.00 mL上述溶液于锥形瓶中,加入过量KI和少量稀硫酸,振荡,充分反应后,加入指示剂,再用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,滴定反应为 。三次平行实验的结果如下:
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
H2O2+2H++2I-===
I2+2H2O
解析 双氧水在酸性条件下氧化KI的离子方程式为H2O2+2H++2I-===I2+2H2O。
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
②过氧化碳酰胺与过量KI在稀硫酸中反应时,若振荡剧烈且时间较长,测定结果会_____(填“偏高”“偏低”或“无影响”)。
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
偏高
解析 过氧化碳酰胺与过量KI在稀硫酸中反应时,如果振荡剧烈且时间较长,会发生副反应O2+4H++4I-===2I2+2H2O,导致生成的I2增多,滴定时消耗Na2S2O3标准溶液的体积偏大,则测得的结果偏高。
③成品中过氧化碳酰胺的质量分数为________。
1
2
3
4
94.00%
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
解析 由三次平行实验的结果可得到V终-V始的值,第三次实验的误差太大,舍去,第一、二次实验结果可得V终-V始的平均值为40.00 mL,由
CO(NH2)2·H2O2~H2O2~I2~ 可知,n[CO(NH2)2·H2O2]= n(Na2S2O3)
= ×40.00 mL×10-3 L·mL-1×0.100 0 mol·L-1=2.000×10-3 mol,因此
成品中过氧化碳酰胺的质量分数为 ×100%=
94.00%。
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
解析 Mo处于第五周期ⅥB族,核外电子排布与Cr相似,其价电子为4d、5s电子,4d能级上有5个电子、5s能级上有1个电子,基态价电子排布式为4d55s1;核外未成对电子是4d、5s能级上的电子,有6个电子。
4.(2020·泰安一模)超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
1
2
3
4
(1)Mo处于第五周期ⅥB族,核外电子排布与Cr相似,它的基态价电子排布式是_______;核外未成对电子数是____个。
4d55s1
6
(2)该超分子中配体CO提供孤电子对的原子是____(填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有________。(已知吡啶可看作苯分子中的一个CH原子团被N取代的化合物)
1
2
3
4
C
sp2和sp3
解析 CO提供孤电子对的是C原子、Mo提供空轨道,两个原子形成配位键;p-甲酸丁酯吡啶配体中C原子价层电子对个数有4、3,根据价层电子对互斥理论,C原子杂化类型为sp3、sp2。
(3)已知:C60分子中存在碳碳单、双键;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。则一个C60分子的结构是由____个五边形和____个六边形组成的球体。用文字简述C60跟F2在一定条件下反应所得的物质的组成:________________
1
2
3
4
12
20
______________________________________________________________________________________________________________________________。
由C60结构和碳
的四个价键理论,可知一个碳需连接一个双键,一个双键被两个碳原子共用,故含有60÷2=30个双键,易与活泼的F2发生加成反应生成C60F60
1
2
3
4
解析 多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:V+F-E=2,即顶点数+面数-棱边数=2;设C60分子中五边形数为x,六边形数
为y。依题意可得方程组:
,解得:x=12,y=20,
即C60分子有12个五边形和20个六边形,由C60结构和碳的四个价键理论,可知一个碳需连接一个双键,一个双键被两个碳原子共用,故含有60÷2=30个双键,与活泼的F2发生加成反应即可生成C60F60。
(4)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点的原子坐标均可以为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及 。
根据以上信息,推断该晶体的原子堆积方式是________________。已知该晶体的密度是ρ g·cm-3,Mo的摩尔质量是M g·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间
的距离为_________________pm。
1
2
3
4
体心立方密堆积
1
2
3
4
B组(30分钟)
1.(2019·潍坊二模)无水MgBr2常用作催化剂。某化学小组在实验室选用下图所示装置(夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
1
2
3
4
1
2
3
4
已知:①在浓硫酸存在下,加热到140 ℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170 ℃时乙醇脱水生成CH2==CH2。
②乙醚的熔点为34.6 ℃,沸点为132 ℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应:MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5。
实验主要步骤如下:
Ⅰ.选用上述部分装置,正确连接,检查
装置的气密性。向装置中加入药品。
Ⅱ.加热装置A,迅速升温至140 ℃,并保
持140 ℃加热一段时间,停止加热。
Ⅲ.通入干燥的氮气,让液溴缓慢进入装
置B中,直至完全加入。
Ⅳ.装置B中反应完毕后恢复至室温,过滤
反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
Ⅴ.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160 ℃分解得无水MgBr2。
1
2
3
4
回答下列问题:
(1)装置A中使用仪器m的优点是__________________________________
______。
(2)步骤Ⅰ中所选装置的正确连接顺序是a_________________________(填小写字母)。装置D的作用是_________。
1
2
3
4
使系统内外压强相等,便于液体顺利
流下
efbcg(ef可颠倒、bc可颠倒)
防止倒吸
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是___________________________。
(4)步骤Ⅴ中用苯洗涤三乙醚合溴化镁的目的是_______________。
1
2
3
4
停止加热,冷却后补加碎瓷片
除去乙醚和乙醇
(5)步骤Ⅴ采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是_____(填序号)。
1
2
3
4
bc
(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______________________________________________________
______________________________________________________________________。
1
2
3
4
取少量CH2Br—CH2Br于试管中,加入NaOH溶液,加热,再加入稀硝酸酸化,滴加AgNO3溶液,有淡黄色沉淀生成证明有CH2Br—CH2Br
2.(2019·济南三模)磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程Ⅰ中,被还原的元素是_______(填元素符号),过程Ⅲ的化学方程式为____________
__________________________________。
1
2
3
4
Cu、P
2Ca3(PO4)2+
6SiO2+10C===6CaSiO3+10CO↑+P4
①复合材料中V的化合价为____,C的作用是_____________________。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为__________________
__________________________;“洗涤”时用乙醇而不用水的目的是_____________。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:
1
2
3
4
+3
增强复合材料的导电性
V2O5+5H2C2O4===
V2(C2O4)3+4CO2↑+5H2O
减少产品损耗
③锂离子电池是一种二次电池,又称“摇椅”电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=== Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为_________________
______________________。
1
2
3
4
Li3V2(PO4)3-xe-
===Li3-xV2(PO4)3+xLi+
3.研究SO2的回收、再利用,既有利于良好大气环境的获得,也有利于社会可持续发展的实现。
(1)已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1
②S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
则CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g) ΔH=_____________。
1
2
3
4
-208 kJ·mol-1
解析 用①-2×②即可得到CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g) ΔH=-208 kJ·mol-1。
(2)为研究某催化剂X的催化活性与温度的关系,在其他条件相同时,改变反应温度,经过相同时间后测得CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g)正反应速率如图1所示。
1
2
3
4
①B、C两温度下反应速率变化的原因是____________________________
________,B、C点对应温度下,该反应的活化能Ea(B)_____Ea(C)(填“>”或“<”)。
温度过高时催化剂的催化活性
降低了
<
1
2
3
4
解析 其他条件相同时,温度越高反应速率本应越大,但由图1知,当温度高于433 K时反应速率反而降低了,其可能的原因是温度过高时催化剂的催化活性降低了,这样一来它使反应物活化能降低的能力减弱了,故活化能Ea(B)②写出两种能提高SO2的转化率的措施__________
____________________________________________。
1
2
3
4
适当降低
温度、增大CH4的浓度、分离出CO2(答案合理即可)
解析 可通过适当降低温度、增大CH4的浓度、分离出CO2等方面提高SO2的转化率。
(3)一定条件下,按不同的投料比X 向
某恒容密闭容器中充入CH4、SO2,测得SO2的转化率与温度、X的关系如图2所示。
①X1____X2(填“>”或“<”)。
1
2
3
4
>
②若T1时,开始时充入6 mol·L-1CH4、10 mol·L-1 SO2,投料比为X1,则平衡常数K=_____,若反应从开始达到平衡时所用时间为5 s,则此时间段内v(CH4)=_______________。
2.25
0.6 mol·L-1·s-1
解析 CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g)
开始浓度/mol·L-1 6 10 0 0
变化浓度/mol·L-1 3 6 3 6
平衡浓度/mol·L-1 3 4 3 6
由此计算出K=2.25。v(CH4)=0.6 mol·L-1·s-1。
1
2
3
4
(4)碱溶液也可以用于吸收SO2,若用200 mL、1 mol·L-1的NaOH溶液吸收0.1 mol SO2,则溶液中除H+外其他各离子浓度由大到小的顺序为______________________________;假设溶液中 =a,
则此时溶液的pH=________[用含a的数值表示,K2(H2SO3)=1×10-7]。
1
2
3
4
7+lg a
1
2
3
4
4.(2020·潍坊联考)铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有____对自旋方向相反的电子。
1
2
3
4
14
解析 Cu为29号元素,根据构造原理知其基态电子排布为1s22s22p63s23p6 3d104s1,则基态铜原子核外有14对自旋方向相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)______I1(Pb)(填“大于”或“小于”)。
1
2
3
4
大于
解析 金属性越强,越易失电子,第一电离能越小,Sn和Pb为同主族元素,且金属性Sn小于Pb,则第一电离能I1(Sn)大于I1(Pb)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是_________
___________________________。
1
2
3
4
4NH3===[Cu(NH3)4]2++2OH-
Cu(OH)2+
解析 碳碳三键中C原子价层电子对个数是2且不含孤电子对,所以杂化方式为sp;苯环中的碳形成3个σ键,无孤电子对,采取sp2杂化。
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子的杂化方式为________。
1
2
3
4
sp、sp2
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(Ⅰ),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(Ⅰ)中含_____个σ键。
1
2
3
4
14
解析 在氯化羰基亚铜(Ⅰ)中C和O之间有1个σ键,H2O分子内有2个σ键,配位键也是σ键,则氯化羰基亚铜(Ⅰ)中含14个σ键。
(6)Cu2O可用于半导体材料。
1
2
3
4
①Cu2O晶胞(如图所示)中,O原子的配位数为____;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标为______________。
4
(0.75,0.75,0.75)
解析 Cu2O晶胞中,O原子周围最靠近的Cu原子数目是4,则O原子的配
位数为4;a位置为顶点O原子和中心O原子的 处,且顶点O原子与a之间
的距离为体对角线的 ,已知a位置Cu+坐标为(0.25,0.25,0.75),即晶胞体
对角线长度为1,则b位置Cu+坐标为(0.75,0.75,0.75)。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_____
(填“高”或“低”),请解释原因_________________________________
_______________________________________。
1
2
3
4
高
两者都是离子晶体,O2-半径比S2-
半径小,所以Cu2O的晶格能更大,熔点更高
解析 Cu2S与Cu2O都是离子晶体,O2-半径比S2-半径小,所以Cu2O的晶格能更大,则Cu2O熔点更高。
题型四 物质结构与性质综合题的研究(选考)
甲方案:将产生的Cl2与足量AgNO3溶液反应,称量生成的AgCl质量,再进行计算得到余酸的量。
乙方案:采用酸碱中和滴定法测定余酸浓度。
丙方案:余酸与已知量CaCO3(过量)反应后,称量剩余的CaCO3质量。
丁方案:余酸与足量Zn反应,测量生成的H2体积。
A组(30分钟)
1
2
3
4
1.(2020·邯郸模拟)实验室常用MnO2与浓盐酸反应制备Cl2(反应主要装置如图一所示,其他装置省略)。当盐酸达到一个临界浓度时,反应就会停止。为测定反应残余液中盐酸的临界浓度,探究小组同学提出了下列实验方案:
具体操作:装配好仪器并检查装置气密性,接下来的操作依次是:
①往烧瓶中加入足量MnO2粉末
②往烧瓶中加入20 mL 12 mol·L-1浓盐酸
③加热使之充分反应。
(1)在实验室中,该发生装置除了可以用于制备Cl2,还可以制备
的气体是______。
A.O2 B.H2 C.CH2==CH2 D.HCl
若使用甲方案,产生的Cl2必须先通过盛有____________(填试剂名称)的洗气瓶, 再通入足量AgNO3溶液中,这样做的目的是__________________;已知AgClO易溶于水,写出Cl2与AgNO3溶液反应的化学方程式:_____________________
______________________。
1
2
3
4
D
饱和食盐水
除去挥发的HCl气体
Cl2+H2O+AgNO3===
AgCl↓+HClO+HNO3
解析 制氯气的装置是典型的固液加热或液液加热的制气装置,可制氯气和HCl;甲方案的原理是通过沉淀量计算出生成的氯气,再由氯气计算反应的HCl,让总量盐酸减去反应的盐酸得到剩余盐酸。若不除去挥发的HCl气体,得到的沉淀量会偏大。
1
2
3
4
(2)进行乙方案实验:准确量取残余清液,稀释5倍后作为试样。准确量取试样25.00 mL,用1.500 mol·L-1NaOH标准溶液滴定,选用合适的指示剂,消耗NaOH标准溶液23.00 mL,则由此计算得到盐酸的临界浓度为___mol·L-1 (保留两位有效数字);选用的合适指示剂是____。
A.石蕊 B.酚酞 C.甲基橙
1
2
3
4
6.9
C
解析 滴定指示剂一般不选石蕊,本题滴定虽属于强酸强碱的中和滴定,但盐酸中含有强酸弱碱盐MnCl2,若用酚酞,滴定终点偏碱性,此时Mn2+也会结合NaOH,导致用碱量偏大,所以只能选用甲基橙。
1
2
3
4
解析 根据题意碳酸锰的Ksp比碳酸钙小,其中有部分碳酸钙与锰离子反应转化成碳酸锰沉淀,碳酸锰的相对分子质量大于碳酸钙,相当于剩余固体质量变大,参加反应的碳酸钙减少,参加反应的盐酸也减少,由此计算得出剩余盐酸的浓度就偏小了。
(3)判断丙方案的实验结果,测得余酸的临界浓度_____(填“偏大”“偏小”或“无影响”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
1
2
3
4
偏小
解析 使Zn粒进入残余清液中让其发生反应。这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边。反应完毕时,要使气体冷却到室温,再调整量气管两端液面相平,最后平视刻度读数。
(4)进行丁方案实验:装置如图二所示(夹持器具已略去)。
(ⅰ)使Y形管中的残余清液与锌粒反应的正确操作是倾斜Y形管,将______转移到_________中。
(ⅱ)反应完毕,需要读出量气管中气体的体积,首先要______________,然后再__________________,最后视线与量气管刻度相平。
1
2
3
4
Zn粒
残余清液
气体冷却到室温
调整两气管液面相平
(5)综合评价:事实上,反应过程中盐酸浓度减小到临界浓度是由两个方面所致,一是反应消耗盐酸,二是盐酸挥发,以上四种实验方案中,盐酸挥发会对 ____方案带来实验误差(假设每一步实验操作均准确)。
A.甲 B.乙 C.丙 D.丁
1
2
3
4
甲
解析 方案甲是通过沉淀量计算出生成的氯气,再由氯气计算反应的HCl,让总量盐酸减去反应的盐酸,再减去挥发出的盐酸,才得到准确的剩余盐酸,而挥发的盐酸无法计算,所以,方案甲有误差,若直接测余酸浓度不用考虑盐酸的挥发,所以只有甲方案会受盐酸挥发影响。
1
2
3
4
2.(2020·泰安一模)苯乙烯是重要的基础有机化工原料。工业中以乙苯催化脱氢来制取苯乙烯:
ΔH=+117.6 kJ·mol-1
已知:上述反应的速率方程为v正=k正 p乙苯,v逆=k逆 p苯乙烯 p氢气,其中k正、k逆分别为正、逆反应速率常数,p为各组分分压。
(1)同时增大乙苯的反应速率和平衡转化率所采取的措施是_____。
1
2
3
4
升温
解析 乙苯催化脱氢反应正向是体积增大的吸热反应,同时增大乙苯的反应速率和平衡转化率所采取的措施有升温。
(2)在CO2气氛下,乙苯可催化脱氢制苯乙烯,其过程同时存在如图两种途径:
1
2
3
4
a=______;与掺水蒸汽工艺
相比,该工艺中还能够发生反应:CO2+H2===CO+H2O,CO2+C=== 2CO。新工艺的特点有_____(填字母)。
a.CO2与H2反应,使乙苯脱氢反应的化学平衡右移
b.不用高温水蒸气,可降低能量消耗
c.有利于减少生产过程中可能产生的积炭
d.CO2在反应体系中作催化剂
159.2
abc
加入的二氧化碳会发生反应CO2+C===2CO,有利于减少积炭,故c正确;
根据图示,二氧化碳反应生成了CO,不是催化剂,故d错误。
解析 由图片可知ΔH1=ΔH2+ΔH3=+117.6 kJ·mol-1+(+41.6 kJ·mol-1)=+159.2 kJ·mol-1,即a=159.2;CO2与H2反应,导致氢气浓度减小,有利于乙苯脱氢反应的化学平衡右移,故a正确;
1
2
3
4
由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少,故b正确;
(3)在实际生产中,往反应釜中同时通入乙苯和水蒸气,加入水蒸气稀释剂能提高乙苯转化率的原因是_____________________________________
_________________________________________。
1
2
3
4
体系总压不变时,加入水蒸气,相当于反
应体系减压,平衡正向移动,乙苯转化率增大
解析 体系总压不变时,加入水蒸气,相当于反应体系减压,平衡正向移动,乙苯转化率增大,因此在实际生产中,往反应釜中同时通入乙苯和水蒸气,能提高乙苯转化率。
(4)测得容器总压(p总)和乙苯转化率α随时间变化结果如图所示。平衡时,p(H2O)=_____kPa,平衡常数Kp=____kPa(用平衡分压代替平衡浓度计
算);a处的 =_____。
1
2
3
4
80
45
2.5
解析 设起始时n(乙苯)=a mol,n(H2O)=b mol,
1
2
3
4
起始量/mol a 0 0
变化量/mol 0.75a 0.75a 0.75a
平衡量/mol 0.25a 0.75a 0.75a
平衡时v正=v逆,即k正 p乙苯=k逆 p苯乙烯 p氢气,
1
2
3
4
a处:
起始量/mol a 0 0
变化量/mol 0.6a 0.6a 0.6a
平衡量/mol 0.4a 0.6a 0.6a
1
2
3
4
3.过氧化碳酰胺[CO(NH2)2·H2O2]是一种治疗尘肺病的药物。工业上合成过氧化碳酰胺的流程如图:
1
2
3
4
已知如下信息:
①合成原理:H2O2+CO(NH2)2 CO(NH2)2·H2O2。
②过氧化碳酰胺在极少量重金属离子存在下就会迅速分解。
请回答下列问题:
(1)合成时控制反应温度为30 ℃的原因可能是________________________
_____________________________________________________。
①温度过低,反应速率过
慢;②温度过高,双氧水分解速率加快,双氧水利用率降低
解析 从反应速率和双氧水分解两个角度分析:温度过低,反应速率过慢,温度过高,双氧水分解速率加快,双氧水的利用率降低。
1
2
3
4
(2)上述流程中,操作②④的名称分别为_________、______。
1
2
3
4
冷却结晶
洗涤
解析 题中所述流程中,操作①②③④⑤分别为减压蒸发、冷却结晶、过滤、洗涤、干燥。
(3)下列物质中,可以作稳定剂的是____(填字母)。
A.FeCl3 B.MnO2 C.NaH2PO4 D.K2S
1
2
3
4
C
解析 Fe3+是重金属离子,根据已知信息②,过氧化碳酰胺在Fe3+存在下会迅速分解;MnO2能催化双氧水分解;K2S具有还原性,能与双氧水反应,所以只有NaH2PO4可以作稳定剂。
解析 依题意,CrO5中铬为+6价,则可设CrO5中-1价的O原子有x个,则+6+(-1)×x+(-2)×(5-x)=0,解得x=4,故1个CrO5分子中有4个-1价氧原子和1个-2价氧原子,故存在2个过氧键。
(4)过氧化碳酰胺的鉴定反应:4H2O2+ +2H+===2CrO5(蓝色)+5H2O。已知该反应是非氧化还原反应,则1 mol CrO5中含____ mol过氧键(—O—O—键)。
1
2
3
4
2
①写出双氧水和KI在稀硫酸中反应的离子方程式:___________________
_________。
(5)测定成品中过氧化碳酰胺的含量:称取成品2.000 g溶于水,配成250 mL溶液;准确量取25.00 mL上述溶液于锥形瓶中,加入过量KI和少量稀硫酸,振荡,充分反应后,加入指示剂,再用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,滴定反应为 。三次平行实验的结果如下:
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
H2O2+2H++2I-===
I2+2H2O
解析 双氧水在酸性条件下氧化KI的离子方程式为H2O2+2H++2I-===I2+2H2O。
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
②过氧化碳酰胺与过量KI在稀硫酸中反应时,若振荡剧烈且时间较长,测定结果会_____(填“偏高”“偏低”或“无影响”)。
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
偏高
解析 过氧化碳酰胺与过量KI在稀硫酸中反应时,如果振荡剧烈且时间较长,会发生副反应O2+4H++4I-===2I2+2H2O,导致生成的I2增多,滴定时消耗Na2S2O3标准溶液的体积偏大,则测得的结果偏高。
③成品中过氧化碳酰胺的质量分数为________。
1
2
3
4
94.00%
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
解析 由三次平行实验的结果可得到V终-V始的值,第三次实验的误差太大,舍去,第一、二次实验结果可得V终-V始的平均值为40.00 mL,由
CO(NH2)2·H2O2~H2O2~I2~ 可知,n[CO(NH2)2·H2O2]= n(Na2S2O3)
= ×40.00 mL×10-3 L·mL-1×0.100 0 mol·L-1=2.000×10-3 mol,因此
成品中过氧化碳酰胺的质量分数为 ×100%=
94.00%。
1
2
3
4
实验序号
1
2
3
滴定前读数V始/mL
0.20
0.10
0.15
滴定终点读数V终/mL
40.22
40.08
42.15
解析 Mo处于第五周期ⅥB族,核外电子排布与Cr相似,其价电子为4d、5s电子,4d能级上有5个电子、5s能级上有1个电子,基态价电子排布式为4d55s1;核外未成对电子是4d、5s能级上的电子,有6个电子。
4.(2020·泰安一模)超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
1
2
3
4
(1)Mo处于第五周期ⅥB族,核外电子排布与Cr相似,它的基态价电子排布式是_______;核外未成对电子数是____个。
4d55s1
6
(2)该超分子中配体CO提供孤电子对的原子是____(填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有________。(已知吡啶可看作苯分子中的一个CH原子团被N取代的化合物)
1
2
3
4
C
sp2和sp3
解析 CO提供孤电子对的是C原子、Mo提供空轨道,两个原子形成配位键;p-甲酸丁酯吡啶配体中C原子价层电子对个数有4、3,根据价层电子对互斥理论,C原子杂化类型为sp3、sp2。
(3)已知:C60分子中存在碳碳单、双键;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。则一个C60分子的结构是由____个五边形和____个六边形组成的球体。用文字简述C60跟F2在一定条件下反应所得的物质的组成:________________
1
2
3
4
12
20
______________________________________________________________________________________________________________________________。
由C60结构和碳
的四个价键理论,可知一个碳需连接一个双键,一个双键被两个碳原子共用,故含有60÷2=30个双键,易与活泼的F2发生加成反应生成C60F60
1
2
3
4
解析 多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:V+F-E=2,即顶点数+面数-棱边数=2;设C60分子中五边形数为x,六边形数
为y。依题意可得方程组:
,解得:x=12,y=20,
即C60分子有12个五边形和20个六边形,由C60结构和碳的四个价键理论,可知一个碳需连接一个双键,一个双键被两个碳原子共用,故含有60÷2=30个双键,与活泼的F2发生加成反应即可生成C60F60。
(4)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点的原子坐标均可以为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及 。
根据以上信息,推断该晶体的原子堆积方式是________________。已知该晶体的密度是ρ g·cm-3,Mo的摩尔质量是M g·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间
的距离为_________________pm。
1
2
3
4
体心立方密堆积
1
2
3
4
B组(30分钟)
1.(2019·潍坊二模)无水MgBr2常用作催化剂。某化学小组在实验室选用下图所示装置(夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
1
2
3
4
1
2
3
4
已知:①在浓硫酸存在下,加热到140 ℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170 ℃时乙醇脱水生成CH2==CH2。
②乙醚的熔点为34.6 ℃,沸点为132 ℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应:MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5。
实验主要步骤如下:
Ⅰ.选用上述部分装置,正确连接,检查
装置的气密性。向装置中加入药品。
Ⅱ.加热装置A,迅速升温至140 ℃,并保
持140 ℃加热一段时间,停止加热。
Ⅲ.通入干燥的氮气,让液溴缓慢进入装
置B中,直至完全加入。
Ⅳ.装置B中反应完毕后恢复至室温,过滤
反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
Ⅴ.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160 ℃分解得无水MgBr2。
1
2
3
4
回答下列问题:
(1)装置A中使用仪器m的优点是__________________________________
______。
(2)步骤Ⅰ中所选装置的正确连接顺序是a_________________________(填小写字母)。装置D的作用是_________。
1
2
3
4
使系统内外压强相等,便于液体顺利
流下
efbcg(ef可颠倒、bc可颠倒)
防止倒吸
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是___________________________。
(4)步骤Ⅴ中用苯洗涤三乙醚合溴化镁的目的是_______________。
1
2
3
4
停止加热,冷却后补加碎瓷片
除去乙醚和乙醇
(5)步骤Ⅴ采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是_____(填序号)。
1
2
3
4
bc
(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______________________________________________________
______________________________________________________________________。
1
2
3
4
取少量CH2Br—CH2Br于试管中,加入NaOH溶液,加热,再加入稀硝酸酸化,滴加AgNO3溶液,有淡黄色沉淀生成证明有CH2Br—CH2Br
2.(2019·济南三模)磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)下图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程Ⅰ中,被还原的元素是_______(填元素符号),过程Ⅲ的化学方程式为____________
__________________________________。
1
2
3
4
Cu、P
2Ca3(PO4)2+
6SiO2+10C===6CaSiO3+10CO↑+P4
①复合材料中V的化合价为____,C的作用是_____________________。
②V2O5与H2C2O4反应生成V2(C2O4)3的化学方程式为__________________
__________________________;“洗涤”时用乙醇而不用水的目的是_____________。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是常用的电极材料,其制备流程如下:
1
2
3
4
+3
增强复合材料的导电性
V2O5+5H2C2O4===
V2(C2O4)3+4CO2↑+5H2O
减少产品损耗
③锂离子电池是一种二次电池,又称“摇椅”电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=== Li3V2(PO4)3+C6,则电池充电时阳极的电极反应式为_________________
______________________。
1
2
3
4
Li3V2(PO4)3-xe-
===Li3-xV2(PO4)3+xLi+
3.研究SO2的回收、再利用,既有利于良好大气环境的获得,也有利于社会可持续发展的实现。
(1)已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1
②S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
则CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g) ΔH=_____________。
1
2
3
4
-208 kJ·mol-1
解析 用①-2×②即可得到CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g) ΔH=-208 kJ·mol-1。
(2)为研究某催化剂X的催化活性与温度的关系,在其他条件相同时,改变反应温度,经过相同时间后测得CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g)正反应速率如图1所示。
1
2
3
4
①B、C两温度下反应速率变化的原因是____________________________
________,B、C点对应温度下,该反应的活化能Ea(B)_____Ea(C)(填“>”或“<”)。
温度过高时催化剂的催化活性
降低了
<
1
2
3
4
解析 其他条件相同时,温度越高反应速率本应越大,但由图1知,当温度高于433 K时反应速率反而降低了,其可能的原因是温度过高时催化剂的催化活性降低了,这样一来它使反应物活化能降低的能力减弱了,故活化能Ea(B)
____________________________________________。
1
2
3
4
适当降低
温度、增大CH4的浓度、分离出CO2(答案合理即可)
解析 可通过适当降低温度、增大CH4的浓度、分离出CO2等方面提高SO2的转化率。
(3)一定条件下,按不同的投料比X 向
某恒容密闭容器中充入CH4、SO2,测得SO2的转化率与温度、X的关系如图2所示。
①X1____X2(填“>”或“<”)。
1
2
3
4
>
②若T1时,开始时充入6 mol·L-1CH4、10 mol·L-1 SO2,投料比为X1,则平衡常数K=_____,若反应从开始达到平衡时所用时间为5 s,则此时间段内v(CH4)=_______________。
2.25
0.6 mol·L-1·s-1
解析 CH4(g)+2SO2(g) CO2(g)+2S(s)+2H2O(g)
开始浓度/mol·L-1 6 10 0 0
变化浓度/mol·L-1 3 6 3 6
平衡浓度/mol·L-1 3 4 3 6
由此计算出K=2.25。v(CH4)=0.6 mol·L-1·s-1。
1
2
3
4
(4)碱溶液也可以用于吸收SO2,若用200 mL、1 mol·L-1的NaOH溶液吸收0.1 mol SO2,则溶液中除H+外其他各离子浓度由大到小的顺序为______________________________;假设溶液中 =a,
则此时溶液的pH=________[用含a的数值表示,K2(H2SO3)=1×10-7]。
1
2
3
4
7+lg a
1
2
3
4
4.(2020·潍坊联考)铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有____对自旋方向相反的电子。
1
2
3
4
14
解析 Cu为29号元素,根据构造原理知其基态电子排布为1s22s22p63s23p6 3d104s1,则基态铜原子核外有14对自旋方向相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)______I1(Pb)(填“大于”或“小于”)。
1
2
3
4
大于
解析 金属性越强,越易失电子,第一电离能越小,Sn和Pb为同主族元素,且金属性Sn小于Pb,则第一电离能I1(Sn)大于I1(Pb)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是_________
___________________________。
1
2
3
4
4NH3===[Cu(NH3)4]2++2OH-
Cu(OH)2+
解析 碳碳三键中C原子价层电子对个数是2且不含孤电子对,所以杂化方式为sp;苯环中的碳形成3个σ键,无孤电子对,采取sp2杂化。
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子的杂化方式为________。
1
2
3
4
sp、sp2
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(Ⅰ),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(Ⅰ)中含_____个σ键。
1
2
3
4
14
解析 在氯化羰基亚铜(Ⅰ)中C和O之间有1个σ键,H2O分子内有2个σ键,配位键也是σ键,则氯化羰基亚铜(Ⅰ)中含14个σ键。
(6)Cu2O可用于半导体材料。
1
2
3
4
①Cu2O晶胞(如图所示)中,O原子的配位数为____;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标为______________。
4
(0.75,0.75,0.75)
解析 Cu2O晶胞中,O原子周围最靠近的Cu原子数目是4,则O原子的配
位数为4;a位置为顶点O原子和中心O原子的 处,且顶点O原子与a之间
的距离为体对角线的 ,已知a位置Cu+坐标为(0.25,0.25,0.75),即晶胞体
对角线长度为1,则b位置Cu+坐标为(0.75,0.75,0.75)。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_____
(填“高”或“低”),请解释原因_________________________________
_______________________________________。
1
2
3
4
高
两者都是离子晶体,O2-半径比S2-
半径小,所以Cu2O的晶格能更大,熔点更高
解析 Cu2S与Cu2O都是离子晶体,O2-半径比S2-半径小,所以Cu2O的晶格能更大,则Cu2O熔点更高。
同课章节目录
