第3讲 研究方法步骤 模块1 分离、提纯、李比希法 讲义 2020-2021学年人教版高二化学选修五
文档属性
| 名称 | 第3讲 研究方法步骤 模块1 分离、提纯、李比希法 讲义 2020-2021学年人教版高二化学选修五 |

|
|
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览


文档简介
第3讲
研究有机物的方法和步骤
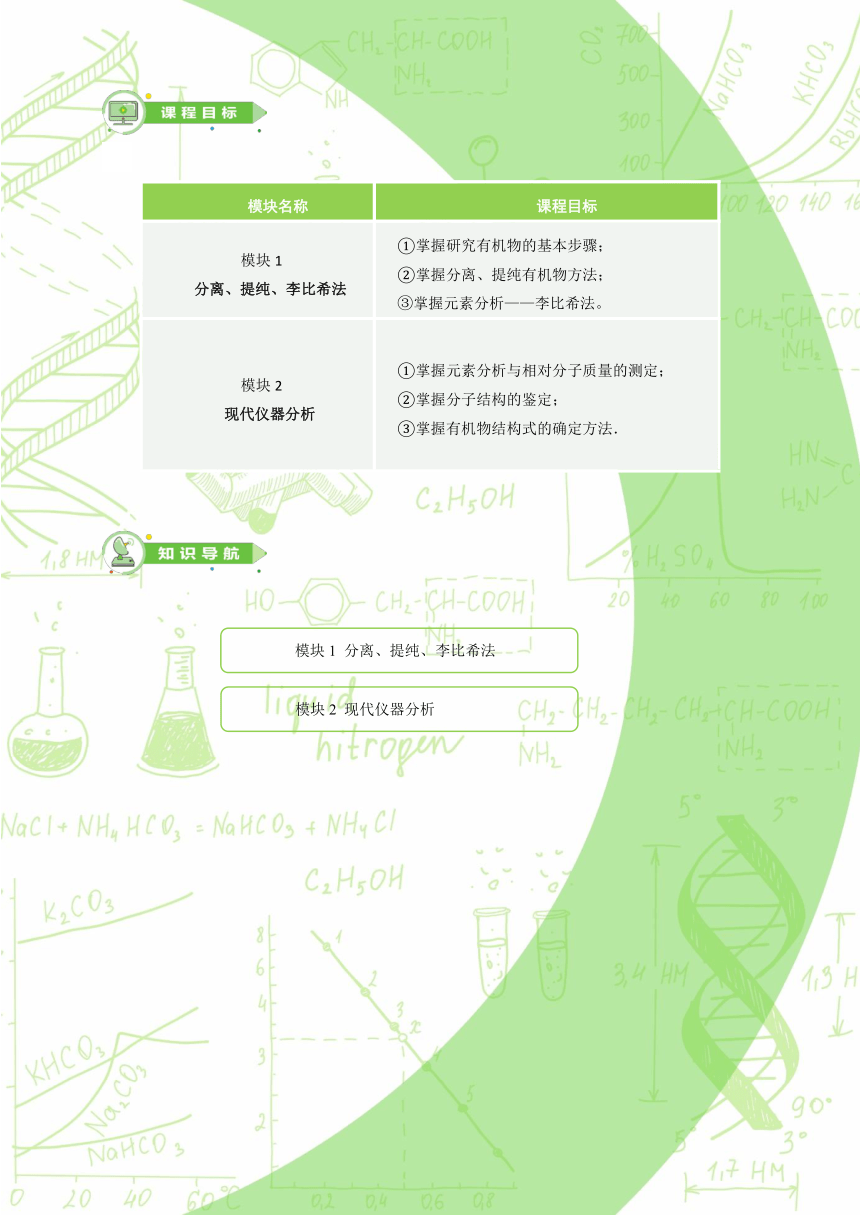
模块名称
课程目标
模块1
分离、提纯、李比希法
①掌握研究有机物的基本步骤;
②掌握分离、提纯有机物方法;
③掌握元素分析——李比希法。
模块2
现代仪器分析
①掌握元素分析与相对分子质量的测定;
②掌握分子结构的鉴定;
③掌握有机物结构式的确定方法.
20
21
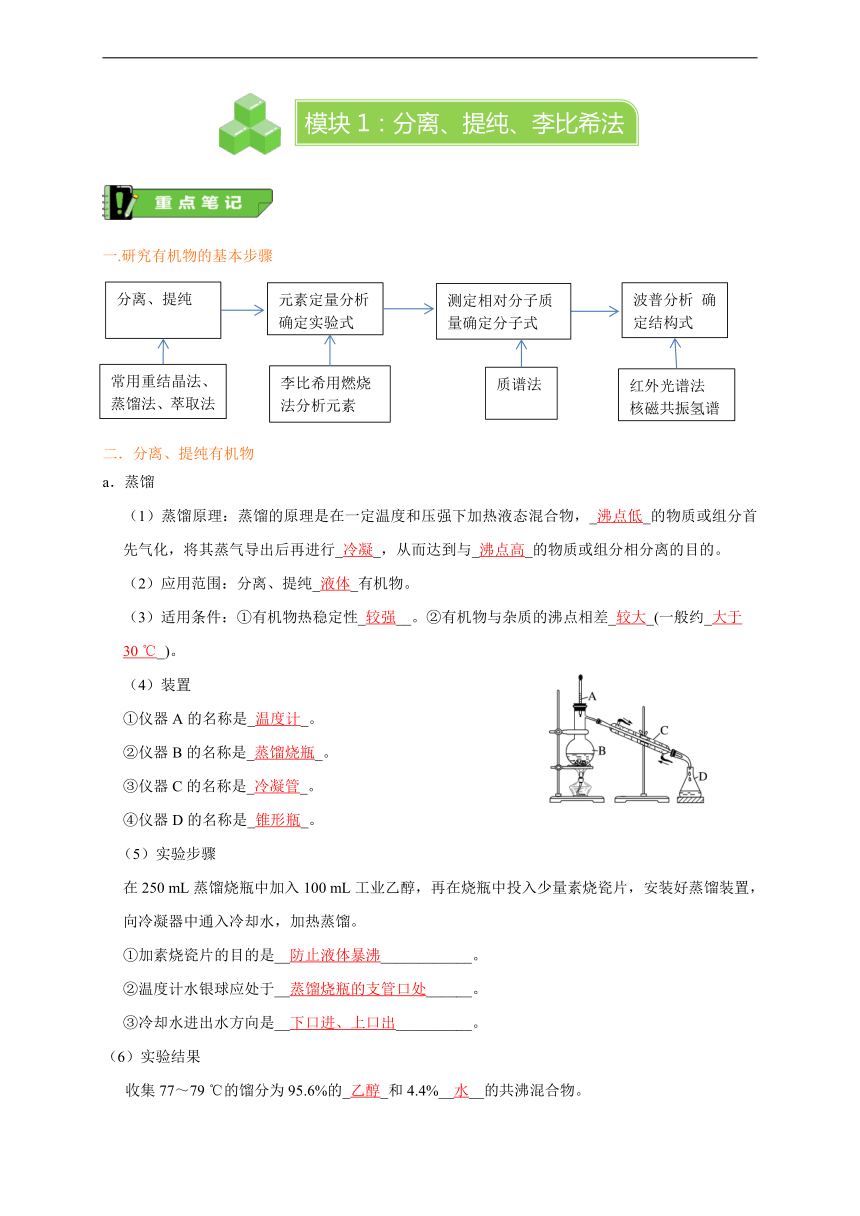
一.研究有机物的基本步骤
二.分离、提纯有机物
a.蒸馏
(1)蒸馏原理:蒸馏的原理是在一定温度和压强下加热液态混合物,_沸点低_的物质或组分首先气化,将其蒸气导出后再进行_冷凝_,从而达到与_沸点高_的物质或组分相分离的目的。
(2)应用范围:分离、提纯_液体_有机物。
(3)适用条件:①有机物热稳定性_较强__。②有机物与杂质的沸点相差_较大_(一般约_大于30
℃_)。
(4)装置[
①仪器A的名称是_温度计_。
②仪器B的名称是_蒸馏烧瓶_。
③仪器C的名称是_冷凝管_。
④仪器D的名称是_锥形瓶_。
(5)实验步骤
在250
mL蒸馏烧瓶中加入100
mL工业乙醇,再在烧瓶中投入少量素烧瓷片,安装好蒸馏装置,向冷凝器中通入冷却水,加热蒸馏。
①加素烧瓷片的目的是__防止液体暴沸____________。
②温度计水银球应处于__蒸馏烧瓶的支管口处______。
③冷却水进出水方向是__下口进、上口出__________。
(6)实验结果
收集77~79
℃的馏分为95.6%的_乙醇_和4.4%__水__的共沸混合物。
b.重结晶
(1)重结晶原理
利用有机物和杂质在同一溶剂中_溶解度随温度的变化__相差较大,采用冷却或蒸发将有机物分离出来,是提纯_固体_有机物的常用方法。
(2)应用范围:提纯_固体_有机物。
(3)适用条件
①杂质在此溶剂中溶解度_很小或溶解度很大_,易除去。
②被提纯的有机物在该溶剂中的溶解度受温度的影响__较大__。
(4)装置与步骤。
___加热溶解__→趁热过滤→____冷却结晶______
3.萃取
(1)原理
①液—液萃取:利用有机物在_两种互不相溶_的溶剂中的_溶解性__不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用_有机溶剂_从固体物质中溶解出有机物的过程。
(2)装置
选择有机化合物分离提纯的方法
1.首先要熟记各种分离和提纯方法的适用范围。常见的分离和提纯有机物的方法及适用范围如下表。
方法
适用范围
分液
互不相溶、分层的两种液体
萃取
同温度下溶质在两种互不相溶的溶剂中的溶解度相差很大
蒸馏
液态有机物与杂质的沸点相差较大(一般大于30
℃)且热稳定性强
重结晶
被提纯有机物的溶解度受温度影响较大而杂质的溶解度受温度影响不大
2.研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
(1)蒸馏是物理变化。
(2)蒸馏时接收汽凝液的容器应用小口容器(如锥形瓶),以减少汽凝液的挥发。
(3)萃取常在分液漏斗中进行,分液是萃取操作的一个步骤,必须经过充分振荡后再静置分层。
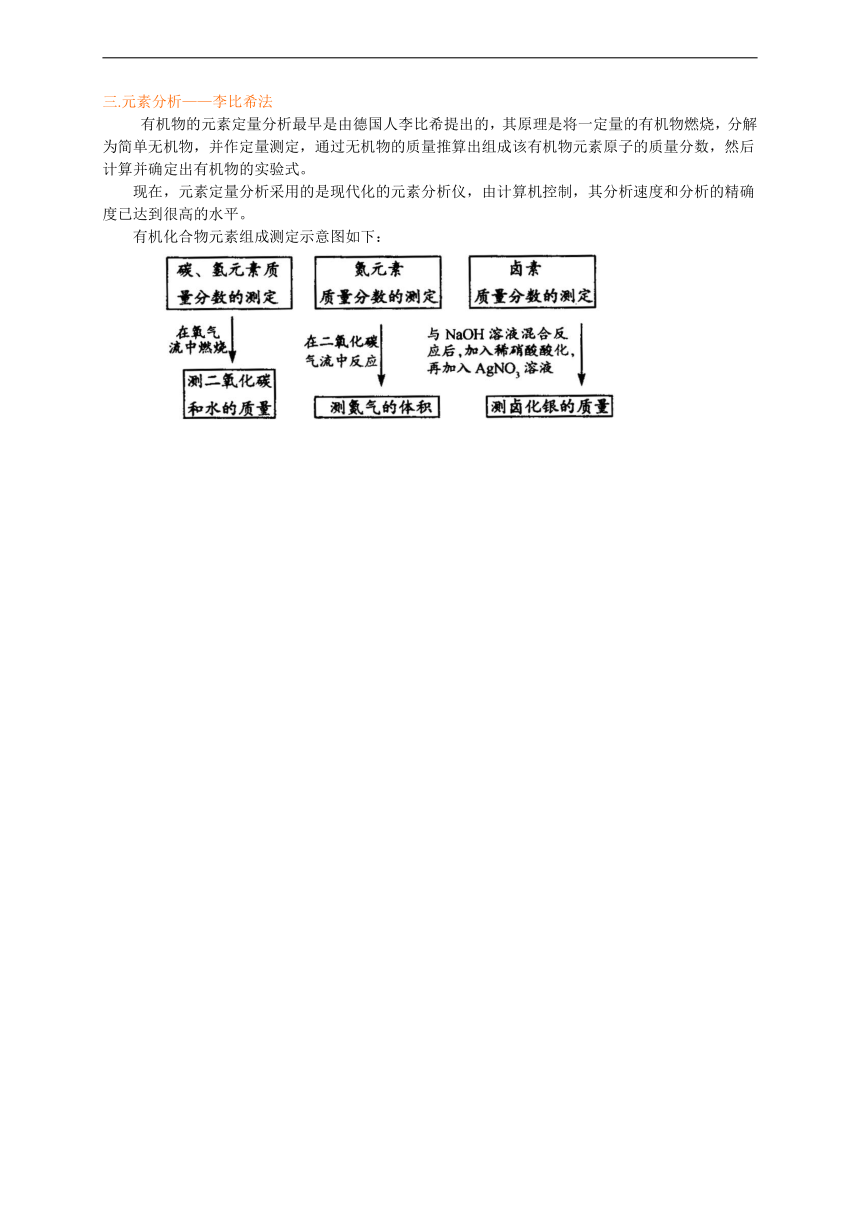
三.元素分析——李比希法
有机物的元素定量分析最早是由德国人李比希提出的,其原理是将一定量的有机物燃烧,分解为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算并确定出有机物的实验式。
现在,元素定量分析采用的是现代化的元素分析仪,由计算机控制,其分析速度和分析的精确度已达到很高的水平。
有机化合物元素组成测定示意图如下:
现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法是(
)。
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液
B.升华
C.重结晶
D.分液
E.蒸馏
F.过滤
(1)________,分离饱和食盐水与沙子的混合物;
(2)________,从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)________,分离水和汽油的混合物;
(4)________,分离CCl4(沸点76.75℃)和甲苯(110.6℃)的混合物。
和的一些物理性质如下表所示:
物质
熔点/℃
沸点/℃
密度/g·
cm-3
水溶性
-10
212
1.162
2
不溶
54
238
1.158
1
不溶
(1)分离这两种物质的混合物可采用的方法是________(填字母)。
a.过滤
b.分液
c.蒸发
d.蒸馏
(2)实验需要用到的主要玻璃仪器是_______、_______、________、________、________、牛角管。
有A、B两种互溶的化合物,均不溶于水且密度均比水小,常温下A、B均为液体,且B的沸点比A高,A不与NaOH溶液反应,B与NaOH溶液作用生成水和可溶性的C,C与盐酸作用得到NaCl和B,分离A和B的混合物,可采用下列方法:
(1)利用这两种化合物与某种试剂作用的差异,可采用的相关实验操作的正确顺序是 (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是A; (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是B。?
可供选择的操作有:①向分液漏斗中加入稀盐酸;②向分液漏斗中加入A和B的混合物;③向分液漏斗中加入氢氧化钠溶液;④充分振荡混合液,静置、分液;⑤将烧杯中的液体重新倒回分液漏斗中。
(2)利用这两种化合物沸点的不同,可采用蒸馏的方法加以分离,实验中需要用到的仪器有:铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、接液管、 、 、 (实验中备有必要的导管和橡皮塞)。首先蒸馏出来的液体是 (填“A”或“B”)。?
研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置。
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是________。
(2)C装置中浓硫酸的作用是________。
(3)D装置中MnO2的作用是________。
(4)燃烧管中CuO的作用是________。
(5)若准确称取0.90
g样品(含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32
g,B管质量增加0.54
g,则该有机物的实验式为________。
(6)要确定该有机物的分子式,还要知道________。
某种有机物在气态时对H:的相对密度为30,充分燃烧3.0
g此有机物可得3.36
L二氧化碳(标准状况)和3.6
g水。此有机物能与金属钠反应,求此有机物的分子式和结构简式。
一.研究有机物的基本步骤
二.分离、提纯有机物
a.蒸馏
(1)蒸馏原理:蒸馏的原理是在一定温度和压强下加热液态混合物,_沸点低_的物质或组分首先气化,将其蒸气导出后再进行_冷凝_,从而达到与_沸点高_的物质或组分相分离的目的。
(2)应用范围:分离、提纯_液体_有机物。
(3)适用条件:①有机物热稳定性_较强__。②有机物与杂质的沸点相差_较大_(一般约_大于30
℃_)。
(4)装置[
①仪器A的名称是_温度计_。
②仪器B的名称是_蒸馏烧瓶_。
③仪器C的名称是_冷凝管_。
④仪器D的名称是_锥形瓶_。
(5)实验步骤
在250
mL蒸馏烧瓶中加入100
mL工业乙醇,再在烧瓶中投入少量素烧瓷片,安装好蒸馏装置,向冷凝器中通入冷却水,加热蒸馏。
①加素烧瓷片的目的是__防止液体暴沸____________。
②温度计水银球应处于__蒸馏烧瓶的支管口处______。
③冷却水进出水方向是__下口进、上口出__________。
(6)实验结果
收集77~79
℃的馏分为95.6%的_乙醇_和4.4%__水__的共沸混合物。
b.重结晶
(1)重结晶原理
利用有机物和杂质在同一溶剂中_溶解度随温度的变化__相差较大,采用冷却或蒸发将有机物分离出来,是提纯_固体_有机物的常用方法。
(2)应用范围:提纯_固体_有机物。
(3)适用条件
①杂质在此溶剂中溶解度_很小或溶解度很大_,易除去。
②被提纯的有机物在该溶剂中的溶解度受温度的影响__较大__。
(4)装置与步骤。
___加热溶解__→趁热过滤→____冷却结晶______
3.萃取
(1)原理
①液—液萃取:利用有机物在_两种互不相溶_的溶剂中的_溶解性__不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用_有机溶剂_从固体物质中溶解出有机物的过程。
(2)装置
选择有机化合物分离提纯的方法
1.首先要熟记各种分离和提纯方法的适用范围。常见的分离和提纯有机物的方法及适用范围如下表。
方法
适用范围
分液
互不相溶、分层的两种液体
萃取
同温度下溶质在两种互不相溶的溶剂中的溶解度相差很大
蒸馏
液态有机物与杂质的沸点相差较大(一般大于30
℃)且热稳定性强
重结晶
被提纯有机物的溶解度受温度影响较大而杂质的溶解度受温度影响不大
2.研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
(1)蒸馏是物理变化。
(2)蒸馏时接收汽凝液的容器应用小口容器(如锥形瓶),以减少汽凝液的挥发。
(3)萃取常在分液漏斗中进行,分液是萃取操作的一个步骤,必须经过充分振荡后再静置分层。
三.元素分析——李比希法
有机物的元素定量分析最早是由德国人李比希提出的,其原理是将一定量的有机物燃烧,分解为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算并确定出有机物的实验式。
现在,元素定量分析采用的是现代化的元素分析仪,由计算机控制,其分析速度和分析的精确度已达到很高的水平。
有机化合物元素组成测定示意图如下:
现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法是(
C
)。
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液
B.升华
C.重结晶
D.分液
E.蒸馏
F.过滤
(1)____F____,分离饱和食盐水与沙子的混合物;
(2)_____C___,从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)____D____,分离水和汽油的混合物;
(4)____E____,分离CCl4(沸点76.75℃)和甲苯(110.6℃)的混合物。
和的一些物理性质如下表所示:
物质
熔点/℃
沸点/℃
密度/g·
cm-3
水溶性
-10
212
1.162
2
不溶
54
238
1.158
1
不溶
(1)分离这两种物质的混合物可采用的方法是____d____(填字母)。
a.过滤
b.分液
c.蒸发
d.蒸馏
(2)实验需要用到的主要玻璃仪器是_酒精灯、蒸馏烧瓶、冷凝管、温度计、锥形瓶_、牛角管。
有A、B两种互溶的化合物,均不溶于水且密度均比水小,常温下A、B均为液体,且B的沸点比A高,A不与NaOH溶液反应,B与NaOH溶液作用生成水和可溶性的C,C与盐酸作用得到NaCl和B,分离A和B的混合物,可采用下列方法:
(1)利用这两种化合物与某种试剂作用的差异,可采用的相关实验操作的正确顺序是 2、3、4 (填序号),从分液漏斗的上(填“上”或“下”)层分离出的液体是A;5、1、4 (填序号),从分液漏斗的 上 (填“上”或“下”)层分离出的液体是B。?
可供选择的操作有:①向分液漏斗中加入稀盐酸;②向分液漏斗中加入A和B的混合物;③向分液漏斗中加入氢氧化钠溶液;④充分振荡混合液,静置、分液;⑤将烧杯中的液体重新倒回分液漏斗中。
(2)利用这两种化合物沸点的不同,可采用蒸馏的方法加以分离,实验中需要用到的仪器有:铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、接液管、冷凝管 、 温度计 、 锥形瓶 (实验中备有必要的导管和橡皮塞)。首先蒸馏出来的液体是 A (填“A”或“B”)。?
研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置。
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是g-f,e-h,i-c(或d),d(或c)-a(或b),
b(或a)。
(2)C装置中浓硫酸的作用是_吸收水分,干燥氧气__。
(3)D装置中MnO2的作用是催化剂,加快O2的生成速率。(2)
(4)燃烧管中CuO的作用是使有机物充分氧化生成CO2和H2O。
(5)若准确称取0.90
g样品(含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32
g,B管质量增加0.54
g,则该有机物的实验式为CH2O。
(6)要确定该有机物的分子式,还要知道有机物的相对分子质量。
某种有机物在气态时对H:的相对密度为30,充分燃烧3.0
g此有机物可得3.36
L二氧化碳(标准状况)和3.6
g水。此有机物能与金属钠反应,求此有机物的分子式和结构简式。
分子式为C3H8O
结构简式为CH3CH2CH2OH或
20
研究有机物的方法和步骤
模块名称
课程目标
模块1
分离、提纯、李比希法
①掌握研究有机物的基本步骤;
②掌握分离、提纯有机物方法;
③掌握元素分析——李比希法。
模块2
现代仪器分析
①掌握元素分析与相对分子质量的测定;
②掌握分子结构的鉴定;
③掌握有机物结构式的确定方法.
20
21
一.研究有机物的基本步骤
二.分离、提纯有机物
a.蒸馏
(1)蒸馏原理:蒸馏的原理是在一定温度和压强下加热液态混合物,_沸点低_的物质或组分首先气化,将其蒸气导出后再进行_冷凝_,从而达到与_沸点高_的物质或组分相分离的目的。
(2)应用范围:分离、提纯_液体_有机物。
(3)适用条件:①有机物热稳定性_较强__。②有机物与杂质的沸点相差_较大_(一般约_大于30
℃_)。
(4)装置[
①仪器A的名称是_温度计_。
②仪器B的名称是_蒸馏烧瓶_。
③仪器C的名称是_冷凝管_。
④仪器D的名称是_锥形瓶_。
(5)实验步骤
在250
mL蒸馏烧瓶中加入100
mL工业乙醇,再在烧瓶中投入少量素烧瓷片,安装好蒸馏装置,向冷凝器中通入冷却水,加热蒸馏。
①加素烧瓷片的目的是__防止液体暴沸____________。
②温度计水银球应处于__蒸馏烧瓶的支管口处______。
③冷却水进出水方向是__下口进、上口出__________。
(6)实验结果
收集77~79
℃的馏分为95.6%的_乙醇_和4.4%__水__的共沸混合物。
b.重结晶
(1)重结晶原理
利用有机物和杂质在同一溶剂中_溶解度随温度的变化__相差较大,采用冷却或蒸发将有机物分离出来,是提纯_固体_有机物的常用方法。
(2)应用范围:提纯_固体_有机物。
(3)适用条件
①杂质在此溶剂中溶解度_很小或溶解度很大_,易除去。
②被提纯的有机物在该溶剂中的溶解度受温度的影响__较大__。
(4)装置与步骤。
___加热溶解__→趁热过滤→____冷却结晶______
3.萃取
(1)原理
①液—液萃取:利用有机物在_两种互不相溶_的溶剂中的_溶解性__不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用_有机溶剂_从固体物质中溶解出有机物的过程。
(2)装置
选择有机化合物分离提纯的方法
1.首先要熟记各种分离和提纯方法的适用范围。常见的分离和提纯有机物的方法及适用范围如下表。
方法
适用范围
分液
互不相溶、分层的两种液体
萃取
同温度下溶质在两种互不相溶的溶剂中的溶解度相差很大
蒸馏
液态有机物与杂质的沸点相差较大(一般大于30
℃)且热稳定性强
重结晶
被提纯有机物的溶解度受温度影响较大而杂质的溶解度受温度影响不大
2.研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
(1)蒸馏是物理变化。
(2)蒸馏时接收汽凝液的容器应用小口容器(如锥形瓶),以减少汽凝液的挥发。
(3)萃取常在分液漏斗中进行,分液是萃取操作的一个步骤,必须经过充分振荡后再静置分层。
三.元素分析——李比希法
有机物的元素定量分析最早是由德国人李比希提出的,其原理是将一定量的有机物燃烧,分解为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算并确定出有机物的实验式。
现在,元素定量分析采用的是现代化的元素分析仪,由计算机控制,其分析速度和分析的精确度已达到很高的水平。
有机化合物元素组成测定示意图如下:
现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法是(
)。
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液
B.升华
C.重结晶
D.分液
E.蒸馏
F.过滤
(1)________,分离饱和食盐水与沙子的混合物;
(2)________,从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)________,分离水和汽油的混合物;
(4)________,分离CCl4(沸点76.75℃)和甲苯(110.6℃)的混合物。
和的一些物理性质如下表所示:
物质
熔点/℃
沸点/℃
密度/g·
cm-3
水溶性
-10
212
1.162
2
不溶
54
238
1.158
1
不溶
(1)分离这两种物质的混合物可采用的方法是________(填字母)。
a.过滤
b.分液
c.蒸发
d.蒸馏
(2)实验需要用到的主要玻璃仪器是_______、_______、________、________、________、牛角管。
有A、B两种互溶的化合物,均不溶于水且密度均比水小,常温下A、B均为液体,且B的沸点比A高,A不与NaOH溶液反应,B与NaOH溶液作用生成水和可溶性的C,C与盐酸作用得到NaCl和B,分离A和B的混合物,可采用下列方法:
(1)利用这两种化合物与某种试剂作用的差异,可采用的相关实验操作的正确顺序是 (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是A; (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是B。?
可供选择的操作有:①向分液漏斗中加入稀盐酸;②向分液漏斗中加入A和B的混合物;③向分液漏斗中加入氢氧化钠溶液;④充分振荡混合液,静置、分液;⑤将烧杯中的液体重新倒回分液漏斗中。
(2)利用这两种化合物沸点的不同,可采用蒸馏的方法加以分离,实验中需要用到的仪器有:铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、接液管、 、 、 (实验中备有必要的导管和橡皮塞)。首先蒸馏出来的液体是 (填“A”或“B”)。?
研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置。
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是________。
(2)C装置中浓硫酸的作用是________。
(3)D装置中MnO2的作用是________。
(4)燃烧管中CuO的作用是________。
(5)若准确称取0.90
g样品(含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32
g,B管质量增加0.54
g,则该有机物的实验式为________。
(6)要确定该有机物的分子式,还要知道________。
某种有机物在气态时对H:的相对密度为30,充分燃烧3.0
g此有机物可得3.36
L二氧化碳(标准状况)和3.6
g水。此有机物能与金属钠反应,求此有机物的分子式和结构简式。
一.研究有机物的基本步骤
二.分离、提纯有机物
a.蒸馏
(1)蒸馏原理:蒸馏的原理是在一定温度和压强下加热液态混合物,_沸点低_的物质或组分首先气化,将其蒸气导出后再进行_冷凝_,从而达到与_沸点高_的物质或组分相分离的目的。
(2)应用范围:分离、提纯_液体_有机物。
(3)适用条件:①有机物热稳定性_较强__。②有机物与杂质的沸点相差_较大_(一般约_大于30
℃_)。
(4)装置[
①仪器A的名称是_温度计_。
②仪器B的名称是_蒸馏烧瓶_。
③仪器C的名称是_冷凝管_。
④仪器D的名称是_锥形瓶_。
(5)实验步骤
在250
mL蒸馏烧瓶中加入100
mL工业乙醇,再在烧瓶中投入少量素烧瓷片,安装好蒸馏装置,向冷凝器中通入冷却水,加热蒸馏。
①加素烧瓷片的目的是__防止液体暴沸____________。
②温度计水银球应处于__蒸馏烧瓶的支管口处______。
③冷却水进出水方向是__下口进、上口出__________。
(6)实验结果
收集77~79
℃的馏分为95.6%的_乙醇_和4.4%__水__的共沸混合物。
b.重结晶
(1)重结晶原理
利用有机物和杂质在同一溶剂中_溶解度随温度的变化__相差较大,采用冷却或蒸发将有机物分离出来,是提纯_固体_有机物的常用方法。
(2)应用范围:提纯_固体_有机物。
(3)适用条件
①杂质在此溶剂中溶解度_很小或溶解度很大_,易除去。
②被提纯的有机物在该溶剂中的溶解度受温度的影响__较大__。
(4)装置与步骤。
___加热溶解__→趁热过滤→____冷却结晶______
3.萃取
(1)原理
①液—液萃取:利用有机物在_两种互不相溶_的溶剂中的_溶解性__不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用_有机溶剂_从固体物质中溶解出有机物的过程。
(2)装置
选择有机化合物分离提纯的方法
1.首先要熟记各种分离和提纯方法的适用范围。常见的分离和提纯有机物的方法及适用范围如下表。
方法
适用范围
分液
互不相溶、分层的两种液体
萃取
同温度下溶质在两种互不相溶的溶剂中的溶解度相差很大
蒸馏
液态有机物与杂质的沸点相差较大(一般大于30
℃)且热稳定性强
重结晶
被提纯有机物的溶解度受温度影响较大而杂质的溶解度受温度影响不大
2.研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
(1)蒸馏是物理变化。
(2)蒸馏时接收汽凝液的容器应用小口容器(如锥形瓶),以减少汽凝液的挥发。
(3)萃取常在分液漏斗中进行,分液是萃取操作的一个步骤,必须经过充分振荡后再静置分层。
三.元素分析——李比希法
有机物的元素定量分析最早是由德国人李比希提出的,其原理是将一定量的有机物燃烧,分解为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算并确定出有机物的实验式。
现在,元素定量分析采用的是现代化的元素分析仪,由计算机控制,其分析速度和分析的精确度已达到很高的水平。
有机化合物元素组成测定示意图如下:
现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法是(
C
)。
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液
B.升华
C.重结晶
D.分液
E.蒸馏
F.过滤
(1)____F____,分离饱和食盐水与沙子的混合物;
(2)_____C___,从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)____D____,分离水和汽油的混合物;
(4)____E____,分离CCl4(沸点76.75℃)和甲苯(110.6℃)的混合物。
和的一些物理性质如下表所示:
物质
熔点/℃
沸点/℃
密度/g·
cm-3
水溶性
-10
212
1.162
2
不溶
54
238
1.158
1
不溶
(1)分离这两种物质的混合物可采用的方法是____d____(填字母)。
a.过滤
b.分液
c.蒸发
d.蒸馏
(2)实验需要用到的主要玻璃仪器是_酒精灯、蒸馏烧瓶、冷凝管、温度计、锥形瓶_、牛角管。
有A、B两种互溶的化合物,均不溶于水且密度均比水小,常温下A、B均为液体,且B的沸点比A高,A不与NaOH溶液反应,B与NaOH溶液作用生成水和可溶性的C,C与盐酸作用得到NaCl和B,分离A和B的混合物,可采用下列方法:
(1)利用这两种化合物与某种试剂作用的差异,可采用的相关实验操作的正确顺序是 2、3、4 (填序号),从分液漏斗的上(填“上”或“下”)层分离出的液体是A;5、1、4 (填序号),从分液漏斗的 上 (填“上”或“下”)层分离出的液体是B。?
可供选择的操作有:①向分液漏斗中加入稀盐酸;②向分液漏斗中加入A和B的混合物;③向分液漏斗中加入氢氧化钠溶液;④充分振荡混合液,静置、分液;⑤将烧杯中的液体重新倒回分液漏斗中。
(2)利用这两种化合物沸点的不同,可采用蒸馏的方法加以分离,实验中需要用到的仪器有:铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、接液管、冷凝管 、 温度计 、 锥形瓶 (实验中备有必要的导管和橡皮塞)。首先蒸馏出来的液体是 A (填“A”或“B”)。?
研究给定混合物的状态,溶解性、熔沸点的差异等,选择与以上适用范围相匹配的方法即可。
电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置。
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是g-f,e-h,i-c(或d),d(或c)-a(或b),
b(或a)。
(2)C装置中浓硫酸的作用是_吸收水分,干燥氧气__。
(3)D装置中MnO2的作用是催化剂,加快O2的生成速率。(2)
(4)燃烧管中CuO的作用是使有机物充分氧化生成CO2和H2O。
(5)若准确称取0.90
g样品(含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32
g,B管质量增加0.54
g,则该有机物的实验式为CH2O。
(6)要确定该有机物的分子式,还要知道有机物的相对分子质量。
某种有机物在气态时对H:的相对密度为30,充分燃烧3.0
g此有机物可得3.36
L二氧化碳(标准状况)和3.6
g水。此有机物能与金属钠反应,求此有机物的分子式和结构简式。
分子式为C3H8O
结构简式为CH3CH2CH2OH或
20
