第5讲 炔烃与芳香烃 模块1 炔烃及其性质 讲义 2020-2021学年人教版高二化学选修五
文档属性
| 名称 | 第5讲 炔烃与芳香烃 模块1 炔烃及其性质 讲义 2020-2021学年人教版高二化学选修五 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览




文档简介
第5讲
炔烃与芳香烃
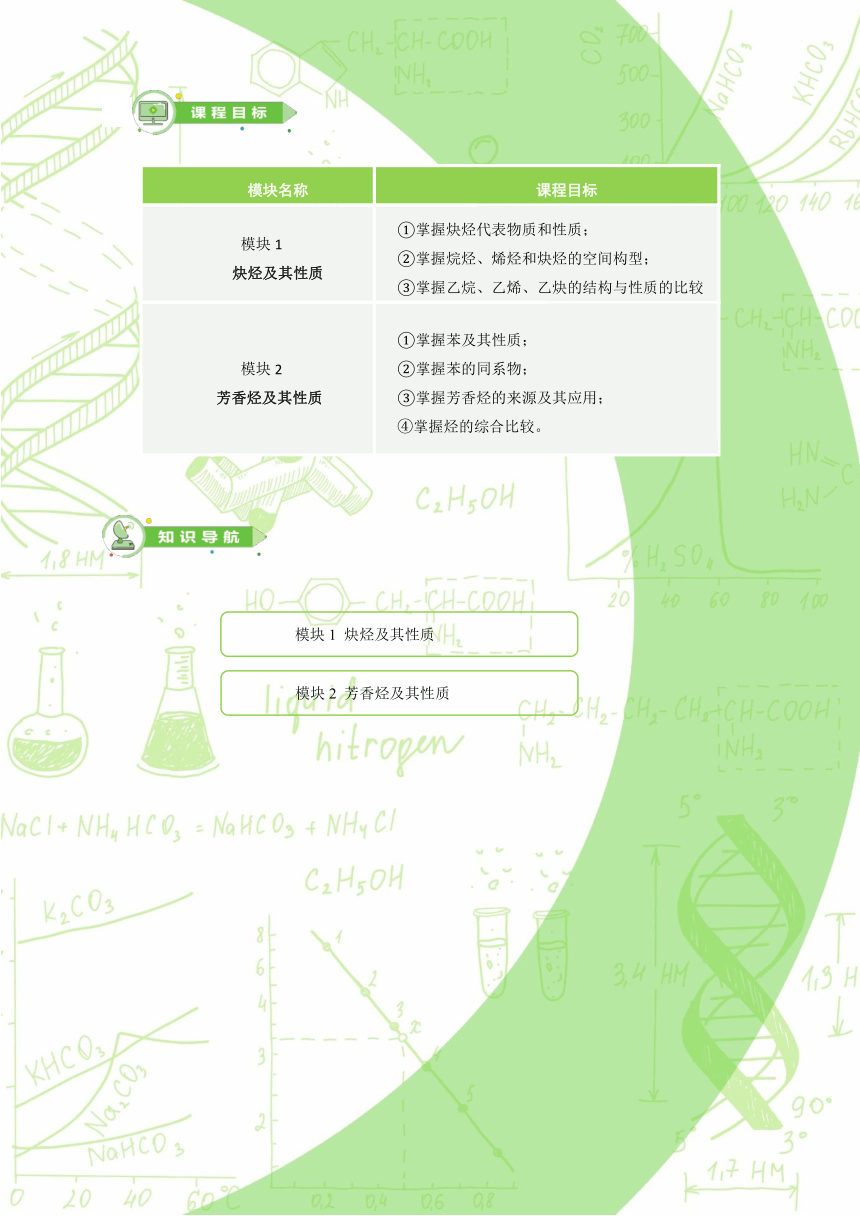
模块名称
课程目标
模块1
炔烃及其性质
①掌握炔烃代表物质和性质;
②掌握烷烃、烯烃和炔烃的空间构型;
③掌握乙烷、乙烯、乙炔的结构与性质的比较
模块2
芳香烃及其性质
①掌握苯及其性质;
②掌握苯的同系物;
③掌握芳香烃的来源及其应用;
④掌握烃的综合比较。
20
21
一.炔烃代表物质和性质
a.炔烃
(1)定义:分子里含有_碳碳三键_的一类脂肪烃的总称。
(2)通式:_CnH2n-2(n≥2)_。
(3)物理性质:与烷烃和烯烃相似,也是随着碳原子数目的增加而递变。
①随碳原子数的增加,炔烃的含碳量逐渐减小。
②炔烃的物理性质随碳原子数的递增呈规律性变化的原因:同属分子晶体,组成和结构相似,分子间作用力随相对分子质量的增大而增大。
③分子式相同的烃,支链越多,熔沸点越低。
④烃的密度随碳原子数的增多而增大,但都小于水。
分子式
最简式
电子式
结构式
结构简式
C2H2
CH
H∶CC∶H
H—C≡C—H
HC≡CH
b.乙炔
(1)表示方法
(2)分子结构
乙炔的分子构型为_直线形_,2个碳原子和2个氢原子均在_同一直线_上。
(3)物理性质。
颜色
气味
状态
密度
溶解性
___无色__
___无味___
__气体__
比空气略小
__微_溶于水,易___溶于有机溶剂[来
(4)化学性质:乙炔分子中的碳碳三键容易断裂,因而其化学性质较活泼,在适宜的条件下可发生氧化、加成、聚合等反应。
①氧化反应
a.乙炔容易燃烧,燃烧时__火焰明亮并伴有浓烈的黑烟_。
2C2H2+5O24CO2+2H2O
b.乙炔能使KMnO4酸性溶液_褪色__,说明乙炔能被KMnO4酸性溶液氧化。
②加成反应
乙炔能与溴水、卤素单质、氢气、氰化氢、卤化氢、水等在适宜的条件下发生加成反应。+Br2CHBr=CHBr(1,2-二溴乙烯)
CHBr=CHBr+Br2CHBr2—CHBr2(1,1,2,2-四溴乙烷)
+HClH2C=CHCl(氯乙烯)
丙炔与HCl加成有哪些可能产物?
③聚合反应
(在聚乙炔中掺入某些物质,就可以使其具有导电能力,因此聚乙炔又叫做导电塑料)
(5)实验室制法
①药品:电石(CaC2)、饱和食盐水。
②反应原理:_CaC2+2H2OCa(OH)2+CH≡CH↑__。
③实验装置:固体+液体→气体。
④收集:__排水集气_法。
二.烷烃、烯烃和炔烃的空间构型
1.烃类碳原子的成键方式
根据成键方式,碳原子可以分为两种类型——饱和碳原子和不饱和碳原子。饱和碳原子是指能够与4个原子形成单键的碳原子,如烷烃中的碳原子;不饱和碳原子是指成键原子数目少于4个的碳原子,如乙烯、乙炔、苯分子中的碳原子。
2.三种代表性脂肪烃的空间构型
(1)甲烷分子中的碳氢单键与四面体结构
甲烷分子中,碳原子与4个氢原子形成碳氢单键,任意2个键的夹角为109°28'。与饱和碳原子相连的4个原子形成四面体结构,如果这4个原子是相同的原子,则为正四面体,如CH4、CCl4;如果这4个原子的种类不同,则为非正四面体,如CH3Cl、CH3CH3等。烷烃分子中,以每个碳原子为中心形成的4个共价键构成了一个四面体,碳原子之间相互连接形成链状分子,这种链状分子中的碳链是呈折线形的。
甲烷分子的比例模型
甲烷分子的球棍模型及夹角示意图
四氯化碳分子的夹角示意图
烷烃的折线结构示意图
(2)乙烯分子中的碳碳双键与平面结构
乙烯分子中含有1个碳碳双键和4个碳氢单键,相邻的2个键的夹角接近120°,乙烯分子中的6个原子共平面,即与双键(包括碳碳双键、碳氧双键、碳硫双键等)相连的所有原子在同一个平面内,故丙烯中的3个碳原子与双键碳原子直接相连的3个氢原子一定共平面。
(3)乙炔的碳碳三键与直线结构
构成三键(包括碳碳三键和碳氮三键等)的2个原子及与这2个原子相连的原子(共4个原子)一定在同一条直线上。如乙炔中的4个原子在同一条直线上;丙炔中的3个碳原子及与三键碳原子相连的氢原子在同一条直线上;丙腈(CH3CH2C≡N)中的2个碳原子与氮原子一定在同一条直线上。
脂肪烃性质推断
解脂肪烃性质推断类题的注意事项
1.熟记几种常见烃的结构特点和化学性质
烃
结构特点
主要化学性质
烷烃
全是单键
①氧化反应(能燃烧,不能使酸性高锰酸钾溶液褪色);②取代反应;③高温分解
烯烃
碳碳双键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
炔烃
碳碳三键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
2.结构决定性质
不同的碳碳键对有机物的性质有着不同的影响:
(1)碳碳单键较稳定,典型反应是取代反应;
(2)碳碳双键中有一个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;
(3)碳碳三键中有两个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应。
三.乙烷、乙烯、乙炔的结构与性质的比较
乙烷
乙烯
乙炔
分子式
C2H6
C2H4
C2H2
结构式
电子式
H∶∶∶H
H∶∶∶∶H
H∶C??C∶H
分子结构特点
C—C(单键)
碳原子达到“饱和”
(双键)
碳原子未达到“饱和”,平面形分子,键角约为120°
(三键)
碳原子未达到“饱和”,直线形分子,键角为180°
活泼程度
稳定
活泼
活泼
取代反应
卤代反应
——
——
加成反应
——
能与H2、X2、HX、H2O等发生加成反应
能与H2、X2、HX、H2O等发生加成反应
加聚反应
不能发生
能发生
能发生
通入KMnO4酸性溶液中
KMnO4酸性溶液不褪色
KMnO4酸性溶液
褪色
KMnO4酸性溶液褪色
燃烧时现象
火焰较明亮
火焰明亮,带黑烟
火焰很明亮,带浓烈黑烟
鉴别
溴水不褪色或KMnO4酸性溶液不褪色
溴水褪色或KMnO4酸性溶液褪色
溴水褪色或KMnO4酸性溶液褪色
等物质的量的CH4、C2H4、C2H2,分别在足量O2中完全燃烧,以下说法正确的是(
)
A.C2H2含碳量最高,燃烧生成的CO2最多
B.C2H2燃烧时火焰最明亮
C.CH4含氢量最高,燃烧生成的H2O最多
D.CH4、C2H4燃烧生成的H2O质量不同,消耗的O2不同
关于炔烃的说法,不正确的是(
)
A.相同碳原子数的炔烃与二烯烃是同分异构体
B.易发生加成反应
C.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
D.分子里所有的碳原子都处在同一条直线上
下列关于的说法正确的是(
)
A.所有碳原子可能共平面
B.除苯环外的碳原子共直线
C.最多只有4个碳原子共平面
D.最多只有3个碳原子共直线
下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中正确的是(
)。
A.6个碳原子有可能都在一条直线上
B.6个碳原子可能都在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能都在同一平面上
1
mol有机物X最多能与1
mol
HCl发生加成反应得到Y,1
mol
Y能与4
mol
Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是(
)
A.
B.
C.
D.
在一定条件下,将A、B、C三种炔烃所组成的混合气体4
g,在催化剂作用下与足量的氢气发生加成反应,可生成4.4
g相应的三种烷烃,则所得的烷烃中一定有(
)
A.戊烷
B.丁烷
C.丙烷
D.乙烷
一.炔烃代表物质和性质
a.炔烃
(1)定义:分子里含有_碳碳三键_的一类脂肪烃的总称。
(2)通式:_CnH2n-2(n≥2)_。
(3)物理性质:与烷烃和烯烃相似,也是随着碳原子数目的增加而递变。
①随碳原子数的增加,炔烃的含碳量逐渐减小。
②炔烃的物理性质随碳原子数的递增呈规律性变化的原因:同属分子晶体,组成和结构相似,分子间作用力随相对分子质量的增大而增大。
③分子式相同的烃,支链越多,熔沸点越低。
④烃的密度随碳原子数的增多而增大,但都小于水。
分子式
最简式
电子式
结构式
结构简式
C2H2
CH
H∶CC∶H
H—C≡C—H
HC≡CH
b.乙炔
(1)表示方法
(2)分子结构
乙炔的分子构型为_直线形_,2个碳原子和2个氢原子均在_同一直线_上。
(3)物理性质。
颜色
气味
状态
密度
溶解性
___无色__
___无味___
__气体__
比空气略小
__微_溶于水,易___溶于有机溶剂[来
(4)化学性质:乙炔分子中的碳碳三键容易断裂,因而其化学性质较活泼,在适宜的条件下可发生氧化、加成、聚合等反应。
①氧化反应
a.乙炔容易燃烧,燃烧时__火焰明亮并伴有浓烈的黑烟_。
2C2H2+5O24CO2+2H2O
b.乙炔能使KMnO4酸性溶液_褪色__,说明乙炔能被KMnO4酸性溶液氧化。
②加成反应
乙炔能与溴水、卤素单质、氢气、氰化氢、卤化氢、水等在适宜的条件下发生加成反应。+Br2CHBr=CHBr(1,2-二溴乙烯)
CHBr=CHBr+Br2CHBr2—CHBr2(1,1,2,2-四溴乙烷)
+HClH2C=CHCl(氯乙烯)
丙炔与HCl加成有哪些可能产物?
③聚合反应
(在聚乙炔中掺入某些物质,就可以使其具有导电能力,因此聚乙炔又叫做导电塑料)
(5)实验室制法
①药品:电石(CaC2)、饱和食盐水。
②反应原理:_CaC2+2H2OCa(OH)2+CH≡CH↑__。
③实验装置:固体+液体→气体。
④收集:__排水集气_法。
二.烷烃、烯烃和炔烃的空间构型
1.烃类碳原子的成键方式
根据成键方式,碳原子可以分为两种类型——饱和碳原子和不饱和碳原子。饱和碳原子是指能够与4个原子形成单键的碳原子,如烷烃中的碳原子;不饱和碳原子是指成键原子数目少于4个的碳原子,如乙烯、乙炔、苯分子中的碳原子。
2.三种代表性脂肪烃的空间构型
(1)甲烷分子中的碳氢单键与四面体结构
甲烷分子中,碳原子与4个氢原子形成碳氢单键,任意2个键的夹角为109°28'。与饱和碳原子相连的4个原子形成四面体结构,如果这4个原子是相同的原子,则为正四面体,如CH4、CCl4;如果这4个原子的种类不同,则为非正四面体,如CH3Cl、CH3CH3等。烷烃分子中,以每个碳原子为中心形成的4个共价键构成了一个四面体,碳原子之间相互连接形成链状分子,这种链状分子中的碳链是呈折线形的。
甲烷分子的比例模型
甲烷分子的球棍模型及夹角示意图
四氯化碳分子的夹角示意图
烷烃的折线结构示意图
(2)乙烯分子中的碳碳双键与平面结构
乙烯分子中含有1个碳碳双键和4个碳氢单键,相邻的2个键的夹角接近120°,乙烯分子中的6个原子共平面,即与双键(包括碳碳双键、碳氧双键、碳硫双键等)相连的所有原子在同一个平面内,故丙烯中的3个碳原子与双键碳原子直接相连的3个氢原子一定共平面。
(3)乙炔的碳碳三键与直线结构
构成三键(包括碳碳三键和碳氮三键等)的2个原子及与这2个原子相连的原子(共4个原子)一定在同一条直线上。如乙炔中的4个原子在同一条直线上;丙炔中的3个碳原子及与三键碳原子相连的氢原子在同一条直线上;丙腈(CH3CH2C≡N)中的2个碳原子与氮原子一定在同一条直线上。
脂肪烃性质推断
解脂肪烃性质推断类题的注意事项
1.熟记几种常见烃的结构特点和化学性质
烃
结构特点
主要化学性质
烷烃
全是单键
①氧化反应(能燃烧,不能使酸性高锰酸钾溶液褪色);②取代反应;③高温分解
烯烃
碳碳双键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
炔烃
碳碳三键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
2.结构决定性质
不同的碳碳键对有机物的性质有着不同的影响:
(1)碳碳单键较稳定,典型反应是取代反应;
(2)碳碳双键中有一个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;
(3)碳碳三键中有两个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应。
三.乙烷、乙烯、乙炔的结构与性质的比较
乙烷
乙烯
乙炔
分子式
C2H6
C2H4
C2H2
结构式
电子式
H∶∶∶H
H∶∶∶∶H
H∶C??C∶H
分子结构特点
C—C(单键)
碳原子达到“饱和”
(双键)
碳原子未达到“饱和”,平面形分子,键角约为120°
(三键)
碳原子未达到“饱和”,直线形分子,键角为180°
活泼程度
稳定
活泼
活泼
取代反应
卤代反应
——
——
加成反应
——
能与H2、X2、HX、H2O等发生加成反应
能与H2、X2、HX、H2O等发生加成反应
加聚反应
不能发生
能发生
能发生
通入KMnO4酸性溶液中
KMnO4酸性溶液不褪色
KMnO4酸性溶液
褪色
KMnO4酸性溶液褪色
燃烧时现象
火焰较明亮
火焰明亮,带黑烟
火焰很明亮,带浓烈黑烟
鉴别
溴水不褪色或KMnO4酸性溶液不褪色
溴水褪色或KMnO4酸性溶液褪色
溴水褪色或KMnO4酸性溶液褪色
等物质的量的CH4、C2H4、C2H2,分别在足量O2中完全燃烧,以下说法正确的是(
B
)
A.C2H2含碳量最高,燃烧生成的CO2最多
B.C2H2燃烧时火焰最明亮
C.CH4含氢量最高,燃烧生成的H2O最多
D.CH4、C2H4燃烧生成的H2O质量不同,消耗的O2不同
关于炔烃的说法,不正确的是(
D
)
A.相同碳原子数的炔烃与二烯烃是同分异构体
B.易发生加成反应
C.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
D.分子里所有的碳原子都处在同一条直线上
下列关于的说法正确的是(
A
)
A.所有碳原子可能共平面
B.除苯环外的碳原子共直线
C.最多只有4个碳原子共平面
D.最多只有3个碳原子共直线
下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中正确的是(
C
)。
A.6个碳原子有可能都在一条直线上
B.6个碳原子可能都在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能都在同一平面上
1
mol有机物X最多能与1
mol
HCl发生加成反应得到Y,1
mol
Y能与4
mol
Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是(
A
)
A.
B.
C.
D.
在一定条件下,将A、B、C三种炔烃所组成的混合气体4
g,在催化剂作用下与足量的氢气发生加成反应,可生成4.4
g相应的三种烷烃,则所得的烷烃中一定有(
D
)
A.戊烷
B.丁烷
C.丙烷
D.乙烷
21
炔烃与芳香烃
模块名称
课程目标
模块1
炔烃及其性质
①掌握炔烃代表物质和性质;
②掌握烷烃、烯烃和炔烃的空间构型;
③掌握乙烷、乙烯、乙炔的结构与性质的比较
模块2
芳香烃及其性质
①掌握苯及其性质;
②掌握苯的同系物;
③掌握芳香烃的来源及其应用;
④掌握烃的综合比较。
20
21
一.炔烃代表物质和性质
a.炔烃
(1)定义:分子里含有_碳碳三键_的一类脂肪烃的总称。
(2)通式:_CnH2n-2(n≥2)_。
(3)物理性质:与烷烃和烯烃相似,也是随着碳原子数目的增加而递变。
①随碳原子数的增加,炔烃的含碳量逐渐减小。
②炔烃的物理性质随碳原子数的递增呈规律性变化的原因:同属分子晶体,组成和结构相似,分子间作用力随相对分子质量的增大而增大。
③分子式相同的烃,支链越多,熔沸点越低。
④烃的密度随碳原子数的增多而增大,但都小于水。
分子式
最简式
电子式
结构式
结构简式
C2H2
CH
H∶CC∶H
H—C≡C—H
HC≡CH
b.乙炔
(1)表示方法
(2)分子结构
乙炔的分子构型为_直线形_,2个碳原子和2个氢原子均在_同一直线_上。
(3)物理性质。
颜色
气味
状态
密度
溶解性
___无色__
___无味___
__气体__
比空气略小
__微_溶于水,易___溶于有机溶剂[来
(4)化学性质:乙炔分子中的碳碳三键容易断裂,因而其化学性质较活泼,在适宜的条件下可发生氧化、加成、聚合等反应。
①氧化反应
a.乙炔容易燃烧,燃烧时__火焰明亮并伴有浓烈的黑烟_。
2C2H2+5O24CO2+2H2O
b.乙炔能使KMnO4酸性溶液_褪色__,说明乙炔能被KMnO4酸性溶液氧化。
②加成反应
乙炔能与溴水、卤素单质、氢气、氰化氢、卤化氢、水等在适宜的条件下发生加成反应。+Br2CHBr=CHBr(1,2-二溴乙烯)
CHBr=CHBr+Br2CHBr2—CHBr2(1,1,2,2-四溴乙烷)
+HClH2C=CHCl(氯乙烯)
丙炔与HCl加成有哪些可能产物?
③聚合反应
(在聚乙炔中掺入某些物质,就可以使其具有导电能力,因此聚乙炔又叫做导电塑料)
(5)实验室制法
①药品:电石(CaC2)、饱和食盐水。
②反应原理:_CaC2+2H2OCa(OH)2+CH≡CH↑__。
③实验装置:固体+液体→气体。
④收集:__排水集气_法。
二.烷烃、烯烃和炔烃的空间构型
1.烃类碳原子的成键方式
根据成键方式,碳原子可以分为两种类型——饱和碳原子和不饱和碳原子。饱和碳原子是指能够与4个原子形成单键的碳原子,如烷烃中的碳原子;不饱和碳原子是指成键原子数目少于4个的碳原子,如乙烯、乙炔、苯分子中的碳原子。
2.三种代表性脂肪烃的空间构型
(1)甲烷分子中的碳氢单键与四面体结构
甲烷分子中,碳原子与4个氢原子形成碳氢单键,任意2个键的夹角为109°28'。与饱和碳原子相连的4个原子形成四面体结构,如果这4个原子是相同的原子,则为正四面体,如CH4、CCl4;如果这4个原子的种类不同,则为非正四面体,如CH3Cl、CH3CH3等。烷烃分子中,以每个碳原子为中心形成的4个共价键构成了一个四面体,碳原子之间相互连接形成链状分子,这种链状分子中的碳链是呈折线形的。
甲烷分子的比例模型
甲烷分子的球棍模型及夹角示意图
四氯化碳分子的夹角示意图
烷烃的折线结构示意图
(2)乙烯分子中的碳碳双键与平面结构
乙烯分子中含有1个碳碳双键和4个碳氢单键,相邻的2个键的夹角接近120°,乙烯分子中的6个原子共平面,即与双键(包括碳碳双键、碳氧双键、碳硫双键等)相连的所有原子在同一个平面内,故丙烯中的3个碳原子与双键碳原子直接相连的3个氢原子一定共平面。
(3)乙炔的碳碳三键与直线结构
构成三键(包括碳碳三键和碳氮三键等)的2个原子及与这2个原子相连的原子(共4个原子)一定在同一条直线上。如乙炔中的4个原子在同一条直线上;丙炔中的3个碳原子及与三键碳原子相连的氢原子在同一条直线上;丙腈(CH3CH2C≡N)中的2个碳原子与氮原子一定在同一条直线上。
脂肪烃性质推断
解脂肪烃性质推断类题的注意事项
1.熟记几种常见烃的结构特点和化学性质
烃
结构特点
主要化学性质
烷烃
全是单键
①氧化反应(能燃烧,不能使酸性高锰酸钾溶液褪色);②取代反应;③高温分解
烯烃
碳碳双键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
炔烃
碳碳三键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
2.结构决定性质
不同的碳碳键对有机物的性质有着不同的影响:
(1)碳碳单键较稳定,典型反应是取代反应;
(2)碳碳双键中有一个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;
(3)碳碳三键中有两个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应。
三.乙烷、乙烯、乙炔的结构与性质的比较
乙烷
乙烯
乙炔
分子式
C2H6
C2H4
C2H2
结构式
电子式
H∶∶∶H
H∶∶∶∶H
H∶C??C∶H
分子结构特点
C—C(单键)
碳原子达到“饱和”
(双键)
碳原子未达到“饱和”,平面形分子,键角约为120°
(三键)
碳原子未达到“饱和”,直线形分子,键角为180°
活泼程度
稳定
活泼
活泼
取代反应
卤代反应
——
——
加成反应
——
能与H2、X2、HX、H2O等发生加成反应
能与H2、X2、HX、H2O等发生加成反应
加聚反应
不能发生
能发生
能发生
通入KMnO4酸性溶液中
KMnO4酸性溶液不褪色
KMnO4酸性溶液
褪色
KMnO4酸性溶液褪色
燃烧时现象
火焰较明亮
火焰明亮,带黑烟
火焰很明亮,带浓烈黑烟
鉴别
溴水不褪色或KMnO4酸性溶液不褪色
溴水褪色或KMnO4酸性溶液褪色
溴水褪色或KMnO4酸性溶液褪色
等物质的量的CH4、C2H4、C2H2,分别在足量O2中完全燃烧,以下说法正确的是(
)
A.C2H2含碳量最高,燃烧生成的CO2最多
B.C2H2燃烧时火焰最明亮
C.CH4含氢量最高,燃烧生成的H2O最多
D.CH4、C2H4燃烧生成的H2O质量不同,消耗的O2不同
关于炔烃的说法,不正确的是(
)
A.相同碳原子数的炔烃与二烯烃是同分异构体
B.易发生加成反应
C.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
D.分子里所有的碳原子都处在同一条直线上
下列关于的说法正确的是(
)
A.所有碳原子可能共平面
B.除苯环外的碳原子共直线
C.最多只有4个碳原子共平面
D.最多只有3个碳原子共直线
下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中正确的是(
)。
A.6个碳原子有可能都在一条直线上
B.6个碳原子可能都在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能都在同一平面上
1
mol有机物X最多能与1
mol
HCl发生加成反应得到Y,1
mol
Y能与4
mol
Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是(
)
A.
B.
C.
D.
在一定条件下,将A、B、C三种炔烃所组成的混合气体4
g,在催化剂作用下与足量的氢气发生加成反应,可生成4.4
g相应的三种烷烃,则所得的烷烃中一定有(
)
A.戊烷
B.丁烷
C.丙烷
D.乙烷
一.炔烃代表物质和性质
a.炔烃
(1)定义:分子里含有_碳碳三键_的一类脂肪烃的总称。
(2)通式:_CnH2n-2(n≥2)_。
(3)物理性质:与烷烃和烯烃相似,也是随着碳原子数目的增加而递变。
①随碳原子数的增加,炔烃的含碳量逐渐减小。
②炔烃的物理性质随碳原子数的递增呈规律性变化的原因:同属分子晶体,组成和结构相似,分子间作用力随相对分子质量的增大而增大。
③分子式相同的烃,支链越多,熔沸点越低。
④烃的密度随碳原子数的增多而增大,但都小于水。
分子式
最简式
电子式
结构式
结构简式
C2H2
CH
H∶CC∶H
H—C≡C—H
HC≡CH
b.乙炔
(1)表示方法
(2)分子结构
乙炔的分子构型为_直线形_,2个碳原子和2个氢原子均在_同一直线_上。
(3)物理性质。
颜色
气味
状态
密度
溶解性
___无色__
___无味___
__气体__
比空气略小
__微_溶于水,易___溶于有机溶剂[来
(4)化学性质:乙炔分子中的碳碳三键容易断裂,因而其化学性质较活泼,在适宜的条件下可发生氧化、加成、聚合等反应。
①氧化反应
a.乙炔容易燃烧,燃烧时__火焰明亮并伴有浓烈的黑烟_。
2C2H2+5O24CO2+2H2O
b.乙炔能使KMnO4酸性溶液_褪色__,说明乙炔能被KMnO4酸性溶液氧化。
②加成反应
乙炔能与溴水、卤素单质、氢气、氰化氢、卤化氢、水等在适宜的条件下发生加成反应。+Br2CHBr=CHBr(1,2-二溴乙烯)
CHBr=CHBr+Br2CHBr2—CHBr2(1,1,2,2-四溴乙烷)
+HClH2C=CHCl(氯乙烯)
丙炔与HCl加成有哪些可能产物?
③聚合反应
(在聚乙炔中掺入某些物质,就可以使其具有导电能力,因此聚乙炔又叫做导电塑料)
(5)实验室制法
①药品:电石(CaC2)、饱和食盐水。
②反应原理:_CaC2+2H2OCa(OH)2+CH≡CH↑__。
③实验装置:固体+液体→气体。
④收集:__排水集气_法。
二.烷烃、烯烃和炔烃的空间构型
1.烃类碳原子的成键方式
根据成键方式,碳原子可以分为两种类型——饱和碳原子和不饱和碳原子。饱和碳原子是指能够与4个原子形成单键的碳原子,如烷烃中的碳原子;不饱和碳原子是指成键原子数目少于4个的碳原子,如乙烯、乙炔、苯分子中的碳原子。
2.三种代表性脂肪烃的空间构型
(1)甲烷分子中的碳氢单键与四面体结构
甲烷分子中,碳原子与4个氢原子形成碳氢单键,任意2个键的夹角为109°28'。与饱和碳原子相连的4个原子形成四面体结构,如果这4个原子是相同的原子,则为正四面体,如CH4、CCl4;如果这4个原子的种类不同,则为非正四面体,如CH3Cl、CH3CH3等。烷烃分子中,以每个碳原子为中心形成的4个共价键构成了一个四面体,碳原子之间相互连接形成链状分子,这种链状分子中的碳链是呈折线形的。
甲烷分子的比例模型
甲烷分子的球棍模型及夹角示意图
四氯化碳分子的夹角示意图
烷烃的折线结构示意图
(2)乙烯分子中的碳碳双键与平面结构
乙烯分子中含有1个碳碳双键和4个碳氢单键,相邻的2个键的夹角接近120°,乙烯分子中的6个原子共平面,即与双键(包括碳碳双键、碳氧双键、碳硫双键等)相连的所有原子在同一个平面内,故丙烯中的3个碳原子与双键碳原子直接相连的3个氢原子一定共平面。
(3)乙炔的碳碳三键与直线结构
构成三键(包括碳碳三键和碳氮三键等)的2个原子及与这2个原子相连的原子(共4个原子)一定在同一条直线上。如乙炔中的4个原子在同一条直线上;丙炔中的3个碳原子及与三键碳原子相连的氢原子在同一条直线上;丙腈(CH3CH2C≡N)中的2个碳原子与氮原子一定在同一条直线上。
脂肪烃性质推断
解脂肪烃性质推断类题的注意事项
1.熟记几种常见烃的结构特点和化学性质
烃
结构特点
主要化学性质
烷烃
全是单键
①氧化反应(能燃烧,不能使酸性高锰酸钾溶液褪色);②取代反应;③高温分解
烯烃
碳碳双键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
炔烃
碳碳三键
①氧化反应(能燃烧,能使酸性高锰酸钾溶液褪色);②加成反应;③加聚反应
2.结构决定性质
不同的碳碳键对有机物的性质有着不同的影响:
(1)碳碳单键较稳定,典型反应是取代反应;
(2)碳碳双键中有一个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应;
(3)碳碳三键中有两个化学键易断裂,典型反应是氧化反应、加成反应和加聚反应。
三.乙烷、乙烯、乙炔的结构与性质的比较
乙烷
乙烯
乙炔
分子式
C2H6
C2H4
C2H2
结构式
电子式
H∶∶∶H
H∶∶∶∶H
H∶C??C∶H
分子结构特点
C—C(单键)
碳原子达到“饱和”
(双键)
碳原子未达到“饱和”,平面形分子,键角约为120°
(三键)
碳原子未达到“饱和”,直线形分子,键角为180°
活泼程度
稳定
活泼
活泼
取代反应
卤代反应
——
——
加成反应
——
能与H2、X2、HX、H2O等发生加成反应
能与H2、X2、HX、H2O等发生加成反应
加聚反应
不能发生
能发生
能发生
通入KMnO4酸性溶液中
KMnO4酸性溶液不褪色
KMnO4酸性溶液
褪色
KMnO4酸性溶液褪色
燃烧时现象
火焰较明亮
火焰明亮,带黑烟
火焰很明亮,带浓烈黑烟
鉴别
溴水不褪色或KMnO4酸性溶液不褪色
溴水褪色或KMnO4酸性溶液褪色
溴水褪色或KMnO4酸性溶液褪色
等物质的量的CH4、C2H4、C2H2,分别在足量O2中完全燃烧,以下说法正确的是(
B
)
A.C2H2含碳量最高,燃烧生成的CO2最多
B.C2H2燃烧时火焰最明亮
C.CH4含氢量最高,燃烧生成的H2O最多
D.CH4、C2H4燃烧生成的H2O质量不同,消耗的O2不同
关于炔烃的说法,不正确的是(
D
)
A.相同碳原子数的炔烃与二烯烃是同分异构体
B.易发生加成反应
C.既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
D.分子里所有的碳原子都处在同一条直线上
下列关于的说法正确的是(
A
)
A.所有碳原子可能共平面
B.除苯环外的碳原子共直线
C.最多只有4个碳原子共平面
D.最多只有3个碳原子共直线
下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中正确的是(
C
)。
A.6个碳原子有可能都在一条直线上
B.6个碳原子可能都在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能都在同一平面上
1
mol有机物X最多能与1
mol
HCl发生加成反应得到Y,1
mol
Y能与4
mol
Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是(
A
)
A.
B.
C.
D.
在一定条件下,将A、B、C三种炔烃所组成的混合气体4
g,在催化剂作用下与足量的氢气发生加成反应,可生成4.4
g相应的三种烷烃,则所得的烷烃中一定有(
D
)
A.戊烷
B.丁烷
C.丙烷
D.乙烷
21
