2021届高中化学考前三个月专项复习课件(27张ppt)命题区间三 角度二 氧化还原反应
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(27张ppt)命题区间三 角度二 氧化还原反应 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览







文档简介
氧化还原反应
角度二
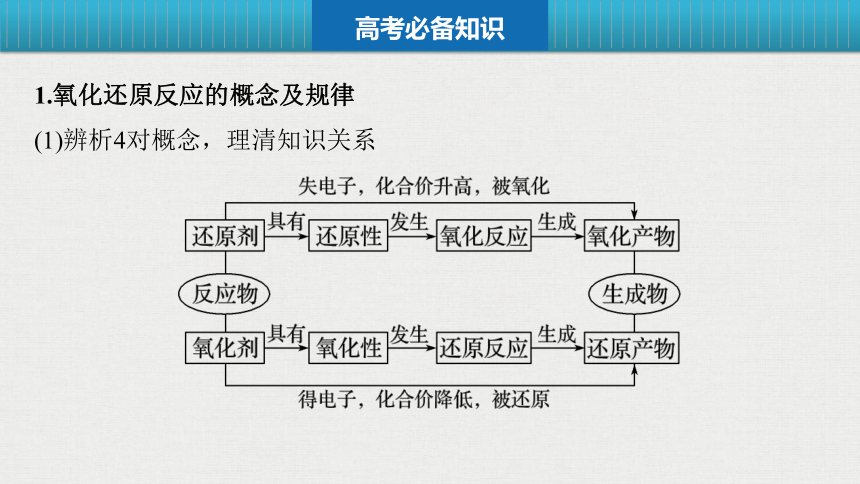
1.氧化还原反应的概念及规律
(1)辨析4对概念,理清知识关系
高考必备知识
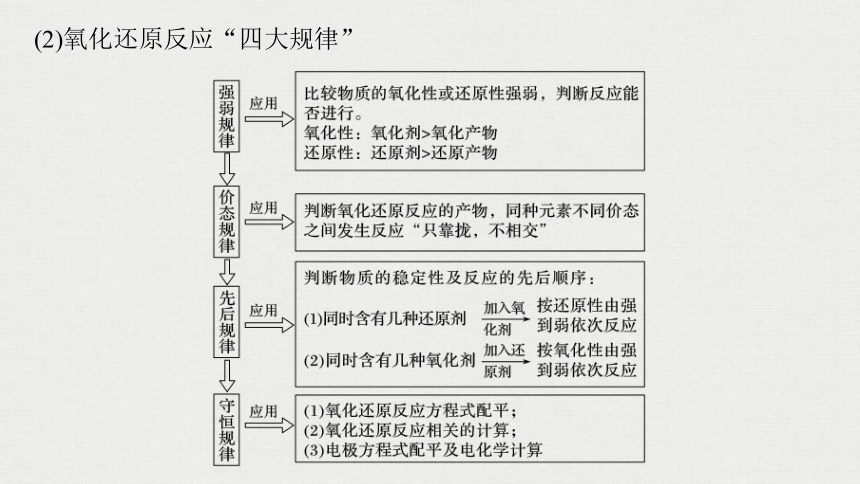
(2)氧化还原反应“四大规律”
2.氧化还原反应计算中重要的解题方法——电子守恒法
(1)应用电子守恒解题的三步骤
“一找各物质”:找出氧化剂、还原剂及相应的还原产物和氧化产物。
“二定得失数”:确定一个原子或离子得失电子数(注意化学式中变价的原子个数)。
“三列关系式”:根据题中各物质的物质的量和得失电子守恒列出关系式:
n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值
(2)对于多步连续进行的氧化还原反应,只要中间各步反应过程中电子没有损耗,可直接找出起始物和最终产物,略去中间产物,建立起始物和最终产物之间的电子守恒关系,从而快速求解。
1.[2020·新高考全国卷Ⅰ(山东),2]下列叙述不涉及氧化还原反应的是
A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成
1
2
3
4
5
√
重练高考真题
解析 谷物发酵的过程中包含淀粉水解、葡萄糖转化为乙醇、乙醇氧化为乙酸的过程;小苏打分解的化学方程式为2NaHCO3 Na2CO3+
CO2↑+H2O,不是氧化还原反应;含氯消毒剂有强氧化性,可用于环境消毒;NO2与水发生反应3NO2+H2O===NO+2HNO3,是氧化还原反应。
2.(2020·浙江7月选考,10)反应MnO2+4HCl(浓) MnCl2+Cl2↑+
2H2O中,氧化产物与还原产物的物质的量之比是
A.1∶2 B.1∶1 C.2∶1 D.4∶1
1
2
3
4
5
√
选项
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
3.(2019·北京,10)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
1
2
3
4
5
√
解析 A项,Fe粉将溶液中的Fe3+转化为Fe2+,涉及氧化还原反应;
B项,Mg2+与NaOH溶液反应生成Mg(OH)2沉淀,多余的NaOH用稀盐酸中和,两个反应均不涉及氧化还原反应;
C项,Cl2能溶于水并与水发生氧化还原反应,不能用水除去Cl2中的HCl;
D项,NO2与水反应生成HNO3和NO,涉及氧化还原反应。
1
2
3
4
5
4.(2019·浙江4月选考,24)聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是
A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗 mol KClO3
B.生成聚合硫酸铁后,水溶液的pH增大
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
√
1
2
3
4
5
解析 根据题干中的信息,写出化学方程式:6nFeSO4+nKClO3+3nH2O
===6[Fe(OH)SO4]n+nKCl,可知KClO3作氧化剂,同时根据计量数关系亦知每生成1 mol[Fe(OH)SO4]n消耗 mol KClO3,A项错误;
绿矾溶于水后,亚铁离子水解使溶液呈酸性,当其转化为聚合硫酸铁后,亚铁离子的浓度减小,因而水溶液的pH增大,B项正确;
聚合硫酸铁可在水中形成氢氧化铁胶体,胶体粒子吸附杂质微粒引起聚沉,因而能净水,C项正确;
1
2
3
4
5
多元弱碱的阳离子的水解是分步进行的,[Fe(OH)]2+的水解相当于Fe3+的二级水解,由于其所带的正电荷比Fe3+少,因而在相同条件下,其结合水电离产生的OH-的能力较弱,故其水解能力不如Fe3+,即在相同条件下,一级水解的程度大于二级水解,D项正确。
1
2
3
4
5
?
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
1
2
3
4
5
5.(2018·北京,9)下列实验中的颜色变化,与氧化还原反应无关的是
√
解析 C项,向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,发生沉淀的转化,反应的离子方程式为2AgCl+S2- Ag2S+2Cl-,与氧化还原反应无关;
A项,NaOH溶液滴入FeSO4溶液中,会生成Fe(OH)2白色沉淀,Fe(OH)2被氧化为Fe(OH)3,反应过程中出现灰绿色,最后变为红褐色,与氧化还原反应有关;
B项,由于氯水显酸性,先使紫色石蕊溶液变红,后由于HClO具有氧化性,使红色溶液迅速褪色,与氧化还原反应有关;
D项,热铜丝插入稀硝酸中发生的反应为3Cu+8HNO3(稀)===3Cu(NO3)2
+2NO↑+4H2O,NO被氧气氧化生成红棕色的NO2,与氧化还原反应有关。
1
2
3
4
5
选项
化学性质
实际应用
A
FeCl3溶液显酸性
脱除燃气中的H2S
B
Na2S溶液显碱性
去除废水中的Cu2+、Hg2+等
C
活性炭具有还原性
用作自来水的净化剂
D
NaClO2具有氧化性
脱除烟气中的SO2及NOx
题组一 氧化还原反应的概念及规律
1.化学在生活中有着广泛的应用,下列反应关系正确的是
1
2
3
4
5
6
√
精练预测押题
1
2
3
4
5
6
解析 脱除H2S利用FeCl3的氧化性,A项错误;
去除废水中的Cu2+、Hg2+等是利用S2-与Cu2+、Hg2+等形成沉淀,与Na2S溶液显弱碱性无关,B项错误;
净化自来水是利用活性炭的吸附性,C项错误;
NaClO2具有氧化性,将SO2及NOx转化为硫酸和硝酸而去除,D项正确。
2.在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到正高碘酸二氢三钠(Na3H2IO6),下列有关该反应的说法错误的是
A.该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于正高碘酸二氢三钠的氧化性
C.反应物中氧化产物与还原产物的物质的量之比为2∶1
D.反应中生成1 mol Na3H2IO6转移2NA个电子
1
2
3
4
5
6
√
解析 因I元素的化合价升高,则在该反应中碘酸钠作还原剂,A项正确;
该反应中I的化合价升高,Cl的化合价降低,则碱性条件下,氯气的氧化性强于正高碘酸二氢三钠的氧化性,B项正确;
由电子守恒可知,反应中氧化产物与还原产物的物质的量之比为1∶2,C项错误;
反应中生成1 mol Na3H2IO6转移1 mol×(7-5)=2 mol电子,即2NA个电子,D项正确。
1
2
3
4
5
6
3.(2019·湖南高三高考模拟)含氰化物的废液乱倒或与酸混合,均易生成有剧毒且易挥发的氰化氢。工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2―→CO2+N2+Cl-+H2O
(未配平)。下列说法错误的是(其中NA表示阿伏加德罗常数的值)
A.Cl2是氧化剂,CO2和N2是氧化产物
B.上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为2∶5
C.该反应中,若有1 mol CN-发生反应,则有5NA电子发生转移
D.若将该反应设计成原电池,则CN-在负极区发生反应
1
2
3
4
5
6
√
解析 在反应CN-+OH-+Cl2―→CO2+N2+Cl-+H2O中,Cl元素化合价由0价降低为-1价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,可知Cl2是氧化剂,CO2和N2是氧化产物,A项正确;
由上述分析可知,反应方程式为2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O,反应中CN-是还原剂,Cl2是氧化剂,氧化剂与还原剂的化学计量数之比为5∶2,B项错误;
由上述分析,根据电子守恒、原子守恒可知,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,所以若有1 mol CN-发生反应,则有[(4-2)+(3-0)]NA=5NA电子发生转移,C项正确;
1
2
3
4
5
6
1
2
3
4
5
6
C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,则若将该反应设计成原电池,则CN-在负极区失去电子,发生氧化反应,D项正确。
题组二 氧化还原反应方程式的配平与计算
4.下列有关物质氧化性或还原性强弱的叙述错误的是
A.在CO2中,Mg燃烧生成MgO和C,Mg的还原性强于C的还原性
B.适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2===2FeCl3+4FeI3
C.将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层
液体呈紫色,验证Br2的氧化性强于I2
D.一定量氯气通入30 mL 10.00 mol·L-1的氢氧化钠溶液中,加热后形成
NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则
0.15<n<0.25
1
2
3
4
5
6
√
解析 CO2是氧化剂,Mg是还原剂,C是还原产物,A项正确;
I-的还原性比Fe2+的强,应先氧化I-,B项错误;
符合氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,C项正确;
运用极端假设法,只生成NaCl、NaClO,转移电子数0.15 mol,若只生成NaCl、NaClO3,则转移电子数为0.25 mol,因而D项正确。
1
2
3
4
5
6
5.(2020·安徽淮北一模)稀有气体化合物是指含有稀有气体元素的化合物。其中二氟化氙(XeF2)、三氧化氙(XeO3),氙酸(H2XeO4)是“绿色氧化剂”,氙酸是一元强酸。下列说法错误的是
A.上述“绿色氧化剂”的优点是产物易分离,不干扰反应
B.三氧化氙可将I-氧化为
C.氙酸的电离方程式为:H2XeO4===2H++
D.XeF2与水反应的化学方程式为:2XeF2+2H2O===2Xe↑+O2↑+4HF↑
1
2
3
4
5
6
√
解析 氟化氙(XeF2)、三氧化氙(XeO3),氙酸(H2XeO4)作氧化剂都生成对应的单质很稳定,易分离,不干扰反应,所以“绿色氧化剂”的优点是产物易分离,不干扰反应,故A正确;
三氧化氙具有氧化性,可将I-氧化为 ,故B正确;
氙酸是一元强酸,则氙酸的电离方程式为:H2XeO4===H++ ,故C错误;
XeF2与水反应生成Xe、O2和HF,化学方程式为:2XeF2+2H2O===2Xe↑
+O2↑+4HF↑,故D正确。
1
2
3
4
5
6
6.(2020·日照一模)Cu2HgI4是一种红色固体,常用作示温涂料。制备反应为:2CuSO4+K2HgI4+SO2+2H2O===Cu2HgI4↓+K2SO4+2H2SO4。下列说法正确的是
A.上述反应的产物Cu2HgI4中,Hg的化合价为+1
B.上述反应中Hg元素与Cu元素均被还原
C.上述反应中生成1 mol Cu2HgI4时,转移的电子数为4NA
D.由以上信息可推知:可发生反应2CuSO4+2NaCl+SO2+2H2O===
2CuCl↓+Na2SO4+2H2SO4
√
1
2
3
4
5
6
解析 Cu2HgI4中Cu的化合价为+1价,则Hg的化合价为+2价,A选项错误;
只有Cu元素被还原,B选项错误;
CuSO4中Cu的化合价由+2价降至+1价,生成1 mol Cu2HgI4时,转移的电子数为2NA,C选项错误;
根据题干信息,CuSO4可与SO2在盐溶液中发生氧化还原反应,Cu2+被还原为Cu+,SO2被氧化为 ,则反应2CuSO4+2NaCl+SO2+2H2O===
2CuCl↓+Na2SO4+2H2SO4可以发生,D选项正确。
1
2
3
4
5
6
角度二
1.氧化还原反应的概念及规律
(1)辨析4对概念,理清知识关系
高考必备知识
(2)氧化还原反应“四大规律”
2.氧化还原反应计算中重要的解题方法——电子守恒法
(1)应用电子守恒解题的三步骤
“一找各物质”:找出氧化剂、还原剂及相应的还原产物和氧化产物。
“二定得失数”:确定一个原子或离子得失电子数(注意化学式中变价的原子个数)。
“三列关系式”:根据题中各物质的物质的量和得失电子守恒列出关系式:
n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值
(2)对于多步连续进行的氧化还原反应,只要中间各步反应过程中电子没有损耗,可直接找出起始物和最终产物,略去中间产物,建立起始物和最终产物之间的电子守恒关系,从而快速求解。
1.[2020·新高考全国卷Ⅰ(山东),2]下列叙述不涉及氧化还原反应的是
A.谷物发酵酿造食醋 B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒 D.大气中NO2参与酸雨形成
1
2
3
4
5
√
重练高考真题
解析 谷物发酵的过程中包含淀粉水解、葡萄糖转化为乙醇、乙醇氧化为乙酸的过程;小苏打分解的化学方程式为2NaHCO3 Na2CO3+
CO2↑+H2O,不是氧化还原反应;含氯消毒剂有强氧化性,可用于环境消毒;NO2与水发生反应3NO2+H2O===NO+2HNO3,是氧化还原反应。
2.(2020·浙江7月选考,10)反应MnO2+4HCl(浓) MnCl2+Cl2↑+
2H2O中,氧化产物与还原产物的物质的量之比是
A.1∶2 B.1∶1 C.2∶1 D.4∶1
1
2
3
4
5
√
选项
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
3.(2019·北京,10)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
1
2
3
4
5
√
解析 A项,Fe粉将溶液中的Fe3+转化为Fe2+,涉及氧化还原反应;
B项,Mg2+与NaOH溶液反应生成Mg(OH)2沉淀,多余的NaOH用稀盐酸中和,两个反应均不涉及氧化还原反应;
C项,Cl2能溶于水并与水发生氧化还原反应,不能用水除去Cl2中的HCl;
D项,NO2与水反应生成HNO3和NO,涉及氧化还原反应。
1
2
3
4
5
4.(2019·浙江4月选考,24)聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是
A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗 mol KClO3
B.生成聚合硫酸铁后,水溶液的pH增大
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
√
1
2
3
4
5
解析 根据题干中的信息,写出化学方程式:6nFeSO4+nKClO3+3nH2O
===6[Fe(OH)SO4]n+nKCl,可知KClO3作氧化剂,同时根据计量数关系亦知每生成1 mol[Fe(OH)SO4]n消耗 mol KClO3,A项错误;
绿矾溶于水后,亚铁离子水解使溶液呈酸性,当其转化为聚合硫酸铁后,亚铁离子的浓度减小,因而水溶液的pH增大,B项正确;
聚合硫酸铁可在水中形成氢氧化铁胶体,胶体粒子吸附杂质微粒引起聚沉,因而能净水,C项正确;
1
2
3
4
5
多元弱碱的阳离子的水解是分步进行的,[Fe(OH)]2+的水解相当于Fe3+的二级水解,由于其所带的正电荷比Fe3+少,因而在相同条件下,其结合水电离产生的OH-的能力较弱,故其水解能力不如Fe3+,即在相同条件下,一级水解的程度大于二级水解,D项正确。
1
2
3
4
5
?
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
1
2
3
4
5
5.(2018·北京,9)下列实验中的颜色变化,与氧化还原反应无关的是
√
解析 C项,向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,发生沉淀的转化,反应的离子方程式为2AgCl+S2- Ag2S+2Cl-,与氧化还原反应无关;
A项,NaOH溶液滴入FeSO4溶液中,会生成Fe(OH)2白色沉淀,Fe(OH)2被氧化为Fe(OH)3,反应过程中出现灰绿色,最后变为红褐色,与氧化还原反应有关;
B项,由于氯水显酸性,先使紫色石蕊溶液变红,后由于HClO具有氧化性,使红色溶液迅速褪色,与氧化还原反应有关;
D项,热铜丝插入稀硝酸中发生的反应为3Cu+8HNO3(稀)===3Cu(NO3)2
+2NO↑+4H2O,NO被氧气氧化生成红棕色的NO2,与氧化还原反应有关。
1
2
3
4
5
选项
化学性质
实际应用
A
FeCl3溶液显酸性
脱除燃气中的H2S
B
Na2S溶液显碱性
去除废水中的Cu2+、Hg2+等
C
活性炭具有还原性
用作自来水的净化剂
D
NaClO2具有氧化性
脱除烟气中的SO2及NOx
题组一 氧化还原反应的概念及规律
1.化学在生活中有着广泛的应用,下列反应关系正确的是
1
2
3
4
5
6
√
精练预测押题
1
2
3
4
5
6
解析 脱除H2S利用FeCl3的氧化性,A项错误;
去除废水中的Cu2+、Hg2+等是利用S2-与Cu2+、Hg2+等形成沉淀,与Na2S溶液显弱碱性无关,B项错误;
净化自来水是利用活性炭的吸附性,C项错误;
NaClO2具有氧化性,将SO2及NOx转化为硫酸和硝酸而去除,D项正确。
2.在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到正高碘酸二氢三钠(Na3H2IO6),下列有关该反应的说法错误的是
A.该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于正高碘酸二氢三钠的氧化性
C.反应物中氧化产物与还原产物的物质的量之比为2∶1
D.反应中生成1 mol Na3H2IO6转移2NA个电子
1
2
3
4
5
6
√
解析 因I元素的化合价升高,则在该反应中碘酸钠作还原剂,A项正确;
该反应中I的化合价升高,Cl的化合价降低,则碱性条件下,氯气的氧化性强于正高碘酸二氢三钠的氧化性,B项正确;
由电子守恒可知,反应中氧化产物与还原产物的物质的量之比为1∶2,C项错误;
反应中生成1 mol Na3H2IO6转移1 mol×(7-5)=2 mol电子,即2NA个电子,D项正确。
1
2
3
4
5
6
3.(2019·湖南高三高考模拟)含氰化物的废液乱倒或与酸混合,均易生成有剧毒且易挥发的氰化氢。工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2―→CO2+N2+Cl-+H2O
(未配平)。下列说法错误的是(其中NA表示阿伏加德罗常数的值)
A.Cl2是氧化剂,CO2和N2是氧化产物
B.上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为2∶5
C.该反应中,若有1 mol CN-发生反应,则有5NA电子发生转移
D.若将该反应设计成原电池,则CN-在负极区发生反应
1
2
3
4
5
6
√
解析 在反应CN-+OH-+Cl2―→CO2+N2+Cl-+H2O中,Cl元素化合价由0价降低为-1价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,可知Cl2是氧化剂,CO2和N2是氧化产物,A项正确;
由上述分析可知,反应方程式为2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O,反应中CN-是还原剂,Cl2是氧化剂,氧化剂与还原剂的化学计量数之比为5∶2,B项错误;
由上述分析,根据电子守恒、原子守恒可知,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,所以若有1 mol CN-发生反应,则有[(4-2)+(3-0)]NA=5NA电子发生转移,C项正确;
1
2
3
4
5
6
1
2
3
4
5
6
C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,则若将该反应设计成原电池,则CN-在负极区失去电子,发生氧化反应,D项正确。
题组二 氧化还原反应方程式的配平与计算
4.下列有关物质氧化性或还原性强弱的叙述错误的是
A.在CO2中,Mg燃烧生成MgO和C,Mg的还原性强于C的还原性
B.适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2===2FeCl3+4FeI3
C.将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层
液体呈紫色,验证Br2的氧化性强于I2
D.一定量氯气通入30 mL 10.00 mol·L-1的氢氧化钠溶液中,加热后形成
NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则
0.15<n<0.25
1
2
3
4
5
6
√
解析 CO2是氧化剂,Mg是还原剂,C是还原产物,A项正确;
I-的还原性比Fe2+的强,应先氧化I-,B项错误;
符合氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,C项正确;
运用极端假设法,只生成NaCl、NaClO,转移电子数0.15 mol,若只生成NaCl、NaClO3,则转移电子数为0.25 mol,因而D项正确。
1
2
3
4
5
6
5.(2020·安徽淮北一模)稀有气体化合物是指含有稀有气体元素的化合物。其中二氟化氙(XeF2)、三氧化氙(XeO3),氙酸(H2XeO4)是“绿色氧化剂”,氙酸是一元强酸。下列说法错误的是
A.上述“绿色氧化剂”的优点是产物易分离,不干扰反应
B.三氧化氙可将I-氧化为
C.氙酸的电离方程式为:H2XeO4===2H++
D.XeF2与水反应的化学方程式为:2XeF2+2H2O===2Xe↑+O2↑+4HF↑
1
2
3
4
5
6
√
解析 氟化氙(XeF2)、三氧化氙(XeO3),氙酸(H2XeO4)作氧化剂都生成对应的单质很稳定,易分离,不干扰反应,所以“绿色氧化剂”的优点是产物易分离,不干扰反应,故A正确;
三氧化氙具有氧化性,可将I-氧化为 ,故B正确;
氙酸是一元强酸,则氙酸的电离方程式为:H2XeO4===H++ ,故C错误;
XeF2与水反应生成Xe、O2和HF,化学方程式为:2XeF2+2H2O===2Xe↑
+O2↑+4HF↑,故D正确。
1
2
3
4
5
6
6.(2020·日照一模)Cu2HgI4是一种红色固体,常用作示温涂料。制备反应为:2CuSO4+K2HgI4+SO2+2H2O===Cu2HgI4↓+K2SO4+2H2SO4。下列说法正确的是
A.上述反应的产物Cu2HgI4中,Hg的化合价为+1
B.上述反应中Hg元素与Cu元素均被还原
C.上述反应中生成1 mol Cu2HgI4时,转移的电子数为4NA
D.由以上信息可推知:可发生反应2CuSO4+2NaCl+SO2+2H2O===
2CuCl↓+Na2SO4+2H2SO4
√
1
2
3
4
5
6
解析 Cu2HgI4中Cu的化合价为+1价,则Hg的化合价为+2价,A选项错误;
只有Cu元素被还原,B选项错误;
CuSO4中Cu的化合价由+2价降至+1价,生成1 mol Cu2HgI4时,转移的电子数为2NA,C选项错误;
根据题干信息,CuSO4可与SO2在盐溶液中发生氧化还原反应,Cu2+被还原为Cu+,SO2被氧化为 ,则反应2CuSO4+2NaCl+SO2+2H2O===
2CuCl↓+Na2SO4+2H2SO4可以发生,D选项正确。
1
2
3
4
5
6
同课章节目录
