2021届高中化学考前三个月专项复习课件(31张ppt)命题区间五 命题区间特训
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(31张ppt)命题区间五 命题区间特训 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览





文档简介
命题区间特训
命题区间五 电化学基础
A组(20分钟)
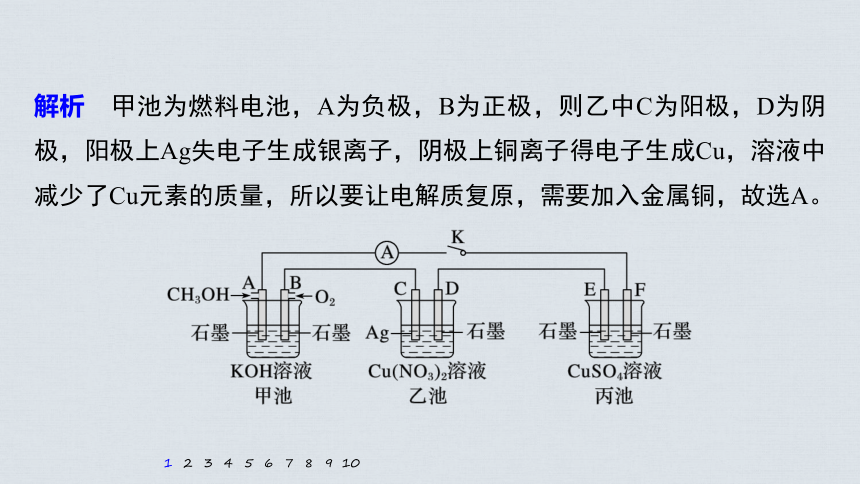
1.(2020·衡水中学四调)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键开关K时,观察到电流表的指针发生了偏转。一段时间后,断开电键开关K,下列物质能使乙池恢复到反应前浓度的是
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
1
2
3
4
5
6
√
7
8
9
10
解析 甲池为燃料电池,A为负极,B为正极,则乙中C为阳极,D为阴极,阳极上Ag失电子生成银离子,阴极上铜离子得电子生成Cu,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,故选A。
1
2
3
4
5
6
7
8
9
10
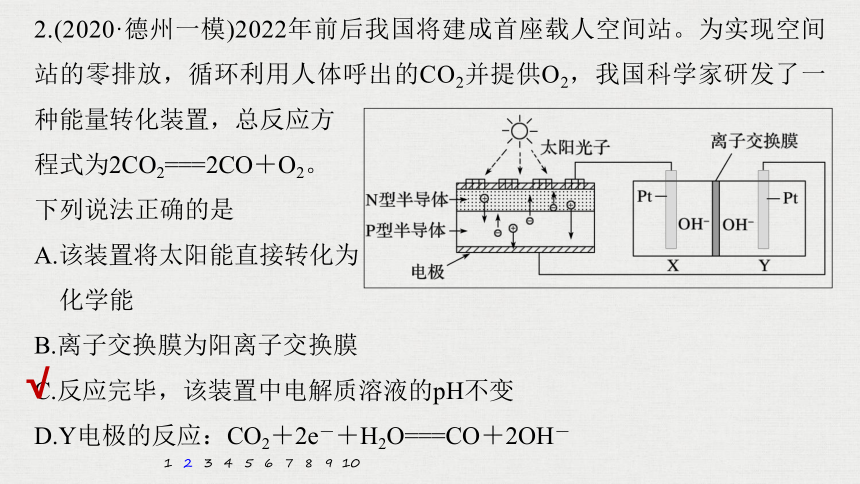
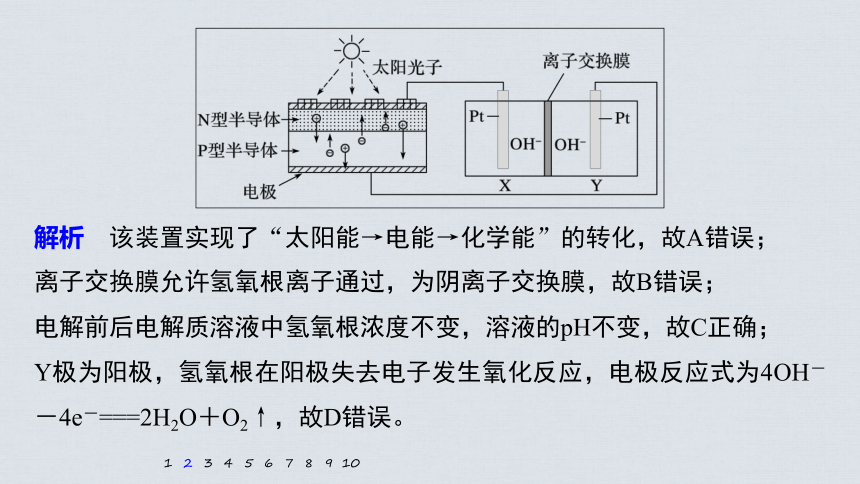
2.(2020·德州一模)2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方
程式为2CO2===2CO+O2。
下列说法正确的是
A.该装置将太阳能直接转化为
化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O===CO+2OH-
1
2
3
4
5
6
7
8
√
9
10
解析 该装置实现了“太阳能→电能→化学能”的转化,故A错误;
离子交换膜允许氢氧根离子通过,为阴离子交换膜,故B错误;
电解前后电解质溶液中氢氧根浓度不变,溶液的pH不变,故C正确;
Y极为阳极,氢氧根在阳极失去电子发生氧化反应,电极反应式为4OH--4e-===2H2O+O2↑,故D错误。
1
2
3
4
5
6
7
8
9
10
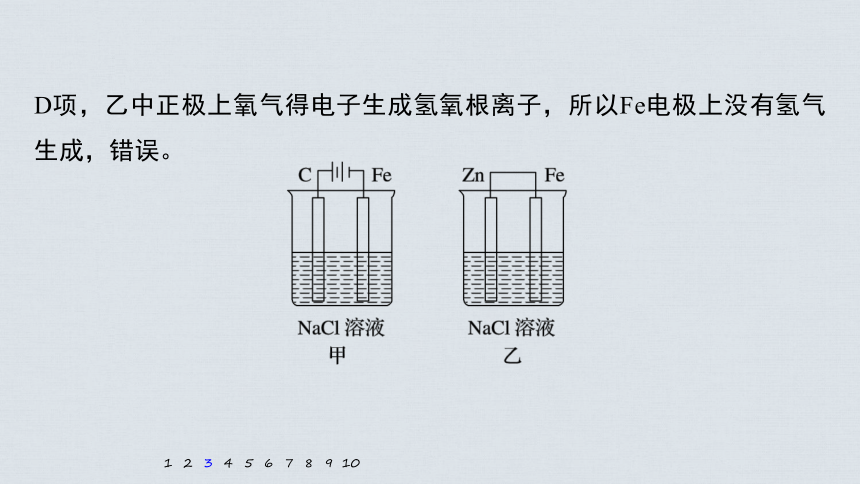
3.对如图装置(铁的防护)的分析正确的是
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均
为2H++2e-===H2↑
1
2
3
4
5
6
7
8
√
9
10
解析 A项,甲装置中C为阳极,阳极上氯离子失电子,Fe为阴极,阴极上氢离子得电子,属于外加电流的阴极保
护法,错误;
B项,乙装置中Zn为负极,Fe为正极,正
极上氧气得电子,Fe不参加反应,Fe被保
护,所以是牺牲阳极的阴极保护法,正确;
C项,甲装置中电解氯化钠生成氢氧化钠,溶液的pH增大,乙装置中负极Zn失电子,正极氧气得电子,最终生成氢氧化锌沉淀,溶液的pH几乎不变,错误;
1
2
3
4
5
6
7
8
9
10
D项,乙中正极上氧气得电子生成氢氧根离子,所以Fe电极上没有氢气生成,错误。
1
2
3
4
5
6
7
8
9
10
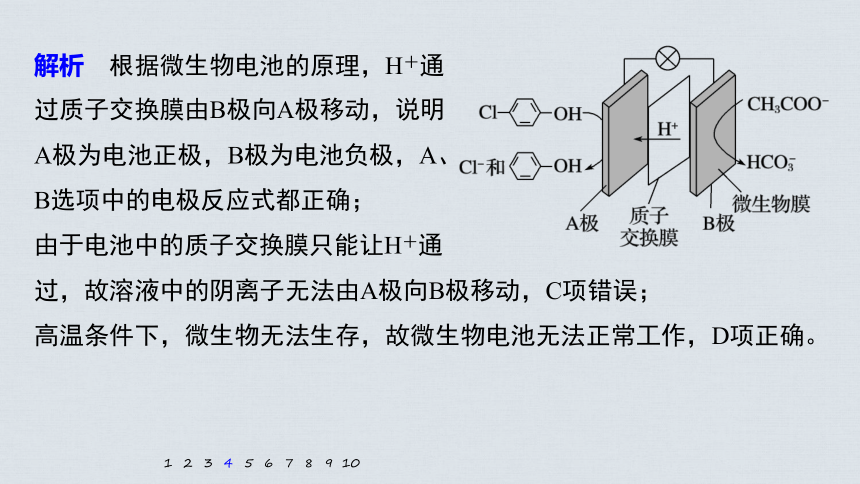
4.科学家尝试用微生物电池除去废水
中的有害有机物,其原理如图所示:?
下列有关说法错误的是
A.A极电极反应式为
+2e-+H+=== +Cl-
B.B极电极反应式为CH3COO--8e-+4H2O=== +9H+
C.溶液中的阴离子由A极向B极移动
D.该微生物电池在高温条件下无法正常工作
1
2
3
4
5
6
√
7
8
9
10
1
2
3
4
5
6
7
8
解析 根据微生物电池的原理,H+通
过质子交换膜由B极向A极移动,说明
A极为电池正极,B极为电池负极,A、
B选项中的电极反应式都正确;
由于电池中的质子交换膜只能让H+通
过,故溶液中的阴离子无法由A极向B极移动,C项错误;
高温条件下,微生物无法生存,故微生物电池无法正常工作,D项正确。
9
10
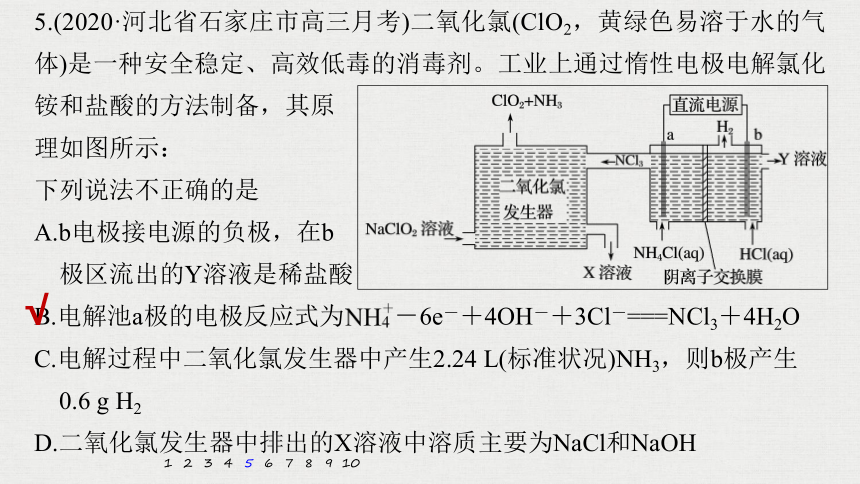
5.(2020·河北省石家庄市高三月考)二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原
理如图所示:
下列说法不正确的是
A.b电极接电源的负极,在b
极区流出的Y溶液是稀盐酸
B.电解池a极的电极反应式为 -6e-+4OH-+3Cl-===NCl3+4H2O
C.电解过程中二氧化氯发生器中产生2.24 L(标准状况)NH3,则b极产生
0.6 g H2
D.二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
1
2
3
4
5
6
7
8
√
9
10
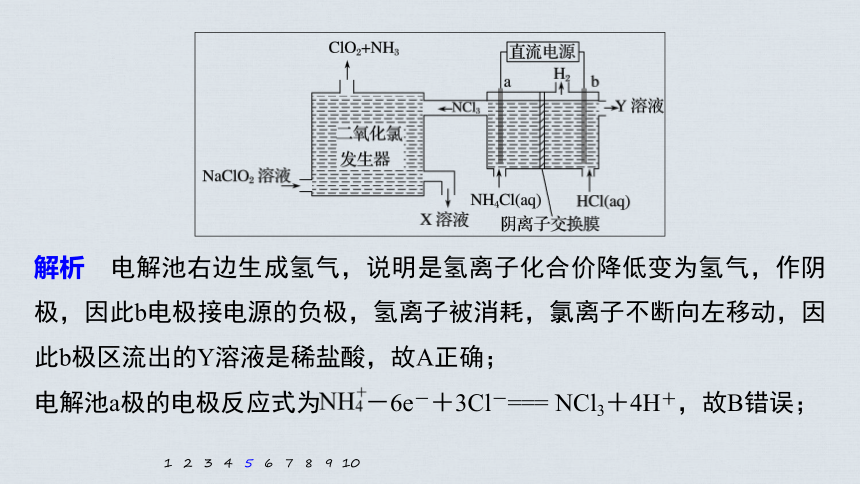
解析 电解池右边生成氢气,说明是氢离子化合价降低变为氢气,作阴极,因此b电极接电源的负极,氢离子被消耗,氯离子不断向左移动,因此b极区流出的Y溶液是稀盐酸,故A正确;
电解池a极的电极反应式为 -6e-+3Cl-=== NCl3+4H+,故B错误;
1
2
3
4
5
6
7
8
9
10
电解过程中二氧化氯发生器中产生2.24 L(标准状况)NH3即0.1 mol,转移电子0.1 mol×6=0.6 mol,根据2e-~H2,则b极产生H2的物质的量为0.3 mol,其质量为0.3 mol×2 g·mol-1=0.6 g,故C正确;
6NaClO2+NCl3+3H2O===NH3↑+6ClO2↑+3NaCl+3NaOH,因此二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH,故D正确。
1
2
3
4
5
6
7
8
9
10
6.肼(分子式为N2H4,又称联氨)具有可
燃性,在氧气中完全燃烧生成氮气,
可用作燃料电池的燃料。
由题图信息可知下列叙述不正确的是
A.甲为原电池,乙为电解池
B.b电极的电极反应式为O2+4e-===2O2-
C.d电极的电极反应式为Cu2++2e-===Cu
D.c电极质量变化128 g时,理论消耗标准状况下的空气约为112 L
1
2
3
4
5
6
7
8
√
9
10
解析 由题图信息可知,甲为乙中的电解提供能量,A项不符合题意;
水溶液中不可能存在O2-,B项符合题意;
d电极与负极相连,发生还原反应,生成Cu,C项不符合题意;
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
铜质量减少128 g,减少的物质的量为2 mol,故转移 4 mol电子,由N2H4+O2===N2+2H2O可知,氧元素的化合价由0降为-2价,故转移4 mol电子时,参与反应的O2的物质的量为1 mol,即消耗空气的物质的量约为
=5 mol,即标准状况下的体积为5 mol×22.4 L·mol-1=112 L,D项不符合题意。
7
1
2
3
4
5
6
8
7.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛,通常是由NaHSO3过饱和溶液经结晶脱水制得。制备Na2S2O5可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。电解后,a室的NaHSO3浓度增大,b室的Na2SO3浓度增大。将a室溶液进行结晶脱水,可得到Na2S2O5。下列叙述错误的是
A.阳极反应式为2H2O-4e-===4H++O2↑
B.两个离子交换膜均为阴离子交换膜
C.a室反应的离子方程式为
D.a室增加0.1 mol NaHSO3时,两极共生成0.9 g气体
√
9
10
7
1
2
3
4
5
6
8
解析 电解池阳极放氧生酸,电极反应为2H2O
-4e-===4H++O2↑,A项正确;
9
10
7
1
2
3
4
5
6
8
a室增加0.1 mol NaHSO3表明有0.1 mol H+穿过离子交换膜,此时外电路中有0.1 mol e-通过,该电解池相当于电解水,每转移4 mol e-时,两极共生成36 g气体,故转移0.1 mol e-时,两极共生成0.9 g气体,D项正确。
9
10
8.水产养殖户常用电解法净化鱼池中的水质,其工作原理如下图所示。下列说法中正确的是
A.X极是电源的负极,发生氧化反应
B.工作过程中阴极区溶液的pH逐渐减小
C.Ⅰ极上的电极反应式:C6H12O6-24e-
+6H2O===6CO2↑+24H+
D.当电路中转移10 mol e-时,Ⅱ极上产生22.4 L N2
7
1
2
3
4
5
6
8
√
9
10
解析 电极Ⅰ和电源X极相连,而电极Ⅰ上发生氧化反应,故电极Ⅰ是阳极,故X极是正极,A项错误;
电极Ⅱ是阴极,电极反应式: +
10e-+12H+===N2↑+6H2O,故在
工作过程中阴极区溶液的pH逐渐增
大,B项错误;
在阳极区,C6H12O6失去电子发生氧化反应,根据化合价变化,结合酸性介质,可得阳极电极反应式:C6H12O6-24e-+6H2O===6CO2↑+24H+,C项正确;
7
1
2
3
4
5
6
8
9
10
根据阴极反应式: +10e-+12H+===N2↑+6H2O,可知转移10 mol e-时,产生1 mol N2,在标准状况下体积为22.4 L,D项错误。
7
1
2
3
4
5
6
8
9
10
9.(2019·华文大教育二模)利用碳呼吸电池为钠硫电池充电的实验装置如图所示,下列说法正确的是
A.a极为多孔碳电极
B.充电时,Na+通过固体氧
化铝陶瓷向N极移动
C.充电过程中每得到1 mol
Al2(C2O4)3,N极上可生成3x mol S单质
D.随着反应的进行,碳呼吸电池中 浓度不断减小
7
1
2
3
4
5
6
8
√
9
10
解析 从图示可知活泼金属钠为钠硫电池的负极,根据充电时,正接正,负接负,可知a极为“碳呼吸电池的负极”,Na+应向阴极M移动,A、B项均错;
7
1
2
3
4
5
6
8
9
10
钠硫电池充电时,N极(阳极) -6e-===3xS,依据电子守恒,生成1 mol
Al2(C2O4)3,转移6 mol e-,可生成3x mol S,C项正确。
7
1
2
3
4
5
6
8
9
10
10.(2020·潍坊高密一中模拟)杂志Joule中题为“Li—CO2Electrochemistry:A New Strategy for CO2 Fixation and Energy Storage”的文章,阐述关于电化学技术固定CO2新的反应途径。下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li—CO2电池组成为钌电极/CO2—饱和LiClO4—DMSO电解液/锂片。下列说法错误的是
A.钌电极为负极,其电极反应
式为:2Li2CO3+C-4e-===
3CO2↑+4Li+
B.Li—CO2电池电解液由LiClO4—DMSO溶于水得到
C.这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体
D.CO2的固定中,每生成1.5 mol气体,可转移2 mol e-
7
1
2
3
4
5
6
8
√
9
10
解析 由图可知,钌电极上的电极反应式为 2Li2CO3+C-4e-===4Li++3CO2↑,故A正确;
由图可知,CO2通过储能系统和CO2固定策略转化为固体产物C,这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体,故C正确;
7
1
2
3
4
5
6
8
9
10
由图可知,CO2的固定中的电极反应式为:2Li2CO3===4Li++2CO2↑+O2↑+4e-,转移4 mol e-生成3 mol气体,CO2的固定中,每生成1.5 mol气体,可转移2 mol e-,故D正确。
7
1
2
3
4
5
6
8
9
10
选项
连接
电极材料
分析
a
b
A
K1、K2
石墨
铁
模拟铁的吸氧腐蚀
B
K1、K2
锌
铁
模拟钢铁防护中牺牲阳极的阴极保护法
C
K1、K3
石墨
铁
模拟电解饱和食盐水
D
K1、K3
铁
石墨
模拟钢铁防护中外加电流的阴极保护法
B组(20分钟)
1.用如图装置研究电化学原理,下列分析中错误的是
1
2
3
4
5
6
√
7
8
9
10
解析 A项,在中性条件下,铁作负极失电子,石墨作正极,正极上氧气得电子生成氢氧根离子,则Fe发生吸氧腐蚀,正确;
B项,Zn、Fe形成原电池,Zn作负极被腐蚀,Fe作正
极被保护,属于牺牲阳极的阴极保护法,正确;
C项,Fe作阴极,阴极上氢离子得电子,石墨作阳极,
阳极上氯离子失电子,电解氯化钠溶液生成氢气、氯
气和氢氧化钠,正确;
D项,Fe与正极相连,Fe作阳极,Fe失电子,被腐蚀,Fe不能被保护,错误。
1
2
3
4
5
6
7
8
9
10
2.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
A.HS-在硫氧化菌作用下转化为
的反应为HS-+4H2O-8e-===
+9H+
B.电子从b极流出,经外电路流向a极
C.如果将反应物直接燃烧,能量的利
用率不会变化
D.若该电池中处理0.1 mol HS-,则有0.45 mol H+通过质子交换膜
1
2
3
4
5
6
√
7
8
9
10
解析 由图可知,负极上硫氧化菌可以将HS-转化为 ,发生氧化反应,电极反应式是HS-+4H2O-8e-=== +9H+,正极上发生氧气得电子的还原反应:4H++O2+4e-===2H2O,A项正确;
b是正极,a是负极,所以电子从a极
流出,经外电路流向b极,B项错误;
如果将反应物直接燃烧,会有部分
化学能转化为光能等,因此能量的
利用率会有变化,C项错误;
若该电池中处理0.1 mol HS-,有0.8 mol电子发生转移,根据电子守恒,则有0.8 mol H+通过质子交换膜,D项错误。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
3.(2020·济南一模)2019年诺贝尔化学奖授予了在锂离子电池领域作出巨大贡献的三位科学家。某锂离子电池以C6Li为负极,Li1-xMO2为正极,锂盐有机溶液作电解质溶液,电池反应为C6Li+Li1-xMO2 LiMO2+C6Li1-x。则下列有关说法正确的是
A.金属锂的密度、熔点和硬度均比同族的碱金属低
B.该锂离子电池可用乙醇作有机溶剂
C.电池放电时,Li+从正极流向负极
D.电池充电时,阳极的电极反应式为LiMO2-xe-===xLi++Li1-xMO2
√
9
10
1
2
3
4
5
6
解析 碱金属元素从上到下对应单质的熔、沸点逐渐降低,故金属锂的熔点均比同族的碱金属高,A选项错误;
乙醇的氧化还原电位太低,容易被氧化,不能作该锂离子电池的有机溶剂,B选项错误;
电池放电时,为原电池,阳离子(Li+)从负极向正极移动,C选项错误;
由上述分析可知,电池充电时,LiMO2作阳极,失去电子发生氧化反应,电极反应式为LiMO2-xe-===xLi++Li1-xMO2,D选项正确。
7
8
9
10
4.工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,可用阳离子交换膜分隔两极区进行电解(装置如图所示)。
下列说法中错误的是
A.图中A口加入的溶液为稀KOH溶液
B.使用阳离子交换膜可以提高Mn元素利用率
C.阴极的电极反应式为2H2O+2e-===H2↑+2OH-
D.当有1 mol KMnO4生成时有2 mol K+通过阳离子交换膜
1
2
3
4
5
6
7
8
√
9
10
解析 惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中的氢离子在阴极得到电子生成氢气,阳极电极反应式: ,阴极电极
反应式:2H2O+2e-===H2↑+2OH-。根据阳
离子移动方向可知,左侧电极为阳极,右侧冒
气泡的电极为阴极,左侧溶液中的K+通过阳离
子交换膜进入阴极,为提高溶液的导电性并提供
反应物H2O,应从A口加入稀KOH溶液,A项说法正确;
1
2
3
4
5
6
7
8
9
10
阳离子交换膜可以防止锰酸根进入阴极区被
还原为MnO2,所以使用阳离子交换膜可以提
高Mn元素利用率,B项说法正确;
由上述分析可知,阴极的电极反应式为2H2O
+2e-===H2↑+2OH-,C项说法正确;
由 可知,当有1 mol KMnO4生成时有1 mol e-转移,所以应该有1 mol K+通过阳离子交换膜,D项说法错误。
1
2
3
4
5
6
7
8
9
10
5.(2019·辽宁高三高考模拟)氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两电极室质量相等,电池反应为NH3·BH3
+3H2O2===NH4BO2+4H2O。已知H2O2
足量,下列说法正确的是
A.正极的电极反应式为2H++2e-===H2↑
B.电池工作时,H+通过质子交换膜向负
极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol
电子
1
2
3
4
5
6
√
7
8
9
10
解析 右侧为正极,H2O2得到电子发生
还原反应,电极反应式为H2O2+2H++
2e-===2H2O,故A项错误;
放电时,阳离子向正极移动,所以H+通
过质子交换膜向正极移动,故B项错误;
电池工作时,负极的电极反应式为NH3·BH3+2H2O-6e-===NH4BO2+6H+,正极电极反应式为3H2O2+6H++6e-===6H2O,不能放出H2和NH3,故C项错误;
1
2
3
4
5
6
7
8
9
10
未加入氨硼烷之前,两电极室质量相等,通入氨硼烷后,负极的电极反应式为NH3·BH3+2H2O-6e-===NH4BO2+6H+,正极的电极反应式为3H2O2+6H++6e-===6H2O,假定转移6 mol电子,则左室质量增加31 g-6 g=25 g,右室质量增加6 g,两极室质量相差19 g,工作一段时间后,若左右两极室质量差为1.9 g,则理论上转移0.6 mol电子,故D项正确。
1
2
3
4
5
6
7
8
9
10
6.铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图1所示,
工作原理为Fe3++Cr2+ Fe2++Cr3+。图2为利用H2S废气资源回收
能量并得到单质硫的质子膜燃料
电池。下列说法正确的是
A.图1电池放电时,Cl-从负极穿
过选择性透过膜移向正极
B.图1电池放电时,电路中每通过
0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
C.用图2电池给图1装置充电时,图2中电极a接图1的正极
D.用图2电池给图1装置充电时,每生成1 mol S2(s),图1装置中就有4 mol
Cr3+被还原
1
2
3
4
5
6
7
8
√
9
10
解析 根据原电池工作原理,内电路中的阴离子向负极移动,A项错误;
电池放电时,电路中每通过0.1 mol电子,Fe3+的物质的量减小0.1 mol,但其浓度降低多少由溶液体积决
定,B项错误;
图2中在电极a上,H2S失去电子生
成S2,所以电极a为负极,应连接
图1的负极,C项错误;
在图2中每生成1 mol S2(s)转移4 mol电子,则图1中就有4 mol Cr3+被还原为Cr2+,D项正确。
1
2
3
4
5
6
7
8
9
10
7.(2020·浙江7月选考,21)电解高浓度RCOONa(羧酸钠)的NaOH溶液,在阳极RCOO-放电可得到R—R(烷烃)。下列说法不正确的是
A.电解总反应方程式:2RCOONa+2H2O R—R+2CO2↑+H2↑+
2NaOH
B.RCOO-在阳极放电,发生氧化反应
C.阴极的电极反应:2H2O+2e-===2OH-+H2↑
D.电解CH3COONa、CH3CH2COONa和NaOH混合溶液可得到乙烷、丙烷
和丁烷
√
7
8
1
2
3
4
5
6
9
10
解析 由于电解液呈强碱性,电解反应不能释放出CO2气体,A错误;
电解高浓度RCOONa的NaOH溶液,阳极上RCOO-发生氧化反应,得到R—R(烷烃),B正确;
阴极上H2O得电子放出H2,电极反应式为2H2O+2e-===2OH-+H2↑,C正确;
根据题中电解原理,电解RCOONa和NaOH混合液可得到R—R(烷烃),类比推理,电解CH3COONa、CH3CH2COONa和NaOH混合溶液,可得到CH3CH3(乙烷)、CH3CH2CH3(丙烷)和CH3CH2CH2CH3(丁烷),D正确。
7
8
1
2
3
4
5
6
9
10
8.我国科学家利用透氧膜,一步获得合成NH3的原料气,工作原理如图所示。(空气中N2与O2的物质的量之比按4∶1计),下列说法正确的是
A.电子由膜2侧向膜1侧迁移
B.膜1侧相当于电池的正极
C.若膜2侧所得气体 =3,n(CH4)∶n(H2O)
∶n(O2)=12∶12∶1
D.膜1侧的电极反应式为CH4-2e-+O2-===CO+2H2
7
8
1
2
3
4
5
6
√
9
10
7
8
1
2
3
4
5
6
解析 本题考查原电池工作原理,意在考查应用能力。观察图示知,CH4中C元素化合价升高,H2O和O2被还原,作氧化剂。即该原电池中膜1侧为负极,膜2侧为正极。电子由膜1侧向
膜2侧迁移,A、B项错误;
令膜2侧的气体中n(N2)=4 mol,则n(O2)=
1 mol,n(H2)=n(H2O)=12 mol,正极(膜2
侧)的电极反应式为H2O+2e-===H2↑+O2-,O2+4e-===2O2-,所以正极得电子总物质的量:n(e-)=24 mol+4 mol=28 mol,由电子守恒知,膜1侧参与反应的甲烷:n(CH4)=14 mol。综上所述,参与反应的CH4、H2O、O2的物质的量之比为14∶12∶1,C项错误。
9
10
9.(2020·天津,11)熔融钠—硫电池性能优良,是具有应用前景的储能电池。右图中的电池反应为2Na+xS Na2Sx
(x=5~3,难溶于熔融硫),
下列说法错误的是
A.Na2S4的电子式为
B.放电时正极反应为xS+2Na++2e-===Na2Sx
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以Na-β-Al2O3为隔膜的二次电池
7
8
1
2
3
4
5
6
√
9
10
解析 A对,四硫化二钠属于离子化合物,其中硫达到8电子稳定结构,其电子式为 ;
B对,根据总反应可知,S在正极发生反应,
电极反应为xS+2Na++2e-===Na2Sx;
C错,电池正极是含碳粉的熔融硫;
D对,因为该电池可以充电,所以为二次电池,其中Na-β-Al2O3是隔膜,防止熔融钠与熔融硫直接反应。
7
8
1
2
3
4
5
6
9
10
10.(2020·烟台一模)相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法不正确的是
A.a电极的电极反应为4H2O+
4e-===2H2↑+4OH-
B.c、d离子交换膜依次为阳离
子交换膜和阴离子交换膜
C.电池放电过程中,Cu(1)电极上的电极反应为Cu2++2e-===Cu
D.电池从开始工作到停止放电,电解池理论上可制得320 g NaOH
7
8
1
2
3
4
5
6
√
9
10
解析 a为电解池的阴极,H2O中的H+得到电子发生还原反应生成H2,电极反应为4H2O+4e-===2H2↑+4OH-,A选项正确;
电解过程中,两个离子交换膜之间的硫酸钠溶液中,Na+通过阳离子交换膜c进入阴极区, 通过阴离子交换膜d进入阳极区,B选项正确;
电池放电过程中,Cu(1)电极上发生使Cu2+浓度降低的还原反应,作正极,电极反应为Cu2++2e-===Cu,C选项正确;
7
8
1
2
3
4
5
6
9
10
电池从开始工作到停止放电,正极区硫酸铜溶液的浓度同时由2.5 mol·L-1降低到1.5 mol·L-1,负极区硫酸铜溶液同时由0.5 mol·L-1升高到1.5 mol·L-1,
正极反应可还原Cu2+的物质的量为2 L×(2.5-1.5) mol·L-1=2 mol,电路中转移4 mol电子,电解池的阴极生成4 mol OH-,即阴极区可得4 mol氢氧化钠,其质量为160 g,D选项错误。
7
8
1
2
3
4
5
6
9
10
命题区间五 电化学基础
A组(20分钟)
1.(2020·衡水中学四调)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键开关K时,观察到电流表的指针发生了偏转。一段时间后,断开电键开关K,下列物质能使乙池恢复到反应前浓度的是
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
1
2
3
4
5
6
√
7
8
9
10
解析 甲池为燃料电池,A为负极,B为正极,则乙中C为阳极,D为阴极,阳极上Ag失电子生成银离子,阴极上铜离子得电子生成Cu,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,故选A。
1
2
3
4
5
6
7
8
9
10
2.(2020·德州一模)2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方
程式为2CO2===2CO+O2。
下列说法正确的是
A.该装置将太阳能直接转化为
化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O===CO+2OH-
1
2
3
4
5
6
7
8
√
9
10
解析 该装置实现了“太阳能→电能→化学能”的转化,故A错误;
离子交换膜允许氢氧根离子通过,为阴离子交换膜,故B错误;
电解前后电解质溶液中氢氧根浓度不变,溶液的pH不变,故C正确;
Y极为阳极,氢氧根在阳极失去电子发生氧化反应,电极反应式为4OH--4e-===2H2O+O2↑,故D错误。
1
2
3
4
5
6
7
8
9
10
3.对如图装置(铁的防护)的分析正确的是
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均
为2H++2e-===H2↑
1
2
3
4
5
6
7
8
√
9
10
解析 A项,甲装置中C为阳极,阳极上氯离子失电子,Fe为阴极,阴极上氢离子得电子,属于外加电流的阴极保
护法,错误;
B项,乙装置中Zn为负极,Fe为正极,正
极上氧气得电子,Fe不参加反应,Fe被保
护,所以是牺牲阳极的阴极保护法,正确;
C项,甲装置中电解氯化钠生成氢氧化钠,溶液的pH增大,乙装置中负极Zn失电子,正极氧气得电子,最终生成氢氧化锌沉淀,溶液的pH几乎不变,错误;
1
2
3
4
5
6
7
8
9
10
D项,乙中正极上氧气得电子生成氢氧根离子,所以Fe电极上没有氢气生成,错误。
1
2
3
4
5
6
7
8
9
10
4.科学家尝试用微生物电池除去废水
中的有害有机物,其原理如图所示:?
下列有关说法错误的是
A.A极电极反应式为
+2e-+H+=== +Cl-
B.B极电极反应式为CH3COO--8e-+4H2O=== +9H+
C.溶液中的阴离子由A极向B极移动
D.该微生物电池在高温条件下无法正常工作
1
2
3
4
5
6
√
7
8
9
10
1
2
3
4
5
6
7
8
解析 根据微生物电池的原理,H+通
过质子交换膜由B极向A极移动,说明
A极为电池正极,B极为电池负极,A、
B选项中的电极反应式都正确;
由于电池中的质子交换膜只能让H+通
过,故溶液中的阴离子无法由A极向B极移动,C项错误;
高温条件下,微生物无法生存,故微生物电池无法正常工作,D项正确。
9
10
5.(2020·河北省石家庄市高三月考)二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原
理如图所示:
下列说法不正确的是
A.b电极接电源的负极,在b
极区流出的Y溶液是稀盐酸
B.电解池a极的电极反应式为 -6e-+4OH-+3Cl-===NCl3+4H2O
C.电解过程中二氧化氯发生器中产生2.24 L(标准状况)NH3,则b极产生
0.6 g H2
D.二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
1
2
3
4
5
6
7
8
√
9
10
解析 电解池右边生成氢气,说明是氢离子化合价降低变为氢气,作阴极,因此b电极接电源的负极,氢离子被消耗,氯离子不断向左移动,因此b极区流出的Y溶液是稀盐酸,故A正确;
电解池a极的电极反应式为 -6e-+3Cl-=== NCl3+4H+,故B错误;
1
2
3
4
5
6
7
8
9
10
电解过程中二氧化氯发生器中产生2.24 L(标准状况)NH3即0.1 mol,转移电子0.1 mol×6=0.6 mol,根据2e-~H2,则b极产生H2的物质的量为0.3 mol,其质量为0.3 mol×2 g·mol-1=0.6 g,故C正确;
6NaClO2+NCl3+3H2O===NH3↑+6ClO2↑+3NaCl+3NaOH,因此二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH,故D正确。
1
2
3
4
5
6
7
8
9
10
6.肼(分子式为N2H4,又称联氨)具有可
燃性,在氧气中完全燃烧生成氮气,
可用作燃料电池的燃料。
由题图信息可知下列叙述不正确的是
A.甲为原电池,乙为电解池
B.b电极的电极反应式为O2+4e-===2O2-
C.d电极的电极反应式为Cu2++2e-===Cu
D.c电极质量变化128 g时,理论消耗标准状况下的空气约为112 L
1
2
3
4
5
6
7
8
√
9
10
解析 由题图信息可知,甲为乙中的电解提供能量,A项不符合题意;
水溶液中不可能存在O2-,B项符合题意;
d电极与负极相连,发生还原反应,生成Cu,C项不符合题意;
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
铜质量减少128 g,减少的物质的量为2 mol,故转移 4 mol电子,由N2H4+O2===N2+2H2O可知,氧元素的化合价由0降为-2价,故转移4 mol电子时,参与反应的O2的物质的量为1 mol,即消耗空气的物质的量约为
=5 mol,即标准状况下的体积为5 mol×22.4 L·mol-1=112 L,D项不符合题意。
7
1
2
3
4
5
6
8
7.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛,通常是由NaHSO3过饱和溶液经结晶脱水制得。制备Na2S2O5可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。电解后,a室的NaHSO3浓度增大,b室的Na2SO3浓度增大。将a室溶液进行结晶脱水,可得到Na2S2O5。下列叙述错误的是
A.阳极反应式为2H2O-4e-===4H++O2↑
B.两个离子交换膜均为阴离子交换膜
C.a室反应的离子方程式为
D.a室增加0.1 mol NaHSO3时,两极共生成0.9 g气体
√
9
10
7
1
2
3
4
5
6
8
解析 电解池阳极放氧生酸,电极反应为2H2O
-4e-===4H++O2↑,A项正确;
9
10
7
1
2
3
4
5
6
8
a室增加0.1 mol NaHSO3表明有0.1 mol H+穿过离子交换膜,此时外电路中有0.1 mol e-通过,该电解池相当于电解水,每转移4 mol e-时,两极共生成36 g气体,故转移0.1 mol e-时,两极共生成0.9 g气体,D项正确。
9
10
8.水产养殖户常用电解法净化鱼池中的水质,其工作原理如下图所示。下列说法中正确的是
A.X极是电源的负极,发生氧化反应
B.工作过程中阴极区溶液的pH逐渐减小
C.Ⅰ极上的电极反应式:C6H12O6-24e-
+6H2O===6CO2↑+24H+
D.当电路中转移10 mol e-时,Ⅱ极上产生22.4 L N2
7
1
2
3
4
5
6
8
√
9
10
解析 电极Ⅰ和电源X极相连,而电极Ⅰ上发生氧化反应,故电极Ⅰ是阳极,故X极是正极,A项错误;
电极Ⅱ是阴极,电极反应式: +
10e-+12H+===N2↑+6H2O,故在
工作过程中阴极区溶液的pH逐渐增
大,B项错误;
在阳极区,C6H12O6失去电子发生氧化反应,根据化合价变化,结合酸性介质,可得阳极电极反应式:C6H12O6-24e-+6H2O===6CO2↑+24H+,C项正确;
7
1
2
3
4
5
6
8
9
10
根据阴极反应式: +10e-+12H+===N2↑+6H2O,可知转移10 mol e-时,产生1 mol N2,在标准状况下体积为22.4 L,D项错误。
7
1
2
3
4
5
6
8
9
10
9.(2019·华文大教育二模)利用碳呼吸电池为钠硫电池充电的实验装置如图所示,下列说法正确的是
A.a极为多孔碳电极
B.充电时,Na+通过固体氧
化铝陶瓷向N极移动
C.充电过程中每得到1 mol
Al2(C2O4)3,N极上可生成3x mol S单质
D.随着反应的进行,碳呼吸电池中 浓度不断减小
7
1
2
3
4
5
6
8
√
9
10
解析 从图示可知活泼金属钠为钠硫电池的负极,根据充电时,正接正,负接负,可知a极为“碳呼吸电池的负极”,Na+应向阴极M移动,A、B项均错;
7
1
2
3
4
5
6
8
9
10
钠硫电池充电时,N极(阳极) -6e-===3xS,依据电子守恒,生成1 mol
Al2(C2O4)3,转移6 mol e-,可生成3x mol S,C项正确。
7
1
2
3
4
5
6
8
9
10
10.(2020·潍坊高密一中模拟)杂志Joule中题为“Li—CO2Electrochemistry:A New Strategy for CO2 Fixation and Energy Storage”的文章,阐述关于电化学技术固定CO2新的反应途径。下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li—CO2电池组成为钌电极/CO2—饱和LiClO4—DMSO电解液/锂片。下列说法错误的是
A.钌电极为负极,其电极反应
式为:2Li2CO3+C-4e-===
3CO2↑+4Li+
B.Li—CO2电池电解液由LiClO4—DMSO溶于水得到
C.这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体
D.CO2的固定中,每生成1.5 mol气体,可转移2 mol e-
7
1
2
3
4
5
6
8
√
9
10
解析 由图可知,钌电极上的电极反应式为 2Li2CO3+C-4e-===4Li++3CO2↑,故A正确;
由图可知,CO2通过储能系统和CO2固定策略转化为固体产物C,这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体,故C正确;
7
1
2
3
4
5
6
8
9
10
由图可知,CO2的固定中的电极反应式为:2Li2CO3===4Li++2CO2↑+O2↑+4e-,转移4 mol e-生成3 mol气体,CO2的固定中,每生成1.5 mol气体,可转移2 mol e-,故D正确。
7
1
2
3
4
5
6
8
9
10
选项
连接
电极材料
分析
a
b
A
K1、K2
石墨
铁
模拟铁的吸氧腐蚀
B
K1、K2
锌
铁
模拟钢铁防护中牺牲阳极的阴极保护法
C
K1、K3
石墨
铁
模拟电解饱和食盐水
D
K1、K3
铁
石墨
模拟钢铁防护中外加电流的阴极保护法
B组(20分钟)
1.用如图装置研究电化学原理,下列分析中错误的是
1
2
3
4
5
6
√
7
8
9
10
解析 A项,在中性条件下,铁作负极失电子,石墨作正极,正极上氧气得电子生成氢氧根离子,则Fe发生吸氧腐蚀,正确;
B项,Zn、Fe形成原电池,Zn作负极被腐蚀,Fe作正
极被保护,属于牺牲阳极的阴极保护法,正确;
C项,Fe作阴极,阴极上氢离子得电子,石墨作阳极,
阳极上氯离子失电子,电解氯化钠溶液生成氢气、氯
气和氢氧化钠,正确;
D项,Fe与正极相连,Fe作阳极,Fe失电子,被腐蚀,Fe不能被保护,错误。
1
2
3
4
5
6
7
8
9
10
2.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是
A.HS-在硫氧化菌作用下转化为
的反应为HS-+4H2O-8e-===
+9H+
B.电子从b极流出,经外电路流向a极
C.如果将反应物直接燃烧,能量的利
用率不会变化
D.若该电池中处理0.1 mol HS-,则有0.45 mol H+通过质子交换膜
1
2
3
4
5
6
√
7
8
9
10
解析 由图可知,负极上硫氧化菌可以将HS-转化为 ,发生氧化反应,电极反应式是HS-+4H2O-8e-=== +9H+,正极上发生氧气得电子的还原反应:4H++O2+4e-===2H2O,A项正确;
b是正极,a是负极,所以电子从a极
流出,经外电路流向b极,B项错误;
如果将反应物直接燃烧,会有部分
化学能转化为光能等,因此能量的
利用率会有变化,C项错误;
若该电池中处理0.1 mol HS-,有0.8 mol电子发生转移,根据电子守恒,则有0.8 mol H+通过质子交换膜,D项错误。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
3.(2020·济南一模)2019年诺贝尔化学奖授予了在锂离子电池领域作出巨大贡献的三位科学家。某锂离子电池以C6Li为负极,Li1-xMO2为正极,锂盐有机溶液作电解质溶液,电池反应为C6Li+Li1-xMO2 LiMO2+C6Li1-x。则下列有关说法正确的是
A.金属锂的密度、熔点和硬度均比同族的碱金属低
B.该锂离子电池可用乙醇作有机溶剂
C.电池放电时,Li+从正极流向负极
D.电池充电时,阳极的电极反应式为LiMO2-xe-===xLi++Li1-xMO2
√
9
10
1
2
3
4
5
6
解析 碱金属元素从上到下对应单质的熔、沸点逐渐降低,故金属锂的熔点均比同族的碱金属高,A选项错误;
乙醇的氧化还原电位太低,容易被氧化,不能作该锂离子电池的有机溶剂,B选项错误;
电池放电时,为原电池,阳离子(Li+)从负极向正极移动,C选项错误;
由上述分析可知,电池充电时,LiMO2作阳极,失去电子发生氧化反应,电极反应式为LiMO2-xe-===xLi++Li1-xMO2,D选项正确。
7
8
9
10
4.工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,可用阳离子交换膜分隔两极区进行电解(装置如图所示)。
下列说法中错误的是
A.图中A口加入的溶液为稀KOH溶液
B.使用阳离子交换膜可以提高Mn元素利用率
C.阴极的电极反应式为2H2O+2e-===H2↑+2OH-
D.当有1 mol KMnO4生成时有2 mol K+通过阳离子交换膜
1
2
3
4
5
6
7
8
√
9
10
解析 惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中的氢离子在阴极得到电子生成氢气,阳极电极反应式: ,阴极电极
反应式:2H2O+2e-===H2↑+2OH-。根据阳
离子移动方向可知,左侧电极为阳极,右侧冒
气泡的电极为阴极,左侧溶液中的K+通过阳离
子交换膜进入阴极,为提高溶液的导电性并提供
反应物H2O,应从A口加入稀KOH溶液,A项说法正确;
1
2
3
4
5
6
7
8
9
10
阳离子交换膜可以防止锰酸根进入阴极区被
还原为MnO2,所以使用阳离子交换膜可以提
高Mn元素利用率,B项说法正确;
由上述分析可知,阴极的电极反应式为2H2O
+2e-===H2↑+2OH-,C项说法正确;
由 可知,当有1 mol KMnO4生成时有1 mol e-转移,所以应该有1 mol K+通过阳离子交换膜,D项说法错误。
1
2
3
4
5
6
7
8
9
10
5.(2019·辽宁高三高考模拟)氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两电极室质量相等,电池反应为NH3·BH3
+3H2O2===NH4BO2+4H2O。已知H2O2
足量,下列说法正确的是
A.正极的电极反应式为2H++2e-===H2↑
B.电池工作时,H+通过质子交换膜向负
极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol
电子
1
2
3
4
5
6
√
7
8
9
10
解析 右侧为正极,H2O2得到电子发生
还原反应,电极反应式为H2O2+2H++
2e-===2H2O,故A项错误;
放电时,阳离子向正极移动,所以H+通
过质子交换膜向正极移动,故B项错误;
电池工作时,负极的电极反应式为NH3·BH3+2H2O-6e-===NH4BO2+6H+,正极电极反应式为3H2O2+6H++6e-===6H2O,不能放出H2和NH3,故C项错误;
1
2
3
4
5
6
7
8
9
10
未加入氨硼烷之前,两电极室质量相等,通入氨硼烷后,负极的电极反应式为NH3·BH3+2H2O-6e-===NH4BO2+6H+,正极的电极反应式为3H2O2+6H++6e-===6H2O,假定转移6 mol电子,则左室质量增加31 g-6 g=25 g,右室质量增加6 g,两极室质量相差19 g,工作一段时间后,若左右两极室质量差为1.9 g,则理论上转移0.6 mol电子,故D项正确。
1
2
3
4
5
6
7
8
9
10
6.铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图1所示,
工作原理为Fe3++Cr2+ Fe2++Cr3+。图2为利用H2S废气资源回收
能量并得到单质硫的质子膜燃料
电池。下列说法正确的是
A.图1电池放电时,Cl-从负极穿
过选择性透过膜移向正极
B.图1电池放电时,电路中每通过
0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
C.用图2电池给图1装置充电时,图2中电极a接图1的正极
D.用图2电池给图1装置充电时,每生成1 mol S2(s),图1装置中就有4 mol
Cr3+被还原
1
2
3
4
5
6
7
8
√
9
10
解析 根据原电池工作原理,内电路中的阴离子向负极移动,A项错误;
电池放电时,电路中每通过0.1 mol电子,Fe3+的物质的量减小0.1 mol,但其浓度降低多少由溶液体积决
定,B项错误;
图2中在电极a上,H2S失去电子生
成S2,所以电极a为负极,应连接
图1的负极,C项错误;
在图2中每生成1 mol S2(s)转移4 mol电子,则图1中就有4 mol Cr3+被还原为Cr2+,D项正确。
1
2
3
4
5
6
7
8
9
10
7.(2020·浙江7月选考,21)电解高浓度RCOONa(羧酸钠)的NaOH溶液,在阳极RCOO-放电可得到R—R(烷烃)。下列说法不正确的是
A.电解总反应方程式:2RCOONa+2H2O R—R+2CO2↑+H2↑+
2NaOH
B.RCOO-在阳极放电,发生氧化反应
C.阴极的电极反应:2H2O+2e-===2OH-+H2↑
D.电解CH3COONa、CH3CH2COONa和NaOH混合溶液可得到乙烷、丙烷
和丁烷
√
7
8
1
2
3
4
5
6
9
10
解析 由于电解液呈强碱性,电解反应不能释放出CO2气体,A错误;
电解高浓度RCOONa的NaOH溶液,阳极上RCOO-发生氧化反应,得到R—R(烷烃),B正确;
阴极上H2O得电子放出H2,电极反应式为2H2O+2e-===2OH-+H2↑,C正确;
根据题中电解原理,电解RCOONa和NaOH混合液可得到R—R(烷烃),类比推理,电解CH3COONa、CH3CH2COONa和NaOH混合溶液,可得到CH3CH3(乙烷)、CH3CH2CH3(丙烷)和CH3CH2CH2CH3(丁烷),D正确。
7
8
1
2
3
4
5
6
9
10
8.我国科学家利用透氧膜,一步获得合成NH3的原料气,工作原理如图所示。(空气中N2与O2的物质的量之比按4∶1计),下列说法正确的是
A.电子由膜2侧向膜1侧迁移
B.膜1侧相当于电池的正极
C.若膜2侧所得气体 =3,n(CH4)∶n(H2O)
∶n(O2)=12∶12∶1
D.膜1侧的电极反应式为CH4-2e-+O2-===CO+2H2
7
8
1
2
3
4
5
6
√
9
10
7
8
1
2
3
4
5
6
解析 本题考查原电池工作原理,意在考查应用能力。观察图示知,CH4中C元素化合价升高,H2O和O2被还原,作氧化剂。即该原电池中膜1侧为负极,膜2侧为正极。电子由膜1侧向
膜2侧迁移,A、B项错误;
令膜2侧的气体中n(N2)=4 mol,则n(O2)=
1 mol,n(H2)=n(H2O)=12 mol,正极(膜2
侧)的电极反应式为H2O+2e-===H2↑+O2-,O2+4e-===2O2-,所以正极得电子总物质的量:n(e-)=24 mol+4 mol=28 mol,由电子守恒知,膜1侧参与反应的甲烷:n(CH4)=14 mol。综上所述,参与反应的CH4、H2O、O2的物质的量之比为14∶12∶1,C项错误。
9
10
9.(2020·天津,11)熔融钠—硫电池性能优良,是具有应用前景的储能电池。右图中的电池反应为2Na+xS Na2Sx
(x=5~3,难溶于熔融硫),
下列说法错误的是
A.Na2S4的电子式为
B.放电时正极反应为xS+2Na++2e-===Na2Sx
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以Na-β-Al2O3为隔膜的二次电池
7
8
1
2
3
4
5
6
√
9
10
解析 A对,四硫化二钠属于离子化合物,其中硫达到8电子稳定结构,其电子式为 ;
B对,根据总反应可知,S在正极发生反应,
电极反应为xS+2Na++2e-===Na2Sx;
C错,电池正极是含碳粉的熔融硫;
D对,因为该电池可以充电,所以为二次电池,其中Na-β-Al2O3是隔膜,防止熔融钠与熔融硫直接反应。
7
8
1
2
3
4
5
6
9
10
10.(2020·烟台一模)相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法不正确的是
A.a电极的电极反应为4H2O+
4e-===2H2↑+4OH-
B.c、d离子交换膜依次为阳离
子交换膜和阴离子交换膜
C.电池放电过程中,Cu(1)电极上的电极反应为Cu2++2e-===Cu
D.电池从开始工作到停止放电,电解池理论上可制得320 g NaOH
7
8
1
2
3
4
5
6
√
9
10
解析 a为电解池的阴极,H2O中的H+得到电子发生还原反应生成H2,电极反应为4H2O+4e-===2H2↑+4OH-,A选项正确;
电解过程中,两个离子交换膜之间的硫酸钠溶液中,Na+通过阳离子交换膜c进入阴极区, 通过阴离子交换膜d进入阳极区,B选项正确;
电池放电过程中,Cu(1)电极上发生使Cu2+浓度降低的还原反应,作正极,电极反应为Cu2++2e-===Cu,C选项正确;
7
8
1
2
3
4
5
6
9
10
电池从开始工作到停止放电,正极区硫酸铜溶液的浓度同时由2.5 mol·L-1降低到1.5 mol·L-1,负极区硫酸铜溶液同时由0.5 mol·L-1升高到1.5 mol·L-1,
正极反应可还原Cu2+的物质的量为2 L×(2.5-1.5) mol·L-1=2 mol,电路中转移4 mol电子,电解池的阴极生成4 mol OH-,即阴极区可得4 mol氢氧化钠,其质量为160 g,D选项错误。
7
8
1
2
3
4
5
6
9
10
同课章节目录
