2021届高中化学考前三个月专项复习课件(39张ppt)命题区间十 命题区间特训
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(39张ppt)命题区间十 命题区间特训 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览









文档简介
命题区间特训
命题区间十 无机物转化的新题型
A组(10分钟)
1.(2019·赤峰月考)自然界中氮元素部分循环如图所示,下列说法错误的是
A.反应①~⑥均属于氧化还原反应
B.反应①②⑤均属于氮的固定
C.反应⑥的离子方程式为
+2H2O
1
2
3
4
5
6
√
7
8
9
解析 上述六步反应中氮元素的化合价均发生变化,均属于氧化还原反应,故A项正确;
氮从游离态到化合态属于氮的固定,图中只
有⑤属于氮的固定,故B项错误;
由图示知,两者发生归中反应,故C项正确;
氮是植物的营养元素,过量排放使水体富营养化,会导致水生植物疯狂繁殖、水体缺氧,从而使水质恶化,故D项正确。
1
2
3
4
5
6
7
8
9
2.(2020·天津,10)理论研究表明,在101 kPa和298 K下,HCN(g)
HNC(g)异构化反应过程的能量变化如
图所示。下列说法错误的是
A.HCN比HNC稳定
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
1
2
3
4
5
6
7
8
√
9
解析 A对,HCN的能量低于HNC的能量,能量越低越稳定;
B对,根据题图可知反应为吸热反应,该反应的ΔH=+59.3 kJ·mol-1;
C对,正反应的活化能为186.5 kJ·mol-1,逆反应的活化能为186.5 kJ·mol-1-59.3 kJ·mol-1
1
2
3
4
5
6
7
8
9
D错,催化剂只能改变反应速率,不影响反应热。
=127.2 kJ·mol-1,故正反应的活化能大于逆反应的活化能;
3.烯烃与氢气混合在常温常压时不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面上进行。反应过
程的示意图如右:
下列说法正确的是
A.乙烯和H2生成乙
烷反应的ΔH>0
B.有催化剂时的活化能E2比无催化剂时的活化能E1低,能减小反应的ΔH
C.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到
中间体
D.催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,
可提高反应物的转化率
1
2
3
4
5
6
7
8
√
9
解析 由乙烯氢化反应能量示意图可知,该加成反应为放热反应,A项错误;
加入催化剂,没有改变反应热,只是降低了活化能,B项错误;
由烯烃催化加氢示意图可知,催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体,C项正确;
催化剂只能改变反应速率,不能改变反应物的转化率,D项错误。
1
2
3
4
5
6
7
8
9
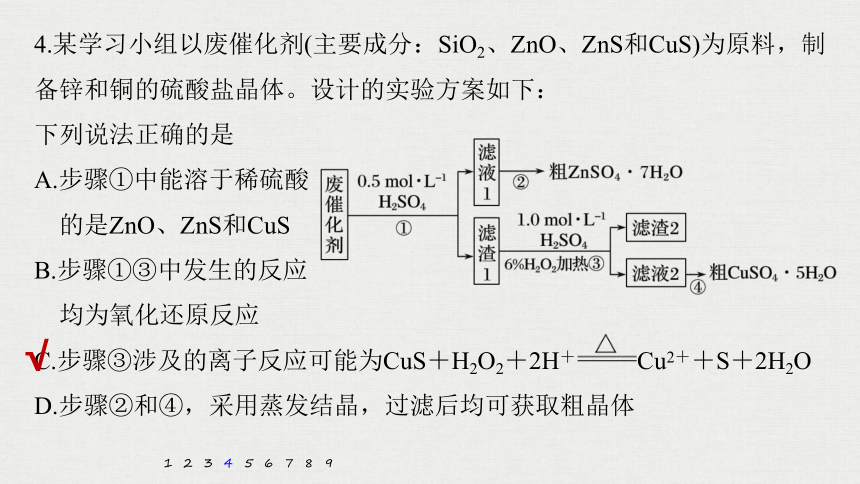
4.某学习小组以废催化剂(主要成分:SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。设计的实验方案如下:
下列说法正确的是
A.步骤①中能溶于稀硫酸
的是ZnO、ZnS和CuS
B.步骤①③中发生的反应
均为氧化还原反应
C.步骤③涉及的离子反应可能为CuS+H2O2+2H+ Cu2++S+2H2O
D.步骤②和④,采用蒸发结晶,过滤后均可获取粗晶体
1
2
3
4
5
6
√
7
8
9
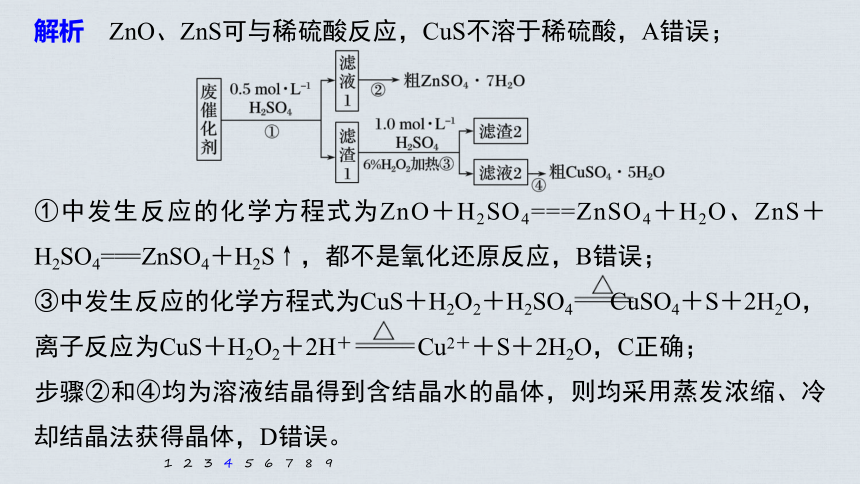
解析 ZnO、ZnS可与稀硫酸反应,CuS不溶于稀硫酸,A错误;
①中发生反应的化学方程式为ZnO+H2SO4===ZnSO4+H2O、ZnS+H2SO4===ZnSO4+H2S↑,都不是氧化还原反应,B错误;
③中发生反应的化学方程式为CuS+H2O2+H2SO4 CuSO4+S+2H2O,离子反应为CuS+H2O2+2H+ Cu2++S+2H2O,C正确;
步骤②和④均为溶液结晶得到含结晶水的晶体,则均采用蒸发浓缩、冷却结晶法获得晶体,D错误。
1
2
3
4
5
6
7
8
9
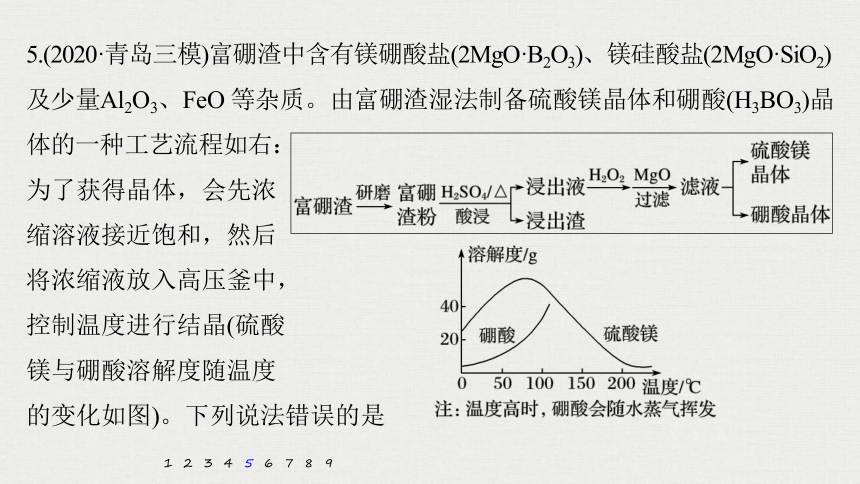
5.(2020·青岛三模)富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)
及少量Al2O3、FeO 等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如右:
为了获得晶体,会先浓
缩溶液接近饱和,然后
将浓缩液放入高压釜中,
控制温度进行结晶(硫酸
镁与硼酸溶解度随温度
的变化如图)。下列说法错误的是
1
2
3
4
5
6
7
8
9
A.该工艺流程中加快反应速率的措施有 2种
B.在高压釜中,先降温结晶得到硼酸晶体,再蒸发结晶得到硫酸镁晶体
C.“酸浸”中镁硼酸盐发生反应2MgO·B2O3+2H2SO4+H2O 2MgSO4
+2H3BO3
D.加入“MgO”后过滤,所得滤渣主要是Al(OH)3 和Fe(OH)3
1
2
3
4
5
6
7
8
√
9
解析 该工艺流程中加快反应速率的措施有研
磨(增大反应物的接触面积)、加热2种措施,A选项正确;
根据硫酸镁与硼酸溶解度随温度的变化图可知,大约80 ℃之前硫酸镁和硼酸的溶解度随温度的升高而升高,因此先降温结晶会同时得到硫酸镁和硼酸的晶体,正确的操作应为浓缩后,升温控制温度在200 ℃以上结晶,趁热过滤得到硫酸镁晶体,再降温结晶,得到硼酸晶体,B选项错误;
1
2
3
4
5
6
7
8
9
由上述分析可知,“酸浸”时镁硼酸盐发生
的反应为2MgO·B2O3+2H2SO4+H2O 2MgSO4+2H3BO3,C选项正确;
加入MgO调节pH可得到Al(OH)3和Fe(OH)3的沉淀,即过滤后的滤渣主要为Al(OH)3 和Fe(OH)3的沉淀,D选项正确。
1
2
3
4
5
6
7
8
9
6.(2019·湖北省天门、仙桃等八市第二次联合考试)某学习小组设计用98%的浓硫酸制取SO2并验证其部分性质的实验装置图如下(夹持装置省略)。下列叙述不正确的是
A.装置A中发生的离子反应
方程式为:2H++
===SO2↑+H2O
B.若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明SO2具有
漂白性
C.若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明SO2
具有还原性
D.装置C产生的白色沉淀为BaSO4
1
2
3
4
5
6
7
8
9
√
7.新版人民币的硬币采用镍合金。工业上,利用镍矿提取镍的一种流程如下:
已知:镍的金属活动性介于铁和铜之间。
下列说法不正确的是
A.将镍矿粉碎可以加快“酸浸”速率
B.NaClO的作用是氧化Fe2+
C.NaxFey(SO4)m(OH)n中,x+2y=n+2m
D.工业上可以用热还原法冶炼镍
7
1
2
3
4
5
6
8
√
9
7
1
2
3
4
5
6
8
解析 将镍矿粉碎,增大接触面积,可以加快“酸浸”速率,A项正确;
由Ni的化合价不改变知,NaClO的作用是氧化Fe2+,2Fe2++ClO-+2H+
===2Fe3++Cl-+H2O,B项正确;
NaxFey(SO4)m(OH)n中Fe为+3价,故x+3y=2m+n,C项错误;
镍的金属活动性介于铁和铜之间,工业上可以采用热还原法冶炼铁和铜,故也可以采用热还原法冶炼镍,D项正确。
9
8.草酸钴主要用作制氧化钴的原料,也可用于制取其他钴化合物。利用废料铝钴膜(含有LiCoO2、Al、Fe)制备草酸钴的工艺如下:
下列有关说法错误的是
A.碱浸的目的是溶解除铝
B.氢碘酸在流程中体现酸
性和还原性
C.滤渣的主要成分是氢氧化铁
D.沉钴时检验沉淀是否洗涤干净可用的试剂为盐酸
7
1
2
3
4
5
6
8
9
√
解析 Al能与NaOH反应,生成可溶的NaAlO2,LiCoO2和Fe均不溶于NaOH,过滤得到LiCoO2和Fe,因此碱浸的目的是溶解除铝,A项正确;
LiCoO2中Co显+3价,产品CoC2O4中Co显+2价,化合价降低,LiCoO2为氧化剂,HI为还原剂,同时体现酸性,B项正确;
沉淀表面有碘化铵,可用硝酸银检验碘离子,D项错误。
7
1
2
3
4
5
6
8
9
9.某化工厂充分利用工业废气中的 CO、CO2,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
A.为减少副反应的发生,过程Ⅱ中的装置需
使用阳离子交换膜
B.在过程Ⅲ中实现了CuCl2 的再生
C.理论上每生成 1 mol CH3OH,可得到1 mol
C2H4Cl2
D.过程Ⅳ中的反应是C2H4+2CuCl2===C2H4Cl2+2CuCl
7
1
2
3
4
5
6
8
9
√
解析 过程Ⅱ为电解饱和NaCl溶液的过程,为减少副反应的发生,装置中可使用阳离子交换膜,A选项正确;
过程Ⅲ发生的反应主要为过程Ⅳ产生的CuCl
与Cl2反应生成CuCl2,CuCl2再进入过程Ⅳ反
应,实现了CuCl2的再生,B选项正确;
7
1
2
3
4
5
6
8
9
过程Ⅰ为H2与CO2、CO反应生成CH3OH,
过程中H元素的化合价由0升高为+1,则
每生成1 mol CH3OH转移4 mol电子,过程
Ⅲ发生反应2CuCl+Cl2===2CuCl2,过程
Ⅳ中发生反应2CuCl2+C2H4===C2H4Cl2+2CuCl,每生成1 mol C2H4Cl2转移2 mol电子,结合过程Ⅱ中发生的反应,则理论上每生成1 mol CH3OH,可得到2 mol C2H4Cl2,C选项错误,D选项正确。
7
1
2
3
4
5
6
8
9
B组(15分钟)
1.三元WO3/C3N4/Ni(OH)x光催化剂产氢机理如图。下列说法正确的是
A.TEOA→TEOA+为还原反应
B.Ni(OH)x降低了H+→H2的活化能
C.能量转化形式为太阳能→电能→
化学能
D.WO3没有参与制氢反应过程
1
2
3
4
5
6
√
7
8
9
解析 TEOA→TEOA+为失去电子的反应,是氧化反应,故A项错误;
如图所示,Ni(OH)x是H+→H2的催化剂,故其可以降低该反应的活化能,故B项正确;如图所示,能量转化形式为太阳能→化学能,故C项错误;
如图所示WO3作为催化剂,参与了制氢反应过程,故D项错误。
1
2
3
4
5
6
7
8
9
2.(2020·江苏,10)下列选项所示的物质间转化均能实现的是
1
2
3
4
5
6
√
7
8
9
解析 由Cl2制备漂白粉应通入石灰乳中而不是石灰水中,A项错误;
向氯化钠溶液中通入二氧化碳,无法制取碳酸氢钠固体,B项错误;
向溴水中加入碘化钠溶液,可得到碘单质,C项正确;
电解MgCl2溶液得不到Mg,D项错误。
1
2
3
4
5
6
7
8
9
3.一种借用CeO2/CeO2-δ的转化,利用CO2和H2O合成燃料的途径如下图所示。下列说法不正确的是
A.上述转化的实质是太阳能转化为化学能
B.若得到三种产物H2、CO、CH4各1 mol,
共放出O2为1 mol
C.利用上述转化有利于遏制温室效应
D.上述转化过程中涉及的反应均属于氧化还原反应
1
2
3
4
5
6
7
8
√
9
1
2
3
4
5
6
7
8
9
解析 B项,氧原子不守恒,错误;
C项,图示中CO2被转化,能遏制温室效应,正确;
上述转化过程每步变化中均有单质生成,有元素化合价的变化,正确。
4.(2019·济宁市第一中学高三上学期第一次调研)氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业,某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究,下列说法正确的是
A.途径1中产生的Cl2可以回收
循环利用,也可以通入饱和
CaCl2溶液中除去
B.途径2中200 ℃时反应的化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑
C.X气体可以是N2,目的是作保护气,抑制CuCl2·2H2O加热过程中可能的
水解
D.CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++ ===2Cu2++2Cl-
+SO2↑+2H2O
1
2
3
4
5
6
7
8
√
9
解析 途径1中产生的Cl2可以转化为HCl,回收循环利用,Cl2在饱和CaCl2溶液中溶解度很小,不能被吸收除去,故A项错误;
Cu2(OH)2Cl2加热到200 ℃生成CuO,由原子守恒可知,还生成HCl,则化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑,故B项正确;
CuCl2水解生成氢氧化铜和HCl,X气体用于抑制CuCl2水解,则X为HCl,不是氮气,故C项错误;
CuCl酸性条件下不稳定,易生成金属Cu和Cu2+,故D项错误。
1
2
3
4
5
6
7
8
9
5.某工厂的废液中含有CCl4、I2、I-等物质,其提取碘的过程如图所示。下列说法错误的是
A.还原过程发生反应的离子方程式为:
B.操作X的名称为分液
C.用淀粉检验所富集碘的溶液中是否含有I-
D.氧化过程通入Cl2是为了提取碘
1
2
3
4
5
6
√
7
8
9
解析 可将I2还原为I-,CCl4与水溶液互不相溶,可用分液法分离,A、B均正确;
淀粉遇I2变蓝,C错误;
氧化过程发生反应为2I-+Cl2===I2+2Cl-,D正确。
1
2
3
4
5
6
7
8
9
6.常用氯气与金属锡反应制备SnCl4,其实验装置如图所示。已知SnCl4极易水解,熔点为-33 ℃,沸点为114.1 ℃。下列说法正确的是
A.试剂瓶②③中的试剂分别为饱和NaHCO3溶液、浓硫酸
B.装置①中发生反应的化学方程式为:MnO2+4HCl(浓)===MnCl2+Cl2↑
+2H2O
C.干燥管c中药品可用无水CaCl2代替
D.装置⑤的主要目的是收集冷凝的SnCl4
1
2
3
4
5
6
7
8
9
√
解析 试剂瓶②的作用为除去Cl2中的HCl,其中应盛放饱和食盐水,A项错误;
制取氯气的装置①中没有加热装置,不能选用MnO2作反应物,B项错误;
干燥管内的碱石灰除吸水外还具有吸收尾气的作用,所以不能用无水CaCl2代替,C项错误;
装置⑤用于收集冷凝的SnCl4,D项正确。
1
2
3
4
5
6
7
8
9
解析 b装置的好处是利于液体流下。
7.亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品探究亚硝酸钠与硫酸的反应及气体产物的成分。已知:气体的沸点为
NO2:21 ℃,NO:-150 ℃。
下列说法错误的是
A.用装置b代替装置a的好处是便于控制反应的发生与停止
B.反应前应打开弹簧夹,先通入一段时间氮气,除去装置中的空气
C.装置中冰水浴的作用是冷凝使NO2液化
D.装置中热水浴有利于促进NO2生成,便于检验是否有NO生成
√
7
8
1
2
3
4
5
6
9
8.(2019·泰安模拟)为探究硫酸亚铁的分解产物,将硫酸亚铁装入如图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是
A.气体产物中有SO3、SO2,
应该先检验SO3
B.装置b中的试剂为Ba(NO3)2
溶液,反应后有白色沉淀生成
C.装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D.装置d之后需要增加尾气处理装置
7
8
1
2
3
4
5
6
√
9
解析 硫酸亚铁在高温下分解生成氧化铁、二氧化硫和三氧化硫,把混合气体通入氯化钡溶液,二氧化硫气体与氯化钡溶液不反应,三氧化硫气体与氯化钡溶液反应生成硫酸钡白色沉淀,因此气体产物中应该先检验SO3,A项正确;
如果把二氧化硫气体通入
硝酸钡溶液中,因为二氧
化硫溶于水使溶液呈酸性,
酸性条件下, 再与钡离子反应生成硫酸钡沉淀,无法判断使硝酸钡溶液中出现白色沉淀的是二氧化硫还是三氧化硫,B项错误;
7
8
1
2
3
4
5
6
9
7
8
1
2
3
4
5
6
装置c中的试剂为酸性KMnO4溶液,作用是检验混合气体中的SO2,若溶液褪色,则证明存在SO2,C项错误;
装置d内装有氢氧化钠溶液,吸收多余的二氧化硫气体,因此装置d之后无须增加尾气处理装置,D项错误。
9
9.合成氨及其相关工业中,部分物质间的转化关系如图所示,下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应Ⅰ、Ⅱ、Ⅲ中含氮元素的反应物都被氧化
C.反应Ⅴ的化学方程式:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
D.反应Ⅵ利用丁物质受热易分解的性质
7
8
1
2
3
4
5
6
9
√
解析 A项,甲、乙、丙分别为N2、NO、NO2,正确;
B项,反应Ⅰ为N2与H2反应,N2为氧化剂,被还原,错误;
D项,利用了NaHCO3受热易分解的性质,正确。
7
8
1
2
3
4
5
6
9
命题区间十 无机物转化的新题型
A组(10分钟)
1.(2019·赤峰月考)自然界中氮元素部分循环如图所示,下列说法错误的是
A.反应①~⑥均属于氧化还原反应
B.反应①②⑤均属于氮的固定
C.反应⑥的离子方程式为
+2H2O
1
2
3
4
5
6
√
7
8
9
解析 上述六步反应中氮元素的化合价均发生变化,均属于氧化还原反应,故A项正确;
氮从游离态到化合态属于氮的固定,图中只
有⑤属于氮的固定,故B项错误;
由图示知,两者发生归中反应,故C项正确;
氮是植物的营养元素,过量排放使水体富营养化,会导致水生植物疯狂繁殖、水体缺氧,从而使水质恶化,故D项正确。
1
2
3
4
5
6
7
8
9
2.(2020·天津,10)理论研究表明,在101 kPa和298 K下,HCN(g)
HNC(g)异构化反应过程的能量变化如
图所示。下列说法错误的是
A.HCN比HNC稳定
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
1
2
3
4
5
6
7
8
√
9
解析 A对,HCN的能量低于HNC的能量,能量越低越稳定;
B对,根据题图可知反应为吸热反应,该反应的ΔH=+59.3 kJ·mol-1;
C对,正反应的活化能为186.5 kJ·mol-1,逆反应的活化能为186.5 kJ·mol-1-59.3 kJ·mol-1
1
2
3
4
5
6
7
8
9
D错,催化剂只能改变反应速率,不影响反应热。
=127.2 kJ·mol-1,故正反应的活化能大于逆反应的活化能;
3.烯烃与氢气混合在常温常压时不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面上进行。反应过
程的示意图如右:
下列说法正确的是
A.乙烯和H2生成乙
烷反应的ΔH>0
B.有催化剂时的活化能E2比无催化剂时的活化能E1低,能减小反应的ΔH
C.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到
中间体
D.催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,
可提高反应物的转化率
1
2
3
4
5
6
7
8
√
9
解析 由乙烯氢化反应能量示意图可知,该加成反应为放热反应,A项错误;
加入催化剂,没有改变反应热,只是降低了活化能,B项错误;
由烯烃催化加氢示意图可知,催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体,C项正确;
催化剂只能改变反应速率,不能改变反应物的转化率,D项错误。
1
2
3
4
5
6
7
8
9
4.某学习小组以废催化剂(主要成分:SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。设计的实验方案如下:
下列说法正确的是
A.步骤①中能溶于稀硫酸
的是ZnO、ZnS和CuS
B.步骤①③中发生的反应
均为氧化还原反应
C.步骤③涉及的离子反应可能为CuS+H2O2+2H+ Cu2++S+2H2O
D.步骤②和④,采用蒸发结晶,过滤后均可获取粗晶体
1
2
3
4
5
6
√
7
8
9
解析 ZnO、ZnS可与稀硫酸反应,CuS不溶于稀硫酸,A错误;
①中发生反应的化学方程式为ZnO+H2SO4===ZnSO4+H2O、ZnS+H2SO4===ZnSO4+H2S↑,都不是氧化还原反应,B错误;
③中发生反应的化学方程式为CuS+H2O2+H2SO4 CuSO4+S+2H2O,离子反应为CuS+H2O2+2H+ Cu2++S+2H2O,C正确;
步骤②和④均为溶液结晶得到含结晶水的晶体,则均采用蒸发浓缩、冷却结晶法获得晶体,D错误。
1
2
3
4
5
6
7
8
9
5.(2020·青岛三模)富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)
及少量Al2O3、FeO 等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如右:
为了获得晶体,会先浓
缩溶液接近饱和,然后
将浓缩液放入高压釜中,
控制温度进行结晶(硫酸
镁与硼酸溶解度随温度
的变化如图)。下列说法错误的是
1
2
3
4
5
6
7
8
9
A.该工艺流程中加快反应速率的措施有 2种
B.在高压釜中,先降温结晶得到硼酸晶体,再蒸发结晶得到硫酸镁晶体
C.“酸浸”中镁硼酸盐发生反应2MgO·B2O3+2H2SO4+H2O 2MgSO4
+2H3BO3
D.加入“MgO”后过滤,所得滤渣主要是Al(OH)3 和Fe(OH)3
1
2
3
4
5
6
7
8
√
9
解析 该工艺流程中加快反应速率的措施有研
磨(增大反应物的接触面积)、加热2种措施,A选项正确;
根据硫酸镁与硼酸溶解度随温度的变化图可知,大约80 ℃之前硫酸镁和硼酸的溶解度随温度的升高而升高,因此先降温结晶会同时得到硫酸镁和硼酸的晶体,正确的操作应为浓缩后,升温控制温度在200 ℃以上结晶,趁热过滤得到硫酸镁晶体,再降温结晶,得到硼酸晶体,B选项错误;
1
2
3
4
5
6
7
8
9
由上述分析可知,“酸浸”时镁硼酸盐发生
的反应为2MgO·B2O3+2H2SO4+H2O 2MgSO4+2H3BO3,C选项正确;
加入MgO调节pH可得到Al(OH)3和Fe(OH)3的沉淀,即过滤后的滤渣主要为Al(OH)3 和Fe(OH)3的沉淀,D选项正确。
1
2
3
4
5
6
7
8
9
6.(2019·湖北省天门、仙桃等八市第二次联合考试)某学习小组设计用98%的浓硫酸制取SO2并验证其部分性质的实验装置图如下(夹持装置省略)。下列叙述不正确的是
A.装置A中发生的离子反应
方程式为:2H++
===SO2↑+H2O
B.若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明SO2具有
漂白性
C.若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明SO2
具有还原性
D.装置C产生的白色沉淀为BaSO4
1
2
3
4
5
6
7
8
9
√
7.新版人民币的硬币采用镍合金。工业上,利用镍矿提取镍的一种流程如下:
已知:镍的金属活动性介于铁和铜之间。
下列说法不正确的是
A.将镍矿粉碎可以加快“酸浸”速率
B.NaClO的作用是氧化Fe2+
C.NaxFey(SO4)m(OH)n中,x+2y=n+2m
D.工业上可以用热还原法冶炼镍
7
1
2
3
4
5
6
8
√
9
7
1
2
3
4
5
6
8
解析 将镍矿粉碎,增大接触面积,可以加快“酸浸”速率,A项正确;
由Ni的化合价不改变知,NaClO的作用是氧化Fe2+,2Fe2++ClO-+2H+
===2Fe3++Cl-+H2O,B项正确;
NaxFey(SO4)m(OH)n中Fe为+3价,故x+3y=2m+n,C项错误;
镍的金属活动性介于铁和铜之间,工业上可以采用热还原法冶炼铁和铜,故也可以采用热还原法冶炼镍,D项正确。
9
8.草酸钴主要用作制氧化钴的原料,也可用于制取其他钴化合物。利用废料铝钴膜(含有LiCoO2、Al、Fe)制备草酸钴的工艺如下:
下列有关说法错误的是
A.碱浸的目的是溶解除铝
B.氢碘酸在流程中体现酸
性和还原性
C.滤渣的主要成分是氢氧化铁
D.沉钴时检验沉淀是否洗涤干净可用的试剂为盐酸
7
1
2
3
4
5
6
8
9
√
解析 Al能与NaOH反应,生成可溶的NaAlO2,LiCoO2和Fe均不溶于NaOH,过滤得到LiCoO2和Fe,因此碱浸的目的是溶解除铝,A项正确;
LiCoO2中Co显+3价,产品CoC2O4中Co显+2价,化合价降低,LiCoO2为氧化剂,HI为还原剂,同时体现酸性,B项正确;
沉淀表面有碘化铵,可用硝酸银检验碘离子,D项错误。
7
1
2
3
4
5
6
8
9
9.某化工厂充分利用工业废气中的 CO、CO2,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
A.为减少副反应的发生,过程Ⅱ中的装置需
使用阳离子交换膜
B.在过程Ⅲ中实现了CuCl2 的再生
C.理论上每生成 1 mol CH3OH,可得到1 mol
C2H4Cl2
D.过程Ⅳ中的反应是C2H4+2CuCl2===C2H4Cl2+2CuCl
7
1
2
3
4
5
6
8
9
√
解析 过程Ⅱ为电解饱和NaCl溶液的过程,为减少副反应的发生,装置中可使用阳离子交换膜,A选项正确;
过程Ⅲ发生的反应主要为过程Ⅳ产生的CuCl
与Cl2反应生成CuCl2,CuCl2再进入过程Ⅳ反
应,实现了CuCl2的再生,B选项正确;
7
1
2
3
4
5
6
8
9
过程Ⅰ为H2与CO2、CO反应生成CH3OH,
过程中H元素的化合价由0升高为+1,则
每生成1 mol CH3OH转移4 mol电子,过程
Ⅲ发生反应2CuCl+Cl2===2CuCl2,过程
Ⅳ中发生反应2CuCl2+C2H4===C2H4Cl2+2CuCl,每生成1 mol C2H4Cl2转移2 mol电子,结合过程Ⅱ中发生的反应,则理论上每生成1 mol CH3OH,可得到2 mol C2H4Cl2,C选项错误,D选项正确。
7
1
2
3
4
5
6
8
9
B组(15分钟)
1.三元WO3/C3N4/Ni(OH)x光催化剂产氢机理如图。下列说法正确的是
A.TEOA→TEOA+为还原反应
B.Ni(OH)x降低了H+→H2的活化能
C.能量转化形式为太阳能→电能→
化学能
D.WO3没有参与制氢反应过程
1
2
3
4
5
6
√
7
8
9
解析 TEOA→TEOA+为失去电子的反应,是氧化反应,故A项错误;
如图所示,Ni(OH)x是H+→H2的催化剂,故其可以降低该反应的活化能,故B项正确;如图所示,能量转化形式为太阳能→化学能,故C项错误;
如图所示WO3作为催化剂,参与了制氢反应过程,故D项错误。
1
2
3
4
5
6
7
8
9
2.(2020·江苏,10)下列选项所示的物质间转化均能实现的是
1
2
3
4
5
6
√
7
8
9
解析 由Cl2制备漂白粉应通入石灰乳中而不是石灰水中,A项错误;
向氯化钠溶液中通入二氧化碳,无法制取碳酸氢钠固体,B项错误;
向溴水中加入碘化钠溶液,可得到碘单质,C项正确;
电解MgCl2溶液得不到Mg,D项错误。
1
2
3
4
5
6
7
8
9
3.一种借用CeO2/CeO2-δ的转化,利用CO2和H2O合成燃料的途径如下图所示。下列说法不正确的是
A.上述转化的实质是太阳能转化为化学能
B.若得到三种产物H2、CO、CH4各1 mol,
共放出O2为1 mol
C.利用上述转化有利于遏制温室效应
D.上述转化过程中涉及的反应均属于氧化还原反应
1
2
3
4
5
6
7
8
√
9
1
2
3
4
5
6
7
8
9
解析 B项,氧原子不守恒,错误;
C项,图示中CO2被转化,能遏制温室效应,正确;
上述转化过程每步变化中均有单质生成,有元素化合价的变化,正确。
4.(2019·济宁市第一中学高三上学期第一次调研)氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业,某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究,下列说法正确的是
A.途径1中产生的Cl2可以回收
循环利用,也可以通入饱和
CaCl2溶液中除去
B.途径2中200 ℃时反应的化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑
C.X气体可以是N2,目的是作保护气,抑制CuCl2·2H2O加热过程中可能的
水解
D.CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++ ===2Cu2++2Cl-
+SO2↑+2H2O
1
2
3
4
5
6
7
8
√
9
解析 途径1中产生的Cl2可以转化为HCl,回收循环利用,Cl2在饱和CaCl2溶液中溶解度很小,不能被吸收除去,故A项错误;
Cu2(OH)2Cl2加热到200 ℃生成CuO,由原子守恒可知,还生成HCl,则化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑,故B项正确;
CuCl2水解生成氢氧化铜和HCl,X气体用于抑制CuCl2水解,则X为HCl,不是氮气,故C项错误;
CuCl酸性条件下不稳定,易生成金属Cu和Cu2+,故D项错误。
1
2
3
4
5
6
7
8
9
5.某工厂的废液中含有CCl4、I2、I-等物质,其提取碘的过程如图所示。下列说法错误的是
A.还原过程发生反应的离子方程式为:
B.操作X的名称为分液
C.用淀粉检验所富集碘的溶液中是否含有I-
D.氧化过程通入Cl2是为了提取碘
1
2
3
4
5
6
√
7
8
9
解析 可将I2还原为I-,CCl4与水溶液互不相溶,可用分液法分离,A、B均正确;
淀粉遇I2变蓝,C错误;
氧化过程发生反应为2I-+Cl2===I2+2Cl-,D正确。
1
2
3
4
5
6
7
8
9
6.常用氯气与金属锡反应制备SnCl4,其实验装置如图所示。已知SnCl4极易水解,熔点为-33 ℃,沸点为114.1 ℃。下列说法正确的是
A.试剂瓶②③中的试剂分别为饱和NaHCO3溶液、浓硫酸
B.装置①中发生反应的化学方程式为:MnO2+4HCl(浓)===MnCl2+Cl2↑
+2H2O
C.干燥管c中药品可用无水CaCl2代替
D.装置⑤的主要目的是收集冷凝的SnCl4
1
2
3
4
5
6
7
8
9
√
解析 试剂瓶②的作用为除去Cl2中的HCl,其中应盛放饱和食盐水,A项错误;
制取氯气的装置①中没有加热装置,不能选用MnO2作反应物,B项错误;
干燥管内的碱石灰除吸水外还具有吸收尾气的作用,所以不能用无水CaCl2代替,C项错误;
装置⑤用于收集冷凝的SnCl4,D项正确。
1
2
3
4
5
6
7
8
9
解析 b装置的好处是利于液体流下。
7.亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品探究亚硝酸钠与硫酸的反应及气体产物的成分。已知:气体的沸点为
NO2:21 ℃,NO:-150 ℃。
下列说法错误的是
A.用装置b代替装置a的好处是便于控制反应的发生与停止
B.反应前应打开弹簧夹,先通入一段时间氮气,除去装置中的空气
C.装置中冰水浴的作用是冷凝使NO2液化
D.装置中热水浴有利于促进NO2生成,便于检验是否有NO生成
√
7
8
1
2
3
4
5
6
9
8.(2019·泰安模拟)为探究硫酸亚铁的分解产物,将硫酸亚铁装入如图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是
A.气体产物中有SO3、SO2,
应该先检验SO3
B.装置b中的试剂为Ba(NO3)2
溶液,反应后有白色沉淀生成
C.装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D.装置d之后需要增加尾气处理装置
7
8
1
2
3
4
5
6
√
9
解析 硫酸亚铁在高温下分解生成氧化铁、二氧化硫和三氧化硫,把混合气体通入氯化钡溶液,二氧化硫气体与氯化钡溶液不反应,三氧化硫气体与氯化钡溶液反应生成硫酸钡白色沉淀,因此气体产物中应该先检验SO3,A项正确;
如果把二氧化硫气体通入
硝酸钡溶液中,因为二氧
化硫溶于水使溶液呈酸性,
酸性条件下, 再与钡离子反应生成硫酸钡沉淀,无法判断使硝酸钡溶液中出现白色沉淀的是二氧化硫还是三氧化硫,B项错误;
7
8
1
2
3
4
5
6
9
7
8
1
2
3
4
5
6
装置c中的试剂为酸性KMnO4溶液,作用是检验混合气体中的SO2,若溶液褪色,则证明存在SO2,C项错误;
装置d内装有氢氧化钠溶液,吸收多余的二氧化硫气体,因此装置d之后无须增加尾气处理装置,D项错误。
9
9.合成氨及其相关工业中,部分物质间的转化关系如图所示,下列说法不正确的是
A.甲、乙、丙三种物质中都含有氮元素
B.反应Ⅰ、Ⅱ、Ⅲ中含氮元素的反应物都被氧化
C.反应Ⅴ的化学方程式:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
D.反应Ⅵ利用丁物质受热易分解的性质
7
8
1
2
3
4
5
6
9
√
解析 A项,甲、乙、丙分别为N2、NO、NO2,正确;
B项,反应Ⅰ为N2与H2反应,N2为氧化剂,被还原,错误;
D项,利用了NaHCO3受热易分解的性质,正确。
7
8
1
2
3
4
5
6
9
同课章节目录
