2021届高中化学考前三个月专项复习课件(29张ppt) 题型二 大题突破
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(29张ppt) 题型二 大题突破 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览



文档简介
大题突破
题型二 无机综合——化工流程综合题的研究
物质制备类工艺流程题的解题策略
1.首尾分析法
破解无机物制备工艺流程原理与过程。对一些线性流程工艺(从原料到产品为“一条龙”的生产工序)题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理和分离、提纯产品的化工工艺,然后结合题设的问题,逐一推敲解答。
考向突破一 物质制备类工艺流程题
高考必备
2.截段分析法
对于用同样的原材料生产两种或多种产品(包括副产品)的工艺流程题,用截段分析法更容易找到解题的切入点。关键在于看清主、副产品是如何分开的,以此确定截几段更合适,一般截段以产品为基准点。
3.掌握“5种”原料预处理(研磨、水浸、酸浸、灼烧、煅烧)的作用和“5种”控制反应条件(调溶液pH、控制温度、使用催化剂、趁热过滤、冰水洗涤)的目的。
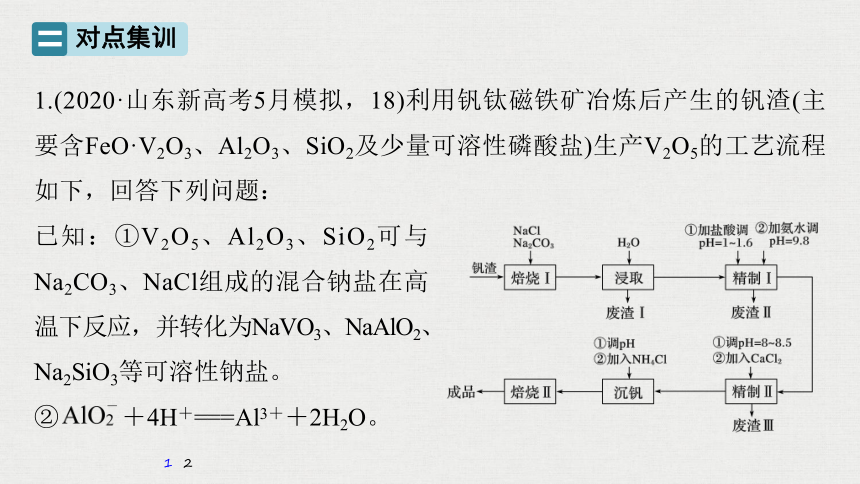
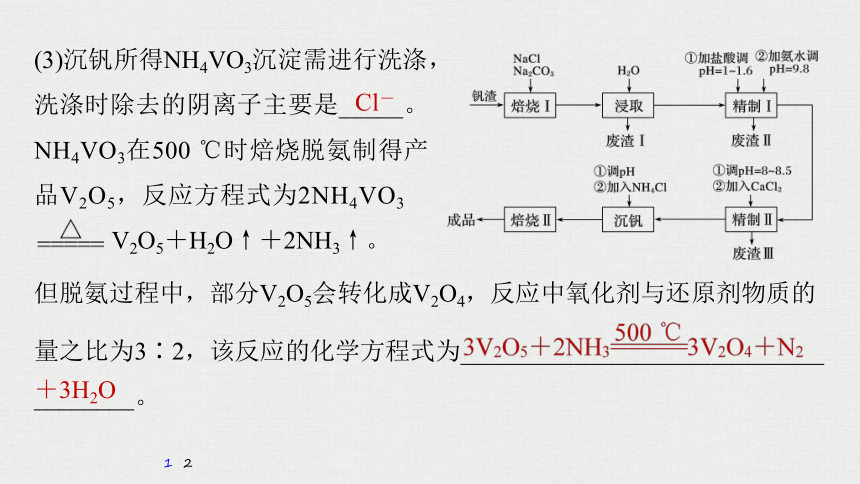
1.(2020·山东新高考5月模拟,18)利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
对点集训
1
2
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
② +4H+===Al3++2H2O。
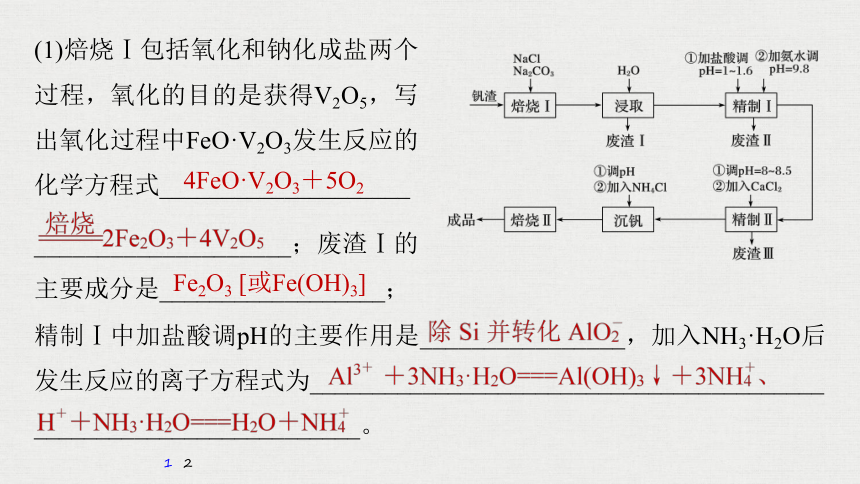
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式____________________
____________________;废渣Ⅰ的主要成分是__________________;
1
2
精制Ⅰ中加盐酸调pH的主要作用是________________,加入NH3·H2O后发生反应的离子方程式为_________________________________________
__________________________。
4FeO·V2O3+5O2
Fe2O3 [或Fe(OH)3]
1
2
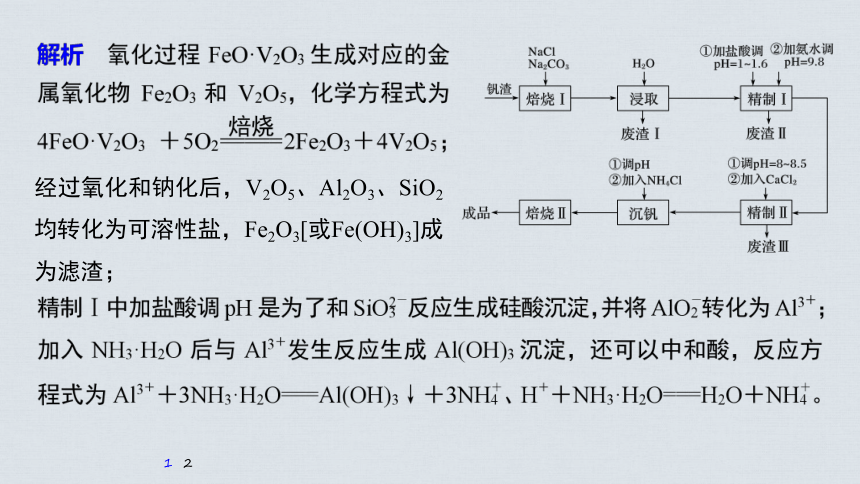
经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3[或Fe(OH)3]成为滤渣;
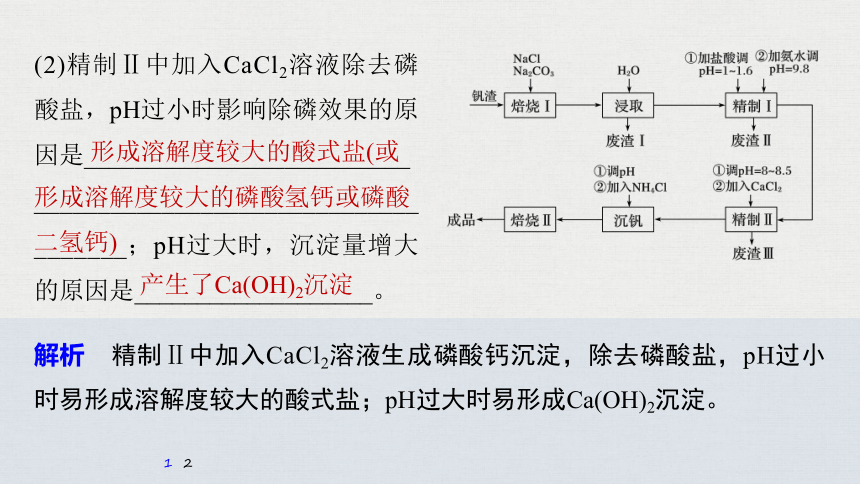
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是__________________________
_____________________________________;pH过大时,沉淀量增大的原因是___________________。
1
2
形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙或磷酸二氢钙)
产生了Ca(OH)2沉淀
解析 精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时易形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是_____。NH4VO3在500 ℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3
V2O5+H2O↑+2NH3↑。
1
2
Cl-
但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的
量之比为3∶2,该反应的化学方程式为_____________________________
________。
+3H2O
1
2
解析 沉钒时加入试剂NH4Cl,因此所得NH4VO3沉淀含有的阴离子主要为Cl-;脱氨过程中,部分V2O5会转化成V2O4,且反应中氧化剂与还原剂物质的量之比为3∶2,则V2O5为氧化剂,NH3为还原剂,还原产物为V2O4,氧化产物为N2,则氧化还原方程式为3V2O5 +2NH3 3V2O4+N2+3H2O。
2.铬及其化合物有许多独特的性质和用途。如炼钢时加入一定量的铬可得到不锈钢,K2Cr2O7是实验中常用的强氧化剂之一。
(1)铬可形成CrCl3、NaCrO2等盐类物质,则NaCrO2中铬元素的化合价为_____,由此知Cr2O3是______(填“酸性”“碱性”或“两性”)化合物。
1
2
+3
两性
解析 由化合价规则知NaCrO2中铬元素价态为+3,由铬形成CrCl3、NaCrO2两类盐及铝元素的性质类推,Cr2O3是两性化合物。
(2)某化工厂利用湿法从主要含有锌、铜、铁、铬、镉(Cd)、钴(Co)等单质的铜铬渣中回收铬的流程如下:
1
2
几种金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物
Fe(OH)3
Zn(OH)2
Cd(OH)2
Cr(OH)3
开始沉淀的pH
1.5
8
7.2
6
沉淀完全的pH
3.3
12
9.5
8
①料渣Ⅰ中只含有一种金属单质,该单质是_____,氧化过程中由铁、铬形成的离子均被氧化,则pH的调控范围是____________。
1
2
铜
3.3≤pH<6
解析 铜不能与稀硫酸反应,故料渣Ⅰ是金属单质铜,调pH时得到Fe(OH)3沉淀,故溶液的pH应不小于3.3,但要小于6。
②酸浸时形成的金属离子的价态均相同,料渣Ⅱ中含有大量的CoAs合金,请写出除钴时反应的离子方程式:_________________________________
______________,氧化过程中氧化产物与还原产物物质的量之比为_____。
1
2
2Co2++7Zn+10H++As2O5===7Zn2+
+2CoAs+5H2O
1∶1
解析 锌将Co2+、As2O5还原为相应的单质,然后两种单质形成合金。氧化过程中是Fe2+被H2O2氧化为Fe3+、H2O2被还原为H2O,氧化产物与还原产物物质的量之比为1∶1。
(3)砷酸可用于制造有机颜料、杀虫剂等,将料渣Ⅱ用NaOH处理后可得到亚砷酸钠(Na3AsO3),再利用如图所示的三室电解池进行电解可得到砷酸(H3AsO4)及NaOH。
1
2
则a极应接电源的____极,b电极上电极反应式为_____________________
____________。
负
物质提纯类工艺流程题的解题策略
1.阅读流程图,明确原料中含有的杂质和目标物质以及提纯的流程。
2.明确提纯的方法及各种方法使用范围
Ⅰ.水溶法:除去可溶性杂质。
Ⅱ.酸溶法:除去碱性杂质。
Ⅲ.碱溶法:除去酸性杂质。
考向突破二 物质提纯类工艺流程题
高考必备
Ⅳ.氧化剂或还原剂法:除去还原性或氧化性杂质。
Ⅴ.加热灼烧法:除去受热易分解或易挥发的杂质。
Ⅵ.调节溶液的pH法:如除去酸性溶液中的Fe3+等。
3.明确常用的分离方法,同时还要注意物质分离、提纯的原则及注意事项等。
1.纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
对点集训
1
2
(1)用黄铜矿(主要成分为CuFeS2)、
废铜渣和稀硫酸共同作用可获得
较纯净的Cu2S,其原理如图2所示,
该反应的离子方程式为__________
______________________________。
CuFeS2+
Cu+2H+===Cu2S+Fe2++H2S↑
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=== 2CuCl2+4FeCl2+S,每生成1 mol CuCl2,反应中转移电子的物质的量为________;
1
2
2 mol
浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_______________________________。
4Fe2++O2+4H+===4Fe3++2H2O
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是___________
_______________________。
1
2
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_____________________________。
生成的硫覆
盖在Cu2S表面,阻碍浸取
Fe3+水解程度随pH的升高而增大
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为________。
1
2
32∶7
解析 在碱性条件下,Cu2+与N2H4反应生成氮气和铜,离子方程式为2Cu2++N2H4+4OH-===2Cu+N2↑+4H2O,反应中还原产物为Cu,氧化产物为N2,质量之比为(2×64)∶28=32∶7。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_______
________等操作可得到Fe2O3产品。
1
2
洗涤
煅烧
(或灼烧)
2.(2020·潍坊高密一中高三模拟)钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
1
2
物质
V2O5
V2O3
K2O
SiO2
Fe2O3
Al2O3
质量分数/%
0.81
1.70
2.11
63.91
5.86
12.51
一种从该钒精矿中提取五氧化二钒的流程如右:
VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为____________
_______________________________。
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为___________________
_________________;若用浓盐酸代替硫酸,V2O5转化为
1
2
2V2O3+8H++O2
===4VO2++4H2O
6HCl(浓)===2VOCl2+Cl2↑+3H2O
V2O5+
解析 “酸浸、氧化”时,V2O3转化为VO2+,该过程中氧气作氧化剂,V2O3为还原剂,结合电子守恒和元素守恒可得方程式为2V2O3+8H++O2===4VO2++4H2O;
1
2
浓盐酸为还原性酸,V2O5转化为VO2+,同时将盐酸氧化成氯气,结合电子守恒和元素守恒可知方程式为V2O5+6HCl(浓)===2VOCl2+Cl2↑+3H2O。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用_____
(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含
1
2
铁粉
硫氰酸钾溶液
有Fe3+,可选用的化学试剂是_____________。
解析 根据分析可知萃取前可用铁粉对浸出液进行“还原”处理;铁离子与硫氰酸钾溶液反应呈红色,可用硫氰酸钾溶液检验是否含有铁离子。
(3)“溶剂萃取与反萃取”可表示为:VO2++(HR2PO4)2(O)
VO(R2PO4)2(O)+
2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈_____性(填“酸”“碱”或“中”)。
1
2
酸
解析 为了提高VO2+的产率需要平衡左移,则需要溶液中有大量氢离子,所以反萃取剂应呈酸性。
(4)“氧化”中,欲使3 mol VO2+变为 ,则需要氧化剂NaClO3至少为_____mol。
1
2
0.5
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为_______________________。
1
2
练后反思
无机化工流程中的常见分离方法总结
(1)洗涤(冰水、热水):洗去晶体表面的杂质离子。
(2)过滤(热滤或抽滤):分离难溶物和易溶物。
(3)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质。
(4)蒸发结晶:提取溶解度随温度变化不大的溶质。
(5)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物。
(6)蒸馏或分馏:分离沸点不同且互溶的液体混合物。
(7)冷却法:利用气体易液化的特点分离气体。
1
2
题型二 无机综合——化工流程综合题的研究
物质制备类工艺流程题的解题策略
1.首尾分析法
破解无机物制备工艺流程原理与过程。对一些线性流程工艺(从原料到产品为“一条龙”的生产工序)题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理和分离、提纯产品的化工工艺,然后结合题设的问题,逐一推敲解答。
考向突破一 物质制备类工艺流程题
高考必备
2.截段分析法
对于用同样的原材料生产两种或多种产品(包括副产品)的工艺流程题,用截段分析法更容易找到解题的切入点。关键在于看清主、副产品是如何分开的,以此确定截几段更合适,一般截段以产品为基准点。
3.掌握“5种”原料预处理(研磨、水浸、酸浸、灼烧、煅烧)的作用和“5种”控制反应条件(调溶液pH、控制温度、使用催化剂、趁热过滤、冰水洗涤)的目的。
1.(2020·山东新高考5月模拟,18)利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
对点集训
1
2
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
② +4H+===Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式____________________
____________________;废渣Ⅰ的主要成分是__________________;
1
2
精制Ⅰ中加盐酸调pH的主要作用是________________,加入NH3·H2O后发生反应的离子方程式为_________________________________________
__________________________。
4FeO·V2O3+5O2
Fe2O3 [或Fe(OH)3]
1
2
经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3[或Fe(OH)3]成为滤渣;
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是__________________________
_____________________________________;pH过大时,沉淀量增大的原因是___________________。
1
2
形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙或磷酸二氢钙)
产生了Ca(OH)2沉淀
解析 精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时易形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是_____。NH4VO3在500 ℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3
V2O5+H2O↑+2NH3↑。
1
2
Cl-
但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的
量之比为3∶2,该反应的化学方程式为_____________________________
________。
+3H2O
1
2
解析 沉钒时加入试剂NH4Cl,因此所得NH4VO3沉淀含有的阴离子主要为Cl-;脱氨过程中,部分V2O5会转化成V2O4,且反应中氧化剂与还原剂物质的量之比为3∶2,则V2O5为氧化剂,NH3为还原剂,还原产物为V2O4,氧化产物为N2,则氧化还原方程式为3V2O5 +2NH3 3V2O4+N2+3H2O。
2.铬及其化合物有许多独特的性质和用途。如炼钢时加入一定量的铬可得到不锈钢,K2Cr2O7是实验中常用的强氧化剂之一。
(1)铬可形成CrCl3、NaCrO2等盐类物质,则NaCrO2中铬元素的化合价为_____,由此知Cr2O3是______(填“酸性”“碱性”或“两性”)化合物。
1
2
+3
两性
解析 由化合价规则知NaCrO2中铬元素价态为+3,由铬形成CrCl3、NaCrO2两类盐及铝元素的性质类推,Cr2O3是两性化合物。
(2)某化工厂利用湿法从主要含有锌、铜、铁、铬、镉(Cd)、钴(Co)等单质的铜铬渣中回收铬的流程如下:
1
2
几种金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物
Fe(OH)3
Zn(OH)2
Cd(OH)2
Cr(OH)3
开始沉淀的pH
1.5
8
7.2
6
沉淀完全的pH
3.3
12
9.5
8
①料渣Ⅰ中只含有一种金属单质,该单质是_____,氧化过程中由铁、铬形成的离子均被氧化,则pH的调控范围是____________。
1
2
铜
3.3≤pH<6
解析 铜不能与稀硫酸反应,故料渣Ⅰ是金属单质铜,调pH时得到Fe(OH)3沉淀,故溶液的pH应不小于3.3,但要小于6。
②酸浸时形成的金属离子的价态均相同,料渣Ⅱ中含有大量的CoAs合金,请写出除钴时反应的离子方程式:_________________________________
______________,氧化过程中氧化产物与还原产物物质的量之比为_____。
1
2
2Co2++7Zn+10H++As2O5===7Zn2+
+2CoAs+5H2O
1∶1
解析 锌将Co2+、As2O5还原为相应的单质,然后两种单质形成合金。氧化过程中是Fe2+被H2O2氧化为Fe3+、H2O2被还原为H2O,氧化产物与还原产物物质的量之比为1∶1。
(3)砷酸可用于制造有机颜料、杀虫剂等,将料渣Ⅱ用NaOH处理后可得到亚砷酸钠(Na3AsO3),再利用如图所示的三室电解池进行电解可得到砷酸(H3AsO4)及NaOH。
1
2
则a极应接电源的____极,b电极上电极反应式为_____________________
____________。
负
物质提纯类工艺流程题的解题策略
1.阅读流程图,明确原料中含有的杂质和目标物质以及提纯的流程。
2.明确提纯的方法及各种方法使用范围
Ⅰ.水溶法:除去可溶性杂质。
Ⅱ.酸溶法:除去碱性杂质。
Ⅲ.碱溶法:除去酸性杂质。
考向突破二 物质提纯类工艺流程题
高考必备
Ⅳ.氧化剂或还原剂法:除去还原性或氧化性杂质。
Ⅴ.加热灼烧法:除去受热易分解或易挥发的杂质。
Ⅵ.调节溶液的pH法:如除去酸性溶液中的Fe3+等。
3.明确常用的分离方法,同时还要注意物质分离、提纯的原则及注意事项等。
1.纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
对点集训
1
2
(1)用黄铜矿(主要成分为CuFeS2)、
废铜渣和稀硫酸共同作用可获得
较纯净的Cu2S,其原理如图2所示,
该反应的离子方程式为__________
______________________________。
CuFeS2+
Cu+2H+===Cu2S+Fe2++H2S↑
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=== 2CuCl2+4FeCl2+S,每生成1 mol CuCl2,反应中转移电子的物质的量为________;
1
2
2 mol
浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_______________________________。
4Fe2++O2+4H+===4Fe3++2H2O
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是___________
_______________________。
1
2
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_____________________________。
生成的硫覆
盖在Cu2S表面,阻碍浸取
Fe3+水解程度随pH的升高而增大
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为________。
1
2
32∶7
解析 在碱性条件下,Cu2+与N2H4反应生成氮气和铜,离子方程式为2Cu2++N2H4+4OH-===2Cu+N2↑+4H2O,反应中还原产物为Cu,氧化产物为N2,质量之比为(2×64)∶28=32∶7。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_______
________等操作可得到Fe2O3产品。
1
2
洗涤
煅烧
(或灼烧)
2.(2020·潍坊高密一中高三模拟)钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
1
2
物质
V2O5
V2O3
K2O
SiO2
Fe2O3
Al2O3
质量分数/%
0.81
1.70
2.11
63.91
5.86
12.51
一种从该钒精矿中提取五氧化二钒的流程如右:
VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为____________
_______________________________。
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为___________________
_________________;若用浓盐酸代替硫酸,V2O5转化为
1
2
2V2O3+8H++O2
===4VO2++4H2O
6HCl(浓)===2VOCl2+Cl2↑+3H2O
V2O5+
解析 “酸浸、氧化”时,V2O3转化为VO2+,该过程中氧气作氧化剂,V2O3为还原剂,结合电子守恒和元素守恒可得方程式为2V2O3+8H++O2===4VO2++4H2O;
1
2
浓盐酸为还原性酸,V2O5转化为VO2+,同时将盐酸氧化成氯气,结合电子守恒和元素守恒可知方程式为V2O5+6HCl(浓)===2VOCl2+Cl2↑+3H2O。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用_____
(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含
1
2
铁粉
硫氰酸钾溶液
有Fe3+,可选用的化学试剂是_____________。
解析 根据分析可知萃取前可用铁粉对浸出液进行“还原”处理;铁离子与硫氰酸钾溶液反应呈红色,可用硫氰酸钾溶液检验是否含有铁离子。
(3)“溶剂萃取与反萃取”可表示为:VO2++(HR2PO4)2(O)
VO(R2PO4)2(O)+
2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈_____性(填“酸”“碱”或“中”)。
1
2
酸
解析 为了提高VO2+的产率需要平衡左移,则需要溶液中有大量氢离子,所以反萃取剂应呈酸性。
(4)“氧化”中,欲使3 mol VO2+变为 ,则需要氧化剂NaClO3至少为_____mol。
1
2
0.5
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为_______________________。
1
2
练后反思
无机化工流程中的常见分离方法总结
(1)洗涤(冰水、热水):洗去晶体表面的杂质离子。
(2)过滤(热滤或抽滤):分离难溶物和易溶物。
(3)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质。
(4)蒸发结晶:提取溶解度随温度变化不大的溶质。
(5)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物。
(6)蒸馏或分馏:分离沸点不同且互溶的液体混合物。
(7)冷却法:利用气体易液化的特点分离气体。
1
2
同课章节目录
