2021届高中化学考前三个月专项复习课件(30张ppt) 题型四 真题调研
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(30张ppt) 题型四 真题调研 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 15:57:41 | ||
图片预览





文档简介
真题调研
题型四 物质结构与性质综合题的研究(选考)
1.(2020·全国卷Ⅰ,35)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为______。
1
2
3
4
4∶5
解析 基态Fe2+的价电子排布式为3d6,未成对电子数为4,基态Fe3+的价电子排布式为3d5,未成对电子数为5,所以两者之比为4∶5。
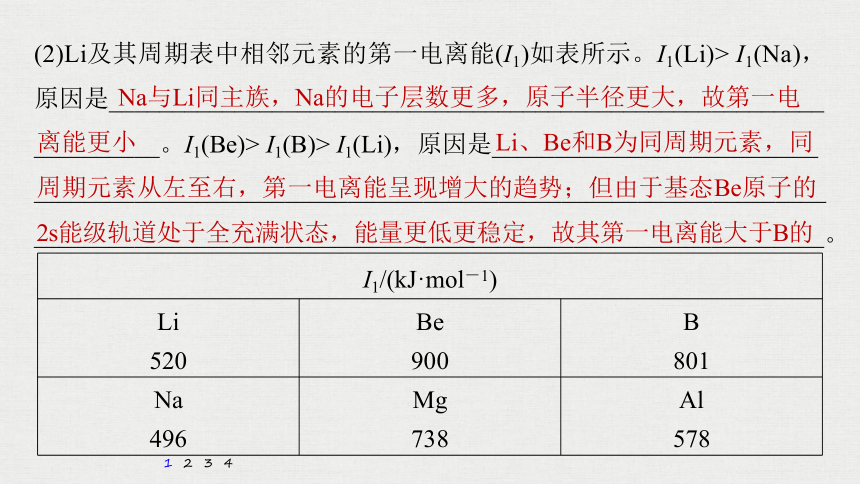
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________________________________________________________
__________。I1(Be)> I1(B)> I1(Li),原因是__________________________
______________________________________________________________________________________________________________________________。
1
2
3
4
I1/(kJ·mol-1)
Li
520
Be
900
B
801
Na
496
Mg
738
Al
578
Na与Li同主族,Na的电子层数更多,原子半径更大,故第一电离能更小
Li、Be和B为同周期元素,同
周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的2s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的
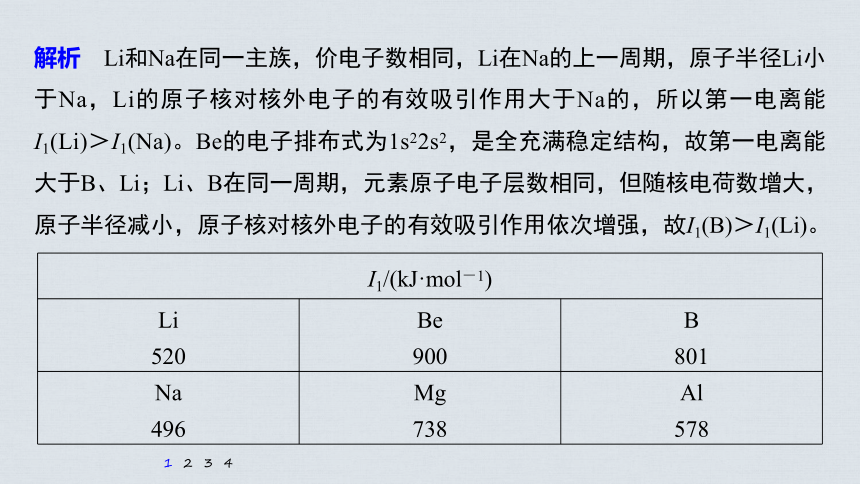
解析 Li和Na在同一主族,价电子数相同,Li在Na的上一周期,原子半径Li小于Na,Li的原子核对核外电子的有效吸引作用大于Na的,所以第一电离能I1(Li)>I1(Na)。Be的电子排布式为1s22s2,是全充满稳定结构,故第一电离能大于B、Li;Li、B在同一周期,元素原子电子层数相同,但随核电荷数增大,原子半径减小,原子核对核外电子的有效吸引作用依次增强,故I1(B)>I1(Li)。
1
2
3
4
I1/(kJ·mol-1)
Li
520
Be
900
B
801
Na
496
Mg
738
Al
578
(3)磷酸根离子的空间构型为___________,其中P的价层电子对数为____、杂化轨道类型为_____。
1
2
3
4
正四面体形
4
sp3
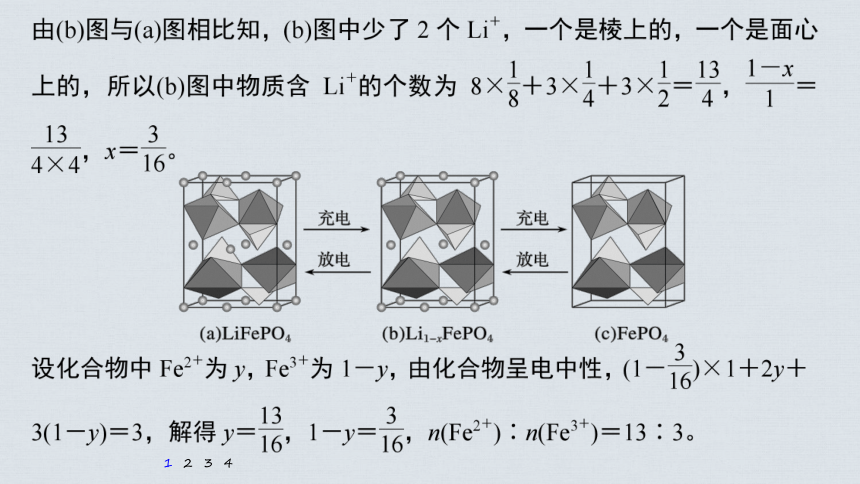
电池充电时,LiFeO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所
示,则x=____________,n(Fe2+ )∶n(Fe3+)=______。
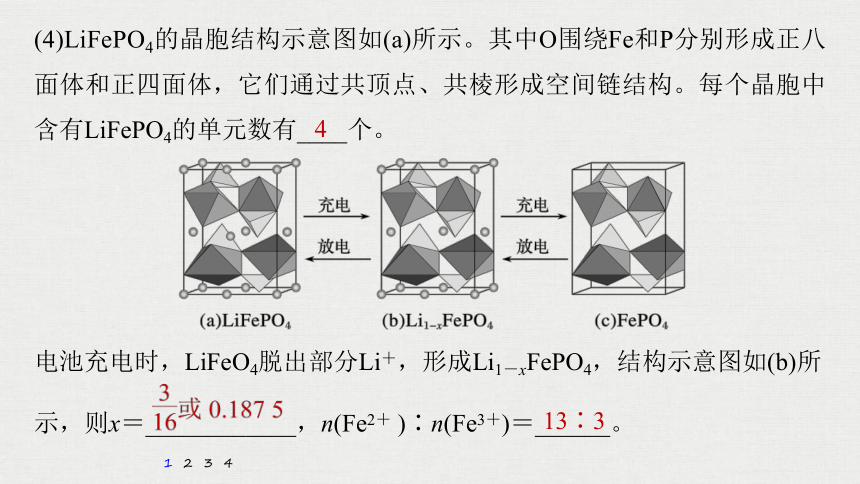
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
1
2
3
4
4
13∶3
1
2
3
4
1
2
3
4
2.(2020·全国卷Ⅱ,35)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为___________________。
1
2
3
4
1s22s22p63s23p63d24s2
解析 Ti的原子序数为22,因此基态Ti原子的核外电子排布式为1s22s22p6 3s23p63d24s2。
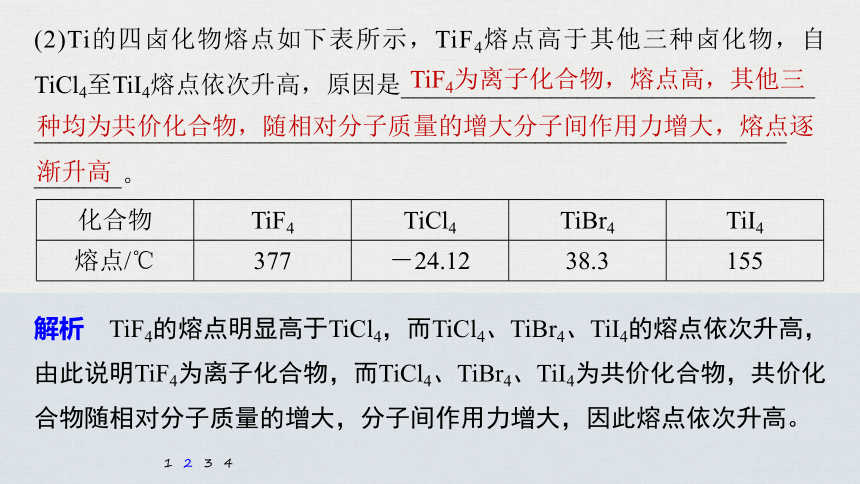
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_________________________________
____________________________________________________________
_______。
1
2
3
4
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
TiF4为离子化合物,熔点高,其他三
种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
解析 TiF4的熔点明显高于TiCl4,而TiCl4、TiBr4、TiI4的熔点依次升高,由此说明TiF4为离子化合物,而TiCl4、TiBr4、TiI4为共价化合物,共价化合物随相对分子质量的增大,分子间作用力增大,因此熔点依次升高。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是____________;金属离子与氧离子间的作用力为_______,Ca2+的配位数是____。
1
2
3
4
O>Ti>Ca
离子键
12
解析 三种元素中O的电负性最大,Ca的电负性最小,因此三种元素电负性的大小顺序为O>Ti>Ca。氧离子与金属离子之间形成的是离子键。由图(a)可知,每个Ca2+周围与之等距离的O2-的个数为12,即配位数为12。
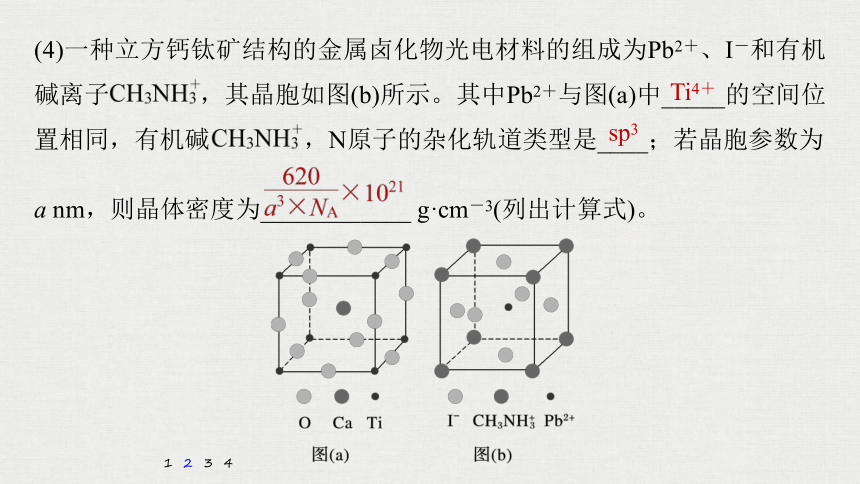
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中_____的空间位置相同,有机碱 ,N原子的杂化轨道类型是____;若晶胞参数为
a nm,则晶体密度为____________ g·cm-3(列出计算式)。
1
2
3
4
Ti4+
sp3
1
2
3
4
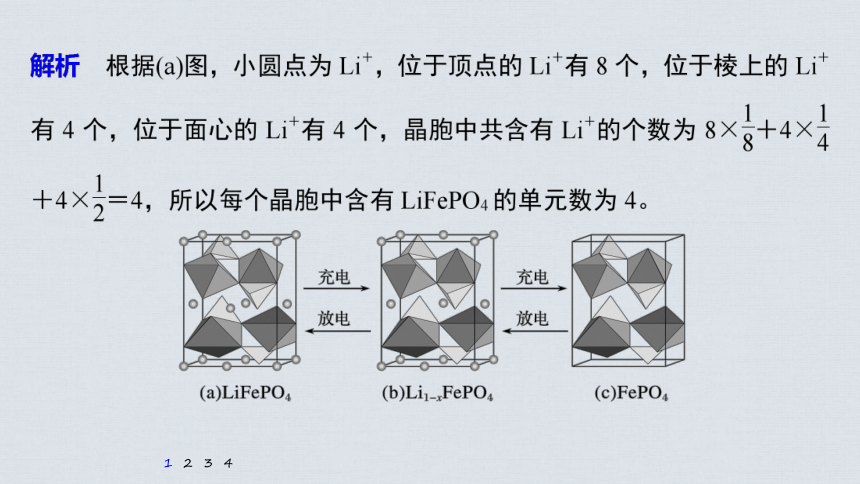
解析 由图(b)可知,该晶胞中I-位于面心上,每个Pb2+周围有6个I-,图(a)中每个Ti4+周围有6个O2-,由此可知,Pb2+与图(a)中的Ti4+位置相同。N原子形成4个σ键,价电子层上无孤电子对,因此杂化轨道类型是sp3。每个晶胞中含有1个Pb(CH3NH3)I3,晶胞的体积为(a×10-7)3 cm3,Pb(CH3NH3)I3的相对分子质量为620,因此1个晶胞的质
量为
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理__________________________、_______________________。
1
2
3
4
2Eu3++Pb===2Eu2++Pb2+
2Eu2++I2===2Eu3++2I-
解析 由图(c)可知,Pb与Eu3+反应生成Pb2+和Eu2+,即离子方程式为Pb+2Eu3+===Pb2++2Eu2+;I2和Eu2+反应生成I-和Eu3+,即离子方程式为I2+2Eu2+===2I-+2Eu3+。
1
2
3
4
3.(2020·全国卷Ⅲ,35)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是____。根据对角线规则,B的一些化学性质与元素_______的相似。
1
2
3
4
B
Si(硅)
解析 一般来说,原子的电子层数越多,半径越大,电子层数相同时,核电荷数越大,原子半径越小,则原子半径:B>N>H。根据对角线规则,B与Si处于元素周期表中对角线位置,化学性质相似。
(2)NH3BH3分子中,N—B化学键称为_____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:
1
2
3
4
的结构为 。在该反应中,B原子的杂化轨道类型由
____变为____。
配位
N
sp3
sp2
1
2
3
4
解析 NH3分子中N原子有1对孤电子对,BH3分子中B原子有空的2p轨道,则NH3BH3分子中N—B化学键是配位键,N原子提供孤电子对,B原子提供空轨道。NH3BH3中B原子形成3个B—H键和1个B—N键,B原子周围
有4对成键电子对,则B原子采取sp3杂化; 中每个B原子均
形成3个B—O键,且B原子最外层不含孤电子对,则B原子采取sp2杂化,故在该反应中,B原子的杂化轨道类型由sp3变为sp2。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是______(写分子式),其熔点比NH3BH3______(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
1
2
3
4
N>H>B
C2H6
低
Hδ+与Hδ-的静电引力
解析 NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),说明N的电负性强于H,B的电负性弱于H,故电负性:N>H>B。NH3BH3分子含8个原子,其价电子总数为14,与其互为等电子体的分子是CH3CH3。CH3CH3分子中的H都呈正电性,NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则CH3CH3的熔点比NH3BH3低的原因是在NH3BH3分子之间存在Hδ+与Hδ-的静电引力。
1
2
3
4
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
1
2
3
4
氨硼烷晶体的密度ρ=_____________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
解析 氨硼烷的2×2×2超晶胞结构的晶胞参数分别为2a pm=2a×10-10 cm、2b pm=2b×10-10 cm、2c pm=2c×10-10 cm、α=β=γ=90°,则晶胞的体积V(晶胞)=8abc×10-30 cm3。
1
2
3
4
4.(2020·天津,13)Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_____________,基态Fe原子的电子排布式为_______________________________。
1
2
3
4
第四周期Ⅷ族
1s22s22p63s23p63d64s2(或[Ar]3d64s2)
解析 Fe、CO、Ni三种元素在周期表中位于第四周期Ⅷ族;Fe的原子序数为26,根据核外电子排布规律可知,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。
(2)CoO的面心立方晶胞如图1所示。设阿伏加德罗
常数的值为NA,则CoO晶体的密度为______g·cm-3;三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为________________。
1
2
3
4
NiO>CoO>FeO
Fe、Co、Ni的原子序数逐渐增大,原子半径逐渐减小,因此FeO、CoO、NiO微粒间的作用力由大到小的顺序为NiO>CoO>FeO,三种晶体的熔点由高到低的顺序为NiO>CoO>FeO。
1
2
3
4
(3)Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____________________,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:___________________________________________。
1
2
3
4
CoCl3>Cl2>FeCl3
2Co(OH)3+6H++2Cl-===2Co2++Cl2↑+6H2O
解析 由Fe和Cl2反应生成FeCl3可知,氧化性:Cl2>Fe3+;由Co和Cl2反应只生成CoCl2而不能生成CoCl3可知,氧化性:Co3+>Cl2。综上分析,FeCl3、CoCl3和Cl2三者氧化性由强到弱的顺序为CoCl3>Cl2>FeCl3。Co(OH)3与盐酸反应生成氯气和Co2+,反应的离子方程式为2Co(OH)3+6H++2Cl-===2Co2++Cl2↑+6H2O。
(4)95 ℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图2所示,当w(H2SO4)大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_________________
_______________________________________。
1
2
3
4
由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为_________(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为___________________________________________
______________________________________________。
随H2SO4质量分数
的增加,Ni表面逐渐形成致密的氧化膜
少量多次
3Ni+3H2SO4+2HNO3===3NiSO4+2NO↑+4H2O
(或Ni+H2SO4+2HNO3===NiSO4+2NO2↑+2H2O)
解析 由铁、铝遇浓硫酸能发生钝化可推知,其原因可能是硫酸的质量分数大于63%时,镍表面逐渐形成致密的氧化物保护膜,使反应速率减慢。因为Ni与稀硝酸反应较快,所以添加HNO3时应少量多次而不是一次过量。
1
2
3
4
由题给信息可知,反应物为Ni、H2SO4、HNO3,Ni被氧化生成NiSO4,HNO3被还原为NO或NO2,因此该反应的化学方程式为3Ni+3H2SO4+2HNO3===3NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3===NiSO4+2NO2↑+2H2O。
物质结构与性质命题规律
(1)载体主要分为两类:一类是根据相关物质,如新型物质、古籍中的某物质等命题;另一类是周期表中若干种前四周期元素,先推断后回答问题.从目前命题形式看,高考趋向选择第一种形式命题。
(2)考查的重点主要有核外电子的表示方法(电子排布式、电子排布图等),未成对电子数的判断,电负性和第一电离能的大小比较,电离能异常变化的原因分析,杂化类型和立体构型的判断,晶体类型与化学键、粒子之间作用力类型的判断。
(3)解释、分析型问题是“物质结构与性质”的难点,主要包括对熔、沸点的高低、热稳定性、键角、配体提供的孤电子对数、形成双键难易程度以及形成共价键和离子键的条件等的考查。
(4)晶胞的相关计算是必考点,主要涉及面心立方、体心立方、氯化钠型、石墨型、六棱柱等晶胞中配位数、密度、空间利用率、晶胞参数和粒子半径等的计算,其中,粒子半径、空间利用率的计算是高考新热点,考查了考生用数学工具解决化学晶胞相关计算的能力。
题型四 物质结构与性质综合题的研究(选考)
1.(2020·全国卷Ⅰ,35)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为______。
1
2
3
4
4∶5
解析 基态Fe2+的价电子排布式为3d6,未成对电子数为4,基态Fe3+的价电子排布式为3d5,未成对电子数为5,所以两者之比为4∶5。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________________________________________________________
__________。I1(Be)> I1(B)> I1(Li),原因是__________________________
______________________________________________________________________________________________________________________________。
1
2
3
4
I1/(kJ·mol-1)
Li
520
Be
900
B
801
Na
496
Mg
738
Al
578
Na与Li同主族,Na的电子层数更多,原子半径更大,故第一电离能更小
Li、Be和B为同周期元素,同
周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的2s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的
解析 Li和Na在同一主族,价电子数相同,Li在Na的上一周期,原子半径Li小于Na,Li的原子核对核外电子的有效吸引作用大于Na的,所以第一电离能I1(Li)>I1(Na)。Be的电子排布式为1s22s2,是全充满稳定结构,故第一电离能大于B、Li;Li、B在同一周期,元素原子电子层数相同,但随核电荷数增大,原子半径减小,原子核对核外电子的有效吸引作用依次增强,故I1(B)>I1(Li)。
1
2
3
4
I1/(kJ·mol-1)
Li
520
Be
900
B
801
Na
496
Mg
738
Al
578
(3)磷酸根离子的空间构型为___________,其中P的价层电子对数为____、杂化轨道类型为_____。
1
2
3
4
正四面体形
4
sp3
电池充电时,LiFeO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所
示,则x=____________,n(Fe2+ )∶n(Fe3+)=______。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
1
2
3
4
4
13∶3
1
2
3
4
1
2
3
4
2.(2020·全国卷Ⅱ,35)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为___________________。
1
2
3
4
1s22s22p63s23p63d24s2
解析 Ti的原子序数为22,因此基态Ti原子的核外电子排布式为1s22s22p6 3s23p63d24s2。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_________________________________
____________________________________________________________
_______。
1
2
3
4
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
TiF4为离子化合物,熔点高,其他三
种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
解析 TiF4的熔点明显高于TiCl4,而TiCl4、TiBr4、TiI4的熔点依次升高,由此说明TiF4为离子化合物,而TiCl4、TiBr4、TiI4为共价化合物,共价化合物随相对分子质量的增大,分子间作用力增大,因此熔点依次升高。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是____________;金属离子与氧离子间的作用力为_______,Ca2+的配位数是____。
1
2
3
4
O>Ti>Ca
离子键
12
解析 三种元素中O的电负性最大,Ca的电负性最小,因此三种元素电负性的大小顺序为O>Ti>Ca。氧离子与金属离子之间形成的是离子键。由图(a)可知,每个Ca2+周围与之等距离的O2-的个数为12,即配位数为12。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中_____的空间位置相同,有机碱 ,N原子的杂化轨道类型是____;若晶胞参数为
a nm,则晶体密度为____________ g·cm-3(列出计算式)。
1
2
3
4
Ti4+
sp3
1
2
3
4
解析 由图(b)可知,该晶胞中I-位于面心上,每个Pb2+周围有6个I-,图(a)中每个Ti4+周围有6个O2-,由此可知,Pb2+与图(a)中的Ti4+位置相同。N原子形成4个σ键,价电子层上无孤电子对,因此杂化轨道类型是sp3。每个晶胞中含有1个Pb(CH3NH3)I3,晶胞的体积为(a×10-7)3 cm3,Pb(CH3NH3)I3的相对分子质量为620,因此1个晶胞的质
量为
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理__________________________、_______________________。
1
2
3
4
2Eu3++Pb===2Eu2++Pb2+
2Eu2++I2===2Eu3++2I-
解析 由图(c)可知,Pb与Eu3+反应生成Pb2+和Eu2+,即离子方程式为Pb+2Eu3+===Pb2++2Eu2+;I2和Eu2+反应生成I-和Eu3+,即离子方程式为I2+2Eu2+===2I-+2Eu3+。
1
2
3
4
3.(2020·全国卷Ⅲ,35)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是____。根据对角线规则,B的一些化学性质与元素_______的相似。
1
2
3
4
B
Si(硅)
解析 一般来说,原子的电子层数越多,半径越大,电子层数相同时,核电荷数越大,原子半径越小,则原子半径:B>N>H。根据对角线规则,B与Si处于元素周期表中对角线位置,化学性质相似。
(2)NH3BH3分子中,N—B化学键称为_____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:
1
2
3
4
的结构为 。在该反应中,B原子的杂化轨道类型由
____变为____。
配位
N
sp3
sp2
1
2
3
4
解析 NH3分子中N原子有1对孤电子对,BH3分子中B原子有空的2p轨道,则NH3BH3分子中N—B化学键是配位键,N原子提供孤电子对,B原子提供空轨道。NH3BH3中B原子形成3个B—H键和1个B—N键,B原子周围
有4对成键电子对,则B原子采取sp3杂化; 中每个B原子均
形成3个B—O键,且B原子最外层不含孤电子对,则B原子采取sp2杂化,故在该反应中,B原子的杂化轨道类型由sp3变为sp2。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是______(写分子式),其熔点比NH3BH3______(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
1
2
3
4
N>H>B
C2H6
低
Hδ+与Hδ-的静电引力
解析 NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),说明N的电负性强于H,B的电负性弱于H,故电负性:N>H>B。NH3BH3分子含8个原子,其价电子总数为14,与其互为等电子体的分子是CH3CH3。CH3CH3分子中的H都呈正电性,NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则CH3CH3的熔点比NH3BH3低的原因是在NH3BH3分子之间存在Hδ+与Hδ-的静电引力。
1
2
3
4
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
1
2
3
4
氨硼烷晶体的密度ρ=_____________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
解析 氨硼烷的2×2×2超晶胞结构的晶胞参数分别为2a pm=2a×10-10 cm、2b pm=2b×10-10 cm、2c pm=2c×10-10 cm、α=β=γ=90°,则晶胞的体积V(晶胞)=8abc×10-30 cm3。
1
2
3
4
4.(2020·天津,13)Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_____________,基态Fe原子的电子排布式为_______________________________。
1
2
3
4
第四周期Ⅷ族
1s22s22p63s23p63d64s2(或[Ar]3d64s2)
解析 Fe、CO、Ni三种元素在周期表中位于第四周期Ⅷ族;Fe的原子序数为26,根据核外电子排布规律可知,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。
(2)CoO的面心立方晶胞如图1所示。设阿伏加德罗
常数的值为NA,则CoO晶体的密度为______g·cm-3;三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为________________。
1
2
3
4
NiO>CoO>FeO
Fe、Co、Ni的原子序数逐渐增大,原子半径逐渐减小,因此FeO、CoO、NiO微粒间的作用力由大到小的顺序为NiO>CoO>FeO,三种晶体的熔点由高到低的顺序为NiO>CoO>FeO。
1
2
3
4
(3)Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____________________,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:___________________________________________。
1
2
3
4
CoCl3>Cl2>FeCl3
2Co(OH)3+6H++2Cl-===2Co2++Cl2↑+6H2O
解析 由Fe和Cl2反应生成FeCl3可知,氧化性:Cl2>Fe3+;由Co和Cl2反应只生成CoCl2而不能生成CoCl3可知,氧化性:Co3+>Cl2。综上分析,FeCl3、CoCl3和Cl2三者氧化性由强到弱的顺序为CoCl3>Cl2>FeCl3。Co(OH)3与盐酸反应生成氯气和Co2+,反应的离子方程式为2Co(OH)3+6H++2Cl-===2Co2++Cl2↑+6H2O。
(4)95 ℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图2所示,当w(H2SO4)大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_________________
_______________________________________。
1
2
3
4
由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为_________(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为___________________________________________
______________________________________________。
随H2SO4质量分数
的增加,Ni表面逐渐形成致密的氧化膜
少量多次
3Ni+3H2SO4+2HNO3===3NiSO4+2NO↑+4H2O
(或Ni+H2SO4+2HNO3===NiSO4+2NO2↑+2H2O)
解析 由铁、铝遇浓硫酸能发生钝化可推知,其原因可能是硫酸的质量分数大于63%时,镍表面逐渐形成致密的氧化物保护膜,使反应速率减慢。因为Ni与稀硝酸反应较快,所以添加HNO3时应少量多次而不是一次过量。
1
2
3
4
由题给信息可知,反应物为Ni、H2SO4、HNO3,Ni被氧化生成NiSO4,HNO3被还原为NO或NO2,因此该反应的化学方程式为3Ni+3H2SO4+2HNO3===3NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3===NiSO4+2NO2↑+2H2O。
物质结构与性质命题规律
(1)载体主要分为两类:一类是根据相关物质,如新型物质、古籍中的某物质等命题;另一类是周期表中若干种前四周期元素,先推断后回答问题.从目前命题形式看,高考趋向选择第一种形式命题。
(2)考查的重点主要有核外电子的表示方法(电子排布式、电子排布图等),未成对电子数的判断,电负性和第一电离能的大小比较,电离能异常变化的原因分析,杂化类型和立体构型的判断,晶体类型与化学键、粒子之间作用力类型的判断。
(3)解释、分析型问题是“物质结构与性质”的难点,主要包括对熔、沸点的高低、热稳定性、键角、配体提供的孤电子对数、形成双键难易程度以及形成共价键和离子键的条件等的考查。
(4)晶胞的相关计算是必考点,主要涉及面心立方、体心立方、氯化钠型、石墨型、六棱柱等晶胞中配位数、密度、空间利用率、晶胞参数和粒子半径等的计算,其中,粒子半径、空间利用率的计算是高考新热点,考查了考生用数学工具解决化学晶胞相关计算的能力。
同课章节目录
