2021届高中化学考前三个月专项复习课件(41张ppt) 题型二 化工流程逐空特训
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(41张ppt) 题型二 化工流程逐空特训 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览










文档简介
化工流程逐空特训
题型二 无机综合——化工流程综合题的研究
A组(30分钟)
1.化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)过氧化钠用于潜水艇或呼吸面具作供氧剂,主要反应的化学方程式为:_____________________________。
(2)工业上用电解饱和食盐水的方法生产氯气,即“氯碱工业”,写出反
应的化学方程式:____________________________________。
2Na2O2+2CO2===2Na2CO3+O2
1
2
3
4
5
6
(3)野外作业中用Al焊接铁轨,该反应的化学方程式为:______________
________________。
(4)将一个铝制易拉罐充满CO2气体,然后往罐内注入足量的NaOH溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起,试用离子方程式解释易拉罐又重新鼓起的原因:_______________
_____________________。
(5)用小苏打治疗胃酸过多,反应的离子方程式为:__________________
______。
2Al+Fe2O3
2Al+2OH-+
CO2↑
1
2
3
4
5
6
2.请回答:
(1)CaH2的电子式:____________________。
(2)将硫黄撒在汞表面,以除去不慎洒落的汞,用化学方程式表示其理由:______________。
(3)完成以下氧化还原反应的离子方程式:____ClO2+____CN-+______ ===____ +____N2↑+____Cl-+_______。
Hg+S===HgS
2
2
4OH-
2
1
2
2H2O
1
2
3
4
5
6
(4)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出SiO2溶于氢氟酸的离子方程式:______________________________。
解析 设二元酸的化学式为H2SixFy,根据化合价代数和为0可知2+4x-y
=0,由氟元素质量分数有 ×100%=79.17%,联立解得x≈1,
y≈6,则化学式为H2SiF6,再根据生成物为水和二元强酸,即可写出离子方程式:SiO2+6HF===2H++ +2H2O。
1
2
3
4
5
6
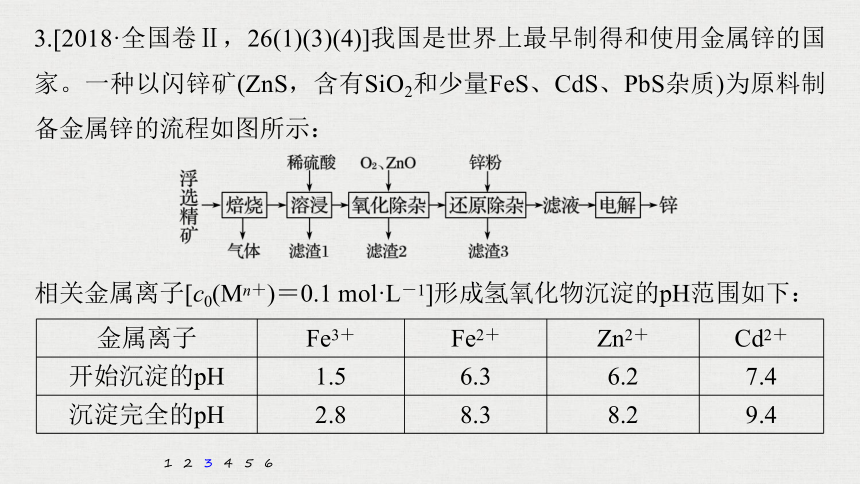
3.[2018·全国卷Ⅱ,26(1)(3)(4)]我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
1
2
3
4
5
6
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为____________________________。
解析 闪锌矿的主要成分是ZnS,所以高温焙烧过程中主要反应的化学方程式为2ZnS+3O2 2ZnO+2SO2。
1
2
3
4
5
6
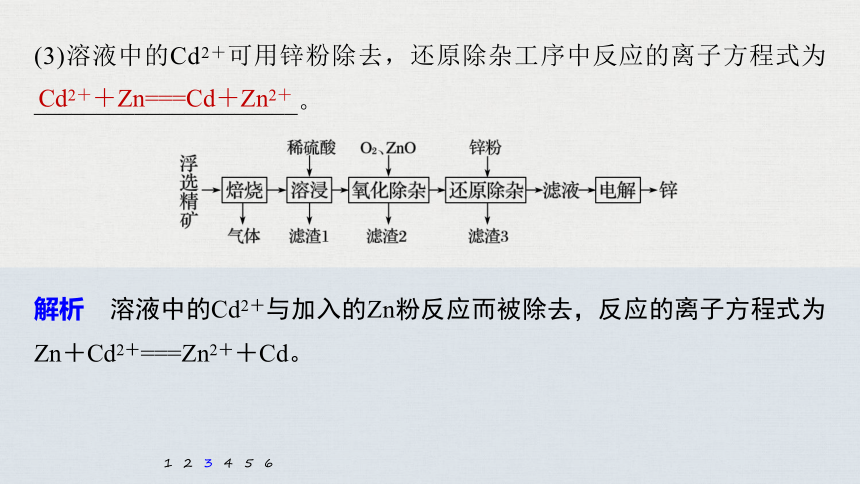
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_____________________。
Cd2++Zn===Cd+Zn2+
解析 溶液中的Cd2+与加入的Zn粉反应而被除去,反应的离子方程式为Zn+Cd2+===Zn2++Cd。
1
2
3
4
5
6
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________________;沉积锌后的电解液可返回_____工序继续使用。
Zn2++2e-===Zn
溶浸
解析 电解ZnSO4溶液制备单质Zn时,阴极放电的是Zn2+和H+。因为溶液中的Zn2+浓度较大,所以阴极电极反应式应该是Zn2++2e-===Zn,阳极放电的是OH-,电极反应式是4OH--4e-===2H2O+O2↑。沉积锌后的溶液应该是ZnSO4和稀H2SO4,可返回到溶浸工序循环使用。
1
2
3
4
5
6
4.结晶水合物在煅烧过程中会发生一系列变化,请回答下列问题:
(1)硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂。将Ce(SO4)2·4H2O(摩尔质
量为404 g·mol-1)在空气中加热,样品的固体残留率(
×100%)随温度的变化如图1所示。
当固体残留率为70.3%时,所得固体可能为____(填字母)。
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
B
1
2
3
4
5
6
解析 若1 mol Ce(SO4)2·4H2O分解,当固体残留率为70.3%时,所剩固体的质量为404 g·mol-1×1 mol×70.3%≈284 g,即对应所得固体的摩尔质量可能为284 g·mol-1,Ce(SO4)2的摩尔质量为332 g·mol-1,CeOSO4的摩尔质量为252 g·mol-1,A、C项不符合题意;
若2 mol Ce(SO4)2·4H2O分解,对应所得1 mol固体时固体的摩尔质量约为568 g·
mol-1,Ce2(SO4)3的摩尔质量为568 g·
mol-1,B项符合题意。
1
2
3
4
5
6
(2)固体A为生石膏(CaSO4·2H2O)和不含结晶水且高温时也不分解的杂质。生石膏在120 ℃时失水生成熟石膏(2CaSO4·H2O),熟石膏在200 ℃时失水生成硫酸钙。为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A 180 g置于坩埚中加热,加热过程中固体质量随温度变化的情况如图2所示。
①实验中每次对固体称量时需要在冷却后进行。为保证实验结果的精确性,固体冷却时必须防止_____。
吸水
解析 失水后的晶体冷却时必须防止吸水,否则会导致测定结果有较大误差。
1
2
3
4
5
6
②将加热到1 400 ℃时生成的气体通入品红溶液中,品红褪色。写出1 400 ℃时反应的化学方程式:__________________________
______。
+O2↑
解析 由图示数据及使品红褪色的信息可推知反应为2CaSO4 2CaO
+2SO2↑+O2↑。
1
2
3
4
5
6
③固体A中生石膏的质量分数约为________(结果保留1位小数)。
95.6%
解析 由②中反应方程式及CaSO4分解时质量减少144 g-64 g=80 g可知生成了1 mol SO2和0.5 mol O2,根据原子守恒知生石膏的物质的量为1 mol,则m(CaSO4·2H2O)=172 g,生石膏的质量分数= ×100%≈95.6%。
1
2
3
4
5
6
5.(2020·济宁二模)铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料
己知:活性炭净化主要
是除去有机杂质。
(1)写出氯化铵的电子式:_________________,“净化”过程属于_____
(填“物理”或“ 化学”)变化。
活性氧化锌的工艺流程如图所示。请回答以下问题:
物理
1
2
3
4
5
6
(2)在反应温度为50 ℃,反应时间为1 h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为____mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________________________________________。
4
1
2
3
4
5
6
(3)滴加KMnO4溶液有MnO2生成,目的是除____元素,除杂3是置换除杂过程,则试剂a是_____,“滤渣Ⅲ”的主要成分为________(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式:________________________
_____________________________,此过程中可以循环利用的副产品是________。
Fe
Zn
Cu、Zn
Zn2(OH)2CO3↓+3CO2↑+H2O
NH4Cl
1
2
3
4
5
6
(5)取m g活性氧化锌样品配成待测液,加入指示剂3~4滴,再加入适量六亚甲基四胺,用a mol·L-1EDTA标准液进行滴定,消耗标准液V mL。已知:与1.0 mL EDTA标准液[c(EDTA)=1.000 mol·L-1]相当的以克表示
的氧化锌质量为0.081 39,则样品中氧化锌的质量分数为______________
___________________(用代数式表示)。
1
2
3
4
5
6
6.一种用铬铁矿(主要成分是FeCr2O4,还含有Al2O3、Fe2O3等)制氧化铬的工艺流程如右:
回答下列问题:
(1)“氧化焙烧”过程中,理论上1 mol FeO·Cr2O3完全被氧化为Na2CrO4和Fe2O3时,转移电子的物质的量为________;“水浸”过程中,为提高Na2CrO4的浸取率,除可适当增大水的用量之外,还可采用的措施是_______________________________________________________________
(列举一条)。
7 mol
适当延长浸取时间或适当提高浸取温度或充分搅拌等(答出一点即可)
1
2
3
4
5
6
解析 Fe元素化合价由+2价变为+3价,升1价,Cr元素由+3价变为+6价,2个Cr升高6价,故1 mol FeO·Cr2O3完全被氧化为Na2CrO4和Fe2O3时转移电子7 mol。为提高Na2CrO4的浸取率,除可适当增大水的用量之外,还可采取的措施是适当延长浸取时间或适当提高浸取温度或充分搅拌等。
1
2
3
4
5
6
(2)“除铝”时通入足量CO2发生反应的离子方程式为_________________
____________________。
1
2
3
4
5
6
(3)“酸化结晶”过程中发生的反应为 ,该
反应的平衡常数表达式为K=_________________。
1
2
3
4
5
6
(4)Na2Cr2O7与(NH4)2SO4混合热解时生成Cr2O3和N2及硫酸盐的化学方程
式为_____________________________________________________;能说明“水洗”完全的方法是_________________________________________
_____________________________________________________。
取少量最后一次洗涤滤液,滴入盐酸酸化的
BaCl2溶液,若无沉淀,说明已洗涤完全(其他合理答案也可)
1
2
3
4
5
6
(5)测定产品中Cr2O3含量的步骤如下:
步骤1:准确称取a g产品,加入KClO3熔融(Cr2O3+5KClO3 2K2CrO4+KCl+5O2↑+2Cl2↑);
步骤2:酸化,转化为K2Cr2O7溶液;
步骤3:加入稍过量的KI溶液充分反应( +6I-+14H+===2Cr3++3I2+7H2O),加入淀粉溶液作指示剂,用c mol·L-1 Na2S2O3标准溶液进行滴定(I2+ ===2I-+ )至终点,消耗标准溶液V mL。则产品中含
Cr2O3的质量分数为_____________________(列出计算表达式)。
1
2
3
4
5
6
1
2
3
4
5
6
B组(30分钟)
1.双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:_________________________。
(2)双氧水和84消毒液混合失去消毒作用,生成无色无味气体,该气体为____(填化学式)。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为_________
______________________;写出制备84消毒液的总反应化学方程式:___________________________。
O2
2H2O+
1
2
3
4
5
6
2e-===2OH-+H2↑
(4)双氧水是二元弱酸,298 K时,Ka1=1.6×10-12,Ka2=1.0×10-25,双氧水电离的方程式为___________________________________;298 K时0.1 mol·L-1双氧水溶液的pH≈_____。(已知:lg 2≈0.3)
6.4
解析 双氧水是二元弱酸,氢离子主要来自一级电离;c(H+)≈
=4×10-7mol·L-1,则298 K时0.1 mol·L-1双氧水溶液的pH=-lg(4×
10-7)=7-lg 4≈6.4。
1
2
3
4
5
6
2.在空气中加热Co(OH)2,固体残留率随温度的变化如图所示。
290 ℃时完全脱水变为Co2O3,反应的化
学方程式为_________________________
______________;500 ℃时的主要产物为________(填化学式)。
2Co2O3+4H2O
Co3O4
1
2
3
4
5
6
3.利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、 等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
(1)TiO2+中钛元素的化合价为_____价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式:__________
___________________________。
+4
TiO2++
1
2
3
4
5
6
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释:___________________________________________
________________________。
Na2CO3消耗H+,c(H+)减少,使TiO2+水解平衡
向生成TiO2·nH2O方向移动
1
2
3
4
5
6
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为___________________
______________________,该反应需在温度308 K以下,其目的是______
_________________________________。
FeCO3↓+CO2↑+H2O
NH4HCO3受热分解和减少Fe2+的水解
1
2
3
4
5
6
防止
4.过氧乙酸( )常用作纺织品漂白剂。
(1)乙醛能与O2在一定条件下反应生成过氧乙酸,若有11.2 L O2(标准状况下)参加反应,理论上可生成浓度为40%的过氧乙酸_____ g。
95
1
2
3
4
5
6
(2)某纺织厂污水中过氧乙酸含量测定:
取一定量的污水加入硫酸酸化,然后加入过量KI溶液充分反应,加入NaOH溶液调节为弱碱性,用Na3AsO3标准液滴定至终点。
①I-将过氧乙酸还原为乙酸的离子方程式为_________________________
___________________。
CH3COOOH+2I-+2H+===
I2+CH3COOH+H2O
1
2
3
4
5
6
②取污水水样100.00 mL,按上述方法测定污水中过氧乙酸含量,消耗0.010 00 mol·L-1 Na3AsO3标准溶液8.50 mL。计算污水中过氧乙酸物质的量浓度(写出计算过程)。
n(CH3COOOH)=n(Na3AsO3)=0.010 00 mol·L-1×8.50×10-3 L=8.50× 10-5 mol
1
2
3
4
5
6
5.黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12及少量Al2O3、CaO、MgO、SiO2等,利用其制备锰锌铁氧体(MnxZn1-xFe2O4)的工艺流程如右。
常温下,相关物质的pKsp(pKsp=-lgKsp)
如下表。
物质
MgF2
CaF2
Al(OH)3
Fe(OH)3
Fe(OH)2
pKsp
8.2
10.2
32.0
37.4
15.0
1
2
3
4
5
6
回答下列问题:
(1)滤渣1的主要成分是___________。
(2)“净化除杂”中铁粉的作用是______________________________________。
(3)加入氨水调pH的数值可能是____(填字母)。
a.3.2 b.5.0 c.9.0
SiO2、CaSO4
将Fe3+还原为Fe2+;与溶液中的H+反应
b
1
2
3
4
5
6
(4)用M2+表示Fe2+、Mn2+、Zn2+,共沉淀过程中,溶液pH与lg c(M2+)、n(NH4HCO3)∶n(M2+)的关系如下图所示。为提高原料利用率,最好控制n(NH4HCO3)∶n(M2+)=____;写出生成MCO3·2M(OH)2·H2O的离子方程式:_____________________________________________。
2.0
1
2
3
4
5
6
(5)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,用氧化物的形式可表示为__________________(最简整数比);制得119.5 kg该锰锌铁氧体,需加入ZnSO4______kg、MnSO4_____kg(不考虑损耗)。
MnO·4ZnO·5Fe2O3
64.4
15.1
1
2
3
4
5
6
6.Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于镍粉的制造,其一种生产工艺如右:
(1)Ni2O3中Ni的化合价为_____。
(2)为了提高金属镍废料浸出速率,
在“酸浸”时可采取的措施有_____________________________________
__________________________________(写两条)。
+3
适当升高温度、适当增大盐酸的浓度、
搅拌或将镍废料研成粉末等(任写两条)
1
2
3
4
5
6
(4)从滤液A中可回收利用的主要物
制质是______;加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为___________________________________________。
(3)加入H2O2“氧化”的离子方程式为__________________________
_______;加入Na2CO3溶液调pH,产生的“滤渣”是_________。
2Fe2++H2O2+2H+===2Fe3+
Fe(OH)3
NaCl
2Ni2++ClO-+4OH-===Ni2O3↓+Cl-+2H2O
+2H2O
1
2
3
4
5
6
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
①NH4Cl的浓度最好控制为_____ g·L-1。
②当NH4Cl浓度大于15 g·L-1时,阴极有气体生成,导致阴极电流效率降低,相应的电极反应式为_________________________________________
_____________________。
10
===2NH3·H2O+H2↑)
1
2
3
4
5
6
题型二 无机综合——化工流程综合题的研究
A组(30分钟)
1.化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)过氧化钠用于潜水艇或呼吸面具作供氧剂,主要反应的化学方程式为:_____________________________。
(2)工业上用电解饱和食盐水的方法生产氯气,即“氯碱工业”,写出反
应的化学方程式:____________________________________。
2Na2O2+2CO2===2Na2CO3+O2
1
2
3
4
5
6
(3)野外作业中用Al焊接铁轨,该反应的化学方程式为:______________
________________。
(4)将一个铝制易拉罐充满CO2气体,然后往罐内注入足量的NaOH溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起,试用离子方程式解释易拉罐又重新鼓起的原因:_______________
_____________________。
(5)用小苏打治疗胃酸过多,反应的离子方程式为:__________________
______。
2Al+Fe2O3
2Al+2OH-+
CO2↑
1
2
3
4
5
6
2.请回答:
(1)CaH2的电子式:____________________。
(2)将硫黄撒在汞表面,以除去不慎洒落的汞,用化学方程式表示其理由:______________。
(3)完成以下氧化还原反应的离子方程式:____ClO2+____CN-+______ ===____ +____N2↑+____Cl-+_______。
Hg+S===HgS
2
2
4OH-
2
1
2
2H2O
1
2
3
4
5
6
(4)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出SiO2溶于氢氟酸的离子方程式:______________________________。
解析 设二元酸的化学式为H2SixFy,根据化合价代数和为0可知2+4x-y
=0,由氟元素质量分数有 ×100%=79.17%,联立解得x≈1,
y≈6,则化学式为H2SiF6,再根据生成物为水和二元强酸,即可写出离子方程式:SiO2+6HF===2H++ +2H2O。
1
2
3
4
5
6
3.[2018·全国卷Ⅱ,26(1)(3)(4)]我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
1
2
3
4
5
6
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为____________________________。
解析 闪锌矿的主要成分是ZnS,所以高温焙烧过程中主要反应的化学方程式为2ZnS+3O2 2ZnO+2SO2。
1
2
3
4
5
6
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_____________________。
Cd2++Zn===Cd+Zn2+
解析 溶液中的Cd2+与加入的Zn粉反应而被除去,反应的离子方程式为Zn+Cd2+===Zn2++Cd。
1
2
3
4
5
6
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________________;沉积锌后的电解液可返回_____工序继续使用。
Zn2++2e-===Zn
溶浸
解析 电解ZnSO4溶液制备单质Zn时,阴极放电的是Zn2+和H+。因为溶液中的Zn2+浓度较大,所以阴极电极反应式应该是Zn2++2e-===Zn,阳极放电的是OH-,电极反应式是4OH--4e-===2H2O+O2↑。沉积锌后的溶液应该是ZnSO4和稀H2SO4,可返回到溶浸工序循环使用。
1
2
3
4
5
6
4.结晶水合物在煅烧过程中会发生一系列变化,请回答下列问题:
(1)硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂。将Ce(SO4)2·4H2O(摩尔质
量为404 g·mol-1)在空气中加热,样品的固体残留率(
×100%)随温度的变化如图1所示。
当固体残留率为70.3%时,所得固体可能为____(填字母)。
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
B
1
2
3
4
5
6
解析 若1 mol Ce(SO4)2·4H2O分解,当固体残留率为70.3%时,所剩固体的质量为404 g·mol-1×1 mol×70.3%≈284 g,即对应所得固体的摩尔质量可能为284 g·mol-1,Ce(SO4)2的摩尔质量为332 g·mol-1,CeOSO4的摩尔质量为252 g·mol-1,A、C项不符合题意;
若2 mol Ce(SO4)2·4H2O分解,对应所得1 mol固体时固体的摩尔质量约为568 g·
mol-1,Ce2(SO4)3的摩尔质量为568 g·
mol-1,B项符合题意。
1
2
3
4
5
6
(2)固体A为生石膏(CaSO4·2H2O)和不含结晶水且高温时也不分解的杂质。生石膏在120 ℃时失水生成熟石膏(2CaSO4·H2O),熟石膏在200 ℃时失水生成硫酸钙。为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A 180 g置于坩埚中加热,加热过程中固体质量随温度变化的情况如图2所示。
①实验中每次对固体称量时需要在冷却后进行。为保证实验结果的精确性,固体冷却时必须防止_____。
吸水
解析 失水后的晶体冷却时必须防止吸水,否则会导致测定结果有较大误差。
1
2
3
4
5
6
②将加热到1 400 ℃时生成的气体通入品红溶液中,品红褪色。写出1 400 ℃时反应的化学方程式:__________________________
______。
+O2↑
解析 由图示数据及使品红褪色的信息可推知反应为2CaSO4 2CaO
+2SO2↑+O2↑。
1
2
3
4
5
6
③固体A中生石膏的质量分数约为________(结果保留1位小数)。
95.6%
解析 由②中反应方程式及CaSO4分解时质量减少144 g-64 g=80 g可知生成了1 mol SO2和0.5 mol O2,根据原子守恒知生石膏的物质的量为1 mol,则m(CaSO4·2H2O)=172 g,生石膏的质量分数= ×100%≈95.6%。
1
2
3
4
5
6
5.(2020·济宁二模)铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料
己知:活性炭净化主要
是除去有机杂质。
(1)写出氯化铵的电子式:_________________,“净化”过程属于_____
(填“物理”或“ 化学”)变化。
活性氧化锌的工艺流程如图所示。请回答以下问题:
物理
1
2
3
4
5
6
(2)在反应温度为50 ℃,反应时间为1 h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为____mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________________________________________。
4
1
2
3
4
5
6
(3)滴加KMnO4溶液有MnO2生成,目的是除____元素,除杂3是置换除杂过程,则试剂a是_____,“滤渣Ⅲ”的主要成分为________(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式:________________________
_____________________________,此过程中可以循环利用的副产品是________。
Fe
Zn
Cu、Zn
Zn2(OH)2CO3↓+3CO2↑+H2O
NH4Cl
1
2
3
4
5
6
(5)取m g活性氧化锌样品配成待测液,加入指示剂3~4滴,再加入适量六亚甲基四胺,用a mol·L-1EDTA标准液进行滴定,消耗标准液V mL。已知:与1.0 mL EDTA标准液[c(EDTA)=1.000 mol·L-1]相当的以克表示
的氧化锌质量为0.081 39,则样品中氧化锌的质量分数为______________
___________________(用代数式表示)。
1
2
3
4
5
6
6.一种用铬铁矿(主要成分是FeCr2O4,还含有Al2O3、Fe2O3等)制氧化铬的工艺流程如右:
回答下列问题:
(1)“氧化焙烧”过程中,理论上1 mol FeO·Cr2O3完全被氧化为Na2CrO4和Fe2O3时,转移电子的物质的量为________;“水浸”过程中,为提高Na2CrO4的浸取率,除可适当增大水的用量之外,还可采用的措施是_______________________________________________________________
(列举一条)。
7 mol
适当延长浸取时间或适当提高浸取温度或充分搅拌等(答出一点即可)
1
2
3
4
5
6
解析 Fe元素化合价由+2价变为+3价,升1价,Cr元素由+3价变为+6价,2个Cr升高6价,故1 mol FeO·Cr2O3完全被氧化为Na2CrO4和Fe2O3时转移电子7 mol。为提高Na2CrO4的浸取率,除可适当增大水的用量之外,还可采取的措施是适当延长浸取时间或适当提高浸取温度或充分搅拌等。
1
2
3
4
5
6
(2)“除铝”时通入足量CO2发生反应的离子方程式为_________________
____________________。
1
2
3
4
5
6
(3)“酸化结晶”过程中发生的反应为 ,该
反应的平衡常数表达式为K=_________________。
1
2
3
4
5
6
(4)Na2Cr2O7与(NH4)2SO4混合热解时生成Cr2O3和N2及硫酸盐的化学方程
式为_____________________________________________________;能说明“水洗”完全的方法是_________________________________________
_____________________________________________________。
取少量最后一次洗涤滤液,滴入盐酸酸化的
BaCl2溶液,若无沉淀,说明已洗涤完全(其他合理答案也可)
1
2
3
4
5
6
(5)测定产品中Cr2O3含量的步骤如下:
步骤1:准确称取a g产品,加入KClO3熔融(Cr2O3+5KClO3 2K2CrO4+KCl+5O2↑+2Cl2↑);
步骤2:酸化,转化为K2Cr2O7溶液;
步骤3:加入稍过量的KI溶液充分反应( +6I-+14H+===2Cr3++3I2+7H2O),加入淀粉溶液作指示剂,用c mol·L-1 Na2S2O3标准溶液进行滴定(I2+ ===2I-+ )至终点,消耗标准溶液V mL。则产品中含
Cr2O3的质量分数为_____________________(列出计算表达式)。
1
2
3
4
5
6
1
2
3
4
5
6
B组(30分钟)
1.双氧水、84消毒液是日常生活中常用的消毒剂。
(1)84消毒液(主要成分是NaClO)溶液呈碱性,用离子方程式表示其原因:_________________________。
(2)双氧水和84消毒液混合失去消毒作用,生成无色无味气体,该气体为____(填化学式)。
(3)工业上,制备84消毒液的原理是:以惰性电极电解饱和氯化钠溶液,产生的氯气用生成的烧碱溶液吸收。阴极发生的电极反应式为_________
______________________;写出制备84消毒液的总反应化学方程式:___________________________。
O2
2H2O+
1
2
3
4
5
6
2e-===2OH-+H2↑
(4)双氧水是二元弱酸,298 K时,Ka1=1.6×10-12,Ka2=1.0×10-25,双氧水电离的方程式为___________________________________;298 K时0.1 mol·L-1双氧水溶液的pH≈_____。(已知:lg 2≈0.3)
6.4
解析 双氧水是二元弱酸,氢离子主要来自一级电离;c(H+)≈
=4×10-7mol·L-1,则298 K时0.1 mol·L-1双氧水溶液的pH=-lg(4×
10-7)=7-lg 4≈6.4。
1
2
3
4
5
6
2.在空气中加热Co(OH)2,固体残留率随温度的变化如图所示。
290 ℃时完全脱水变为Co2O3,反应的化
学方程式为_________________________
______________;500 ℃时的主要产物为________(填化学式)。
2Co2O3+4H2O
Co3O4
1
2
3
4
5
6
3.利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、 等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
(1)TiO2+中钛元素的化合价为_____价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式:__________
___________________________。
+4
TiO2++
1
2
3
4
5
6
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释:___________________________________________
________________________。
Na2CO3消耗H+,c(H+)减少,使TiO2+水解平衡
向生成TiO2·nH2O方向移动
1
2
3
4
5
6
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为___________________
______________________,该反应需在温度308 K以下,其目的是______
_________________________________。
FeCO3↓+CO2↑+H2O
NH4HCO3受热分解和减少Fe2+的水解
1
2
3
4
5
6
防止
4.过氧乙酸( )常用作纺织品漂白剂。
(1)乙醛能与O2在一定条件下反应生成过氧乙酸,若有11.2 L O2(标准状况下)参加反应,理论上可生成浓度为40%的过氧乙酸_____ g。
95
1
2
3
4
5
6
(2)某纺织厂污水中过氧乙酸含量测定:
取一定量的污水加入硫酸酸化,然后加入过量KI溶液充分反应,加入NaOH溶液调节为弱碱性,用Na3AsO3标准液滴定至终点。
①I-将过氧乙酸还原为乙酸的离子方程式为_________________________
___________________。
CH3COOOH+2I-+2H+===
I2+CH3COOH+H2O
1
2
3
4
5
6
②取污水水样100.00 mL,按上述方法测定污水中过氧乙酸含量,消耗0.010 00 mol·L-1 Na3AsO3标准溶液8.50 mL。计算污水中过氧乙酸物质的量浓度(写出计算过程)。
n(CH3COOOH)=n(Na3AsO3)=0.010 00 mol·L-1×8.50×10-3 L=8.50× 10-5 mol
1
2
3
4
5
6
5.黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12及少量Al2O3、CaO、MgO、SiO2等,利用其制备锰锌铁氧体(MnxZn1-xFe2O4)的工艺流程如右。
常温下,相关物质的pKsp(pKsp=-lgKsp)
如下表。
物质
MgF2
CaF2
Al(OH)3
Fe(OH)3
Fe(OH)2
pKsp
8.2
10.2
32.0
37.4
15.0
1
2
3
4
5
6
回答下列问题:
(1)滤渣1的主要成分是___________。
(2)“净化除杂”中铁粉的作用是______________________________________。
(3)加入氨水调pH的数值可能是____(填字母)。
a.3.2 b.5.0 c.9.0
SiO2、CaSO4
将Fe3+还原为Fe2+;与溶液中的H+反应
b
1
2
3
4
5
6
(4)用M2+表示Fe2+、Mn2+、Zn2+,共沉淀过程中,溶液pH与lg c(M2+)、n(NH4HCO3)∶n(M2+)的关系如下图所示。为提高原料利用率,最好控制n(NH4HCO3)∶n(M2+)=____;写出生成MCO3·2M(OH)2·H2O的离子方程式:_____________________________________________。
2.0
1
2
3
4
5
6
(5)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,用氧化物的形式可表示为__________________(最简整数比);制得119.5 kg该锰锌铁氧体,需加入ZnSO4______kg、MnSO4_____kg(不考虑损耗)。
MnO·4ZnO·5Fe2O3
64.4
15.1
1
2
3
4
5
6
6.Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于镍粉的制造,其一种生产工艺如右:
(1)Ni2O3中Ni的化合价为_____。
(2)为了提高金属镍废料浸出速率,
在“酸浸”时可采取的措施有_____________________________________
__________________________________(写两条)。
+3
适当升高温度、适当增大盐酸的浓度、
搅拌或将镍废料研成粉末等(任写两条)
1
2
3
4
5
6
(4)从滤液A中可回收利用的主要物
制质是______;加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为___________________________________________。
(3)加入H2O2“氧化”的离子方程式为__________________________
_______;加入Na2CO3溶液调pH,产生的“滤渣”是_________。
2Fe2++H2O2+2H+===2Fe3+
Fe(OH)3
NaCl
2Ni2++ClO-+4OH-===Ni2O3↓+Cl-+2H2O
+2H2O
1
2
3
4
5
6
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
①NH4Cl的浓度最好控制为_____ g·L-1。
②当NH4Cl浓度大于15 g·L-1时,阴极有气体生成,导致阴极电流效率降低,相应的电极反应式为_________________________________________
_____________________。
10
===2NH3·H2O+H2↑)
1
2
3
4
5
6
同课章节目录
