2021届高中化学考前三个月专项复习课件(125张ppt) 题型一 大题突破
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件(125张ppt) 题型一 大题突破 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-03 00:00:00 | ||
图片预览







文档简介
大题突破
题型一 化学实验综合题的研究
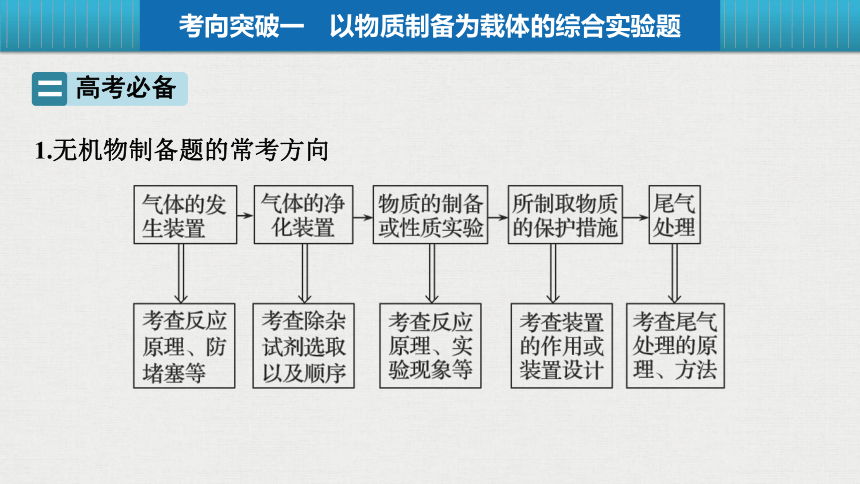
1.无机物制备题的常考方向
考向突破一 以物质制备为载体的综合实验题
高考必备
2.有气体参与的制备实验的注意事项
(1)操作顺序问题
与气体有关的实验操作顺序:装置选择与连接→气密性检查→装入固体药品→加液体药品→按程序实验→拆卸仪器。
(2)加热操作的要求
①使用可燃性气体(如H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。
②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。
(3)尾气处理的方法
有毒气体常采用溶液(或固体)吸收或将之点燃的方法,不能直接排放。
(4)特殊实验装置
①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。
②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。
③若制备物质易被空气中氧气氧化,应加排空气装置。
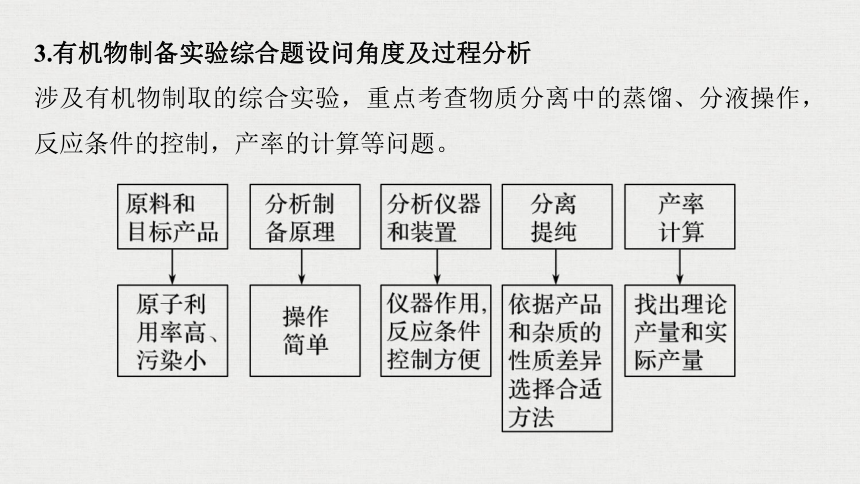
3.有机物制备实验综合题设问角度及过程分析
涉及有机物制取的综合实验,重点考查物质分离中的蒸馏、分液操作,反应条件的控制,产率的计算等问题。
题组一 无机物的制备实验综合题
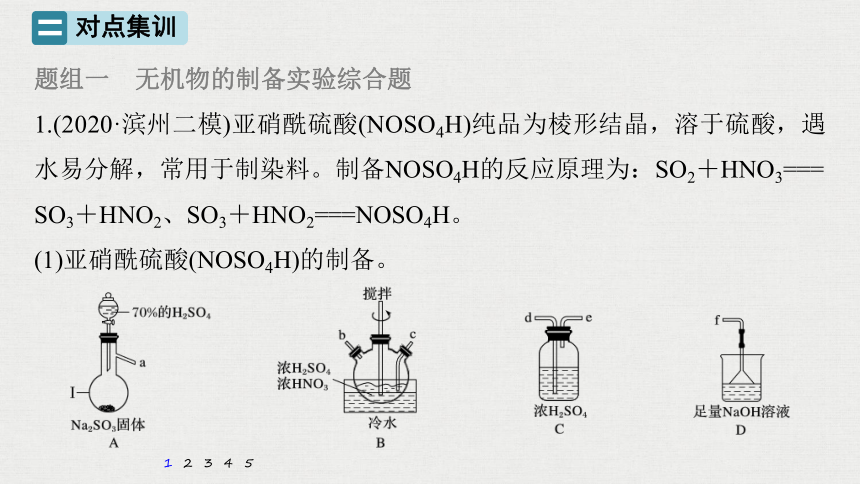
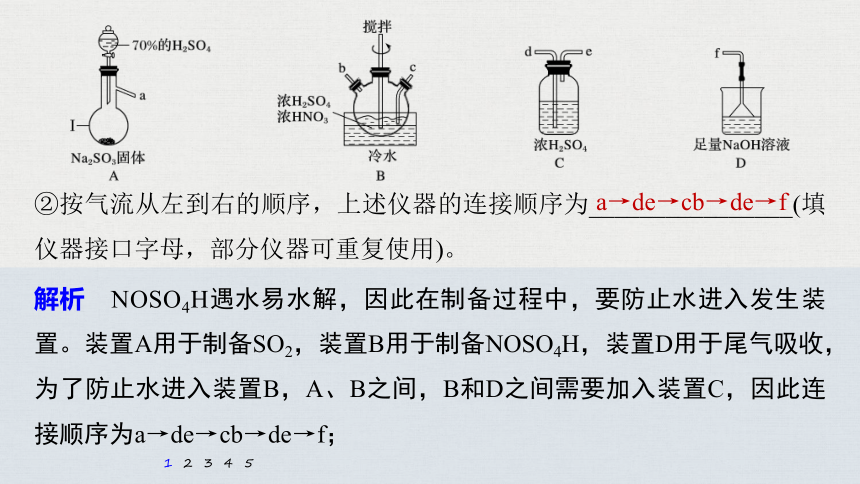
1.(2020·滨州二模)亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。制备NOSO4H的反应原理为:SO2+HNO3===
SO3+HNO2、SO3+HNO2===NOSO4H。
(1)亚硝酰硫酸(NOSO4H)的制备。
对点集训
1
2
3
4
5
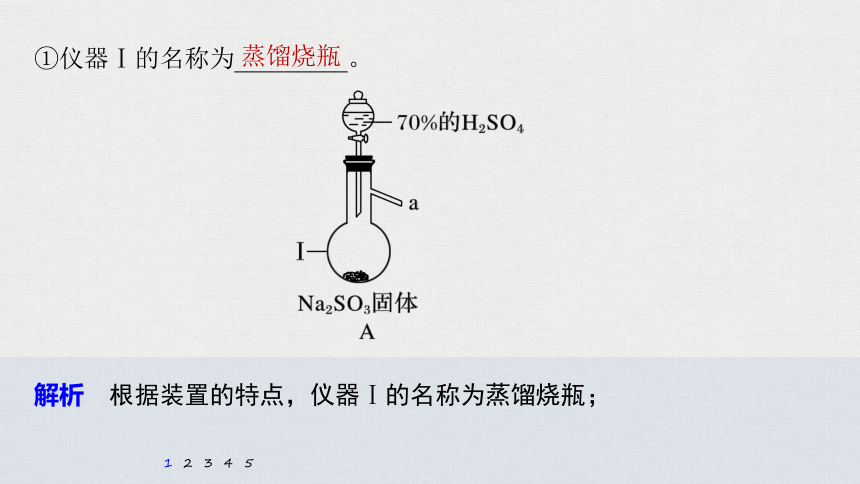
①仪器Ⅰ的名称为_________。
1
2
解析 根据装置的特点,仪器Ⅰ的名称为蒸馏烧瓶;
蒸馏烧瓶
3
4
5
解析 NOSO4H遇水易水解,因此在制备过程中,要防止水进入发生装置。装置A用于制备SO2,装置B用于制备NOSO4H,装置D用于尾气吸收,为了防止水进入装置B,A、B之间,B和D之间需要加入装置C,因此连接顺序为a→de→cb→de→f;
②按气流从左到右的顺序,上述仪器的连接顺序为________________(填仪器接口字母,部分仪器可重复使用)。
1
2
a→de→cb→de→f
3
4
5
解析 可以通过调节装置A中分液漏斗,来调节硫酸溶液的滴加速度,从而控制通入SO2的速率;
③为了控制B中通入SO2的速率,可以采取的措施是______________________________________
_____________。
1
2
调节装置A中的分液漏斗活塞,控制硫酸溶液的滴加速度
3
4
5
解析 NOSO4H与水反应生成HNO2和H2SO4,化学方程式为NOSO4H+H2O===H2SO4+HNO2;如果去掉装置C,产物就会与进入装置B中的水反应,会使产物的量减少。
④NOSO4H遇水分解的化学方程式为__________________
______________________________,若去掉装置C会使NOSO4H的产量_____(填“增大”“减少”或“无影响”)。
1
2
NOSO4H+H2O===
H2SO4+HNO2(其他合理答案均可)
减少
3
4
5
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
准确称取1.337 g产品加入250 mL碘量瓶中,加入60.00 mL浓度为0.100 0 mol·
L-1KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.250 0 mol·L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积为20.00 mL。
1
2
3
4
5
①完成反应ⅰ的离子方程式:
1
2
2 5 2
2 Mn2+
5 5 9
3
4
5
②滴定终点的现象为_____________________________________________
_______________________。
1
2
滴入最后一滴Na2C2O4溶液后,溶液由浅紫色变为无色且半分钟内颜色不恢复
解析 刚开始,KMnO4是过量的,溶液的颜色为紫色,加入Na2C2O4溶液滴定过量的KMnO4,溶液会从紫色变为无色,因此滴定终点的现象为滴入最后一滴Na2C2O4溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
3
4
5
解析 根据题意,KMnO4氧化了NOSO4H和Na2C2O4,则用总的KMnO4减去氧化Na2C2O4的KMnO4,可求得氧化NOSO4H的KMnO4,从而求得NOSO4H的质量,根据化学方程式,可得关系式2KMnO4~5Na2C2O4,则氧化Na2C2O4的KMnO4的物质的量n1=0.250 0 mol·L-1×20.00 mL×10-3 mL·L-1
× =2×10-3 mol;总的KMnO4的物质的量n2=0.100 0 mol·L-1×60.00 mL×
10-3 mL·L-1=6×10-3 mol,则氧化NOSO4H的KMnO4的物质的量n3=6×10-3 mol-2×10-3 mol=4×10-3 mol。根据化学方程式,可得关系式2KMnO4~5NOSO4H,则NOSO4H的物质的量n4=4×10-3 mol× =0.01 mol,NOSO4H的质量m=n4×M=0.01 mol×127 g·mol-1=1.27 g,NOSO4H的纯度
③产品的纯度为____%(保留两位有效数字)。
1
2
95
3
4
5
2.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137 ℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140 ℃反应制得,氯气过量则会生成SCl2。
(1)选用以下装置制取少量S2Cl2(加热及夹持装置略):
1
2
3
4
5
①仪器m的名称为____________。
②装置连接顺序:A→______→______→______→______。
③A中发生反应的化学方程式为______________________________________。
④B中玻璃纤维的作用是_____________________________________。
⑤D中的最佳试剂是_____(填字母)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
1
2
直形冷凝管
C B E D
增大硫与氯气的接触面积,加快反应速率
a
3
4
5
解析 制取少量S2Cl2:装置A制备氯气,装置C除去氯气中混有的水蒸气,B中发生氯气与硫单质的反应,装置E冷凝并收集产物,装置D用于吸收未反应完的氯气和阻止空气中的水蒸气进入收集装置。
1
2
3
4
5
(2)S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
①该固体是________。
1
2
S(或硫)
解析 S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体,S2Cl2―→SO2,硫元素化合价升高,根据氧化还原反应中化合价有升有降,则该固体为S单质。
3
4
5
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案________(填“可行”或“不可行”),原因是__________________________________________
________________。
1
2
不可行
SO2易被硝酸氧化生成 ,既难于检验SO2,
又干扰HCl的检验
解析 二氧化硫被氧化为硫酸根离子,硫酸银微溶,会干扰氯离子的检验。
3
4
5
(3)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25 g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87 g。
则产品中氯元素的质量分数为_______,由此可知产品中_____(填“含有”或“不含有”)SCl2杂质。
1
2
56.8%
含有
3
4
5
1
2
3
4
5
合成反应:SO2+Na2CO3===Na2SO3+CO2 2Na2S+3SO2===2Na2SO3+3S Na2SO3+S Na2S2O3
滴定反应:I2+2Na2S2O3===2NaI+Na2S4O6
已知:Na2S2O3·5H2O易溶于水,难溶于乙醇,50 ℃开始失结晶水。
3.(2020·浙江7月选考,30)硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备Na2S2O3·5H2O。
1
2
3
4
5
实验步骤:
Ⅰ.Na2S2O3制备:装置A制备的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发
浓缩、冷却结晶、过滤、洗涤、干燥,
得到Na2S2O3·5H2O产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用
Na2S2O3·5H2O产品配制的溶液滴定碘标准溶液至滴定终点,计算Na2S2O3·5H2O含量。
1
2
3
4
5
请回答:
(1)步骤Ⅰ单向阀的作用是__________;装置C中的反应混合溶液pH过高或过低将导致产率降低,原因是___________________________________
_________________________________。
1
2
防止倒吸
pH过高,Na2CO3、Na2S反应不充分;pH过低,导致Na2S2O3转化为S和SO2
3
4
5
1
2
3
4
5
(2)步骤Ⅱ下列说法正确的是_____。
A.快速蒸发溶液中水分,可得较大晶体颗粒
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.冷却结晶后的固液混合物中加入乙醇可提高产率
D.可选用冷的Na2CO3溶液作洗涤剂
1
2
BC
3
4
5
会得到Na2S2O3·5H2O晶体;
C对,由题目已知信息,Na2S2O3·5H2O难溶于乙醇,所以冷却结晶后的固液混合物中加入乙醇可提高Na2S2O3·5H2O的产率;
D错,Na2S2O3·5H2O晶体易溶于水,若用Na2CO3溶液作洗涤剂,Na2S2O3·
5H2O会溶解,造成损失。
1
2
解析 A错,快速蒸发水分,加热温度过高,会造成Na2S2O3·5H2O晶体失去结晶水;
B对,蒸发浓缩至溶液表面出现晶膜时,停止加热,利用余热蒸发水分,
3
4
5
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度
或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数
1
2
F B E C G
3
4
5
1
2
解析 滴定管使用前的正确操作顺序为检漏→蒸馏水洗涤→用滴定液润洗2至3次→装入滴定液至零刻度以上→排除气泡→调整滴定液液面至零刻度或零刻度以下→记录起始读数→开始滴定。
3
4
5
解析 为了防止标准液中的碘挥发,造成标准液的浓度偏低,滴定前的碘量瓶应盖上瓶塞。
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是____________。
1
2
防止碘挥发
3
4
5
③滴定法测得产品中Na2S2O3·5H2O含量为100.5%,则Na2S2O3·5H2O产品中可能混有的物质是______________________________________。
1
2
Na2SO3或失去部分结晶水的Na2S2O3·5H2O
3
4
5
1
2
解析 根据题给滴定反应的化学方程式,可得滴定反应的关系式为2Na2S2O3·5H2O~I2,Na2SO3与I2反应的对应关系为Na2SO3~I2,M(Na2SO3)
=126 g·mol-1,M(Na2S2O3·5H2O)=248 g·mol-1,M(Na2SO3)<M(Na2S2O3·
5H2O);若产品中Na2S2O3·5H2O的含量超过100%,说明产品中可能存在Na2SO3或失去部分结晶水的Na2S2O3·5H2O。
3
4
5
题组二 有机物的制备综合实验题
4.某化学兴趣小组设计实验制备苯甲酸异丙酯,其反应原理为
+ +H2O。用如图所
示装置进行实验:
1
2
3
4
5
物质的部分物理性质如表所示:
1
2
3
4
5
物质
相对分子质量
密度/ g·cm-3
沸点/℃
水溶性
苯甲酸
122
1.27
249
微溶
异丙醇
60
0.79
82
易溶
苯甲酸异丙酯
164
1.17
218
不溶
实验步骤:
步骤Ⅰ.在干燥的仪器a中加入38.1 g苯
甲酸、30 mL异丙醇和15 mL浓硫酸,
再加入几粒沸石;
步骤Ⅱ.加热至70 ℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:
步骤Ⅳ.将粗产品用图乙所示装置进行精制。
1
2
3
4
5
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后
顺序一定错误的是_____(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为_____________________。加入的苯甲酸和异丙醇中,需过量的是________,目的是_______________________________
____________________。
1
2
B
三颈烧瓶(或三口烧瓶)
有利于酯化反应向正反应方向进行,提高苯甲酸的转化率
异丙醇
3
4
5
(3)本实验一般采用水浴加热,因为温度过
高会使产率_____(填“增大”“减小”或
“不变”)。
(4)操作Ⅰ中第二次水洗的目的是_______
___________,操作Ⅱ中加入无水硫酸镁的
作用为______________。
(5)步骤Ⅳ所用的装置中冷却水的进口为_____(填字母),操作时应收集218 ℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为________(填物质名称)。
1
2
减小
除去残
留的碳酸钠
除去残留的水
g
苯甲酸
3
4
5
(6)如果得到的苯甲酸异丙酯的质量为40.930 g,则该实验的产率为____%(结果保留2位有效数字)。
1
2
80
3
4
5
类比乙酸乙酯制备实验试剂的添加顺序,一般都是将浓硫
酸缓缓注入其他溶液中―→解答第(1)问
结合装置特点、可逆反应特点―→解答第(2)问
有机物特点,异丙醇的沸点82 ℃―→解答第(3)问
分离提纯的方法及实验操作目的―→解答第(4)问
蒸馏实验原理―→解答第(5)问
产率计算方法―→解答第(6)问
[思路点拨]
1
2
提取信息
并与实验
知识相结合
3
4
5
1
2
3
4
5
5.(2020·山师附中4月模拟)2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
1
2
3
4
5
部分物质的相关性质如下:
1
2
名称
相对分子质量
性状
熔点/℃
水溶性(常温)
间苯二酚
110
白色针状晶体
110.7
易溶
2-硝基-1,3-苯二酚
155
桔红色针状晶体
87.8
难溶
制备过程如下:
第一步:磺化。称取71.5 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15 min(如图1)。
3
4
5
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100 ℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。
1
2
3
4
5
请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)_____。
a.30 ℃~60 ℃ b.60 ℃~65 ℃
c.65 ℃~70 ℃ d.70 ℃~100 ℃
1
2
b
解析 由题意可知,为控制适当的反应速率及防止副产物出现,反应温度应控制在60~65 ℃左右,b正确。
3
4
5
(2)图2中的冷凝管是否可以换为图1所用冷凝管_____(填“是”或“否”)。
1
2
否
解析 若图2中的直形冷凝管换为图1所用的球形冷凝管,不便于被冷凝的液体顺利流下。
3
4
5
(3)硝化步骤中制取“混酸”的具体操作是__________________________
_______________________________________________。
1
2
解析 溶液混合时,必须把密度大的溶液加入到密度小的溶液中,浓硫酸的密度大于浓硝酸,则硝化步骤中制取“混酸”的具体操作是在烧杯中加适量的浓硝酸,沿杯壁缓慢加入一定量的浓硫酸,边加边搅拌,冷却。
在烧杯中加入适量的浓硝酸,沿杯壁缓慢加入一定量的浓硫酸,边加边搅拌,冷却
3
4
5
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止_____________________;冷凝管C中可能看到的现象是___________________________,反应一段时间后,停止蒸馏,此时的操作是______________________(填有关旋塞和酒精灯的操作)。
1
2
压强过小引起倒吸
冷凝管内壁有桔红色晶体析出
打开旋塞,撤去酒精灯
3
4
5
解析 图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小产生倒吸,根据反应原理,在直形冷凝管C中应出现2-硝基-1,3-苯二酚,被冷却后以固体形式出现,则可以观察到冷凝管内壁有桔红色晶体析出;停止蒸馏时,应先打开旋塞,再停止在A处加热。
1
2
3
4
5
解析 能用水蒸气蒸馏来分离和提纯物质,则被提纯物质必须不溶或难溶于水,便于最后分离、在沸腾下与水不发生化学反应、具有一定的挥发性,则ab正确。
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是______。
a.不溶或难溶于水,便于最后分离
b.在沸腾下与水不发生化学反应
c.难挥发性
d.易溶于水
1
2
ab
3
4
5
解析 71.5 g间苯二酚的物质的量为0.65 mol,根据元素守恒可知,生成的2-硝基-1,3-苯二酚的质量为0.65 mol×155 g·mol-1=100.75 g,则2-硝基-1,3-苯二酚的产率为
(6)本实验最终获得12.0 g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为________(保留3位有效数字)。
1
2
11.9%
3
4
5
1.题型特点
该类题型以探究物质未知的性质,主要包括酸碱性、氧化性、还原性、热稳定性等以及可能发生的反应为主要目的。在性质探究实验中主要考查试剂的选择、装置仪器的规范、步骤优化、实验设计、现象的探究和结论的评价等综合分析能力。
考向突破二 性质探究类综合实验题
高考必备
2.研究物质性质的基本方法和程序
3.注意事项
(1)若探究影响性质的因素,首先应确定变量,其次是“定多变一”,即其他因素不变,只改变一种因素,看这种因素与探究的问题存在怎样的关系。
(2)多角度辩证地看问题。
①研究反应物中各微粒的性质(即内因)。
②研究反应条件的影响(温度、浓度、环境中的其他物质)。
对点集训
1
2
1.(2016·全国卷Ⅱ,28)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______________。
防止Fe2+被氧化
解析 亚铁离子具有还原性,能被空气中的氧气氧化,所以在配制的FeCl2溶液中加入少量铁屑的目的是防止Fe2+被空气氧化。
3
1
2
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________。
2Fe2++Cl2===2Fe3++2Cl-
解析 Cl2可将Fe2+氧化成Fe3+,自身得电子生成Cl-,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
3
1
2
(3)乙组同学认为甲组的实验不够严谨,该组同学在 2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______________________________。
隔绝空气(排除氧气对实验的影响)
解析 煤油的作用是隔绝空气,防止空气中的氧气将Fe2+氧化,产生干扰。
3
1
2
(4)丙组同学取10 mL 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为___________。
Fe2+
Fe3+
可逆反应
3
1
2
解析 根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀,一定含有Fe2+,则实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显红色,实验①和③说明,在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为可逆反应,反应为2Fe3++2I- 2Fe2++I2。
3
1
2
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________________
______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________,生成沉淀的原因是______________________________________________(用平衡移动原理解释)。
H2O2+2Fe2++2H+===2Fe3++
2H2O
Fe3+催化H2O2分解产生O2
H2O2分解反应放热,促进Fe3+的水解平衡正向移动
3
1
2
解析 H2O2溶液中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O,铁离子的溶液呈棕黄色;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是反应产生的Fe3+是H2O2分解的催化剂,促使H2O2分解生成O2,同时H2O2分解反应是放热反应,促进了Fe3+水解平衡Fe3++3H2O Fe(OH)3+3H+正向移动,产生较多 Fe(OH)3,聚集形成沉淀。
3
并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入CO2和SO2混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加BaCl2溶液,产生白色沉淀。
2.(2020·青岛一模)化学小组为探究SO2在酸性KI溶液中的反应,利用如图装置进行实验:
1
2
Ⅰ.排出装置内的空气。减缓CO2的流速,向丁装置中通入CO2和SO2的混合气体。
Ⅱ.一段时间后,溶液变黄
3
解析 装置丁中苯有两个作用:萃取碘单质,隔绝空气防止I-被氧化;用二氧化碳排出甲、乙、丙中的空气,打开K3,打开K1,关闭K2。
回答下列问题:
(1)苯的作用为_________________________________。排出装置内空气的具体操作为_______________________。
1
2
萃取碘单质,隔绝空气防止I-被氧化
关闭K2,打开K3,打开K1
3
解析 若只将SO2通入丁中,SO2反应后压强减小,会倒吸,通入CO2和SO2混合气体,CO2不反应,始终有气体排出,起防止倒吸的作用。
(2)向装置丁中缓慢通入CO2的作用是__________。
1
2
防止倒吸
3
(3)步骤Ⅱ反应的离子方程式为_________________________________;步骤Ⅲ反应的离子方程式为_________________________________。
1
2
SO2+4I-+4H+===2I2+S↓+2H2O
3
解析 步骤Ⅱ中,溶液变黄并出现浑浊,说明生成了硫单质,摇动锥形瓶、静置,苯与溶液边缘呈紫红色,说明生成了碘单质,离子方程式为SO2+4I-+4H+===2I2+S↓+2H2O;步骤Ⅲ通入CO2和SO2混合气体,溶液变为无色,说明碘单质被消耗,离子方程式为:SO2+I2+2H2O===
1
2
3
(4)实验的总反应为_______________________________,KI和HI在反应中的作用为_______。
1
2
催化剂
3
1
2
3
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
3.(2020·潍坊高密一中高三模拟)某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
1
2
3
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
解析 实验室配制FeCl3溶液时,为了防止铁离子水解,先将FeCl3固体溶解在较浓的盐酸中然后加水稀释。
(1)怎样配制FeCl3溶液? ____________________________________。
1
2
将FeCl3溶于浓盐酸,再稀释至指定浓度
3
解析 若有硫酸根生成,则加入盐酸酸化的氯化钡溶液会有白色沉淀生成;
(2)甲同学探究实验Ⅰ的电极产物。
①取少量Na2SO3溶液电极附近的混合液,加入______________________,产生白色沉淀,证明产生了
1
2
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
足量盐酸和BaCl2溶液
3
②该同学又设计实验探究另一电极的产物,其实验方案为________________
____________________________________________________________________。
1
2
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
取少量FeCl3溶液
电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+
3
1
2
解析 氯化铁溶液为原电池正极,发生还原反应,Fe3+被还原成Fe2+,所以方案为取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+。
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
3
装置
编号
反应时间
实验现象
?
Ⅲ
0~1 min
产生红色沉淀,有刺激性气味气体逸出
1~30 min
沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后
与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
(3)实验Ⅰ中负极的电极反应式为________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
1
2
3
装置
编号
反应时间
实验现象
?
Ⅲ
0~1 min
产生红色沉淀,有刺激性气味气体逸出
1~30 min
沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后
与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
1
2
3
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
②________________________。
1
2
解析 pH=1的氯化铁溶液中有大量的氢离子,亚硫酸氢根离子结合氢离子生成二氧化硫气体,反应的离子方程式:
3
(5)查阅资料:溶液中 三种微粒会形成红色配合物并存在如下转化:
1
2
(红色) (橙色)
从反应速率和化学平衡两个角度解释1~30 min的实验现象:__________
_______________________________________________________________
_______________________________________________________________
_______________________________。
生成红色
配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在O2的
作用下,橙色的HOFeOSO2浓度下降,平衡
不断正向移动,最终溶液几乎无色
3
1
2
3
【实验反思】
(6)分别对比Ⅰ和Ⅱ、Ⅱ和Ⅲ,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和_______________________________________________________
______________________________________________________________________________________有关(写出两条)。
1
2
溶液pH不同,Na2SO3、NaHSO3溶液中 浓度不同(或Na2SO3与NaHSO3不同,或Na2SO3与NaHSO3的阴离子不同),反应物是否接触形成红色配合物(任写两条)
3
1.定量实验数据的测定方法
(1)沉淀法
先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。
考向突破三 定量测定型综合实验题
高考必备
(2)测气体体积法
对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。
①常见测量气体体积的实验装置
②量气时应注意的问题
a.量气时应保持装置处于
室温状态。
b.读数时要特别注意消除
“压强差”,保持液面相
平,还要注意视线与液面
最低处相平。如图(Ⅰ)(Ⅳ)应使左侧和右侧的液面高度保持相平。
(3)测气体质量法
将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。
(4)滴定法
即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
2.解题注意事项
(1)定量测定实验中要具备的3种意识:
①要有消除干扰气体的意识:如用“惰性气体”将干扰气体排出,或用溶液吸收干扰气体等。
②要有被测量气体全部被测量的意识:如可以采用反应结束后继续向装置中通入“惰性”气体以使被测量的气体全部被吸收剂吸收的方法。
③要有“数据”的采集处理意识:实验数据的采集是化学计算的基础,一般的固体试剂称取质量,而液体试剂和气体试剂测量体积。
(2)“关系式法”在定量测定实验中的应用:
关系式法是表示两种或多种物质之间“物质的量”关系的一种简化式子。在多步反应中,它可以把始态的反应物与终态的生成物之间“物质的量”的关系表示出来,把多步计算简化成一步完成。正确提取关系式是用关系式法解题的关键。
(3)定量型实验的关键为数据处理和误差分析,数据的处理一般注意五个方面:
①是否符合测量仪器的精度。
②数据是否在误差允许范围内。
③数据的测试环境。
④数据的测量过程是否规范、合理。
⑤少量物质是否完全反应;过量物质对数据是否有影响。误差分析的依据为计算式,看测量对结果会产生什么影响。
对点集训
1
2
题组一 以含量测定为目的的综合实验
1.(2020·济南一模)工业上处理含苯酚废水的过程如下。回答下列问题:
Ⅰ.测定废水中苯酚的含量。
测定原理: +3Br2―→ ↓+3HBr
3
4
测定步骤:
步骤1:准确量取25.00 mL待测废水于250 mL锥形瓶中。
步骤2:将5.00 mL a mol·L-1浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入b mL 0.10 mol·L-1KI溶液(过量),塞紧瓶塞,振荡。
步骤4:滴入2~3滴指示剂,再用0.010 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V1mL(反应原理:I2+2Na2S2O3===2NaI+Na2S4O6)。
待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗Na2S2O3溶液V2 mL。
1
2
3
4
(1)“步骤1”量取待测废水所用仪器是___________。
酸式滴定管
解析 由于苯酚显酸性,因此选用酸式滴定管。
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和____
_____。
解析 由于溴单质易挥发,因此可采用塞紧瓶塞、迅速加入试剂等方法防止其挥发。
塞紧
瓶塞
1
2
3
4
(3)“步骤4”滴定终点的现象为___________________________________
___________________________。
滴入一滴溶液后,锥形瓶内溶液蓝色恰
好褪去,且半分钟不恢复原色
解析 用0.010 mol·L-1Na2S2O3标准溶液滴定至终点,由于Na2S2O3标准溶液会与I2反应,加入的淀粉遇I2变成蓝色,所以滴定终点的现象为滴入一滴溶液后,锥形瓶内溶液蓝色恰好褪去,且半分钟不恢复原色。
1
2
3
4
(4)该废水中苯酚的含量为___________mg·L-1(用含V1、V2的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量_____(填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量______。
偏低
偏低
1
2
3
4
解析 根据反应方程式可得各物质的物质的量关系式:
Br2~2KI~I2~2Na2S2O3
0.005V1 0.010V1
0.005V2 0.010V2
剩下的浓溴水中Br2的物质的量为0.005V1 mmol,将待测废液换成蒸馏水时,5 mL a mol·L-1的浓溴水中Br2的物质的量为0.005V2 mmol,则与苯酚参与反应的Br2的物质的量为0.005(V2-V1)mmol,根据方程式 +3Br2―→
↓+3HBr可得苯酚的物质的量为
1
2
3
4
1
2
3
4
Ⅱ.处理废水。采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基自由基(·OH),阴极上产生H2O2。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(5)写出阳极的电极反应式:______________________。
H2O-e-===·OH+H+
解析 Ti基PbO2为阳极,则阳极H2O失去电子产生·OH,电极反应式为H2O-e-===H++·OH。
1
2
3
4
(6)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:______________
_________________________。
C6H5OH+
解析 根据题干信息可知,苯酚被阴极产生的H2O2深度氧化产生CO2和H2O,由氧化还原反应规律得到其反应方程式为C6H5OH+14H2O2===
6CO2↑+17H2O。
14H2O2===6CO2↑+17H2O
1
2
3
4
解析 装置A是过滤器,装有无碱玻璃棉的作用是过滤,除去粉尘。
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140 ℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用为______。
2.(2018·天津,9)烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样
除尘
1
2
3
4
解析 C中填充的是干燥剂,除去H2O且不能与NOx反应,所以应选有酸性、干燥能力强的P2O5。
(2)C中填充的干燥剂是____(填序号)。
a.碱石灰 b.无水CuSO4 c.P2O5
c
1
2
3
4
答案
(3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
1
2
3
4
解析 D装置中装有碱液,用于吸收NOx,作用与实验室中的洗气瓶相同,该装置的示意图为
。
1
2
3
4
(4)采样步骤②加热烟道气的目的是___________________。
Ⅱ.NOx含量的测定
将V L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成 ,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
防止NOx溶于冷凝水
1
2
3
4
解析 烟道气中有水,采样步骤②加热器将烟道气加热至140 ℃的目的是防止NOx溶于冷凝水。
1
2
3
4
(5)NO被H2O2氧化为 的离子方程式为___________________________
________。
+2H2O
1
2
3
4
(6)滴定操作使用的玻璃仪器主要有____________________。
锥形瓶、酸式滴定管
解析 滴定操作使用的玻璃仪器主要有锥形瓶、滴定管,因为该滴定液呈酸性,所以选用酸式滴定管。
1
2
3
4
(7)滴定过程中发生下列反应:
则气样中NOx折合成NO2的含量为______________________ mg·m-3。
1
2
3
4
解析 滴定过程中发生下列反应:
1
2
3
4
(8)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。
若缺少采样步骤③,会使测定结果______。若FeSO4标准溶液部分变质,会使测定结果______。
偏低
偏高
1
2
3
4
解析 若缺少采样步骤③,系统内存在空气,会使收集的气样中NOx偏少,测定结果偏低。若FeSO4标准溶液部分变质,溶液中的Fe2+浓度减小,消耗的FeSO4标准溶液体积增大,会使测定结果偏高。
1
2
3
4
题组二 以化学式测定为目的的综合实验题
3.某学习小组在实验室中利用如图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中
含硫化合物的组成。
(一)硫化物(FexSy)的组成
实验步骤:
步骤Ⅰ 按图连接装置,检查装置气密性,装入药品;
步骤Ⅱ 打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续通入一段时间的O2;
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
……
1
2
3
4
请回答:
(1)步骤Ⅲ中,停止加热后还需继续向烧瓶中滴水一段时间,其目的为_______________________________________________________________。
(2)在C、D装置之间不需要防倒吸装置的理由是______________________
_______。
(3)步骤Ⅳ中配制溶液时所需的
玻璃仪器除玻璃棒和烧杯外,
还有______________________。
继续生成O2,驱赶装置内残留的SO2,使生成的气体全部被NaOH溶液吸收
SO2中含不溶于NaOH溶
液的O2
250 mL容量瓶、胶头滴管
1
2
3
4
(4)取25.00 mL步骤Ⅳ中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66 g。则FexSy的化学式为______。
FeS2
1
2
3
4
解析 A装置中产生足量的氧气经干燥后,进入C装置与FexSy在加热条件下反应,生成硫的氧化物,进入D装置被氢氧化钠吸收。
n(BaSO4)= =0.02 mol,根据硫元素守恒,250 mL溶液中n(S)=0.2 mol,故12.0 g FexSy中n(S)=0.2 mol,m(S)=6.4 g,m(Fe)=12.0 g-6.4 g=5.6 g,n(Fe)=0.1 mol,所以x∶y=1∶2,故FexSy的化学式为FeS2。
1
2
3
4
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案是否合理?____(填“是”或“否”),原因为_________________________________
_______________________。
部分SO2被氧化;空气中的CO2和水蒸气可能使干燥管增重偏大
否
1
2
3
4
(二)探究反应后D装置所得溶液中含硫化合物的组成
(6)反应后D装置所得溶液中除含有Na2SO4外,还可能含有Na2SO3。现用滴定法测定溶液中Na2SO3的含量。可供选择的试剂:①0.100 0 mol·L-1 KMnO4酸性溶液;②0.100 0 mol·L-1 H2O2溶液;③0.100 0 mol·L-1 KI-淀粉溶液;④0.100 0 mol·L-1 BaCl2溶液;⑤0.100 0 mol·L-1 HCl溶液。
①所选试剂应装在_____(填“酸式”或“碱式”)滴定管中。
②所利用的反应原理为___________________________________________
(用离子方程式表示)。
酸式
1
2
3
4
解析 要用滴定法测定溶液中Na2SO3的含量,即利用Na2SO3的还原性,故选一个氧化剂,还要有颜色的变化来判断反应的终点,所以只能选择0.100 0 mol·L-1 KMnO4酸性溶液。
1
2
3
4
实验步骤如下:
Ⅰ.按图示连接仪器,检查装
置气密性后加入药品;
Ⅱ.打开K1、K2,通入一段时间氮气,关闭K1、K2,取下干燥管称量其质量(m1)后再连接好装置;
4.(2020·日照一模)中国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为FeS2和FeCO3,实验室为测定FeS2和FeCO3的物质的量之比,利用如图所示装置进行实验。
1
2
3
4
Ⅳ.关闭K1、K2,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
Ⅲ.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开K2通入一段时间氮气;
Ⅴ.取下上述步骤Ⅱ中的干燥管并称量其质量(m2);
Ⅵ.取配制好的滤液25 mL于锥形瓶中,用0.1 mol·L-1KMnO4溶液滴定。
1
2
3
4
回答下列问题:
(1)步骤Ⅱ中需要称重的干燥管是____(填“E”或“F”)。
解析 装置E吸收CO2并测定其质量,故步骤Ⅱ中需要称重的干燥管是E。
E
1
2
3
4
(2)实验过程中发现B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式:_____________________________。
解析 B装置为检验H2S的装置,B中有黑色的CuS沉淀生成,则A中FeS2与稀硫酸反应的化学方程式为FeS2+H2SO4===FeSO4+S+H2S。
FeS2+H2SO4===FeSO4+S+H2S
1
2
3
4
解析 酸性高锰酸钾溶液具有强氧化性,可除去H2S并检验H2S是否除尽,F装置可吸收空气中的CO2和H2O,若撤去装置F,E装置所测得的CO2的质量将会偏大,使得最终FeCO3的含量偏大。
(3)C装置的作用是__________________________;若撤去装置F,则测得的FeCO3的含量会_____(填“偏大”“偏小”或“无影响”)。
除去H2S并检验H2S是否除尽
偏大
1
2
3
4
(4)下列关于步骤Ⅳ的叙述正确的是______(填字母)。
A.滤渣中含有还原产物单质硫
B.过滤过程中玻璃棒起到引流和搅拌的作用
C.过滤操作要迅速,否则会使测得的FeS2含量偏低
D.检验沉淀是否洗涤干净,可向滤液中加入氯化钡溶液,观察是否有白色沉淀生成
C
1
2
3
4
解析 反应FeS2+H2SO4===FeSO4+S+H2S中FeS2中的S化合价由-1升高至0价,S为氧化产物,故滤渣中含有氧化产物S,A选项错误;
过滤过程中玻璃棒的作用是引流,B选项错误;
过滤操作要迅速,否则FeSO4被空气中的氧气氧化,Fe2+含量偏低,消耗的KMnO4溶液体积偏小,从而Fe2+总量偏小,FeCO3的量不变,则测得的FeS2含量偏低,C选项正确;
1
2
3
4
检验沉淀是否洗涤干净,应取最后一次洗涤液,向其中加入稀盐酸酸化的BaCl2溶液,观察是否有白色沉淀生成,若有,则未洗涤干净,反之则洗涤干净,D选项错误。
1
2
3
4
(5)步骤Ⅵ中发生反应的离子方程式为______________________________
_______________,到达滴定终点的现象是__________________________
_____________________________。
滴入最后一滴KMnO4溶液,溶液变为浅红色且半分钟不褪去
+5Fe3++4H2O
1
2
3
4
解析 步骤Ⅵ中,Fe2+与酸性高锰酸钾溶液发生氧化还原反应生成Mn2+和Fe3+,反应的离子方程式为5Fe2++ +8H+===Mn2++5Fe3++4H2O,反应终点的现象是最后一滴KMnO4溶液滴下时,溶液变为浅红色且半分钟不褪去。
1
2
3
4
(6)若上述实验中m2-m1=2.2 g,步骤Ⅵ消耗0.1 mol·L-1KMnO4溶液45 mL,则该矿石样品中n(FeS2)∶n(FeCO3)=________。
4∶5
1
2
3
4
解析 m1-m2=2.2 g,即CO2的质量为2.2 g,物质的量为0.05 mol,则FeCO3的物质的量为0.05 mol,由方程式5Fe2++ +8H+===Mn2++5Fe3++4H2O可知,5Fe2+~ ,n( )=0.045 L×0.1 mol·L-1=0.004 5 mol,25 mL滤液中,n(Fe2+)=5×0.004 5 mol=0.022 5 mol,则100 mL滤液中n(Fe2+)=4×0.022 5 mol=0.09 mol,因此n(FeS2)=0.09 mol-n(FeCO3)=0.04 mol,n(FeS2)∶n(FeCO3)=0.04∶0.05=4∶5。
1
2
3
4
题型一 化学实验综合题的研究
1.无机物制备题的常考方向
考向突破一 以物质制备为载体的综合实验题
高考必备
2.有气体参与的制备实验的注意事项
(1)操作顺序问题
与气体有关的实验操作顺序:装置选择与连接→气密性检查→装入固体药品→加液体药品→按程序实验→拆卸仪器。
(2)加热操作的要求
①使用可燃性气体(如H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。
②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。
(3)尾气处理的方法
有毒气体常采用溶液(或固体)吸收或将之点燃的方法,不能直接排放。
(4)特殊实验装置
①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。
②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。
③若制备物质易被空气中氧气氧化,应加排空气装置。
3.有机物制备实验综合题设问角度及过程分析
涉及有机物制取的综合实验,重点考查物质分离中的蒸馏、分液操作,反应条件的控制,产率的计算等问题。
题组一 无机物的制备实验综合题
1.(2020·滨州二模)亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。制备NOSO4H的反应原理为:SO2+HNO3===
SO3+HNO2、SO3+HNO2===NOSO4H。
(1)亚硝酰硫酸(NOSO4H)的制备。
对点集训
1
2
3
4
5
①仪器Ⅰ的名称为_________。
1
2
解析 根据装置的特点,仪器Ⅰ的名称为蒸馏烧瓶;
蒸馏烧瓶
3
4
5
解析 NOSO4H遇水易水解,因此在制备过程中,要防止水进入发生装置。装置A用于制备SO2,装置B用于制备NOSO4H,装置D用于尾气吸收,为了防止水进入装置B,A、B之间,B和D之间需要加入装置C,因此连接顺序为a→de→cb→de→f;
②按气流从左到右的顺序,上述仪器的连接顺序为________________(填仪器接口字母,部分仪器可重复使用)。
1
2
a→de→cb→de→f
3
4
5
解析 可以通过调节装置A中分液漏斗,来调节硫酸溶液的滴加速度,从而控制通入SO2的速率;
③为了控制B中通入SO2的速率,可以采取的措施是______________________________________
_____________。
1
2
调节装置A中的分液漏斗活塞,控制硫酸溶液的滴加速度
3
4
5
解析 NOSO4H与水反应生成HNO2和H2SO4,化学方程式为NOSO4H+H2O===H2SO4+HNO2;如果去掉装置C,产物就会与进入装置B中的水反应,会使产物的量减少。
④NOSO4H遇水分解的化学方程式为__________________
______________________________,若去掉装置C会使NOSO4H的产量_____(填“增大”“减少”或“无影响”)。
1
2
NOSO4H+H2O===
H2SO4+HNO2(其他合理答案均可)
减少
3
4
5
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
准确称取1.337 g产品加入250 mL碘量瓶中,加入60.00 mL浓度为0.100 0 mol·
L-1KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.250 0 mol·L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积为20.00 mL。
1
2
3
4
5
①完成反应ⅰ的离子方程式:
1
2
2 5 2
2 Mn2+
5 5 9
3
4
5
②滴定终点的现象为_____________________________________________
_______________________。
1
2
滴入最后一滴Na2C2O4溶液后,溶液由浅紫色变为无色且半分钟内颜色不恢复
解析 刚开始,KMnO4是过量的,溶液的颜色为紫色,加入Na2C2O4溶液滴定过量的KMnO4,溶液会从紫色变为无色,因此滴定终点的现象为滴入最后一滴Na2C2O4溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
3
4
5
解析 根据题意,KMnO4氧化了NOSO4H和Na2C2O4,则用总的KMnO4减去氧化Na2C2O4的KMnO4,可求得氧化NOSO4H的KMnO4,从而求得NOSO4H的质量,根据化学方程式,可得关系式2KMnO4~5Na2C2O4,则氧化Na2C2O4的KMnO4的物质的量n1=0.250 0 mol·L-1×20.00 mL×10-3 mL·L-1
× =2×10-3 mol;总的KMnO4的物质的量n2=0.100 0 mol·L-1×60.00 mL×
10-3 mL·L-1=6×10-3 mol,则氧化NOSO4H的KMnO4的物质的量n3=6×10-3 mol-2×10-3 mol=4×10-3 mol。根据化学方程式,可得关系式2KMnO4~5NOSO4H,则NOSO4H的物质的量n4=4×10-3 mol× =0.01 mol,NOSO4H的质量m=n4×M=0.01 mol×127 g·mol-1=1.27 g,NOSO4H的纯度
③产品的纯度为____%(保留两位有效数字)。
1
2
95
3
4
5
2.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137 ℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140 ℃反应制得,氯气过量则会生成SCl2。
(1)选用以下装置制取少量S2Cl2(加热及夹持装置略):
1
2
3
4
5
①仪器m的名称为____________。
②装置连接顺序:A→______→______→______→______。
③A中发生反应的化学方程式为______________________________________。
④B中玻璃纤维的作用是_____________________________________。
⑤D中的最佳试剂是_____(填字母)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
1
2
直形冷凝管
C B E D
增大硫与氯气的接触面积,加快反应速率
a
3
4
5
解析 制取少量S2Cl2:装置A制备氯气,装置C除去氯气中混有的水蒸气,B中发生氯气与硫单质的反应,装置E冷凝并收集产物,装置D用于吸收未反应完的氯气和阻止空气中的水蒸气进入收集装置。
1
2
3
4
5
(2)S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
①该固体是________。
1
2
S(或硫)
解析 S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体,S2Cl2―→SO2,硫元素化合价升高,根据氧化还原反应中化合价有升有降,则该固体为S单质。
3
4
5
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案________(填“可行”或“不可行”),原因是__________________________________________
________________。
1
2
不可行
SO2易被硝酸氧化生成 ,既难于检验SO2,
又干扰HCl的检验
解析 二氧化硫被氧化为硫酸根离子,硫酸银微溶,会干扰氯离子的检验。
3
4
5
(3)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25 g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87 g。
则产品中氯元素的质量分数为_______,由此可知产品中_____(填“含有”或“不含有”)SCl2杂质。
1
2
56.8%
含有
3
4
5
1
2
3
4
5
合成反应:SO2+Na2CO3===Na2SO3+CO2 2Na2S+3SO2===2Na2SO3+3S Na2SO3+S Na2S2O3
滴定反应:I2+2Na2S2O3===2NaI+Na2S4O6
已知:Na2S2O3·5H2O易溶于水,难溶于乙醇,50 ℃开始失结晶水。
3.(2020·浙江7月选考,30)硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备Na2S2O3·5H2O。
1
2
3
4
5
实验步骤:
Ⅰ.Na2S2O3制备:装置A制备的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发
浓缩、冷却结晶、过滤、洗涤、干燥,
得到Na2S2O3·5H2O产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用
Na2S2O3·5H2O产品配制的溶液滴定碘标准溶液至滴定终点,计算Na2S2O3·5H2O含量。
1
2
3
4
5
请回答:
(1)步骤Ⅰ单向阀的作用是__________;装置C中的反应混合溶液pH过高或过低将导致产率降低,原因是___________________________________
_________________________________。
1
2
防止倒吸
pH过高,Na2CO3、Na2S反应不充分;pH过低,导致Na2S2O3转化为S和SO2
3
4
5
1
2
3
4
5
(2)步骤Ⅱ下列说法正确的是_____。
A.快速蒸发溶液中水分,可得较大晶体颗粒
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.冷却结晶后的固液混合物中加入乙醇可提高产率
D.可选用冷的Na2CO3溶液作洗涤剂
1
2
BC
3
4
5
会得到Na2S2O3·5H2O晶体;
C对,由题目已知信息,Na2S2O3·5H2O难溶于乙醇,所以冷却结晶后的固液混合物中加入乙醇可提高Na2S2O3·5H2O的产率;
D错,Na2S2O3·5H2O晶体易溶于水,若用Na2CO3溶液作洗涤剂,Na2S2O3·
5H2O会溶解,造成损失。
1
2
解析 A错,快速蒸发水分,加热温度过高,会造成Na2S2O3·5H2O晶体失去结晶水;
B对,蒸发浓缩至溶液表面出现晶膜时,停止加热,利用余热蒸发水分,
3
4
5
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→( )→( )→( )→( )→( )→开始滴定。
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度
或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡 F.用滴定液润洗2至3次 G.记录起始读数
1
2
F B E C G
3
4
5
1
2
解析 滴定管使用前的正确操作顺序为检漏→蒸馏水洗涤→用滴定液润洗2至3次→装入滴定液至零刻度以上→排除气泡→调整滴定液液面至零刻度或零刻度以下→记录起始读数→开始滴定。
3
4
5
解析 为了防止标准液中的碘挥发,造成标准液的浓度偏低,滴定前的碘量瓶应盖上瓶塞。
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是____________。
1
2
防止碘挥发
3
4
5
③滴定法测得产品中Na2S2O3·5H2O含量为100.5%,则Na2S2O3·5H2O产品中可能混有的物质是______________________________________。
1
2
Na2SO3或失去部分结晶水的Na2S2O3·5H2O
3
4
5
1
2
解析 根据题给滴定反应的化学方程式,可得滴定反应的关系式为2Na2S2O3·5H2O~I2,Na2SO3与I2反应的对应关系为Na2SO3~I2,M(Na2SO3)
=126 g·mol-1,M(Na2S2O3·5H2O)=248 g·mol-1,M(Na2SO3)<M(Na2S2O3·
5H2O);若产品中Na2S2O3·5H2O的含量超过100%,说明产品中可能存在Na2SO3或失去部分结晶水的Na2S2O3·5H2O。
3
4
5
题组二 有机物的制备综合实验题
4.某化学兴趣小组设计实验制备苯甲酸异丙酯,其反应原理为
+ +H2O。用如图所
示装置进行实验:
1
2
3
4
5
物质的部分物理性质如表所示:
1
2
3
4
5
物质
相对分子质量
密度/ g·cm-3
沸点/℃
水溶性
苯甲酸
122
1.27
249
微溶
异丙醇
60
0.79
82
易溶
苯甲酸异丙酯
164
1.17
218
不溶
实验步骤:
步骤Ⅰ.在干燥的仪器a中加入38.1 g苯
甲酸、30 mL异丙醇和15 mL浓硫酸,
再加入几粒沸石;
步骤Ⅱ.加热至70 ℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:
步骤Ⅳ.将粗产品用图乙所示装置进行精制。
1
2
3
4
5
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后
顺序一定错误的是_____(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为_____________________。加入的苯甲酸和异丙醇中,需过量的是________,目的是_______________________________
____________________。
1
2
B
三颈烧瓶(或三口烧瓶)
有利于酯化反应向正反应方向进行,提高苯甲酸的转化率
异丙醇
3
4
5
(3)本实验一般采用水浴加热,因为温度过
高会使产率_____(填“增大”“减小”或
“不变”)。
(4)操作Ⅰ中第二次水洗的目的是_______
___________,操作Ⅱ中加入无水硫酸镁的
作用为______________。
(5)步骤Ⅳ所用的装置中冷却水的进口为_____(填字母),操作时应收集218 ℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为________(填物质名称)。
1
2
减小
除去残
留的碳酸钠
除去残留的水
g
苯甲酸
3
4
5
(6)如果得到的苯甲酸异丙酯的质量为40.930 g,则该实验的产率为____%(结果保留2位有效数字)。
1
2
80
3
4
5
类比乙酸乙酯制备实验试剂的添加顺序,一般都是将浓硫
酸缓缓注入其他溶液中―→解答第(1)问
结合装置特点、可逆反应特点―→解答第(2)问
有机物特点,异丙醇的沸点82 ℃―→解答第(3)问
分离提纯的方法及实验操作目的―→解答第(4)问
蒸馏实验原理―→解答第(5)问
产率计算方法―→解答第(6)问
[思路点拨]
1
2
提取信息
并与实验
知识相结合
3
4
5
1
2
3
4
5
5.(2020·山师附中4月模拟)2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
1
2
3
4
5
部分物质的相关性质如下:
1
2
名称
相对分子质量
性状
熔点/℃
水溶性(常温)
间苯二酚
110
白色针状晶体
110.7
易溶
2-硝基-1,3-苯二酚
155
桔红色针状晶体
87.8
难溶
制备过程如下:
第一步:磺化。称取71.5 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15 min(如图1)。
3
4
5
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100 ℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。
1
2
3
4
5
请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)_____。
a.30 ℃~60 ℃ b.60 ℃~65 ℃
c.65 ℃~70 ℃ d.70 ℃~100 ℃
1
2
b
解析 由题意可知,为控制适当的反应速率及防止副产物出现,反应温度应控制在60~65 ℃左右,b正确。
3
4
5
(2)图2中的冷凝管是否可以换为图1所用冷凝管_____(填“是”或“否”)。
1
2
否
解析 若图2中的直形冷凝管换为图1所用的球形冷凝管,不便于被冷凝的液体顺利流下。
3
4
5
(3)硝化步骤中制取“混酸”的具体操作是__________________________
_______________________________________________。
1
2
解析 溶液混合时,必须把密度大的溶液加入到密度小的溶液中,浓硫酸的密度大于浓硝酸,则硝化步骤中制取“混酸”的具体操作是在烧杯中加适量的浓硝酸,沿杯壁缓慢加入一定量的浓硫酸,边加边搅拌,冷却。
在烧杯中加入适量的浓硝酸,沿杯壁缓慢加入一定量的浓硫酸,边加边搅拌,冷却
3
4
5
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止_____________________;冷凝管C中可能看到的现象是___________________________,反应一段时间后,停止蒸馏,此时的操作是______________________(填有关旋塞和酒精灯的操作)。
1
2
压强过小引起倒吸
冷凝管内壁有桔红色晶体析出
打开旋塞,撤去酒精灯
3
4
5
解析 图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小产生倒吸,根据反应原理,在直形冷凝管C中应出现2-硝基-1,3-苯二酚,被冷却后以固体形式出现,则可以观察到冷凝管内壁有桔红色晶体析出;停止蒸馏时,应先打开旋塞,再停止在A处加热。
1
2
3
4
5
解析 能用水蒸气蒸馏来分离和提纯物质,则被提纯物质必须不溶或难溶于水,便于最后分离、在沸腾下与水不发生化学反应、具有一定的挥发性,则ab正确。
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是______。
a.不溶或难溶于水,便于最后分离
b.在沸腾下与水不发生化学反应
c.难挥发性
d.易溶于水
1
2
ab
3
4
5
解析 71.5 g间苯二酚的物质的量为0.65 mol,根据元素守恒可知,生成的2-硝基-1,3-苯二酚的质量为0.65 mol×155 g·mol-1=100.75 g,则2-硝基-1,3-苯二酚的产率为
(6)本实验最终获得12.0 g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为________(保留3位有效数字)。
1
2
11.9%
3
4
5
1.题型特点
该类题型以探究物质未知的性质,主要包括酸碱性、氧化性、还原性、热稳定性等以及可能发生的反应为主要目的。在性质探究实验中主要考查试剂的选择、装置仪器的规范、步骤优化、实验设计、现象的探究和结论的评价等综合分析能力。
考向突破二 性质探究类综合实验题
高考必备
2.研究物质性质的基本方法和程序
3.注意事项
(1)若探究影响性质的因素,首先应确定变量,其次是“定多变一”,即其他因素不变,只改变一种因素,看这种因素与探究的问题存在怎样的关系。
(2)多角度辩证地看问题。
①研究反应物中各微粒的性质(即内因)。
②研究反应条件的影响(温度、浓度、环境中的其他物质)。
对点集训
1
2
1.(2016·全国卷Ⅱ,28)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______________。
防止Fe2+被氧化
解析 亚铁离子具有还原性,能被空气中的氧气氧化,所以在配制的FeCl2溶液中加入少量铁屑的目的是防止Fe2+被空气氧化。
3
1
2
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________。
2Fe2++Cl2===2Fe3++2Cl-
解析 Cl2可将Fe2+氧化成Fe3+,自身得电子生成Cl-,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。
3
1
2
(3)乙组同学认为甲组的实验不够严谨,该组同学在 2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______________________________。
隔绝空气(排除氧气对实验的影响)
解析 煤油的作用是隔绝空气,防止空气中的氧气将Fe2+氧化,产生干扰。
3
1
2
(4)丙组同学取10 mL 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为___________。
Fe2+
Fe3+
可逆反应
3
1
2
解析 根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀,一定含有Fe2+,则实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显红色,实验①和③说明,在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为可逆反应,反应为2Fe3++2I- 2Fe2++I2。
3
1
2
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________________
______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________,生成沉淀的原因是______________________________________________(用平衡移动原理解释)。
H2O2+2Fe2++2H+===2Fe3++
2H2O
Fe3+催化H2O2分解产生O2
H2O2分解反应放热,促进Fe3+的水解平衡正向移动
3
1
2
解析 H2O2溶液中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O,铁离子的溶液呈棕黄色;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是反应产生的Fe3+是H2O2分解的催化剂,促使H2O2分解生成O2,同时H2O2分解反应是放热反应,促进了Fe3+水解平衡Fe3++3H2O Fe(OH)3+3H+正向移动,产生较多 Fe(OH)3,聚集形成沉淀。
3
并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入CO2和SO2混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加BaCl2溶液,产生白色沉淀。
2.(2020·青岛一模)化学小组为探究SO2在酸性KI溶液中的反应,利用如图装置进行实验:
1
2
Ⅰ.排出装置内的空气。减缓CO2的流速,向丁装置中通入CO2和SO2的混合气体。
Ⅱ.一段时间后,溶液变黄
3
解析 装置丁中苯有两个作用:萃取碘单质,隔绝空气防止I-被氧化;用二氧化碳排出甲、乙、丙中的空气,打开K3,打开K1,关闭K2。
回答下列问题:
(1)苯的作用为_________________________________。排出装置内空气的具体操作为_______________________。
1
2
萃取碘单质,隔绝空气防止I-被氧化
关闭K2,打开K3,打开K1
3
解析 若只将SO2通入丁中,SO2反应后压强减小,会倒吸,通入CO2和SO2混合气体,CO2不反应,始终有气体排出,起防止倒吸的作用。
(2)向装置丁中缓慢通入CO2的作用是__________。
1
2
防止倒吸
3
(3)步骤Ⅱ反应的离子方程式为_________________________________;步骤Ⅲ反应的离子方程式为_________________________________。
1
2
SO2+4I-+4H+===2I2+S↓+2H2O
3
解析 步骤Ⅱ中,溶液变黄并出现浑浊,说明生成了硫单质,摇动锥形瓶、静置,苯与溶液边缘呈紫红色,说明生成了碘单质,离子方程式为SO2+4I-+4H+===2I2+S↓+2H2O;步骤Ⅲ通入CO2和SO2混合气体,溶液变为无色,说明碘单质被消耗,离子方程式为:SO2+I2+2H2O===
1
2
3
(4)实验的总反应为_______________________________,KI和HI在反应中的作用为_______。
1
2
催化剂
3
1
2
3
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
3.(2020·潍坊高密一中高三模拟)某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
1
2
3
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
解析 实验室配制FeCl3溶液时,为了防止铁离子水解,先将FeCl3固体溶解在较浓的盐酸中然后加水稀释。
(1)怎样配制FeCl3溶液? ____________________________________。
1
2
将FeCl3溶于浓盐酸,再稀释至指定浓度
3
解析 若有硫酸根生成,则加入盐酸酸化的氯化钡溶液会有白色沉淀生成;
(2)甲同学探究实验Ⅰ的电极产物。
①取少量Na2SO3溶液电极附近的混合液,加入______________________,产生白色沉淀,证明产生了
1
2
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
足量盐酸和BaCl2溶液
3
②该同学又设计实验探究另一电极的产物,其实验方案为________________
____________________________________________________________________。
1
2
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
取少量FeCl3溶液
电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+
3
1
2
解析 氯化铁溶液为原电池正极,发生还原反应,Fe3+被还原成Fe2+,所以方案为取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明产生了Fe2+。
装置
编号
试剂X
实验现象
?
Ⅰ
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流表指针发生偏转
Ⅱ
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流表指针未发生偏转
3
装置
编号
反应时间
实验现象
?
Ⅲ
0~1 min
产生红色沉淀,有刺激性气味气体逸出
1~30 min
沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后
与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
(3)实验Ⅰ中负极的电极反应式为________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
1
2
3
装置
编号
反应时间
实验现象
?
Ⅲ
0~1 min
产生红色沉淀,有刺激性气味气体逸出
1~30 min
沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后
与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
1
2
3
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
②________________________。
1
2
解析 pH=1的氯化铁溶液中有大量的氢离子,亚硫酸氢根离子结合氢离子生成二氧化硫气体,反应的离子方程式:
3
(5)查阅资料:溶液中 三种微粒会形成红色配合物并存在如下转化:
1
2
(红色) (橙色)
从反应速率和化学平衡两个角度解释1~30 min的实验现象:__________
_______________________________________________________________
_______________________________________________________________
_______________________________。
生成红色
配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;在O2的
作用下,橙色的HOFeOSO2浓度下降,平衡
不断正向移动,最终溶液几乎无色
3
1
2
3
【实验反思】
(6)分别对比Ⅰ和Ⅱ、Ⅱ和Ⅲ,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和_______________________________________________________
______________________________________________________________________________________有关(写出两条)。
1
2
溶液pH不同,Na2SO3、NaHSO3溶液中 浓度不同(或Na2SO3与NaHSO3不同,或Na2SO3与NaHSO3的阴离子不同),反应物是否接触形成红色配合物(任写两条)
3
1.定量实验数据的测定方法
(1)沉淀法
先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。
考向突破三 定量测定型综合实验题
高考必备
(2)测气体体积法
对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。
①常见测量气体体积的实验装置
②量气时应注意的问题
a.量气时应保持装置处于
室温状态。
b.读数时要特别注意消除
“压强差”,保持液面相
平,还要注意视线与液面
最低处相平。如图(Ⅰ)(Ⅳ)应使左侧和右侧的液面高度保持相平。
(3)测气体质量法
将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。
(4)滴定法
即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
2.解题注意事项
(1)定量测定实验中要具备的3种意识:
①要有消除干扰气体的意识:如用“惰性气体”将干扰气体排出,或用溶液吸收干扰气体等。
②要有被测量气体全部被测量的意识:如可以采用反应结束后继续向装置中通入“惰性”气体以使被测量的气体全部被吸收剂吸收的方法。
③要有“数据”的采集处理意识:实验数据的采集是化学计算的基础,一般的固体试剂称取质量,而液体试剂和气体试剂测量体积。
(2)“关系式法”在定量测定实验中的应用:
关系式法是表示两种或多种物质之间“物质的量”关系的一种简化式子。在多步反应中,它可以把始态的反应物与终态的生成物之间“物质的量”的关系表示出来,把多步计算简化成一步完成。正确提取关系式是用关系式法解题的关键。
(3)定量型实验的关键为数据处理和误差分析,数据的处理一般注意五个方面:
①是否符合测量仪器的精度。
②数据是否在误差允许范围内。
③数据的测试环境。
④数据的测量过程是否规范、合理。
⑤少量物质是否完全反应;过量物质对数据是否有影响。误差分析的依据为计算式,看测量对结果会产生什么影响。
对点集训
1
2
题组一 以含量测定为目的的综合实验
1.(2020·济南一模)工业上处理含苯酚废水的过程如下。回答下列问题:
Ⅰ.测定废水中苯酚的含量。
测定原理: +3Br2―→ ↓+3HBr
3
4
测定步骤:
步骤1:准确量取25.00 mL待测废水于250 mL锥形瓶中。
步骤2:将5.00 mL a mol·L-1浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入b mL 0.10 mol·L-1KI溶液(过量),塞紧瓶塞,振荡。
步骤4:滴入2~3滴指示剂,再用0.010 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V1mL(反应原理:I2+2Na2S2O3===2NaI+Na2S4O6)。
待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗Na2S2O3溶液V2 mL。
1
2
3
4
(1)“步骤1”量取待测废水所用仪器是___________。
酸式滴定管
解析 由于苯酚显酸性,因此选用酸式滴定管。
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和____
_____。
解析 由于溴单质易挥发,因此可采用塞紧瓶塞、迅速加入试剂等方法防止其挥发。
塞紧
瓶塞
1
2
3
4
(3)“步骤4”滴定终点的现象为___________________________________
___________________________。
滴入一滴溶液后,锥形瓶内溶液蓝色恰
好褪去,且半分钟不恢复原色
解析 用0.010 mol·L-1Na2S2O3标准溶液滴定至终点,由于Na2S2O3标准溶液会与I2反应,加入的淀粉遇I2变成蓝色,所以滴定终点的现象为滴入一滴溶液后,锥形瓶内溶液蓝色恰好褪去,且半分钟不恢复原色。
1
2
3
4
(4)该废水中苯酚的含量为___________mg·L-1(用含V1、V2的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量_____(填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量______。
偏低
偏低
1
2
3
4
解析 根据反应方程式可得各物质的物质的量关系式:
Br2~2KI~I2~2Na2S2O3
0.005V1 0.010V1
0.005V2 0.010V2
剩下的浓溴水中Br2的物质的量为0.005V1 mmol,将待测废液换成蒸馏水时,5 mL a mol·L-1的浓溴水中Br2的物质的量为0.005V2 mmol,则与苯酚参与反应的Br2的物质的量为0.005(V2-V1)mmol,根据方程式 +3Br2―→
↓+3HBr可得苯酚的物质的量为
1
2
3
4
1
2
3
4
Ⅱ.处理废水。采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基自由基(·OH),阴极上产生H2O2。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(5)写出阳极的电极反应式:______________________。
H2O-e-===·OH+H+
解析 Ti基PbO2为阳极,则阳极H2O失去电子产生·OH,电极反应式为H2O-e-===H++·OH。
1
2
3
4
(6)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:______________
_________________________。
C6H5OH+
解析 根据题干信息可知,苯酚被阴极产生的H2O2深度氧化产生CO2和H2O,由氧化还原反应规律得到其反应方程式为C6H5OH+14H2O2===
6CO2↑+17H2O。
14H2O2===6CO2↑+17H2O
1
2
3
4
解析 装置A是过滤器,装有无碱玻璃棉的作用是过滤,除去粉尘。
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140 ℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用为______。
2.(2018·天津,9)烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样
除尘
1
2
3
4
解析 C中填充的是干燥剂,除去H2O且不能与NOx反应,所以应选有酸性、干燥能力强的P2O5。
(2)C中填充的干燥剂是____(填序号)。
a.碱石灰 b.无水CuSO4 c.P2O5
c
1
2
3
4
答案
(3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
1
2
3
4
解析 D装置中装有碱液,用于吸收NOx,作用与实验室中的洗气瓶相同,该装置的示意图为
。
1
2
3
4
(4)采样步骤②加热烟道气的目的是___________________。
Ⅱ.NOx含量的测定
将V L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成 ,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
防止NOx溶于冷凝水
1
2
3
4
解析 烟道气中有水,采样步骤②加热器将烟道气加热至140 ℃的目的是防止NOx溶于冷凝水。
1
2
3
4
(5)NO被H2O2氧化为 的离子方程式为___________________________
________。
+2H2O
1
2
3
4
(6)滴定操作使用的玻璃仪器主要有____________________。
锥形瓶、酸式滴定管
解析 滴定操作使用的玻璃仪器主要有锥形瓶、滴定管,因为该滴定液呈酸性,所以选用酸式滴定管。
1
2
3
4
(7)滴定过程中发生下列反应:
则气样中NOx折合成NO2的含量为______________________ mg·m-3。
1
2
3
4
解析 滴定过程中发生下列反应:
1
2
3
4
(8)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。
若缺少采样步骤③,会使测定结果______。若FeSO4标准溶液部分变质,会使测定结果______。
偏低
偏高
1
2
3
4
解析 若缺少采样步骤③,系统内存在空气,会使收集的气样中NOx偏少,测定结果偏低。若FeSO4标准溶液部分变质,溶液中的Fe2+浓度减小,消耗的FeSO4标准溶液体积增大,会使测定结果偏高。
1
2
3
4
题组二 以化学式测定为目的的综合实验题
3.某学习小组在实验室中利用如图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中
含硫化合物的组成。
(一)硫化物(FexSy)的组成
实验步骤:
步骤Ⅰ 按图连接装置,检查装置气密性,装入药品;
步骤Ⅱ 打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续通入一段时间的O2;
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
……
1
2
3
4
请回答:
(1)步骤Ⅲ中,停止加热后还需继续向烧瓶中滴水一段时间,其目的为_______________________________________________________________。
(2)在C、D装置之间不需要防倒吸装置的理由是______________________
_______。
(3)步骤Ⅳ中配制溶液时所需的
玻璃仪器除玻璃棒和烧杯外,
还有______________________。
继续生成O2,驱赶装置内残留的SO2,使生成的气体全部被NaOH溶液吸收
SO2中含不溶于NaOH溶
液的O2
250 mL容量瓶、胶头滴管
1
2
3
4
(4)取25.00 mL步骤Ⅳ中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66 g。则FexSy的化学式为______。
FeS2
1
2
3
4
解析 A装置中产生足量的氧气经干燥后,进入C装置与FexSy在加热条件下反应,生成硫的氧化物,进入D装置被氢氧化钠吸收。
n(BaSO4)= =0.02 mol,根据硫元素守恒,250 mL溶液中n(S)=0.2 mol,故12.0 g FexSy中n(S)=0.2 mol,m(S)=6.4 g,m(Fe)=12.0 g-6.4 g=5.6 g,n(Fe)=0.1 mol,所以x∶y=1∶2,故FexSy的化学式为FeS2。
1
2
3
4
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案是否合理?____(填“是”或“否”),原因为_________________________________
_______________________。
部分SO2被氧化;空气中的CO2和水蒸气可能使干燥管增重偏大
否
1
2
3
4
(二)探究反应后D装置所得溶液中含硫化合物的组成
(6)反应后D装置所得溶液中除含有Na2SO4外,还可能含有Na2SO3。现用滴定法测定溶液中Na2SO3的含量。可供选择的试剂:①0.100 0 mol·L-1 KMnO4酸性溶液;②0.100 0 mol·L-1 H2O2溶液;③0.100 0 mol·L-1 KI-淀粉溶液;④0.100 0 mol·L-1 BaCl2溶液;⑤0.100 0 mol·L-1 HCl溶液。
①所选试剂应装在_____(填“酸式”或“碱式”)滴定管中。
②所利用的反应原理为___________________________________________
(用离子方程式表示)。
酸式
1
2
3
4
解析 要用滴定法测定溶液中Na2SO3的含量,即利用Na2SO3的还原性,故选一个氧化剂,还要有颜色的变化来判断反应的终点,所以只能选择0.100 0 mol·L-1 KMnO4酸性溶液。
1
2
3
4
实验步骤如下:
Ⅰ.按图示连接仪器,检查装
置气密性后加入药品;
Ⅱ.打开K1、K2,通入一段时间氮气,关闭K1、K2,取下干燥管称量其质量(m1)后再连接好装置;
4.(2020·日照一模)中国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为FeS2和FeCO3,实验室为测定FeS2和FeCO3的物质的量之比,利用如图所示装置进行实验。
1
2
3
4
Ⅳ.关闭K1、K2,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
Ⅲ.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开K2通入一段时间氮气;
Ⅴ.取下上述步骤Ⅱ中的干燥管并称量其质量(m2);
Ⅵ.取配制好的滤液25 mL于锥形瓶中,用0.1 mol·L-1KMnO4溶液滴定。
1
2
3
4
回答下列问题:
(1)步骤Ⅱ中需要称重的干燥管是____(填“E”或“F”)。
解析 装置E吸收CO2并测定其质量,故步骤Ⅱ中需要称重的干燥管是E。
E
1
2
3
4
(2)实验过程中发现B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式:_____________________________。
解析 B装置为检验H2S的装置,B中有黑色的CuS沉淀生成,则A中FeS2与稀硫酸反应的化学方程式为FeS2+H2SO4===FeSO4+S+H2S。
FeS2+H2SO4===FeSO4+S+H2S
1
2
3
4
解析 酸性高锰酸钾溶液具有强氧化性,可除去H2S并检验H2S是否除尽,F装置可吸收空气中的CO2和H2O,若撤去装置F,E装置所测得的CO2的质量将会偏大,使得最终FeCO3的含量偏大。
(3)C装置的作用是__________________________;若撤去装置F,则测得的FeCO3的含量会_____(填“偏大”“偏小”或“无影响”)。
除去H2S并检验H2S是否除尽
偏大
1
2
3
4
(4)下列关于步骤Ⅳ的叙述正确的是______(填字母)。
A.滤渣中含有还原产物单质硫
B.过滤过程中玻璃棒起到引流和搅拌的作用
C.过滤操作要迅速,否则会使测得的FeS2含量偏低
D.检验沉淀是否洗涤干净,可向滤液中加入氯化钡溶液,观察是否有白色沉淀生成
C
1
2
3
4
解析 反应FeS2+H2SO4===FeSO4+S+H2S中FeS2中的S化合价由-1升高至0价,S为氧化产物,故滤渣中含有氧化产物S,A选项错误;
过滤过程中玻璃棒的作用是引流,B选项错误;
过滤操作要迅速,否则FeSO4被空气中的氧气氧化,Fe2+含量偏低,消耗的KMnO4溶液体积偏小,从而Fe2+总量偏小,FeCO3的量不变,则测得的FeS2含量偏低,C选项正确;
1
2
3
4
检验沉淀是否洗涤干净,应取最后一次洗涤液,向其中加入稀盐酸酸化的BaCl2溶液,观察是否有白色沉淀生成,若有,则未洗涤干净,反之则洗涤干净,D选项错误。
1
2
3
4
(5)步骤Ⅵ中发生反应的离子方程式为______________________________
_______________,到达滴定终点的现象是__________________________
_____________________________。
滴入最后一滴KMnO4溶液,溶液变为浅红色且半分钟不褪去
+5Fe3++4H2O
1
2
3
4
解析 步骤Ⅵ中,Fe2+与酸性高锰酸钾溶液发生氧化还原反应生成Mn2+和Fe3+,反应的离子方程式为5Fe2++ +8H+===Mn2++5Fe3++4H2O,反应终点的现象是最后一滴KMnO4溶液滴下时,溶液变为浅红色且半分钟不褪去。
1
2
3
4
(6)若上述实验中m2-m1=2.2 g,步骤Ⅵ消耗0.1 mol·L-1KMnO4溶液45 mL,则该矿石样品中n(FeS2)∶n(FeCO3)=________。
4∶5
1
2
3
4
解析 m1-m2=2.2 g,即CO2的质量为2.2 g,物质的量为0.05 mol,则FeCO3的物质的量为0.05 mol,由方程式5Fe2++ +8H+===Mn2++5Fe3++4H2O可知,5Fe2+~ ,n( )=0.045 L×0.1 mol·L-1=0.004 5 mol,25 mL滤液中,n(Fe2+)=5×0.004 5 mol=0.022 5 mol,则100 mL滤液中n(Fe2+)=4×0.022 5 mol=0.09 mol,因此n(FeS2)=0.09 mol-n(FeCO3)=0.04 mol,n(FeS2)∶n(FeCO3)=0.04∶0.05=4∶5。
1
2
3
4
同课章节目录
