化学人教版(2019)必修第2册第五章第二节《氮及其化合物》---硝酸(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第2册第五章第二节《氮及其化合物》---硝酸(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-05 15:03:54 | ||
图片预览






文档简介
(共19张PPT)
硝酸
高一化学
玻尔是丹麦著名的物理学家,曾获得过诺贝尔奖。第二次世界大战中,玻尔被迫离开将要被德国占领的祖国。为了表示他一定要返回祖国的决心,他决定将诺贝尔金质奖章溶解在王水里,装于玻璃瓶中。后来,纳粹分子闯进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。你知道王水的成分吗?硝酸能将金质奖章溶解吗?
化学爱国小故事
宏观辨析与微观探析
掌握硝酸的物理性质和化学性质
(不稳定性、酸性、强氧化性)。
证据推理与模型认知
通过对实验现象的观察、分析和推理,培养学生的实验能力、观察能力、思维能力,提高学生的化学素养。
科学态度及社会责任
关心酸雨等热点问题,形成与环境和谐共处,合理利用资源的观念。
新课程标准
新闻快报:
4月24日上午,一辆装载了12吨浓度为69%的浓硝酸的铝槽车发生严重泄漏事故,一瞬间看到车辆周围升起一团白雾,刺鼻气味扑面而来,
还不停地冒出浓浓的红棕色“雾”,
消防员紧急调来大量沙子,在酸液流经之处垒起一个小堤坝,然后迅速运来熟石灰,为什么??
3min小组讨论:
1、“白雾”、“刺鼻气味”、
“用水喷射”和硝酸哪些
物理性质有关?
2、“熟石灰”
“红棕色”、
体现硝酸哪些化学性质?
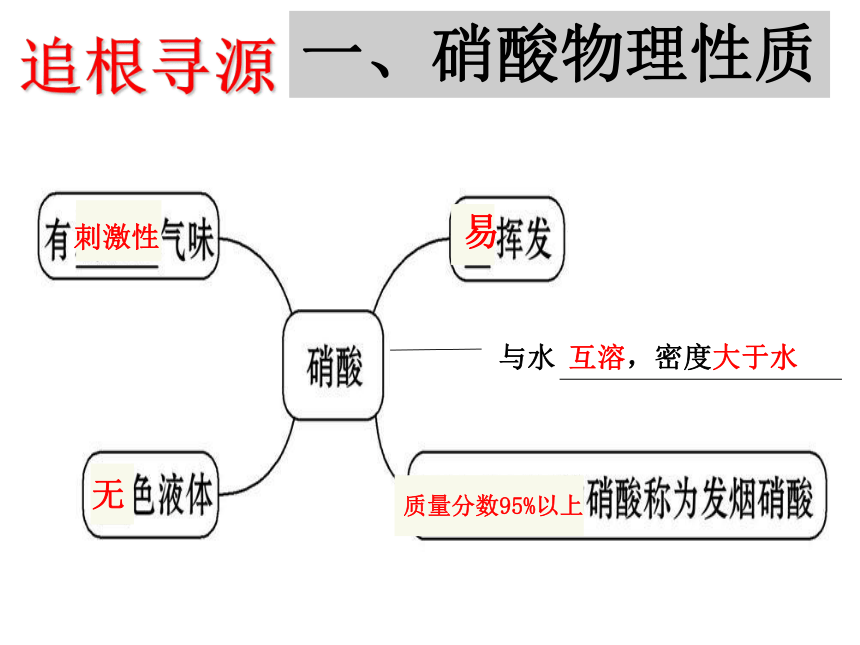
一、硝酸物理性质
追根寻源
互溶,密度大于水
刺激性
易
无
质量分数95%以上
与水
1、酸的通性(一元强酸)
(1)与酸碱指示剂反应:稀硝酸遇紫色石蕊试液变红色
(2)与金属单质反应
(3)与碱反应(如氢氧化钠)
(4)与碱性属氧化物反应(如氧化铜)
(5)与某些盐反应(如碳酸钙)
2H++CuO=Cu2++H2O
2H+
+CaCO3=Ca2++CO2↑+
H2O
H++OH-
=H2O
HNO3=H++NO3-
二、硝酸化学性质
追根寻源
2、不稳定性:
久置浓硝酸为什么
呈黄色?
硝酸应如何保存?
4HNO3
O2↑
+2H2O
+
4NO2↑
△
或光照
一般硝酸越浓越不稳定。
久置硝酸分解
产生的NO2溶于溶液
中,使得溶液变黄!
密封于
棕色瓶中,并放在
阴凉处!
浓HNO3
凡见光易分解的化学试剂均须避光保存。
如:氯水、HNO3
溶液、AgNO3溶液等。
追根寻源
《本草纲目拾遗》记载硝酸:西洋人所造,性最烈,能蚀五金。其水甚强,五金八石皆能穿滴,惟玻璃可盛。
追根寻源
【情境·思考】
体现硝酸哪些性质?
实验探究:
实
验
装
置
追根寻源
Cu与稀、浓硝酸:
稀硝酸
浓硝酸
实
验
现
象
反应缓慢,有少量
气泡产生,_____
_____,试管口有红
棕色气体产生
反应剧烈,有_____
_____产生,_______
___,液面上有_____
___气体产生
实
验
结
论
铜与稀硝酸常温
下缓慢反应生成
___气体
铜与浓硝酸常温下
剧烈反应生成___
气体
溶液
变蓝
大量
气泡
溶液变
绿
红棕
色
NO
NO2
Cu与稀硝酸、浓硝酸反应:
尾气处理:
2NO2
+2NaOH=NaNO2
+NaNO3
+
H2O
NO2
+NO
+
2NaOH=2NaNO2
+
H2O
(1)常温或冷的条件下,Fe、Al在浓HNO3或浓H2SO4中由
于被氧化生成一层致密的氧化膜而“钝化”,属化学变化。
不生成H2!
硝酸遇金属单质体现氧化性和酸性
(2)与金属单质反应:除Au(金)Pt(铂)外:
Cu+4HNO3
(浓)
=Cu(NO3
)2
+2NO2
↑
+
2H2O
3Fe+8HNO3
(稀,少)
=3Fe
(NO3
)2+2NO
↑
+
4H2O
Fe+4HNO3
(稀,过)
=Fe
(NO3
)3
+
NO
↑
+
2H2O
小哲理:空有天赋,努力不够,只能伤仲永!
3Cu+8HNO3
(稀)
=3Cu(NO3
)2+2NO
↑
+
4H2O
追根寻源
3、强氧化性:
化学数字对联
上联:38324
(铜与稀硝酸或铁与少量稀硝酸)
下联:14122
(铜与浓硝酸)
横批:4546(氨的催化氧化)
☆
工业制
硝酸
(3)与非金属单质反应:碳与浓硝酸
谐音记忆:意思意思啊!
(4)
NO3-很稳定,在中性和碱性溶液中几乎与所有的离子能共存,但在酸性溶液中,NO3-/H+
具有了强氧化性,与Fe2+
、S2-、I-、SO32-
等不能共存!
与还原性离子如Fe2+
、S2-、I-、SO32-
等反应。
三、硝酸的功与过
1、功:化肥、农药、炸药、染料等
2、过:酸雨、光化学烟雾、雾霾等
酸雨(PH<5.6)
危害及防治
课堂小结
一、硝酸物理性质
二、硝酸化学性质
酸性、
不稳定性、
强氧化性
三、硝酸功与过
1、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2
下面是三位同学提出的三个方案:
甲:铜
浓硝酸
乙:铜
稀硝酸
丙:铜
空气
△
硝酸
请问:那一种方案最好?为什么?
Cu(NO3)2
Cu(NO3)2
Cu(NO3)2
CuO
当堂检测
2、将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。
则:
(1)写出下列物质的化学式:
丙______,B________,C________,D________。
(2)丙与乙反应离子方程式________________________。
(3)尾气处理:
_________________________________________________________。
Cu
NO
CaCO3
Cu(NO3)2
3Cu+8H+
+2NO3-
=3Cu2+
+2NO↑+4H2O
2NO+O2=2NO2
2NO2
+2NaOH=NaNO2
+NaNO3
+
H2O
学好知识更好地爱护我们的家园
硝酸
高一化学
玻尔是丹麦著名的物理学家,曾获得过诺贝尔奖。第二次世界大战中,玻尔被迫离开将要被德国占领的祖国。为了表示他一定要返回祖国的决心,他决定将诺贝尔金质奖章溶解在王水里,装于玻璃瓶中。后来,纳粹分子闯进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。你知道王水的成分吗?硝酸能将金质奖章溶解吗?
化学爱国小故事
宏观辨析与微观探析
掌握硝酸的物理性质和化学性质
(不稳定性、酸性、强氧化性)。
证据推理与模型认知
通过对实验现象的观察、分析和推理,培养学生的实验能力、观察能力、思维能力,提高学生的化学素养。
科学态度及社会责任
关心酸雨等热点问题,形成与环境和谐共处,合理利用资源的观念。
新课程标准
新闻快报:
4月24日上午,一辆装载了12吨浓度为69%的浓硝酸的铝槽车发生严重泄漏事故,一瞬间看到车辆周围升起一团白雾,刺鼻气味扑面而来,
还不停地冒出浓浓的红棕色“雾”,
消防员紧急调来大量沙子,在酸液流经之处垒起一个小堤坝,然后迅速运来熟石灰,为什么??
3min小组讨论:
1、“白雾”、“刺鼻气味”、
“用水喷射”和硝酸哪些
物理性质有关?
2、“熟石灰”
“红棕色”、
体现硝酸哪些化学性质?
一、硝酸物理性质
追根寻源
互溶,密度大于水
刺激性
易
无
质量分数95%以上
与水
1、酸的通性(一元强酸)
(1)与酸碱指示剂反应:稀硝酸遇紫色石蕊试液变红色
(2)与金属单质反应
(3)与碱反应(如氢氧化钠)
(4)与碱性属氧化物反应(如氧化铜)
(5)与某些盐反应(如碳酸钙)
2H++CuO=Cu2++H2O
2H+
+CaCO3=Ca2++CO2↑+
H2O
H++OH-
=H2O
HNO3=H++NO3-
二、硝酸化学性质
追根寻源
2、不稳定性:
久置浓硝酸为什么
呈黄色?
硝酸应如何保存?
4HNO3
O2↑
+2H2O
+
4NO2↑
△
或光照
一般硝酸越浓越不稳定。
久置硝酸分解
产生的NO2溶于溶液
中,使得溶液变黄!
密封于
棕色瓶中,并放在
阴凉处!
浓HNO3
凡见光易分解的化学试剂均须避光保存。
如:氯水、HNO3
溶液、AgNO3溶液等。
追根寻源
《本草纲目拾遗》记载硝酸:西洋人所造,性最烈,能蚀五金。其水甚强,五金八石皆能穿滴,惟玻璃可盛。
追根寻源
【情境·思考】
体现硝酸哪些性质?
实验探究:
实
验
装
置
追根寻源
Cu与稀、浓硝酸:
稀硝酸
浓硝酸
实
验
现
象
反应缓慢,有少量
气泡产生,_____
_____,试管口有红
棕色气体产生
反应剧烈,有_____
_____产生,_______
___,液面上有_____
___气体产生
实
验
结
论
铜与稀硝酸常温
下缓慢反应生成
___气体
铜与浓硝酸常温下
剧烈反应生成___
气体
溶液
变蓝
大量
气泡
溶液变
绿
红棕
色
NO
NO2
Cu与稀硝酸、浓硝酸反应:
尾气处理:
2NO2
+2NaOH=NaNO2
+NaNO3
+
H2O
NO2
+NO
+
2NaOH=2NaNO2
+
H2O
(1)常温或冷的条件下,Fe、Al在浓HNO3或浓H2SO4中由
于被氧化生成一层致密的氧化膜而“钝化”,属化学变化。
不生成H2!
硝酸遇金属单质体现氧化性和酸性
(2)与金属单质反应:除Au(金)Pt(铂)外:
Cu+4HNO3
(浓)
=Cu(NO3
)2
+2NO2
↑
+
2H2O
3Fe+8HNO3
(稀,少)
=3Fe
(NO3
)2+2NO
↑
+
4H2O
Fe+4HNO3
(稀,过)
=Fe
(NO3
)3
+
NO
↑
+
2H2O
小哲理:空有天赋,努力不够,只能伤仲永!
3Cu+8HNO3
(稀)
=3Cu(NO3
)2+2NO
↑
+
4H2O
追根寻源
3、强氧化性:
化学数字对联
上联:38324
(铜与稀硝酸或铁与少量稀硝酸)
下联:14122
(铜与浓硝酸)
横批:4546(氨的催化氧化)
☆
工业制
硝酸
(3)与非金属单质反应:碳与浓硝酸
谐音记忆:意思意思啊!
(4)
NO3-很稳定,在中性和碱性溶液中几乎与所有的离子能共存,但在酸性溶液中,NO3-/H+
具有了强氧化性,与Fe2+
、S2-、I-、SO32-
等不能共存!
与还原性离子如Fe2+
、S2-、I-、SO32-
等反应。
三、硝酸的功与过
1、功:化肥、农药、炸药、染料等
2、过:酸雨、光化学烟雾、雾霾等
酸雨(PH<5.6)
危害及防治
课堂小结
一、硝酸物理性质
二、硝酸化学性质
酸性、
不稳定性、
强氧化性
三、硝酸功与过
1、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2
下面是三位同学提出的三个方案:
甲:铜
浓硝酸
乙:铜
稀硝酸
丙:铜
空气
△
硝酸
请问:那一种方案最好?为什么?
Cu(NO3)2
Cu(NO3)2
Cu(NO3)2
CuO
当堂检测
2、将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。
则:
(1)写出下列物质的化学式:
丙______,B________,C________,D________。
(2)丙与乙反应离子方程式________________________。
(3)尾气处理:
_________________________________________________________。
Cu
NO
CaCO3
Cu(NO3)2
3Cu+8H+
+2NO3-
=3Cu2+
+2NO↑+4H2O
2NO+O2=2NO2
2NO2
+2NaOH=NaNO2
+NaNO3
+
H2O
学好知识更好地爱护我们的家园
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
