2021届高中化学考前三个月专项复习课件 命题区间四 角度一 微粒结构与化学键
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件 命题区间四 角度一 微粒结构与化学键 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-05 00:00:00 | ||
图片预览




文档简介
微粒结构与化学键
角度一
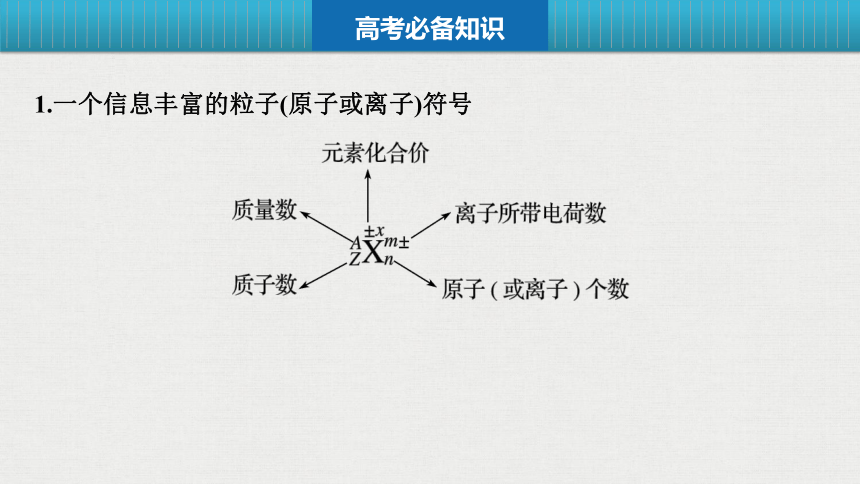
1.一个信息丰富的粒子(原子或离子)符号
高考必备知识
2.微粒间的“四个”数量关系
(1)质子数=核电荷数=核外电子数=原子序数;
(2)质量数=质子数+中子数;
(3)质子数=阳离子的核外电子数+阳离子所带正电荷数;
(4)质子数=阴离子的核外电子数-阴离子所带负电荷数。
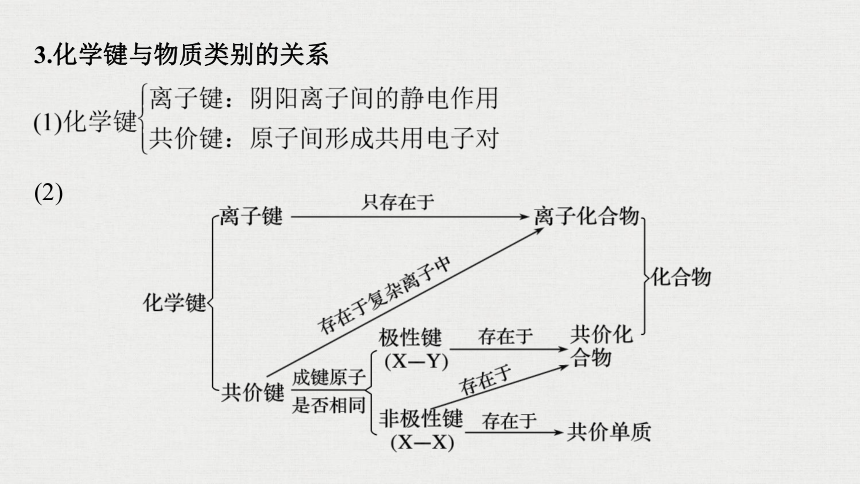
3.化学键与物质类别的关系
(2)
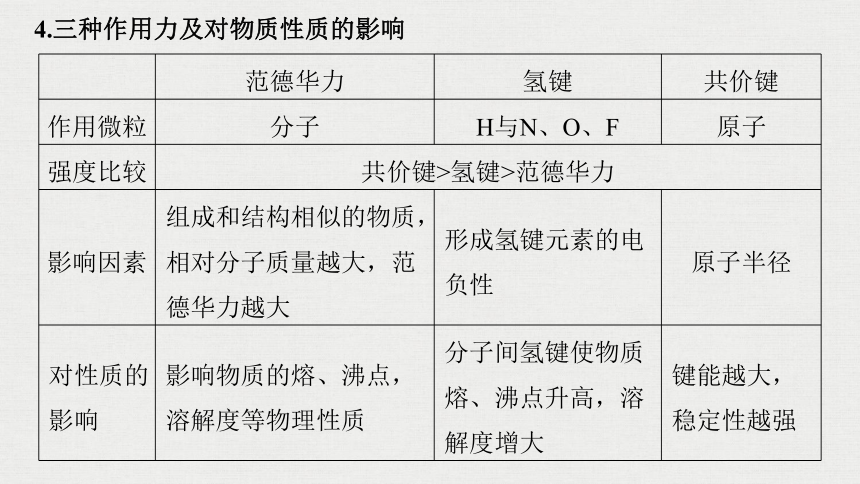
4.三种作用力及对物质性质的影响
?
范德华力
氢键
共价键
作用微粒
分子
H与N、O、F
原子
强度比较
共价键>氢键>范德华力
影响因素
组成和结构相似的物质,相对分子质量越大,范德华力越大
形成氢键元素的电负性
原子半径
对性质的影响
影响物质的熔、沸点,溶解度等物理性质
分子间氢键使物质熔、沸点升高,溶解度增大
键能越大,稳定性越强
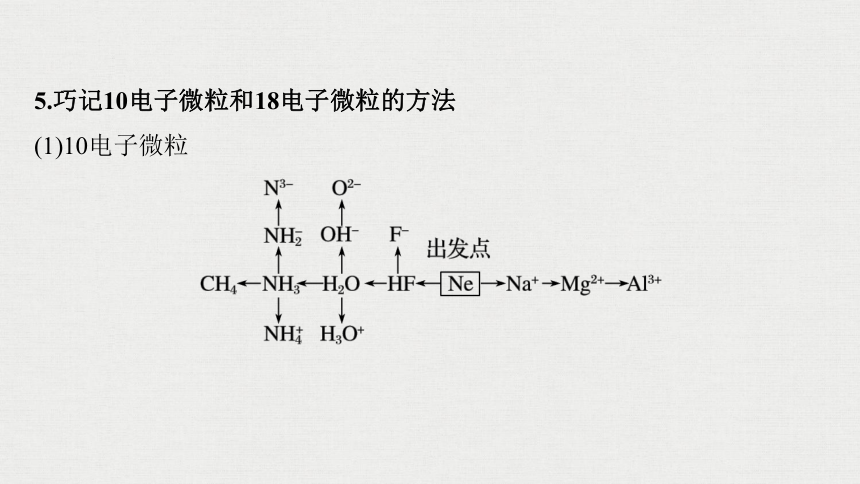
5.巧记10电子微粒和18电子微粒的方法
(1)10电子微粒
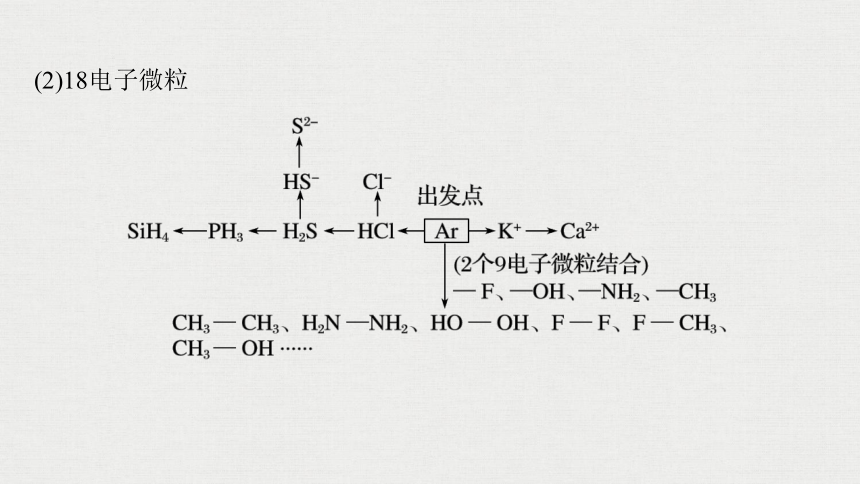
(2)18电子微粒
1.(2020·全国卷Ⅰ,11)1934年约里奥—居里夫妇在核反应中用α粒子(即氦核 )轰击金属原子 ,开创了人造放射性核素的先河:
其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A. 的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
1
2
3
4
5
重练高考真题
√
解析 由守恒关系可知元素X的质量数为27, 的相对原子质量近似等于该原子的质量数,A项错误;
X与Y最外层电子数之和为8,质子数相差2,且X为金属元素,可推知X为Al元素,Y为P元素,二者都有+3价,都可以形成三氯化物,B项正确;
同一周期主族元素自左向右,原子半径逐渐减小,故Al的原子半径大于P,C项错误;
P元素的含氧酸有H3PO4、H3PO3、H3PO2等,D项错误。
1
2
3
4
5
2.(2020·浙江7月选考,16)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是
A.原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y>M
C.X2Z—ZX2易溶于水,其水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
1
2
3
4
5
√
解析 短周期元素X、Y、Z、M、Q的原子序数依次增大,Y元素的最高正价为+4价,则Y处于第ⅣA族;Y元素与M元素同主族,且M的原子序数大于Y,则Y是C,M是Si;Y元素与Z、M元素相邻,且Z的原子序数大于Y,则Z是N。化合物Z2X4为N2X4,其电子总数为18个,则X含1个电子,X应为H。Q元素的原子最外层电子数比次外层少一个电子,且Q的原子序数大于M(Si),则Q是Cl。一般来说,电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大,故原子半径:N<C<Si,A正确;
元素的非金属性:N>C>Si,则最高价氧化物对应水化物的酸性:HNO3>H2CO3>H2SiO3,B正确;
1
2
3
4
5
X2Z—ZX2为H2N—NH2,其性质类似于NH3,易溶于水,其水溶液呈碱性,C正确;
H、N、Cl三种元素可形成离子化合物NH4Cl,D错误。
1
2
3
4
5
3.(2019·北京,8)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B. 的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
1
2
3
4
5
√
解析 Rb为碱金属,属于第五周期元素,故In亦为第五周期元素,由In的核外电子排布可得In与Al同主族,即为第ⅢA族元素,A项正确;
的中子数为115-49=66,质子数为49,故中子数与电子数之差为17,B项正确;
同主族元素,从上到下,原子半径逐渐增大,故原子半径:In>Al,C项正确;
同周期元素从左到右,金属性逐渐减弱,故其最高价氧化物对应水化物的碱性逐渐减弱,即碱性:In(OH)31
2
3
4
5
4.(2019·全国卷Ⅲ,9)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
√
1
2
3
4
5
解析 MgO为离子晶体,碳的氧化物为分子晶体,故镁的氧化物的熔点高于碳的氧化物,A错误;
非金属性:C>Si,故氢化物的热稳定性:CH4>SiH4,B正确;
C、Si形成的化合物SiC为共价化合物,C错误;
Mg能溶解在浓硝酸中,Si不能溶于浓硝酸,D错误。
1
2
3
4
5
1
2
3
4
5
5.(2018·全国卷Ⅲ,8)下列叙述正确的是
A.24 g镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数比为2∶1
D.1 mol乙烷与1 mol乙烯中,化学键数相同
√
1
2
3
4
5
解析 等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,B项正确;
24 g镁、27 g铝的物质的量均为1 mol,1个镁原子和1个铝原子所含的质子数分别为12、13,故24 g镁与27 g铝中含有的质子数分别为12 mol和13 mol,
A项错误;
1个重水分子含有10个中子,1个水分子含有8个中子,1 mol重水与1 mol水中含有的中子数之比为10∶8(5∶4),C项错误;
1个乙烷分子中含有7对共用电子,而1个乙烯分子中含有6对共用电子,故1 mol乙烷与1 mol乙烯中,含有的化学键数之比为7∶6,D项错误。
1.下列叙述错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
1
2
3
4
√
精练预测押题
1
2
3
4
解析 13C和14C属于碳元素的两种不同原子,二者中子数不同,互为同位素;1H和2H是不同的核素,它们的质子数相等,均为1;14C和14N的质量数相等,它们的中子数分别是8、7;6Li和7Li的电子数相等,均为3,但中子数不同,分别为3、4。
2.下列说法不正确的是
A.NaClO是含有两种类型化学键的离子化合物
B.CO2通入水的过程中,有共价键的形成和断裂,但不涉及离子键的变化
C.金刚石和足球烯都只由碳元素组成,且含有的化学键类型也相同
D.常温常压下,H2O与CH4的不同状态可以说明H2O的热稳定性更好
1
2
3
4
√
解析 NaClO是由Na+和ClO-组成的,即NaClO属于离子化合物,含有离子键,ClO-中存在共价键,故A项正确;
CO2溶于水形成H2CO3,H2CO3电离,CO2、H2O、H2CO3均属于共价化合物,有共价键的形成和断裂,没有离子键的变化,故B项正确;
金刚石和足球烯都是由碳元素组成的单质,都是由共价键组成,故C项正确;
热稳定性与物质状态无关,故D项错误。
1
2
3
4
3.(2019·浙江嘉兴一中期末)下列说法正确的是
A.PCl3、Cl2及Cl2O三种分子中各原子最外层都具有8电子稳定结构
B.HF分子比HCl分子稳定是因为分子间作用力前者强于后者
C.核外电子排布相同的两种微粒化学性质也相同
D.CaCl2和CaSO4中化学键的类型完全相同
1
2
3
4
√
1
2
3
4
解析 PCl3中P原子中的最外层电子数为5,形成3个共用电子对,Cl原子的最外层电子数为7,形成1个共用电子对,所以每个原子的最外层都具有8电子稳定结构。Cl2中Cl原子的最外层电子数为7,形成1个共用电子对,所以每个原子的最外层都具有8电子稳定结构,Cl2O中Cl原子的最外层电子数为7,形成1个共用电子对,O原子的最外层电子数为6,形成2个共用电子对,所以每个原子的最外层都具有8电子稳定结构,A正确;
HF分子比HCl分子稳定是因为前者共价键强于后者,与分子间作用力无关,B错误;
1
2
3
4
核外电子排布相同的微粒,不一定属于同一种元素,故化学性质不一定相同,C错误;
CaCl2中只存在离子键,CaSO4中存在离子键和共价键,化学键的类型不完全相同,D错误。
4.短周期主族元素R、X、Y、Z的原子序数依次增大,由这些元素组成的物质之间的转化关系如图所示,其中,c、d为单质,a、b、g为二元化合物。b、g分别是10电子分子、18电子分子。下列说法正确的是
A.简单离子半径:Y>Z>X
B.e和f含化学键类型相同
C.0.1 mol·L-1的e和f溶液,后者pH较大
D.含X、R、Z三种元素的化合物只有一种
1
2
3
4
√
解析 依题意知,g为18电子分子,且在点燃条件下由两种单质生成,且这两种单质是在电解条件下产生的,故可推知g应为HCl,c、d分别为H2、Cl2中的一种,且是由电解饱和食盐水产生的,因b为10电子分子,故a为NaCl,b为H2O,e为NaOH,因d与e能发生
反应,故d为Cl2,c为H2,f为NaClO。则R
为H,X为O,Y为Na,Z为Cl。A项,半径
大小:r(Cl-)>r(O2-)>r(Na+),错误;
B项,NaOH、NaClO都含有离子键和共价键,正确;
C项,相同浓度的氢氧化钠溶液的碱性比次氯酸钠的强,错误;
D项,由H、O、Cl组成的化合物有HClO、HClO2、HClO3、HClO4,错误。
1
2
3
4
角度一
1.一个信息丰富的粒子(原子或离子)符号
高考必备知识
2.微粒间的“四个”数量关系
(1)质子数=核电荷数=核外电子数=原子序数;
(2)质量数=质子数+中子数;
(3)质子数=阳离子的核外电子数+阳离子所带正电荷数;
(4)质子数=阴离子的核外电子数-阴离子所带负电荷数。
3.化学键与物质类别的关系
(2)
4.三种作用力及对物质性质的影响
?
范德华力
氢键
共价键
作用微粒
分子
H与N、O、F
原子
强度比较
共价键>氢键>范德华力
影响因素
组成和结构相似的物质,相对分子质量越大,范德华力越大
形成氢键元素的电负性
原子半径
对性质的影响
影响物质的熔、沸点,溶解度等物理性质
分子间氢键使物质熔、沸点升高,溶解度增大
键能越大,稳定性越强
5.巧记10电子微粒和18电子微粒的方法
(1)10电子微粒
(2)18电子微粒
1.(2020·全国卷Ⅰ,11)1934年约里奥—居里夫妇在核反应中用α粒子(即氦核 )轰击金属原子 ,开创了人造放射性核素的先河:
其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A. 的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
1
2
3
4
5
重练高考真题
√
解析 由守恒关系可知元素X的质量数为27, 的相对原子质量近似等于该原子的质量数,A项错误;
X与Y最外层电子数之和为8,质子数相差2,且X为金属元素,可推知X为Al元素,Y为P元素,二者都有+3价,都可以形成三氯化物,B项正确;
同一周期主族元素自左向右,原子半径逐渐减小,故Al的原子半径大于P,C项错误;
P元素的含氧酸有H3PO4、H3PO3、H3PO2等,D项错误。
1
2
3
4
5
2.(2020·浙江7月选考,16)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是
A.原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y>M
C.X2Z—ZX2易溶于水,其水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
1
2
3
4
5
√
解析 短周期元素X、Y、Z、M、Q的原子序数依次增大,Y元素的最高正价为+4价,则Y处于第ⅣA族;Y元素与M元素同主族,且M的原子序数大于Y,则Y是C,M是Si;Y元素与Z、M元素相邻,且Z的原子序数大于Y,则Z是N。化合物Z2X4为N2X4,其电子总数为18个,则X含1个电子,X应为H。Q元素的原子最外层电子数比次外层少一个电子,且Q的原子序数大于M(Si),则Q是Cl。一般来说,电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大,故原子半径:N<C<Si,A正确;
元素的非金属性:N>C>Si,则最高价氧化物对应水化物的酸性:HNO3>H2CO3>H2SiO3,B正确;
1
2
3
4
5
X2Z—ZX2为H2N—NH2,其性质类似于NH3,易溶于水,其水溶液呈碱性,C正确;
H、N、Cl三种元素可形成离子化合物NH4Cl,D错误。
1
2
3
4
5
3.(2019·北京,8)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B. 的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
1
2
3
4
5
√
解析 Rb为碱金属,属于第五周期元素,故In亦为第五周期元素,由In的核外电子排布可得In与Al同主族,即为第ⅢA族元素,A项正确;
的中子数为115-49=66,质子数为49,故中子数与电子数之差为17,B项正确;
同主族元素,从上到下,原子半径逐渐增大,故原子半径:In>Al,C项正确;
同周期元素从左到右,金属性逐渐减弱,故其最高价氧化物对应水化物的碱性逐渐减弱,即碱性:In(OH)3
2
3
4
5
4.(2019·全国卷Ⅲ,9)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
√
1
2
3
4
5
解析 MgO为离子晶体,碳的氧化物为分子晶体,故镁的氧化物的熔点高于碳的氧化物,A错误;
非金属性:C>Si,故氢化物的热稳定性:CH4>SiH4,B正确;
C、Si形成的化合物SiC为共价化合物,C错误;
Mg能溶解在浓硝酸中,Si不能溶于浓硝酸,D错误。
1
2
3
4
5
1
2
3
4
5
5.(2018·全国卷Ⅲ,8)下列叙述正确的是
A.24 g镁与27 g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol重水与1 mol水中,中子数比为2∶1
D.1 mol乙烷与1 mol乙烯中,化学键数相同
√
1
2
3
4
5
解析 等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,B项正确;
24 g镁、27 g铝的物质的量均为1 mol,1个镁原子和1个铝原子所含的质子数分别为12、13,故24 g镁与27 g铝中含有的质子数分别为12 mol和13 mol,
A项错误;
1个重水分子含有10个中子,1个水分子含有8个中子,1 mol重水与1 mol水中含有的中子数之比为10∶8(5∶4),C项错误;
1个乙烷分子中含有7对共用电子,而1个乙烯分子中含有6对共用电子,故1 mol乙烷与1 mol乙烯中,含有的化学键数之比为7∶6,D项错误。
1.下列叙述错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
1
2
3
4
√
精练预测押题
1
2
3
4
解析 13C和14C属于碳元素的两种不同原子,二者中子数不同,互为同位素;1H和2H是不同的核素,它们的质子数相等,均为1;14C和14N的质量数相等,它们的中子数分别是8、7;6Li和7Li的电子数相等,均为3,但中子数不同,分别为3、4。
2.下列说法不正确的是
A.NaClO是含有两种类型化学键的离子化合物
B.CO2通入水的过程中,有共价键的形成和断裂,但不涉及离子键的变化
C.金刚石和足球烯都只由碳元素组成,且含有的化学键类型也相同
D.常温常压下,H2O与CH4的不同状态可以说明H2O的热稳定性更好
1
2
3
4
√
解析 NaClO是由Na+和ClO-组成的,即NaClO属于离子化合物,含有离子键,ClO-中存在共价键,故A项正确;
CO2溶于水形成H2CO3,H2CO3电离,CO2、H2O、H2CO3均属于共价化合物,有共价键的形成和断裂,没有离子键的变化,故B项正确;
金刚石和足球烯都是由碳元素组成的单质,都是由共价键组成,故C项正确;
热稳定性与物质状态无关,故D项错误。
1
2
3
4
3.(2019·浙江嘉兴一中期末)下列说法正确的是
A.PCl3、Cl2及Cl2O三种分子中各原子最外层都具有8电子稳定结构
B.HF分子比HCl分子稳定是因为分子间作用力前者强于后者
C.核外电子排布相同的两种微粒化学性质也相同
D.CaCl2和CaSO4中化学键的类型完全相同
1
2
3
4
√
1
2
3
4
解析 PCl3中P原子中的最外层电子数为5,形成3个共用电子对,Cl原子的最外层电子数为7,形成1个共用电子对,所以每个原子的最外层都具有8电子稳定结构。Cl2中Cl原子的最外层电子数为7,形成1个共用电子对,所以每个原子的最外层都具有8电子稳定结构,Cl2O中Cl原子的最外层电子数为7,形成1个共用电子对,O原子的最外层电子数为6,形成2个共用电子对,所以每个原子的最外层都具有8电子稳定结构,A正确;
HF分子比HCl分子稳定是因为前者共价键强于后者,与分子间作用力无关,B错误;
1
2
3
4
核外电子排布相同的微粒,不一定属于同一种元素,故化学性质不一定相同,C错误;
CaCl2中只存在离子键,CaSO4中存在离子键和共价键,化学键的类型不完全相同,D错误。
4.短周期主族元素R、X、Y、Z的原子序数依次增大,由这些元素组成的物质之间的转化关系如图所示,其中,c、d为单质,a、b、g为二元化合物。b、g分别是10电子分子、18电子分子。下列说法正确的是
A.简单离子半径:Y>Z>X
B.e和f含化学键类型相同
C.0.1 mol·L-1的e和f溶液,后者pH较大
D.含X、R、Z三种元素的化合物只有一种
1
2
3
4
√
解析 依题意知,g为18电子分子,且在点燃条件下由两种单质生成,且这两种单质是在电解条件下产生的,故可推知g应为HCl,c、d分别为H2、Cl2中的一种,且是由电解饱和食盐水产生的,因b为10电子分子,故a为NaCl,b为H2O,e为NaOH,因d与e能发生
反应,故d为Cl2,c为H2,f为NaClO。则R
为H,X为O,Y为Na,Z为Cl。A项,半径
大小:r(Cl-)>r(O2-)>r(Na+),错误;
B项,NaOH、NaClO都含有离子键和共价键,正确;
C项,相同浓度的氢氧化钠溶液的碱性比次氯酸钠的强,错误;
D项,由H、O、Cl组成的化合物有HClO、HClO2、HClO3、HClO4,错误。
1
2
3
4
同课章节目录
