2021届高中化学考前三个月专项复习课件 命题区间五 角度一 原电池原理及化学电源
文档属性
| 名称 | 2021届高中化学考前三个月专项复习课件 命题区间五 角度一 原电池原理及化学电源 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-05 15:43:59 | ||
图片预览





文档简介
原电池原理及化学电源
角度一
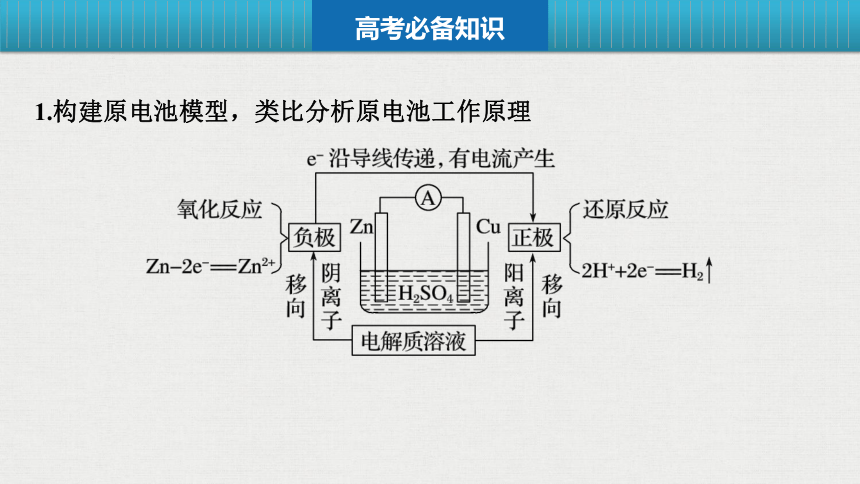
1.构建原电池模型,类比分析原电池工作原理
高考必备知识
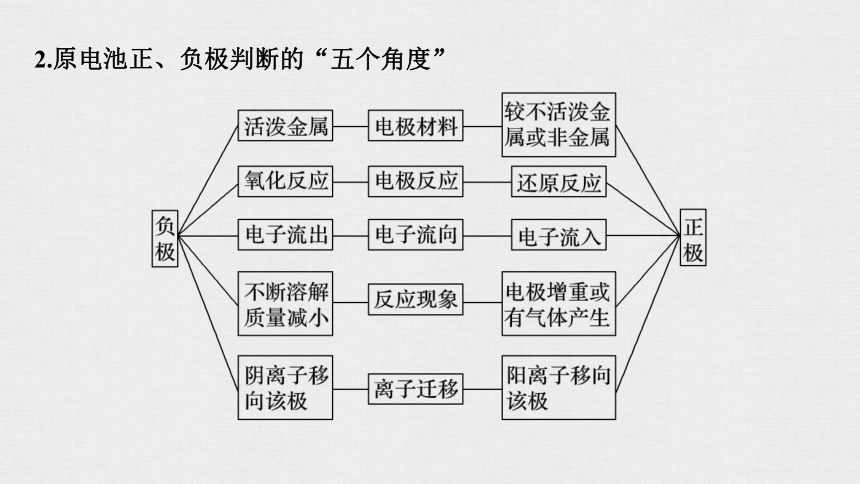
2.原电池正、负极判断的“五个角度”
3.化学电源中电极反应式书写的思维模板
(1)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物。
(2)确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物。
(3)配平:根据电荷守恒、原子守恒配平电极反应式。
注意 ①H+在碱性环境中不存在;
②O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境中结合H2O,生成OH-;
③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得较难写出的另一极的电极反应式。
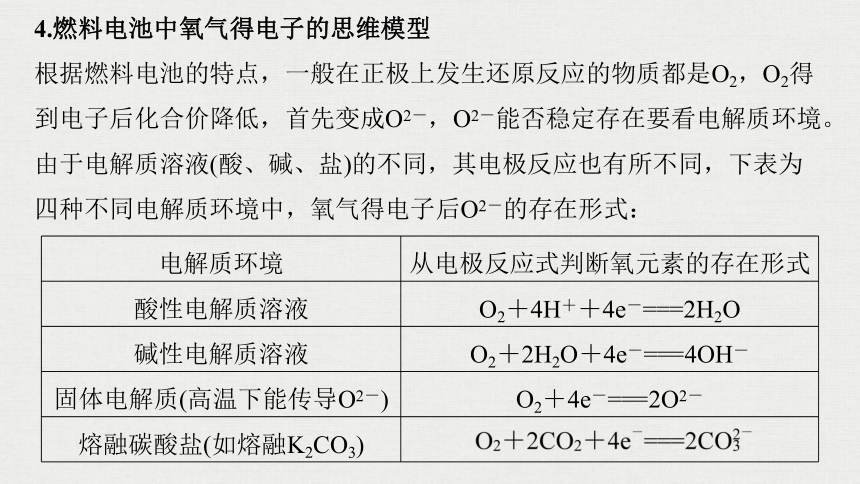
4.燃料电池中氧气得电子的思维模型
根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,O2得到电子后化合价降低,首先变成O2-,O2-能否稳定存在要看电解质环境。由于电解质溶液(酸、碱、盐)的不同,其电极反应也有所不同,下表为四种不同电解质环境中,氧气得电子后O2-的存在形式:
电解质环境
从电极反应式判断氧元素的存在形式
酸性电解质溶液
O2+4H++4e-===2H2O
碱性电解质溶液
O2+2H2O+4e-===4OH-
固体电解质(高温下能传导O2-)
O2+4e-===2O2-
熔融碳酸盐(如熔融K2CO3)
1.(2020·全国卷Ⅲ,12)一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:VB2+
该电池工作时,下列说法错误的是
A.负载通过0.04 mol电子时,有0.224 L(标准状
况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
1
2
3
4
√
重练高考真题
解析 根据VB2电极发生的反应VB2+16OH--11e-===
+4H2O,判断得出VB2电极为负极,复合碳电极为正极,电极反应式为O2+4e-+2H2O===4OH-,所以电池总反应
为4VB2+11O2+20OH-+6H2O===
,C正确;
负载通过0.04 mol电子时,有0.01 mol氧气参
与反应,即标准状况下有0.224 L氧气参与反
应,A正确;
负极区消耗OH-,溶液的pH降低,正极区生成OH-,溶液的pH升高,B错误。
1
2
3
4
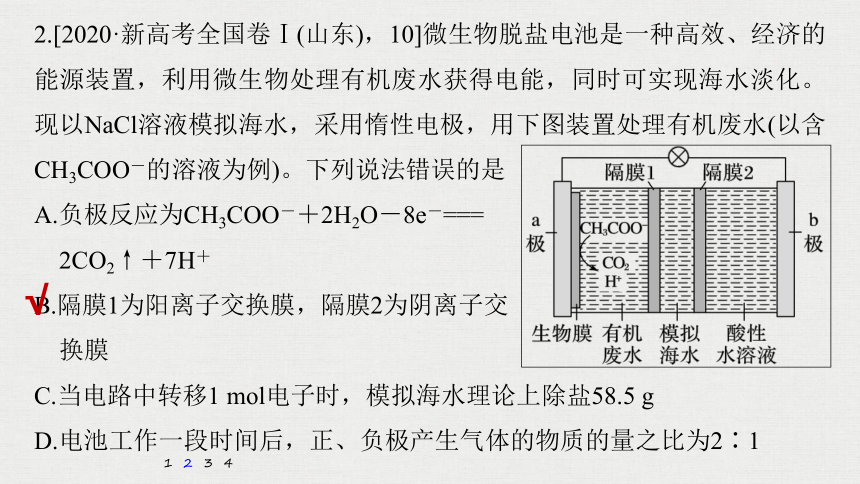
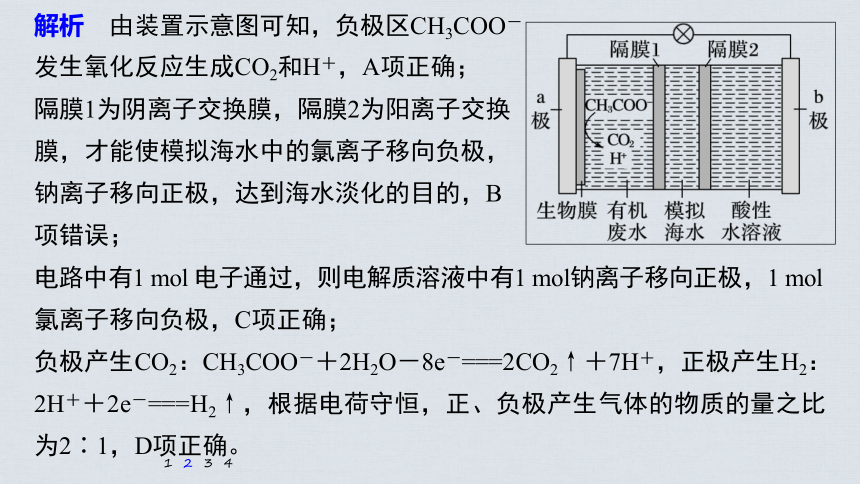
2.[2020·新高考全国卷Ⅰ(山东),10]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.负极反应为CH3COO-+2H2O-8e-===
2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交
换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
1
2
3
4
√
解析 由装置示意图可知,负极区CH3COO-
发生氧化反应生成CO2和H+,A项正确;
隔膜1为阴离子交换膜,隔膜2为阳离子交换
膜,才能使模拟海水中的氯离子移向负极,
钠离子移向正极,达到海水淡化的目的,B
项错误;
电路中有1 mol 电子通过,则电解质溶液中有1 mol钠离子移向正极,1 mol
氯离子移向负极,C项正确;
负极产生CO2:CH3COO-+2H2O-8e-===2CO2↑+7H+,正极产生H2:2H++2e-===H2↑,根据电荷守恒,正、负极产生气体的物质的量之比为2∶1,D项正确。
1
2
3
4
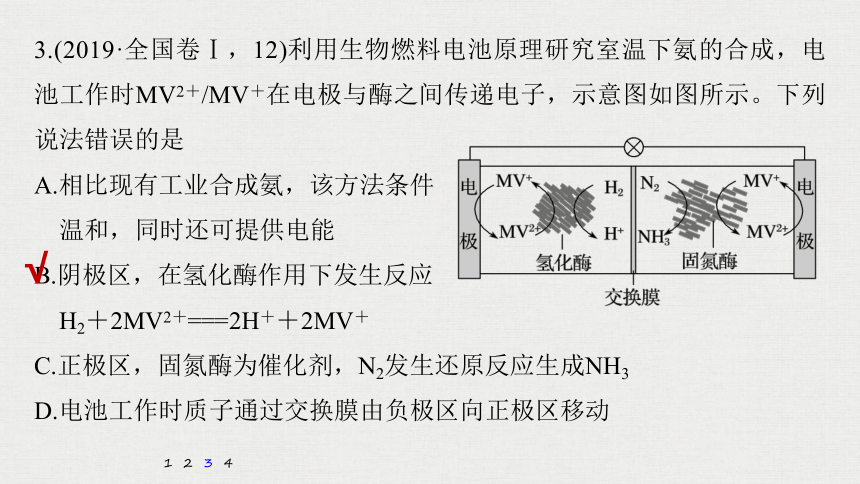
3.(2019·全国卷Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件
温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应
H2+2MV2+===2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
1
2
3
4
√
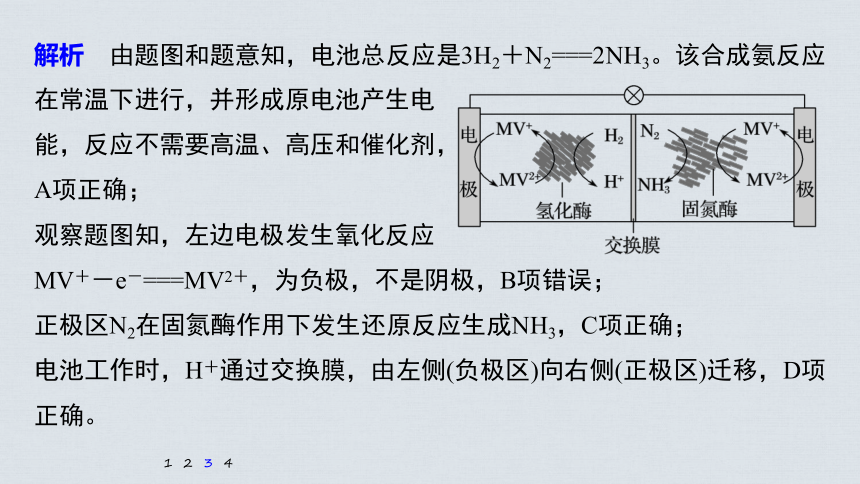
解析 由题图和题意知,电池总反应是3H2+N2===2NH3。该合成氨反应在常温下进行,并形成原电池产生电
能,反应不需要高温、高压和催化剂,
A项正确;
观察题图知,左边电极发生氧化反应
MV+-e-===MV2+,为负极,不是阴极,B项错误;
正极区N2在固氮酶作用下发生还原反应生成NH3,C项正确;
电池工作时,H+通过交换膜,由左侧(负极区)向右侧(正极区)迁移,D项正确。
1
2
3
4
4.(2018·浙江11月选考,17)最近,科学家研发
了“全氢电池”,其工作原理如图所示。下列
说法不正确的是
A.右边吸附层中发生了还原反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.电池的总反应是2H2+O2===2H2O
D.电解质溶液中Na+向右移动, 向左移动
√
1
2
3
4
解析 根据装置图中电子的流向,通H2的一极
为负极,出H2的一极为正极,电极反应式为:
负极:H2-2e-+2OH-===2H2O
正极:2H++2e-===H2
A项,正极上发生还原反应;
C项,电池总反应式为H++OH-===H2O;
D项,由于在负极区消耗OH-,所以Na+向右移动,而 向左移动。
1
2
3
4
题组一 原电池工作原理
1.(2019·武汉二模)Zn-ZnSO4-PbSO4-Pb电池装置如图,下列说法错误的是
A. 从右向左迁移
B.电池的正极反应为Pb2++2e-===Pb
C.左边ZnSO4浓度增大,右边ZnSO4浓度不变
D.若有6.5 g锌溶解,有0.1 mol 通过离子
交换膜
1
2
3
4
5
6
7
√
精练预测押题
1
2
3
4
5
6
7
解析 装置左侧电极为负极,右侧电极为正
极,阴离子移向负极,即 从右向左迁移,
A项正确;
电池的正极反应式为PbSO4+2e-===Pb+ ,
B项错误;
负极反应式为Zn-2e-===Zn2+,产生ZnSO4,左边ZnSO4浓度增大,右边ZnSO4浓度不变,C项正确;
6.5 g锌溶解,转移0.2 mol e-,电解液中有0.2 mol负电荷通过离子交换膜,即有0.1 mol 通过离子交换膜,D项正确。
2.下面是利用盐桥电池从某些含碘盐中提取碘的两个装置,下列说法中正确的是
A.两个装置中石墨Ⅰ和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.①中MnO2极的电极反应式为MnO2+2H2O+2e-===Mn2++4OH-
D.装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5
1
2
3
4
5
6
7
√
解析 装置①中碘离子失去电子,石墨Ⅰ是负极,装置②中碘酸钠得到电子,石墨Ⅱ作正极,A项错误;
根据A项分析可知,碘元素在装置①中被氧化,在装置②中被还原,B项错误;
1
2
3
4
5
6
7
①中MnO2得到电子,溶液呈酸性,则电极反应式为MnO2+4H++2e-===Mn2++2H2O,C项错误;
①中1 mol碘化钠失去1 mol电子,②中1 mol碘酸钠得到5 mol电子,则装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5,D项正确。
1
2
3
4
5
6
7
3.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:
下列说法正确的是
A.N为正极,发生氧化反应
B.a气体为氧气,b气体为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池通过交换膜进入乙池
1
2
3
4
5
6
7
√
1
2
3
4
5
6
7
解析 燃料电池工作时,燃料发生氧化反应,失去电子,故M电极为负极,a气体为甲醇,电极反应式为:CH3OH+H2O-6e-===CO2↑+6H+,甲醇在负极被氧化生成CO2。有1 mol CO2生成,则有6 mol H+生成,甲池溶液pH减小。N电极为正极,在其表面发生还原反应;电池中,阳离子从负极移向正极,H+从甲池通过质子交换膜进入乙池。
题组二 新型化学电源的分析
4.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度在700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,
反应产物均为无毒无害的物质。下列说法正确
的是
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上有1 mol N2H4消耗时,电极乙上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
1
2
3
4
5
6
7
√
解析 该装置中电极甲为负极,电极乙为正极,
所以O2-由电极乙移向电极甲,A项正确;
电池的总反应为N2H4+O2===N2+2H2O,B项
错误;
当电极甲上消耗1 mol N2H4时,电极乙上就有
1 mol O2参与反应,在标准状况下O2的体积为22.4 L,但题目没有指明该过程是否处于标准状况,C项错误;
在外电路中,电子由负极(甲)移向正极(乙),D项错误。
1
2
3
4
5
6
7
5.(2020·衡水中学四调)2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列
说法不正确的是
A.放电时B电极反应式为:I2+2e-
===2I-
B.放电时电解质储罐中离子总浓度
增大
C.M为阳离子交换膜,N为阴离子交换膜
D.充电时,A极增重65 g时,C区增加的离子数为4NA
1
2
3
4
5
6
7
√
解析 放电时,B电极为正极,I2得到电子
生成I-,电极反应式为I2+2e-===2I-,A
正确;
放电时,左侧即负极,电极反应式为Zn-
2e-===Zn2+,所以储罐中的离子总浓度增大,B正确;
离子交换膜是防止正负极I2、Zn接触发生反应,负极区生成Zn2+、正电荷增加,正极区生成I-、负电荷增加,所以Cl-通过M膜进入负极区,K+通过N膜进入正极区,所以M为阴离子交换膜,N为阳离子交换膜,C错误;
充电时,A极反应式Zn2++2e-===Zn,A极增重65 g转移2 mol电子,所以C区增加2 mol K+、2 mol Cl-,增加的离子总数为4NA,D正确。
1
2
3
4
5
6
7
6.(2020·湖北省名师联盟高三4月月考)“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大气相通,B区为封
闭体系并有N2保护。下列关于该电池
的说法错误的是
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3-xe-===WO3+xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c,b电极的电极反应式为O2+4H++4e-===2H2O
√
1
2
3
4
5
6
7
解析 用导线连接a、c,a极发生氧化反应,为负极,发生的电极反应为2H2O-4e-===4H++O2↑,a电极周围
H+浓度增大,溶液pH减小,故A正确;
用导线连接a、c,c极为正极,发生还原
反应,电极反应为WO3+xH++xe-===HxWO3,故B错误;
用导线先连接a、c,再连接b、c,由光电池转化为原电池,实现太阳能向电能转化,故C正确;
用导线连接b、c,b电极为正极,电极表面氧气得电子,发生还原反应,电极反应式为O2+4H++4e-===2H2O,故D正确。
1
2
3
4
5
6
7
7.一种钌(Ru)配合物光敏太阳
能电池的工作原理及电池中发
生的反应如图所示:
下列说法正确的是
A.电极X为电池的正极
B.电池工作时,电能转变为光能
C.电池工作时,电极Y上发生还原反应
D.电池的电解质溶液中I-和 的浓度不断减小
1
2
3
4
5
6
7
√
解析 电子由负极流向正极,故X为电池的负极,A项错误;
电池工作时,光能转变为电能,B项错误;
电极Y为正极,发生还原反应,C项正确;
通过信息③、④可知,电池的电解质溶液中I-和 的浓度不变,D项错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
练后反思
解答新型化学电源的步骤
(1)判断电池类型→确认电池原理→核实电子、离子移动方向。
(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。
(3)充电电池→放电时为原电池→失去电子的一极为负极。
(4)电极反应→总反应离子方程式减去较简单一极的电极反应式→另一电极反应式。
角度一
1.构建原电池模型,类比分析原电池工作原理
高考必备知识
2.原电池正、负极判断的“五个角度”
3.化学电源中电极反应式书写的思维模板
(1)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物。
(2)确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物。
(3)配平:根据电荷守恒、原子守恒配平电极反应式。
注意 ①H+在碱性环境中不存在;
②O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境中结合H2O,生成OH-;
③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得较难写出的另一极的电极反应式。
4.燃料电池中氧气得电子的思维模型
根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,O2得到电子后化合价降低,首先变成O2-,O2-能否稳定存在要看电解质环境。由于电解质溶液(酸、碱、盐)的不同,其电极反应也有所不同,下表为四种不同电解质环境中,氧气得电子后O2-的存在形式:
电解质环境
从电极反应式判断氧元素的存在形式
酸性电解质溶液
O2+4H++4e-===2H2O
碱性电解质溶液
O2+2H2O+4e-===4OH-
固体电解质(高温下能传导O2-)
O2+4e-===2O2-
熔融碳酸盐(如熔融K2CO3)
1.(2020·全国卷Ⅲ,12)一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:VB2+
该电池工作时,下列说法错误的是
A.负载通过0.04 mol电子时,有0.224 L(标准状
况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
1
2
3
4
√
重练高考真题
解析 根据VB2电极发生的反应VB2+16OH--11e-===
+4H2O,判断得出VB2电极为负极,复合碳电极为正极,电极反应式为O2+4e-+2H2O===4OH-,所以电池总反应
为4VB2+11O2+20OH-+6H2O===
,C正确;
负载通过0.04 mol电子时,有0.01 mol氧气参
与反应,即标准状况下有0.224 L氧气参与反
应,A正确;
负极区消耗OH-,溶液的pH降低,正极区生成OH-,溶液的pH升高,B错误。
1
2
3
4
2.[2020·新高考全国卷Ⅰ(山东),10]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.负极反应为CH3COO-+2H2O-8e-===
2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交
换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
1
2
3
4
√
解析 由装置示意图可知,负极区CH3COO-
发生氧化反应生成CO2和H+,A项正确;
隔膜1为阴离子交换膜,隔膜2为阳离子交换
膜,才能使模拟海水中的氯离子移向负极,
钠离子移向正极,达到海水淡化的目的,B
项错误;
电路中有1 mol 电子通过,则电解质溶液中有1 mol钠离子移向正极,1 mol
氯离子移向负极,C项正确;
负极产生CO2:CH3COO-+2H2O-8e-===2CO2↑+7H+,正极产生H2:2H++2e-===H2↑,根据电荷守恒,正、负极产生气体的物质的量之比为2∶1,D项正确。
1
2
3
4
3.(2019·全国卷Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件
温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应
H2+2MV2+===2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
1
2
3
4
√
解析 由题图和题意知,电池总反应是3H2+N2===2NH3。该合成氨反应在常温下进行,并形成原电池产生电
能,反应不需要高温、高压和催化剂,
A项正确;
观察题图知,左边电极发生氧化反应
MV+-e-===MV2+,为负极,不是阴极,B项错误;
正极区N2在固氮酶作用下发生还原反应生成NH3,C项正确;
电池工作时,H+通过交换膜,由左侧(负极区)向右侧(正极区)迁移,D项正确。
1
2
3
4
4.(2018·浙江11月选考,17)最近,科学家研发
了“全氢电池”,其工作原理如图所示。下列
说法不正确的是
A.右边吸附层中发生了还原反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.电池的总反应是2H2+O2===2H2O
D.电解质溶液中Na+向右移动, 向左移动
√
1
2
3
4
解析 根据装置图中电子的流向,通H2的一极
为负极,出H2的一极为正极,电极反应式为:
负极:H2-2e-+2OH-===2H2O
正极:2H++2e-===H2
A项,正极上发生还原反应;
C项,电池总反应式为H++OH-===H2O;
D项,由于在负极区消耗OH-,所以Na+向右移动,而 向左移动。
1
2
3
4
题组一 原电池工作原理
1.(2019·武汉二模)Zn-ZnSO4-PbSO4-Pb电池装置如图,下列说法错误的是
A. 从右向左迁移
B.电池的正极反应为Pb2++2e-===Pb
C.左边ZnSO4浓度增大,右边ZnSO4浓度不变
D.若有6.5 g锌溶解,有0.1 mol 通过离子
交换膜
1
2
3
4
5
6
7
√
精练预测押题
1
2
3
4
5
6
7
解析 装置左侧电极为负极,右侧电极为正
极,阴离子移向负极,即 从右向左迁移,
A项正确;
电池的正极反应式为PbSO4+2e-===Pb+ ,
B项错误;
负极反应式为Zn-2e-===Zn2+,产生ZnSO4,左边ZnSO4浓度增大,右边ZnSO4浓度不变,C项正确;
6.5 g锌溶解,转移0.2 mol e-,电解液中有0.2 mol负电荷通过离子交换膜,即有0.1 mol 通过离子交换膜,D项正确。
2.下面是利用盐桥电池从某些含碘盐中提取碘的两个装置,下列说法中正确的是
A.两个装置中石墨Ⅰ和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.①中MnO2极的电极反应式为MnO2+2H2O+2e-===Mn2++4OH-
D.装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5
1
2
3
4
5
6
7
√
解析 装置①中碘离子失去电子,石墨Ⅰ是负极,装置②中碘酸钠得到电子,石墨Ⅱ作正极,A项错误;
根据A项分析可知,碘元素在装置①中被氧化,在装置②中被还原,B项错误;
1
2
3
4
5
6
7
①中MnO2得到电子,溶液呈酸性,则电极反应式为MnO2+4H++2e-===Mn2++2H2O,C项错误;
①中1 mol碘化钠失去1 mol电子,②中1 mol碘酸钠得到5 mol电子,则装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5,D项正确。
1
2
3
4
5
6
7
3.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:
下列说法正确的是
A.N为正极,发生氧化反应
B.a气体为氧气,b气体为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池通过交换膜进入乙池
1
2
3
4
5
6
7
√
1
2
3
4
5
6
7
解析 燃料电池工作时,燃料发生氧化反应,失去电子,故M电极为负极,a气体为甲醇,电极反应式为:CH3OH+H2O-6e-===CO2↑+6H+,甲醇在负极被氧化生成CO2。有1 mol CO2生成,则有6 mol H+生成,甲池溶液pH减小。N电极为正极,在其表面发生还原反应;电池中,阳离子从负极移向正极,H+从甲池通过质子交换膜进入乙池。
题组二 新型化学电源的分析
4.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度在700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,
反应产物均为无毒无害的物质。下列说法正确
的是
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上有1 mol N2H4消耗时,电极乙上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
1
2
3
4
5
6
7
√
解析 该装置中电极甲为负极,电极乙为正极,
所以O2-由电极乙移向电极甲,A项正确;
电池的总反应为N2H4+O2===N2+2H2O,B项
错误;
当电极甲上消耗1 mol N2H4时,电极乙上就有
1 mol O2参与反应,在标准状况下O2的体积为22.4 L,但题目没有指明该过程是否处于标准状况,C项错误;
在外电路中,电子由负极(甲)移向正极(乙),D项错误。
1
2
3
4
5
6
7
5.(2020·衡水中学四调)2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列
说法不正确的是
A.放电时B电极反应式为:I2+2e-
===2I-
B.放电时电解质储罐中离子总浓度
增大
C.M为阳离子交换膜,N为阴离子交换膜
D.充电时,A极增重65 g时,C区增加的离子数为4NA
1
2
3
4
5
6
7
√
解析 放电时,B电极为正极,I2得到电子
生成I-,电极反应式为I2+2e-===2I-,A
正确;
放电时,左侧即负极,电极反应式为Zn-
2e-===Zn2+,所以储罐中的离子总浓度增大,B正确;
离子交换膜是防止正负极I2、Zn接触发生反应,负极区生成Zn2+、正电荷增加,正极区生成I-、负电荷增加,所以Cl-通过M膜进入负极区,K+通过N膜进入正极区,所以M为阴离子交换膜,N为阳离子交换膜,C错误;
充电时,A极反应式Zn2++2e-===Zn,A极增重65 g转移2 mol电子,所以C区增加2 mol K+、2 mol Cl-,增加的离子总数为4NA,D正确。
1
2
3
4
5
6
7
6.(2020·湖北省名师联盟高三4月月考)“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大气相通,B区为封
闭体系并有N2保护。下列关于该电池
的说法错误的是
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3-xe-===WO3+xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c,b电极的电极反应式为O2+4H++4e-===2H2O
√
1
2
3
4
5
6
7
解析 用导线连接a、c,a极发生氧化反应,为负极,发生的电极反应为2H2O-4e-===4H++O2↑,a电极周围
H+浓度增大,溶液pH减小,故A正确;
用导线连接a、c,c极为正极,发生还原
反应,电极反应为WO3+xH++xe-===HxWO3,故B错误;
用导线先连接a、c,再连接b、c,由光电池转化为原电池,实现太阳能向电能转化,故C正确;
用导线连接b、c,b电极为正极,电极表面氧气得电子,发生还原反应,电极反应式为O2+4H++4e-===2H2O,故D正确。
1
2
3
4
5
6
7
7.一种钌(Ru)配合物光敏太阳
能电池的工作原理及电池中发
生的反应如图所示:
下列说法正确的是
A.电极X为电池的正极
B.电池工作时,电能转变为光能
C.电池工作时,电极Y上发生还原反应
D.电池的电解质溶液中I-和 的浓度不断减小
1
2
3
4
5
6
7
√
解析 电子由负极流向正极,故X为电池的负极,A项错误;
电池工作时,光能转变为电能,B项错误;
电极Y为正极,发生还原反应,C项正确;
通过信息③、④可知,电池的电解质溶液中I-和 的浓度不变,D项错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
练后反思
解答新型化学电源的步骤
(1)判断电池类型→确认电池原理→核实电子、离子移动方向。
(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。
(3)充电电池→放电时为原电池→失去电子的一极为负极。
(4)电极反应→总反应离子方程式减去较简单一极的电极反应式→另一电极反应式。
同课章节目录
