2020-2021学年九年级化学人教版(五四学制)全一册 第四单元 盐 化肥 复分解反应及其应用复习 课件(19张PPT)
文档属性
| 名称 | 2020-2021学年九年级化学人教版(五四学制)全一册 第四单元 盐 化肥 复分解反应及其应用复习 课件(19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-04 21:03:02 | ||
图片预览





文档简介
(共19张PPT)
复分解反应及其应用
回归课本
/10
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
H+
OH-
H+
CO32-
Cu2+
OH-
实验一
实验二
实验三
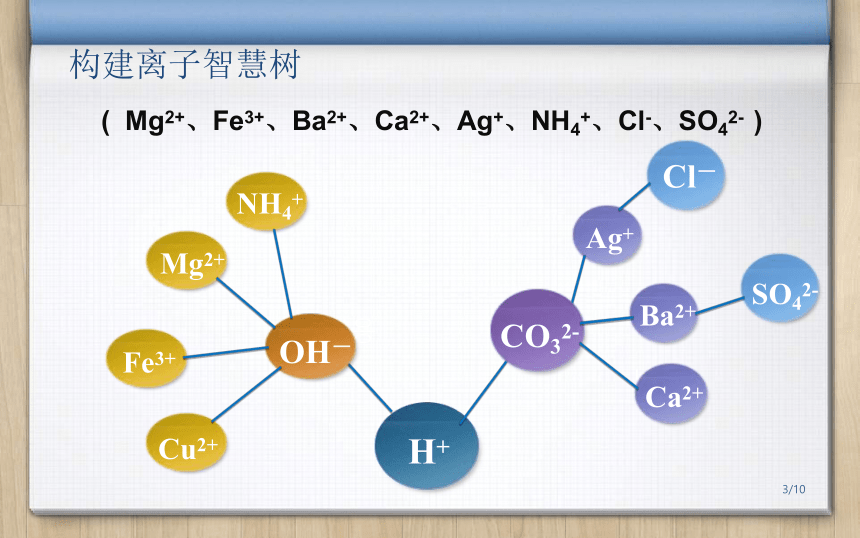
构建离子智慧树
H+
??
/10
??
OH-
NH4+
Mg2+
Fe3+
Cu2+
CO32-
Ba2+
Ca2+
Ag+
SO42-
Cl-
(
Mg2+、Fe3+、Ba2+、Ca2+、Ag+、NH4+、Cl-、SO42-
)
H+
??
/10
??
OH-
NH4+
Mg2+
Fe3+
Cu2+
CO32-
Ba2+
Ca2+
Ag+
SO42-
Cl-
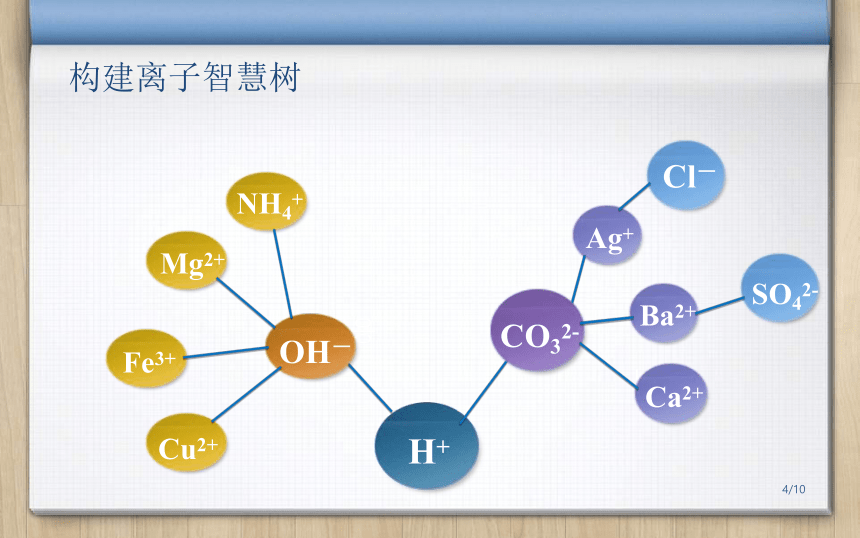
构建离子智慧树
我会应用-离子共存
/10
?【典例精析1】下列各组离子在溶液中一定能大量共存的是( )
A.H+、C1-、HCO3- B.Na+、Cu2+、OH-
C.Ag+、Cl-、NO3- D.H+、Fe2+、SO42-
D
我会应用-离子共存
/10
?【典例精析2】在无色溶液中能大量共存的一组离子是(
)
A.
H+、Ag+、Na+、Cl- B.
H+、Na+、Cl-、NO3-
C.
H+、Na+、Cl-、CO32-
D.
Cu2+、Na+、Cl-、NO3-
解题思路:
Cu2+
Fe3+
Fe2+
MnO4-
蓝色
黄色
浅绿色
紫红色
B
我会应用-离子共存
/10
?【典例精析3】下列各组离子在酸性溶液中能大量共存的是
(
)
A.
Ag+、Na+、Cl-、NO3-
B.
K+、Na+、OH-、SO42-
C.
K+、Na+、Cl-、CO32-
D.
Ba2+、Mg2+、Cl-、NO3-
H+
D
H+
H+
H+
我会应用-物质的鉴别
/10
现有两瓶标签脱落的无色溶液,其中一瓶是氯化钠溶液,另一瓶是碳酸钠溶液,你有哪些方法能将他们区分开来?
实验步骤
实验现象
实验结论
分别取两种无色溶液少许于两支试管中,各滴加几滴无色酚酞溶液,观察实验现象。
一支试管中酚酞溶液变红,一支试管中酚酞溶液不变色。
溶液变红的试管中原溶液为碳酸钠溶液,另一试管中原溶液为氯化钠溶液。
(1)若只需除去沙子
等难溶性杂质,提纯的步骤为:
。
/10
粗盐中主要含有多种可溶性杂质如(CaCl2
,MgCl2)和难溶性杂质,如(泥沙等)。
请思考:
①溶解
②过滤
③蒸发结晶
我会应用-物质的分离
/10
⑤
NaOH溶液
④
Na2CO3溶液
请思考:
(2)若要除去CaCl2、MgCl2,可加入哪些物质?
过量
过量
(3)过量的Na2CO3和NaOH溶液,应该如何除去?
⑥
加入适量的稀盐酸
我会应用-物质的分离
粗盐中主要含有多种可溶性杂质如(CaCl2
,MgCl2)和难溶性杂质,如(泥沙等)。
/10
请思考:
(4)将以上实验步骤:①溶解②过滤③蒸发结晶④过量Na2CO3溶液⑤过量NaOH溶液⑥适量的稀盐酸,按正确提纯顺序排列。
①
④
⑤
②
⑥
③
我会应用-物质的分离
粗盐中主要含有多种可溶性杂质如(CaCl2
,MgCl2)和难溶性杂质,如(泥沙等)。
/10
1.某工厂排出的废水澄清透明,测得该废水的pH=13,此废水中还可能大量共存的是( )
A.SO42-、Cl-、Na+、H+
B.K+、SO42-、Cu2+、NO3-
C.Cl-、K+、SO42-、Na+
D.
Ca2+、Cl-、CO32-、Na+
OH-
OH-
OH-
C
OH-
直通中考
/10
2.某市有甲、乙两个化工厂分布在如图所示的位置上,箭头所指为工厂排水渠中水流方向。如果在
a处取得水样经检测只含少量HNO3和
Ba(NO3)2,在c处取得的水样经检测
pH=7,且只含有少量NaNO3,则b处
的水中含有的物质应是下列4组物质中的
(
)
A.MgSO4,NaCl
B.K2SO4,NaOH
C.KOH,Na2SO4
D.NaOH,Na2SO4
甲
b
a
c
乙
D
直通中考
/10
3.除去下列物质中的少量杂质,所选试剂及操作都正确的是(
)
A
物??质
杂??质
试??剂
操??作
A
MgCl2溶液
HCl
过量Mg(OH)2
过滤
B
CO2
H2O
NaOH固体
干燥
C
H2O
悬浮物
明矾
吸附
D
NaNO3溶液
NaCl
过量AgNO3溶液
过滤
浓硫酸
过滤
适量
直通中考
/10
4.欲鉴别澄清石灰水、稀硫酸和蒸馏水三瓶失去标签的无色液体.提供的试剂有:①Na2CO3溶液②紫色石蕊试纸③无色酚酞试液;只用一种即可将它们鉴别出来的试剂是(
)
A.只有①
B.①或②
C.只有②
D.①②③
Ca(OH)2
H2SO4
H2O
Na2
CO3
↓
↑
—
紫色石蕊试纸
变蓝
变红
不变色
无色酚酞试液
变红
不变色
不变色
滴有酚酞的Ca(OH)2
红色消失
不变色
D
直通中考
/10
5.
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、
CuSO4、NaCl中的一种或儿种,为确定其组成,取适量试样进行下列实验。请根据实验现象判断:
(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有 、 。
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加人过量的稀硝酸,沉淀部分消失并产生气泡则此固体粉末中一定有 、 。
CaCO3
CuSO4
Na2CO3
Na2SO4
/10
5.
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、
CuSO4、NaCl中的一种或儿种,为确定其组成,取适量试样进行下列实验。请根据实验现象判断:
(3)取步骤(2)实验后的上层清液,加人稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得到此固体粉末中一定含有NaCl,你认为此结论是否正确 (填“是”或“否”)。
否
/10
5.
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、
CuSO4、NaCl中的一种或儿种,为确定其组成,取适量试样进行下列实验。请根据实验现象判断:
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进
(若步骤(3)填“是”,此空不作答)
重新取样再进行步骤(3)的操作
愿同学们学以致用、学有所成!谢 谢!
复分解反应及其应用
回归课本
/10
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
H+
OH-
H+
CO32-
Cu2+
OH-
实验一
实验二
实验三
构建离子智慧树
H+
??
/10
??
OH-
NH4+
Mg2+
Fe3+
Cu2+
CO32-
Ba2+
Ca2+
Ag+
SO42-
Cl-
(
Mg2+、Fe3+、Ba2+、Ca2+、Ag+、NH4+、Cl-、SO42-
)
H+
??
/10
??
OH-
NH4+
Mg2+
Fe3+
Cu2+
CO32-
Ba2+
Ca2+
Ag+
SO42-
Cl-
构建离子智慧树
我会应用-离子共存
/10
?【典例精析1】下列各组离子在溶液中一定能大量共存的是( )
A.H+、C1-、HCO3- B.Na+、Cu2+、OH-
C.Ag+、Cl-、NO3- D.H+、Fe2+、SO42-
D
我会应用-离子共存
/10
?【典例精析2】在无色溶液中能大量共存的一组离子是(
)
A.
H+、Ag+、Na+、Cl- B.
H+、Na+、Cl-、NO3-
C.
H+、Na+、Cl-、CO32-
D.
Cu2+、Na+、Cl-、NO3-
解题思路:
Cu2+
Fe3+
Fe2+
MnO4-
蓝色
黄色
浅绿色
紫红色
B
我会应用-离子共存
/10
?【典例精析3】下列各组离子在酸性溶液中能大量共存的是
(
)
A.
Ag+、Na+、Cl-、NO3-
B.
K+、Na+、OH-、SO42-
C.
K+、Na+、Cl-、CO32-
D.
Ba2+、Mg2+、Cl-、NO3-
H+
D
H+
H+
H+
我会应用-物质的鉴别
/10
现有两瓶标签脱落的无色溶液,其中一瓶是氯化钠溶液,另一瓶是碳酸钠溶液,你有哪些方法能将他们区分开来?
实验步骤
实验现象
实验结论
分别取两种无色溶液少许于两支试管中,各滴加几滴无色酚酞溶液,观察实验现象。
一支试管中酚酞溶液变红,一支试管中酚酞溶液不变色。
溶液变红的试管中原溶液为碳酸钠溶液,另一试管中原溶液为氯化钠溶液。
(1)若只需除去沙子
等难溶性杂质,提纯的步骤为:
。
/10
粗盐中主要含有多种可溶性杂质如(CaCl2
,MgCl2)和难溶性杂质,如(泥沙等)。
请思考:
①溶解
②过滤
③蒸发结晶
我会应用-物质的分离
/10
⑤
NaOH溶液
④
Na2CO3溶液
请思考:
(2)若要除去CaCl2、MgCl2,可加入哪些物质?
过量
过量
(3)过量的Na2CO3和NaOH溶液,应该如何除去?
⑥
加入适量的稀盐酸
我会应用-物质的分离
粗盐中主要含有多种可溶性杂质如(CaCl2
,MgCl2)和难溶性杂质,如(泥沙等)。
/10
请思考:
(4)将以上实验步骤:①溶解②过滤③蒸发结晶④过量Na2CO3溶液⑤过量NaOH溶液⑥适量的稀盐酸,按正确提纯顺序排列。
①
④
⑤
②
⑥
③
我会应用-物质的分离
粗盐中主要含有多种可溶性杂质如(CaCl2
,MgCl2)和难溶性杂质,如(泥沙等)。
/10
1.某工厂排出的废水澄清透明,测得该废水的pH=13,此废水中还可能大量共存的是( )
A.SO42-、Cl-、Na+、H+
B.K+、SO42-、Cu2+、NO3-
C.Cl-、K+、SO42-、Na+
D.
Ca2+、Cl-、CO32-、Na+
OH-
OH-
OH-
C
OH-
直通中考
/10
2.某市有甲、乙两个化工厂分布在如图所示的位置上,箭头所指为工厂排水渠中水流方向。如果在
a处取得水样经检测只含少量HNO3和
Ba(NO3)2,在c处取得的水样经检测
pH=7,且只含有少量NaNO3,则b处
的水中含有的物质应是下列4组物质中的
(
)
A.MgSO4,NaCl
B.K2SO4,NaOH
C.KOH,Na2SO4
D.NaOH,Na2SO4
甲
b
a
c
乙
D
直通中考
/10
3.除去下列物质中的少量杂质,所选试剂及操作都正确的是(
)
A
物??质
杂??质
试??剂
操??作
A
MgCl2溶液
HCl
过量Mg(OH)2
过滤
B
CO2
H2O
NaOH固体
干燥
C
H2O
悬浮物
明矾
吸附
D
NaNO3溶液
NaCl
过量AgNO3溶液
过滤
浓硫酸
过滤
适量
直通中考
/10
4.欲鉴别澄清石灰水、稀硫酸和蒸馏水三瓶失去标签的无色液体.提供的试剂有:①Na2CO3溶液②紫色石蕊试纸③无色酚酞试液;只用一种即可将它们鉴别出来的试剂是(
)
A.只有①
B.①或②
C.只有②
D.①②③
Ca(OH)2
H2SO4
H2O
Na2
CO3
↓
↑
—
紫色石蕊试纸
变蓝
变红
不变色
无色酚酞试液
变红
不变色
不变色
滴有酚酞的Ca(OH)2
红色消失
不变色
D
直通中考
/10
5.
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、
CuSO4、NaCl中的一种或儿种,为确定其组成,取适量试样进行下列实验。请根据实验现象判断:
(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有 、 。
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加人过量的稀硝酸,沉淀部分消失并产生气泡则此固体粉末中一定有 、 。
CaCO3
CuSO4
Na2CO3
Na2SO4
/10
5.
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、
CuSO4、NaCl中的一种或儿种,为确定其组成,取适量试样进行下列实验。请根据实验现象判断:
(3)取步骤(2)实验后的上层清液,加人稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得到此固体粉末中一定含有NaCl,你认为此结论是否正确 (填“是”或“否”)。
否
/10
5.
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、
CuSO4、NaCl中的一种或儿种,为确定其组成,取适量试样进行下列实验。请根据实验现象判断:
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进
(若步骤(3)填“是”,此空不作答)
重新取样再进行步骤(3)的操作
愿同学们学以致用、学有所成!谢 谢!
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
